17 лютого, 2016
Рекомендації 2015 Європейського товариства кардіологів (ESC) щодо лікування пацієнтів зі шлуночковими аритміями та попередження раптової серцевої смерті*
*Переклад пунктів 6 та 7 рекомендацій.
Робоча група Європейського товариства кардіологів (European Society of Cardiology, ESC) щодо лікування пацієнтів зі шлуночковими аритміями та попередження раптової серцевої смерті
За загальною редакцією
Європейської асоціації педіатричної кардіології та вроджених вад серця (AEPC)
Автори/члени робочої групи: Сильвія Дж. Пріорі (Silvia G. Priori) (Голова робочої групи) (Італія), Каріна Бломстрьом-Лундквіст (Carina Blomstrоm-Lundqvist) (Співголова робочої групи) (Швеція), Андреа Маццанті (Andrea Mazzanti) (Італія), Ніко Блом (Nico Blom)a (Нідерланди), Мартін Борггрефе (Martin Borggrefe) (Німеччина), Джон Камм (John Camm) (Велика Британія), Перрі Марк Елліот (Perry Mark Elliott) (Велика Британія), Донна Фітцсаймонс (Donna Fitzsimons) (Велика Британія), Роберт Хатала (Robert Hatala) (Словаччина), Герхард Хіндрікс (Gerhard Hindricks) (Німеччина), Паулюс Кіркхоф (Paulus Kirchhof) (Велика Британія/Німеччина), Кельд К’єльдсен (Keld Kjeldsen) (Данія), Карл-Хейнц Кук (Karl-Heinz Kuck) (Німеччина), Антоніо Ернандес-Мадрид (Antonio Hernandez-Madrid) (Іспанія), Ніколаос Ніколаоу (Nikolaos Nikolaou) (Греція), Тоне М. Нореквал (Tone M. Norekval) (Норвегія), Крістіан Спаулдінг (Christian Spaulding) (Франція) та Дірк Дж. Ван Вельдх’юсен (Dirk J. Van Veldhuisen) (Нідерланди).
Рецензенти документа: Філіпп Коль (Philippe Kolh) (Клінічні рекомендації Координатор рецензії CPG Review Coordinator) (Бельгія), Грегорі І. Х. Ліп (Gregory Y. H. Lip) (Клінічні рекомендації Координатор рецензії CPG Review Coordinator) (Велика Британія), Стефан Агевалл (Stefan Agewall) (Норвегія ), Гонзало Барон-Ескуівіас (Gonzalo Barоn-Esquivias) (Іспанія), Джузеппе Боріані (Giuseppe Boriani) (Італія), Вернер Будтс (Werner Budts) (Бельгія), Ектор Буено (Hеctor Bueno) (Іспанія), Давід Каподанно (Davide Capodanno) (Італія), Шіпіоне Карерй (Scipione Carerj) (Італія), Марія Г. Креспо-Лейро (Maria G. Crespo-Leiro) (Іспанія), Мартін Черні (Martin Czerny) (Швейцарія), Крісті Дітон (Christi Deaton) (Велика Британія), Добромір Добрєв (Dobromir Dobrev) (Німеччина), Четін Ерол (Сetin Erol) (Туреччина), Мауріціо Галдерізі (Maurizio Galderisi) (Італія), Булент Горенек (Bulent Gorenek) (Туреччина), Томас Крейбел (Thomas Kriebel) (Німеччина), П’єр Ламб’є (Pier Lambiase) (Велика Британія), Патріціо Ланцелотті (Patrizio Lancellotti) (Бельгія), Дейдре А. Лейн (Deirdre A. Lane) (Велика Британія), Ірен Ланг (Irene Lang) (Австрія), Атанасіос Дж. Маноліс (Athanasios J. Manolis) (Греція), Жуа Мораіс (Joao Morais) (Португалія), Хав’єр Морено (Javier Moreno) (Іспанія), Массімо Ф. П’єполі (Massimo F. Piepoli) (Італія), Франс Х. Руттен (Frans H. Rutten) (Нідерланди), Беата Средніава (Beata Sredniawa) (Польща), Хосе Л. Заморано (Jose L. Zamorano) (Іспанія) та Файє Заннад (Faiez Zannad) (Франція).
Абревіатури та акроніми
АПФ Ангіотензинперетворювальний фермент
ФП Фібриляція передсердь
AHA Американська кардіологічна асоціація
AMIOVIRT «Аміодарон у порівнянні з імплантованим кардіовертером-дефібрилятором»:
рандомізоване дослідження серед пацієнтів з неішемічною дилатаційною кардіоміопатією
та безсимптомною нестійкою тахікардією шлуночків
БРА Блокатор рецептора ангіотензину II
АКПШ Аритмогенна кардіоміопатія правого шлуночка
АВ Атріовентрикулярний
AVID «Протиаритмічні лікарські засоби в порівнянні з імплантованим дефібрилятором»
CARE-HF «Серцева ресинхронізація – серцева недостатність (CArdiac REsynchronization – Heart Failure)»
CASH Дослідження «Зупинка серцевої діяльності», Гамбург
CAT Дослідження «Кардіоміопатія»
ДІ Довірчий інтервал
CIDS Канадське дослідження імплантованого дефібрилятора
СМР Серцевий магнітний резонанс
COMPANION Дослідження «Порівняння терапії лікарськими засобами, стимуляції ритму серця та дефібриляції при серцевій недостатності»
СРТ Серцева ресинхронізуюча терапія
СРТ-ІКД Бівентрикулярний електрокардіостимулятор з функцією кардіоверсії-дефібриляції
СРТ-ЕКС Бівентрикулярний електрокардіостимулятор
ДКМП Дилатаційна кардіоміопатія
DEFINITE Дослідження лікування за допомогою дефібриляторів при неішемічній кардіоміопатії
ЕКГ Електрокардіограма/електрокардіографічний
EHRA Європейська асоціація серцевого ритму (European Heart Rhythm Association)
ESC Європейське товариство кардіологів (European Society of Cardiology)
СН Серцева недостатність
СНЗФВ Серцева недостатність із збереженням фракції викиду
СНЗнФВ Серцева недостатність із зниженою фракцією викиду
СР Співвідношення ризиків
ІКД Імплантований кардіовертер-дефібрилятор
БЛНПГ Блокада лівої ніжки пучка Гіса
LMNA Ламін A/C
ЛШ Лівий шлуночок/лівошлуночковий
ФВ ЛШ Фракція викиду лівого шлуночка
ВТЛШ Виносний тракт лівого шлуночка
MADIT Багатоцентрове дослідження імплантації автоматичного дефібрилятора
MIRACLE Багатоцентрове синхронізоване рандомізоване клінічне дослідження
АМР Антагоніст мінералокортикоїдного рецептора
мс мілісекунда
НШТ Нестійка шлуночкова тахікардія
NYHA Нью-Йоркська кардіологічна асоціація (New York Heart Association)
OPTIC Дослідження «Оптимальна фармакологічна терапія для пацієнтів з кардіовертером-дефібрилятором»
ВШ Відношення шансів
ШЕ Шлуночкова екстрасистолія
ПСШ Програмована стимуляція шлуночків
RAFT Дослідження «Ресинхронізація – дефібриляція при амбулаторному лікуванні серцевої недостатності»
БПНПГ Блокада правої ніжки пучка Гіса
РКД Рандомізоване контрольоване дослідження
REVERSE Дослідження «Заміна ремоделювання ресинхронізацією при систолічній дисфункції лівого шлуночка»
MIRACLE ICD Багатоцентрове синхронізоване рандомізоване клінічне дослідження ІКД
ВР Відносний ризик
ПШ Правий шлуночок
РСС Раптова серцева смерть
SCD-HeFT Дослідження «Раптова серцева смерть при серцевій недостатності»
ША Шлуночкова аритмія
ФШ Фібриляція шлуночків
ШТ Шлуночкова тахікардія
VTACH Дослідження «Абляція шлуночкової тахікардії при коронарній хворобі серця»
Коментар
керівника відділу серцевої недостатності Національного наукового центру «Інститут кардіології ім. М.Д. Стражеска» НАМН України, президента Української асоціації фахівців з серцевої недостатності, професора Л.Г. Воронкова
Вихід довгоочікуваних нових рекомендацій Європейського кардіологічного товариства з лікування пацієнтів зі шлуночковими аритміями (ША) та з попередження раптової серцевої смерті (РСС), безперечно, є значущою подією як для кардіологів, так і для фахівців з інвазивної аритмології, у тому числі тих, що працюють в Україні. Високий методологічний та науковий рівень зазначеного документа є запорукою того, що на найближчі кілька років він буде базою для реалізації відповідних профілактичних і лікувальних заходів у кардіологічних пацієнтів.
Пропоновані увазі читачів 6-й та 7-й розділи зазначених рекомендацій стосуються лікування ША і профілактики РСС у пацієнтів із серцевою недостатністю (СН)/дисфункцією лівого шлуночка (ЛШ) та з кардіоміопатіями. Порівняно з попередніми редакціями аналогічного документа відповідно до розширення набутої доказової бази в більшому обсязі й більш деталізовано викладено положення, що стосуються використання сучасних високотехнологічних лікувальних методів – імплантованих кардіовертерів-дефібриляторів (ІКД), кардіоресинхронізуючої терапії (КРТ) та катетерної абляції. Поряд з тим достатня увага приділяється медикаментозним методам профілактики й контролю ША, які, як видно з документа, застосовуються як самостійно, так і в комбінації зі згаданими вище немедикаментозними технологіями. Варто зазначити, що у пацієнтів із систолічною дисфункцією ЛШ (як коронарогенної, так і некоронарогенної природи) єдиним фармакологічним засобом, що чинить ефективну супресію ША і водночас не спричиняє погіршення клінічного прогнозу, є аміодарон. Слід звернути увагу, що застосування останнього, поряд із катетерною абляцією, розглядається як рекомендована опція (класи І, ІІа) у випадках рецидивів стійкої ШТ на фоні використання ІКД та у пацієнтів з нападами стійкої ШТ без ІКД. Остання позиція є найбільш актуальною в нашій країні, де, на жаль, застосування превентивної ІКД-стратегії у зазначеної категорії хворих залишається з відомих причин проблематичним. Наразі маємо не втрачати надію на відповідне покращення ситуації в майбутньому, мобілізовуючи увесь наявний арсенал медикаментозних призначень та втручань у кожному індивідуальному випадку.
Вступ
Цей документ створений як Європейське оновлення керівництва Американського коледжу кардіології (ACC)/Американської кардіологічної асоціації (AHA)/ESC 2006 р. щодо лікування пацієнтів зі шлуночковими аритміями (ША) та попередження раптової серцевої смерті (РСС)1. У світлі найновіших погоджувальних документів щодо лікування пацієнтів з ША, випущених визнаними міжнародними товариствами, які займаються проблемами ритму серця2, 3, Комітет з розробки керівництв ESC вирішив зосередити зміст цього документа на попередженні РСС.

Оновлення вносяться регулярно з урахуванням нових аналітичних висновків щодо природного перебігу захворювань, які провокують РСС, та результатів завершених масштабних досліджень, що можуть вплинути на методи лікування серцевої недостатності (СН), включаючи як фармакологічні засоби, так і апаратну терапію.
6. Терапевтичні підходи до лікування пацієнтів з дисфункцією лівого шлуночка за наявності або відсутності серцевої недостатності
ША виявляють у більшості пацієнтів із СН, і раптова смерть часто трапляється в цій популяції пацієнтів1, 8, 295, 296. Наявність та тяжкість ША зростають разом із тяжкістю СН, але їх цінність щодо прогнозу раптової смерті нез’ясована297-300. Дійсно, визначати підвищений ризик раптової смерті у пацієнтів із СН сумнозвісно важко, а єдиним відомим встановленим – та незалежним – зв’язком є зв’язок з тяжкістю дисфункції ЛШ або ФВ ЛШ.
6.1. Первинне попередження раптової серцевої смерті
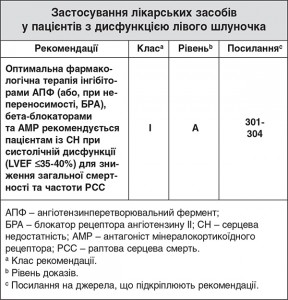
6.1.1. Лікарські засоби
Інгібітори АПФ, бета-блокатори та АМР рекомендуються пацієнтам із СН при систолічній дисфункції (ФВ ЛШ ≤35-40%), оскільки вони знижують загальну та раптову смертність8 (див. розділ 5).
Інгібітори АПФ знижують загальну смертність на 15-25% та рекомендуються всім пацієнтам зі зниженою ФВ ЛШ8, 305.
Бета-блокатори знижу ють смертність на ~35% та мають протиішемічні властивості, які призводять до специфічної протиаритмічної дії, і такі препарати особливо знижують частоту раптової смерті.8 Останні дані Групи співпраці з питань застосування бета-блокаторів при серцевій недостатності піддали сумніву клінічне твердження про те, що бета-блокатори покращують прогноз для пацієнтів із СН та ФП, і вони наполягають, що клініцисти мають обирати терапію відповідно до підгрупи пацієнтів із СН306. Для подальшого дослідження цього провокативного спостереження автори визнають, що «терміново необхідні та з нетерпінням очікуються дані досліджень саме пацієнтів із СН та ФП»307.
АМР знижують смертність та рівень раптової смерті серед пацієнтів із СН, які вже приймали інгібітори АПФ та терапію бета-блокаторами143, 308, 309. У найновішому дослідженні із застосуванням еплеренону 20% пацієнтів також мали імплантовані апарати (ІКД або бівентрикулярний кардіостимулятор), але препарат був однаково ефективним як у пацієнтів з апаратною терапією, так і без такої309. Такий сприятливий ефект АМР на частоту РСС серед пацієнтів із систолічною дисфункцією ЛШ був підтверджений метааналізом шести досліджень, який показав, що у пацієнтів, які отримували терапію АМР, спостерігалася на 23% менша імовірність РСС порівняно з контрольною групою [ВР 0,77 (95% ДІ 0,66-0,89), p=0,001]310. Діуретики та дигоксин все ще застосовуються багатьма пацієнтами із СН, але вони не знижують загальної або раптової смертності. Тільки блокатори рецепторів ангіотензину та івабрадин рекомендуються підгрупам пацієнтів із СН8. Аміодарон не впливає на результати лікування пацієнтів із СН132, а з урахуванням частоти прояву його токсичності8 цей препарат не рекомендується для загального застосування у таких пацієнтів. Втім, у випадках симптоматичної шлуночкової (тахі-)аритмії у пацієнтів із СН (наприклад, пацієнти, які страждають від імпульсів дефібрилятора або нестійкої ША, що спричиняє симптоми) аміодарон є протиаритмічним препаратом вибору через те, що він не погіршує результати лікування132. Інші протиаритмічні препарати не рекомендуються пацієнтам із СН з міркувань безпеки8.
За останні 10 років поширилася думка про те, що у багатьох пацієнтів з ознаками та симптомами СН спостерігається нормальна або збережена фракція викиду (СНЗФВ)8, 311. Багато методів лікування, що покращують виживання при СН зі зниженою фракцією викиду (СНЗнФВ), менш ефективні при СНЗФВ. Відносно велика частка таких пацієнтів мають несерцеві супутні захворювання, і тому раптова смерть трапляється часто312, а достатньо потужних досліджень із застосуванням ІКД та бівентрикулярного кардіофібрилятора немає. Стали доступними (у 2005 р.) найбільш широкомасштабні дослідження препаратів, які застосовуються при СН, проведені до позитивних результатів значущих досліджень ІКД63, 64 та бівентрикулярного електрокардіостимулятора313, 314; свідчення цих досліджень призвели до появи потужних рекомендацій керівництв щодо СН та шаленого росту частоти їх застосування7, 315.
6.1.2. Імплантовані кардіовертери-дефібрилятори
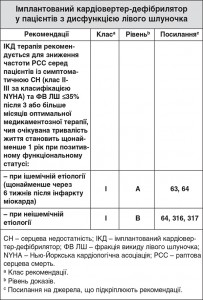
Ранні дослідження щодо цінності ІКД при дисфункції ЛШ були проведені серед пацієнтів з попередньою зупинкою серця (тобто превентивні заходи були вторинними) або серед таких, які потребували додаткових електрофізіологічних критеріїв1. Два великі дослідження надали дані щодо первинного попередження РСС за допомогою ІКД серед пацієнтів із СН та зниженою ФВ ЛШ: дослідження SCD-HeFT64 та «Багатоцентрове дослідження імплантації автоматичного дефібрилятора II» (MADIT-II) 63, 318. У SCD-HeFT застосування ІКД було пов’язане зі зниженням ризику смерті на 23% [співвідношення ризиків (СР) 0,77 (95% ДІ 0,62-0,96), p=0,007] та абсолютним зниженням смертності на 7% через 5 років (з 29 до 22%). При застосуванні ІКД показник раптової смерті знизився на 60%319. Вплив на загальну смертність не відрізнявся залежно від ішемічного та неішемічного походження СН, але спостерігалася різниця залежно від класу за класифікацією NYHA: ІКД були дуже ефективними серед пацієнтів класу II, але помітного впливу на смертність серед пацієнтів класу III не було. В MADIT-II серед пацієнтів групи застосування ІКД загальна смертність занизилася на 31% [СР 0,69 (95% ДІ 0,51-0,93), p=0,016], а пізніший аналіз цього дослідження показав, що користь застосування ІКД у цій популяції мала залежність від часу318 з більшою перевагою у пацієнтів, чий індекс інфаркту міокарда був віддаленіший від рандомізації. Одночасно з багатьма даними, які свідчать на користь застосування ІКД у пацієнтів, що перенесли інфаркт міокарда (тобто ішемічної етіології), серед пацієнтів з СНЗнФВ з неішемічною етіологією також спостерігається зниження загальної та аритмічної смертності. У «Дослідженні лікування за допомогою дефібриляторів при неішемічній кардіоміопатії» (DEFINITE)316 спостерігалося незначне зниження смертності в групі застосування ІКД [СР 0,65 (95% ДІ 0,40-1,06), p=0,08], тоді як показник раптової серцевої смертності значно знизився [HR 0,20 (95% ДІ 0,06-0,71), p=0,006]. У дослідженні SCD-HeFT63 тенденція до зниження загальної смертності [СР 0,73 (95% ДІ 0,50-1,07), p=0,06] спостерігалася серед пацієнтів без попередньо перенесеного інфаркту (та з неішемічною СН). У тому ж дослідженні серед пацієнтів з ішемічною етіологією також спостерігалася лише тенденція до зниження загальної смертності [СР 0,79 (95% ДІ 0,60-1,04), p=0,05], ймовірно, через те, що дві підгрупи були надто малими для досягнення статистичної значущості63. Відповідно, в метааналізі п’яти досліджень первинного попередження із залученням 1854 пацієнтів з неішемічною СН, проведеному Дезаі (Desai) та співавт.317, застосування ІКД було пов’язане зі значним, на 31%, зниженням загальної смертності [СР 0,69 (95% ДІ 0,55-0,87), p=0,002]. ІКД терапія не рекомендується пацієнтам із СН на останній стадії (клас IV за класифікацією NYHA) та іншим пацієнтам, чия очікувана тривалість життя становить менше 1 року.
Останнім часом немає РКД, які б демонстрували цінність ІКД у пацієнтів без проявів симптомів (клас I за класифікацією NYHA) при систолічній дисфункції (ФВ ЛШ ≤35-40%) або у пацієнтів із СН та збереженою ФВ ЛШ >40-45%, тому ІКД не рекомендується в них як первинний запобіжний захід.
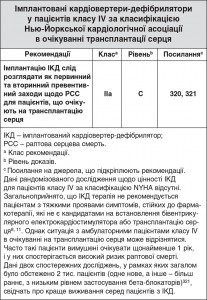
6.1.3. Імплантовані кардіовертери-дефібрилятори у пацієнтів класу IV за класифікацією Нью-Йоркської кардіологічної асоціації в очікуванні трансплантації серця
6.1.4. Серцева ресинхронізуюча терапія
6.1.4.1. Серцева недостатність при зниженій фракції викиду лівого шлуночка та пацієнти класу III за класифікацією Нью-Йоркської кардіологічної асоціації/амбулаторні пацієнти класу IV
Для пацієнтів із синусовим ритмом рекомендації надано відносно морфології з БЛНПГ порівняно з її відсутністю, а також тривалості QRS (120-150 мс порівняно з понад 150 мс)10 (табл. А цього розділу). Для пацієнтів з ФП рекомендації надано в таблиці B цього розділу.
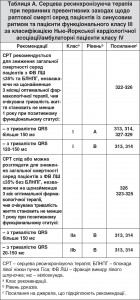
Два великі РКД [дослідження «Порівняння терапії лікарськими засобами, стимуляції ритму серця та дефібриляції при серцевій недостатності» (COMPANION)313 та дослідження «Серцева ресинхронізація – серцева недостатність» (CARE-HF)314] серед пацієнтів із СН від помірної до тяжкої (клас III-IV) та синусовим ритмом показали, що СРТ зменшує частоту ускладнень та смертність у цій популяції.
COMPANION залучило пацієнтів із СНЗнФВ при тривалості QRS ≥120 мс. При порівнянні з пацієнтами тільки на оптимальній фармакологічній терапії спостерігалася тенденція до зниження загальної смертності при СРТ пейсмейкері (СРТ-ЕКС) [СР 0,76 (95% ДІ 0,58-1,01), p=0,059], та при СРТ-ІКД відбувалося зниження загальної смертності на 36% [СР 0,64 (95% ДІ 0,48-0,86), p=0,003]. СРТ-ІКД, але не СРТ-ЕКС, знижує рівень РСС у цьому дослідженні.
Також при тривалості QRS ≥120 мс у дослідженні CARE-HF необхідно було дотримуватися додаткових критеріїв десинхронії серед пацієнтів з QRS інтервалом 120-149 мс. СРТ-ЕКС знизив загальну смертність на 36% [СР 0,64 (95% ДІ 0,48-0,85), p<0,002]64. У розширеному звіті дослідження CARE-HF (середній період подальшого спостереження 37 міс) СРТ-ЕКС також знизив показник раптової смерті на 46% [СР 0,54 (95% ДІ 0,35-0,84), р=0,005], зі зниженням загальної смертності на той момент на 40% [СР 0,60 (95% ДІ 0,47-0,77), p<0,001] 335.
Разом дослідження COMPANION та CARE-HF надають потужні свідчення на користь застосування СРТ (СРТ-ЕКС або СРТ-ІКД) у пацієнтів із СНЗнФВ з проявами симптомів від помірних до тяжких з подовженою тривалістю QRS, особливо з морфологією БЛНПГ. Кілька інших досліджень, реєстрових та метааналізів, звернулися до проблеми відповіді на СРТ, ґрунтуючись на QRS морфології, і більшість з них підтвердили думку про те, що QRS морфологія при БЛНПГ визначає підгрупу пацієнтів з більшою перевагою (стислий огляд основних досліджень, реєстрових та метааналізів наведено тут).
Дані реєстрового дослідження ІКД326, отримані від Medicare, яке охоплювало 14 946 пацієнтів, показали, що СРТ-ІКД не був ефективним для пацієнтів з БПНПГ, як видно з підвищення смертності за 3 роки БПНПГ порівняно з БЛНПГ [СР 1,37 (95% ДІ 1,26-1,49), p<0,001]. Дослідження «Заміна ремоделювання ресинхронізацією при систолічній дисфункції лівого шлуночка» (REVERSE)336 підтвердило зниження в комбінованому клінічному результаті тільки у пацієнтів з БЛНПГ (ВР 0,53; p<0,0032) та показало відсутність переваг для пацієнтів не з БЛНПГ (ВР 0,74; р=0,21). Аналогічно аналіз QRS морфології в дослідженні MADIT-CRT322 показав зниження первинного очікуваного результату у пацієнтів з БЛНПГ QRS морфологією (СР 0,47; p<0,001), але не серед пацієнтів не з БЛНПГ QRS морфологією (HR 1,24, p=0,257). Також цікаво, що ризики ШТ, ФШ та смерті були значно зниженими тільки у пацієнтів з БЛНПГ. Нещодавно опублікований довготривалий аналіз залучених пацієнтів у дослідження MADIT-CRT148 підтверджує, що через 7 років подальшого спостереження користь СРТ-ІКД стосовно виживання спостерігалася тільки у пацієнтів з БЛНПГ QRS морфологією [СР 0,59 (95% ДІ 0,43-0,80), p<0,001], тоді як пацієнти не з БЛНПГ QRS морфологією продемонстрували відсутність ефекту та ймовірну шкоду, пов’язану із СРТ-ІКД [СР 1,57 (95% ДІ 1,03-2,39) p=0,04]. Коли дані дослідження «Ресинхронізація – дефібриляція при амбулаторному лікуванні серцевої недостатності» (RAFT) були проаналізовані, на основі QRS морфології СРТ продемонстрована більша користь серед пацієнтів з БЛНПГ порівняно не з БЛНПГ морфологією323. Цікаво, що у пацієнтів не з БЛНПГ QRS морфологією при QRS >160 мс спостерігалося помірне зниження первинного результату лікування [СР 0,52 (95% ДІ 0,29-0,96), p=0,033]. Незважаючи на той факт, що в цій групі було лише 53 пацієнти, ймовірна користь СРТ при не БЛНПГ QRS морфології за наявності помітного подовження QRS (QRS ≥160 мс) варта вивчення. Це спостереження підтримується результатами метааналізу, проведеного Кліландом (Cleland) та співавт.334 із залученням даних досліджень CARE-HF, багатоцентрового синхронізованого рандомізованого клінічного дослідження (MIRACLE), REVERSE, багатоцентрового синхронізованого рандомізованого клінічного дослідження ІКД (MIRACLE ICD) та RAFT. Незважаючи на виявлену користь СРТ у пацієнтів з БЛНПГ при однофакторному аналізі, результати багатофакторної моделі передбачають, що тільки тривалість QRS прогнозувала обсяг впливу СРТ на результат терапії. Нері (Nery) та співавт.324 представили метааналіз клінічних досліджень СРТ, зосереджених на 485 пацієнтах з БПНПГ QRS морфологією, і показали відсутність користі ресинхронізаційної терапії [СР 2,04 (95% ДІ 1,32-3,15), p=0,001] (на жаль, дані щодо тривалості QRS не надані).
Сіпахі (Sipahi) та співавт.325 провели метааналіз, в якому було вивчено 33 клінічні дослідження щодо впливу QRS морфології на СРТ, але тільки чотири з них (COMPANION, CARE-HF, MADIT-CRT та RAFT) включали результати відповідно до QRS морфології. Коли вони досліджували вплив СРТ на комбіновані побічні клінічні явища у 3349 пацієнтів з БЛНПГ на вихідному рівні, то виявили зниження ризику на 36% при застосуванні СРТ [RR 0,64 (95% ДІ 0,52-0,77), p<0,00001]. Втім, такої користі не спостерігалося серед пацієнтів не з БЛНПГ патологіями [RR 0,97 (95% ДІ 0,82-1,15), p=0,75]325. Цікаво, що при обмеженні аналізу дослідженнями без ІКД (CARE-HF та COMPANION) користь СРТ так само спостерігалася тільки у пацієнтів з БЛНПГ (p<0,000001).
В останньому великому метааналізі шести РКД (COMPANION, CARE-HF, MADIT-CRT, MIRACLE, RAFT та REVERSE)337, який включав 6914 учасників (1683 не з БЛНПГ QRS морфологією), СРТ не була пов’язана зі зниженням рівня смертності та/або частоти госпіталізації з приводу СН серед пацієнтів не з БЛНПГ QRS морфологією [СР 1,09 (95% ДІ 0,85-1,39)]337.
Таким чином, широкий QRS при не БЛНПГ морфології все ще залишається непевною сферою щодо застосування СРТ. На основі цих даних, незважаючи на той факт, що більшість пацієнтів в Європі отримують СРТ-ІКД314, наші рекомендації стосуються СРТ загалом.
Існують невідповідності в попередніх документах [керівництва Фонду Американського коледжу кардіології/AHA та погоджувального документа щодо стимуляції серцевого ритму Європейської асоціації серцевого ритму (EHRA)/ESC] стосовно класу рекомендацій щодо СРТ у пацієнтів з QRS між 120 та 150 мс. Згідно з даними метааналізу Сіпахі (Sipahi) та співавт.328 СРТ значно знизила загальну смертність або частоту госпіталізації серед пацієнтів з тривалістю QRS ≥150 мс [RR 0,60 (95% ДІ 0,53-0,67), p<0,001], але не серед пацієнтів з тривалістю QRS 120-150 мс [RR 0,95 (95% ДІ 0,82-1,10), p=0,49]. Втім, методологічні проблеми через складність аналізу в дослідженні, проведеному Сіпахі (Sipahi) та співавт., визначені338, і тому висновок про ефективність СРТ тільки у пацієнтів з тривалістю QRS ≥150 мс на сьогодні слід вважати виключно дослідницьким338. СРТ не рекомендується пацієнтам із СН при тривалості комплексу QRS <120 мс339.
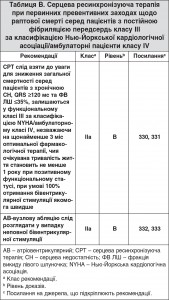
СРТ слід брати до уваги стосовно пацієнтів з ФП зі значно зниженою ФВ ЛШ, але така терапія не показала зниження смертності або частоти раптової смерті серед таких пацієнтів8, 340. У дослідженні RAFT у 229 (або 13% загальної популяції з 1798 осіб) пацієнтів спостерігалася ФП або тріпотіння на вихідному рівні327. Оскільки формально значної взаємодії між вихідним ритмом та ефектом лікування не було (ІКД порівняно з СРТ-ІКД, p=0,14), кількість пацієнтів в цьому дослідженні була малою, і вплив на пацієнтів з ФП або тріпотінням передсердь виявився меншим, ніж у таких із синусовим ритмом. Успіх СРТ у пацієнтів з ФП здебільшого визначався за ступенем бівентрикулярної стимуляції серцевого ритму, а у багатьох пацієнтів цього можна досягти лише за допомогою АВ-вузлової абляції10.
Оскільки рішення щодо проведення АВ-вузлової абляції у таких пацієнтів ще й досі є предметом певних суперечок, останні дані передбачають, що тривале виживання після СРТ серед пацієнтів з ФП, які пройшли АВ-вузлову абляцію, подібне до такого, що спостерігається серед пацієнтів із синусовим ритмом333. Підсумовуючи вищезазначене, СРТ можна розглядати у пацієнтів із СН, постійною ФП та ФВ ЛШ ≤35%, якщо: 1) необхідна стимуляція шлуночків та 2) майже 100% стимуляцій шлуночків досягається з допомогою СМР при АВ-вузловій абляції або фармакологічному регулюванні (рівень рекомендацій класу 2A-B).
6.1.4.2. Серцева недостатність при зниженій фракції викиду лівого шлуночка та пацієнти класу III, але зі слабко вираженими симптомами (клас II за класифікацією Нью-Йоркської кардіологічної асоціації)
У двох контрольованих дослідженнях рандомізували 3618 пацієнтів зі слабкою СН у групи оптимальної фармакологічної терапії та ІКД або оптимальної фармакологічної терапії та СРТ-ІКД327, 329.
Дослідження MADIT-CRT329 залучило 1820 пацієнтів зі слабко вираженою симптоматикою (клас I або II за класифікацією NYHA) та ФВ ЛШ ≤30% при тривалості QRS комплексу ≥130 мс. Первинний звіт показав зниження на 34% основного кінцевого показника загальної смертності або явищ СН [25,3% порівняно з 17,2% для ІКД порівняно із СРТ-ІКД; СР 0,66 (95% ДІ 0,52-0,84), p=0,001]. Відповідно до довгострокового звіту про наступне спостереження дослідження MADIT-CRT (середній період якого – 7 років)148 СРТ-ІКД значно знизив смертність [СР 0,59 (95% ДІ 0,43-0,80), p<0,001] порівняно з просто ІКД, що, втім, обмежувалося пацієнтами з БЛНПГ на вихідному рівні, тоді як сприятливого впливу у таких без БЛНПГ не спостерігалося (p<0,001 для взаємодії) (табл. C цього розділу).
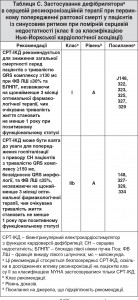
Дослідження RAFT327 залучило 1798 пацієнтів із СН від слабкої до помірної (клас II або III за класифікацією NYHA), ФВ ЛШ ≤30% та тривалістю QRS комплексу ≥120 мс (або стимульована тривалість QRS комплексу ≥200 мс). Порівняно з пацієнтами, які застосовували тільки ІКД, група СРТ-ІКД показала зниження RR на 25% при загальній смертності [СР 0,75 (95% ДІ 0,62-0,91), p=0,003], що підтверджує систематичне застосування СРТ у пацієнтів із СНЗнФВ при слабкому прояві симптомів.
6.2. Шлуночкова екстрасистолія у пацієнтів зі структурним захворюванням серця/дисфункцією лівого шлуночка
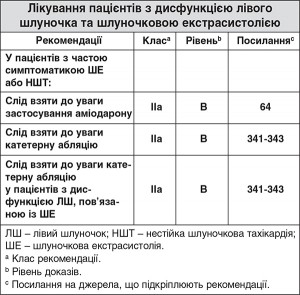
ШЕ та цикли НШТ часто зустрічаються у пацієнтів з дисфункцією ЛШ і можуть бути наслідком або причиною дисфункції ЛШ. ШЕ та цикли НШТ у суб’єкта зі структурним захворюванням серця сприяють підвищенню ризику смертності, а більше 10 ШЕ на годину або циклів НШТ є припустимим маркером підвищеного ризику344. Якщо у пацієнтів проявляються симптоми через ШЕ або НШТ, або у випадку сприяння ШЕ або НШТ зниженню ФВ ЛШ («кардіоміопатія, спровокована тахікардією»), слід взяти до уваги застосування аміодарону.
Високе навантаження ШЕ (понад 24%) у пацієнтів з дисфункцією ЛШ та порівняно короткий інтервал зчеплення ШЕ (менше 300 мс) передбачає кардіоміопатію, спровоковану ШЕ342. Катетерна абляція у таких пацієнтів може пригнічувати ШЕ та відновлювати функцію ЛШ341.
6.3. Стійка шлуночкова тахікардія
6.3.1. Терапія лікарськими засобами
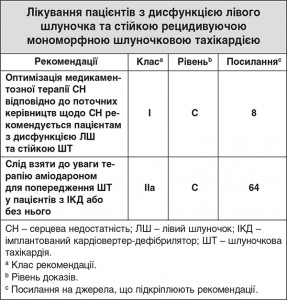
Пацієнтів з дисфункцією ЛШ за наявності або без СН, яка проявляється стійкою ШТ, слід лікувати відповідно до поточних опублікованих керівництв щодо СН, подібно до пацієнтів з дисфункцією ЛШ без ШТ8. Крім того, терапія стійкої ШТ лікарськими засобами має бути спрямована на максимальну симпатичну блокаду. В дослідженні MADIT-II пацієнти з ІКД, які отримували терапію найвищими дозами бета-блокаторів, мали значне зниження частоти нападів рецидиву ШТ або ФШ, викликаних інтервенцією ІКД, порівняно з пацієнтами, які не приймали бета-блокатори [СР 0,48 (95% ДІ 0,26-0,89), p=0,02]8. Дослідження «Оптимальна фармакологічна терапія для пацієнтів з кардіовертером-дефібрилятором» (OPTIC) порівнювало застосування бета-блокаторів, соталолу та бета-блокаторів у комбінації з аміодароном для попередження імпульсів ІКД156. Аміодарон у комбінації з бета-блокаторами значно знижує ризик імпульсу порівняно з монотерапією бета-блокаторами [СР 0,27 (95% ДІ 0,14-0,52), p<0,001] та соталолом [СР 0,43 (95% ДІ 0,22-0,85), p=0,02]. Втім, припинення прийому препарату частіше траплялося у пацієнтів, які приймали соталол або аміодарон у комбінації з бета-блокатором. Рівень припинення прийому досліджуваного препарату в 1 рік становив 18,2% для аміодарону, 23,5% для соталолу та 5,3% для монотерапії бета-блокатором.
У дослідженні SCD-HeFT пацієнти з дисфункцією ЛШ та СН класу II або III за класифікацією NYHA отримували звичайну СН-терапію, звичайну терапію в комбінації з аміодароном або звичайну терапію та застосовували однокамерний ІКД64. Порівняно зі звичайною СН-терапією додавання аміодарону не підвищило рівень смертності.
6.3.2. Катетерна абляція
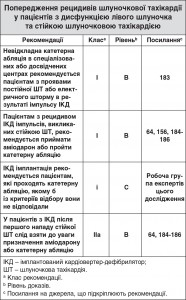
Залежно від основного субстрату катетерна абляція при стійкій ШТ може призвести до різкого припинення та зниження частоти рецидивів ШТ у пацієнтів зі структурним захворюванням серця.
6.3.2.1. Пацієнти з дисфункцією лівого шлуночка
У пацієнтів з дисфункцією ЛШ та стійкою ШТ повторний вхід, опосередкований рубцем, є частим патофізіологічним механізмом, і абляція спрямована на критичний істмус із контуром повторного входу. ШТ здебільшого мономорфна. Якщо ЕКГ у 12 відведеннях клінічної ШТ недоступна пацієнтам з ІКД, довжина циклу збереженої електрограми ІКД під час ШТ може полегшити визначення клінічної ШТ при електрофізіологічному обстеженні. Зазвичай застосовуються зрошувані абляційні катетери, які сприяють глибшому формуванню ураження та знижують ризик формування опіку під час передачі енергії. Наразі найкраща аблятивна стратегія невідома. РКД порівняння катетерної абляції під час ШТ при підході на основі субстрату недостатньо. Крім того, немає згоди щодо ідеального результату процедури. При виключенні всіх клінічних ШТ неіндуцибельність ШТ після абляції може бути кращим кінцевим результатом процедури.
У пацієнтів можуть траплятися електричні шторми. Катетерна абляція може різко припинити такі явища з потенційною загрозою для життя та знижувати рівень рекурентних нападів електричного шторму порівняно із застосуванням тільки медикаментозної терапії183. Пацієнти із ШТ, пов’язаною з рубцем після інфаркту міокарда, схильні до кращого результату після катетерної абляції, ніж пацієнти із ШТ, спричиненою неішемічною кардіоміопатією. П’ять проспективних досліджень вивчали роль катетерної абляції в лікуванні стійкої ШТ184-188. Автори багатоцентрового дослідження катетерів «Термокул» повідомили про значний успіх, визначений як усунення всіх індуцибельних ШТ на 49% та середньострокове звільнення від ШТ на 53% впродовж понад 6 міс наступного спостереження185. У дослідженні багатоцентрової групи дослідників охолоджених РЧ значний успіх, визначений як виключення всіх індуцибельних ШТ, був досягнутий у 41% пацієнтів184. Звільнення від рецидиву ША було зареєстровано у 46% пацієнтів під час наступного спостереження впродовж 8±5 міс. У проспективному дослідженні Євро-ШТ абляція була успішною у 81% пацієнтів, а звільнення від рецидиву ШТ досягли 51% пацієнтів186. Дослідження «Картування субстрату та абляція при синусному ритмі для припинення тахікардії» (SMASH-VT) вивчало роль катетерної абляції у лікуванні пацієнтів з попереднім інфарктом міокарда та зниженою ФВ ЛШ187. Пацієнти проходили імплантацію ІКД з приводу ФШ, гемодинамічно нестабільної ШТ або синкопе при індуцибельній ШТ під час інвазивного електрофізіологічного тестування. Контрольна група проходила тільки імплантацію ІКД. Ніхто з пацієнтів не приймав протиаритмічні препарати. Катетерна абляція проводилася із застосуванням субстрат-спрямованого підходу, націленого на аномальні потенціали шлуночка під час синусного ритму без необхідності провокації ШТ.
Упродовж середнього періоду наступного спостереження 23±6 міс відбулося значне зниження частоти нападів ШТ: із 33% у контрольній групі до 12% у групі проведення абляції. Більше того, після катетерної абляції рівень адекватних імпульсів ІКД знизився з 31 до 9%.
Дослідження «Абляція шлуночкової тахікардії при коронарній хворобі серця» (VTACH) проспективно рандомізувало пацієнтів з попереднім інфарктом міокарда на групу зниженої фракції викиду (≤50%) та гемодинамічно стабільної ШТ для проходження катетерної абляції або групу з відсутньою додатковою терапією, окремо від ІКД188. Первинним очікуваним результатом був час до першого рецидиву ШТ або ФШ. Рівень виживання без рецидиву ШТ понад 24 міс був вищим у групі проходження абляції порівняно з контрольною групою [47% порівняно з 29%, СР 0,61 (95% ДІ 0,37-0,99), p=0,045]. Середня кількість адекватних імпульсів ІКД на пацієнта на рік знизилася з 3,4±9,2 до 0,6±2,1 у пацієнтів, що пройшли абляцію (p=0,018). Катетерна абляція не вплинула на смертність.
Загалом рівень успіху катетерної абляції при ШТ визначається обсягом рубцевого навантаження у зв’язку з інфарктом, представленим як ділянки низької напруги в системі електроанатомічного картування209, тоді як вузькоспеціалізовані відділення для лікування пацієнтів, що проходять катетерну абляцію ШО, можуть позитивно впливати на результат210.
6.3.2.2. Шлуночкова тахікардія з циркулюючим збудженням ніжки пучка Гіса
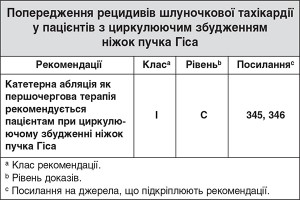
Тахікардія з циркулюючим збудженням ніжки пучка Гіса є рідкісною macro-re-entry тахікардією, яка зазвичай охоплює праву ніжку пучка Гіса як антероградну та ліву ніжку як ретроградну кінцівку. БЛНПГ морфологію з відхиленням лівої осі видно при 12-канальній поверхневій ЕКГ. Повторний вхід ніжки пучка Гіса часто пов’язаний з кардіоміопатією347. Катетерна абляція однієї з ніжок пучка Гіса є радикальним способом лікування, однак права ніжка є кращою мішенню, оскільки доступ до неї при абляції простіший347. Якщо основне структурне порушення залишається незмінним, слід ретельно продумати одночасне встановлення ІКД347.
6.3.3. Імплантований кардіовертер-дефібрилятор
Імплантація ІКД пацієнтам зі стійкою ШТ збільшує виживання порівняно з протиаритмічною медикаментозною терапією. Дотепер дослідження порівняння катетерної абляції при стійкій ШТ без імплантації ІКД та самої імплантації ІКД не проводилися. З огляду на мізерність даних та досить високий рівень рекурентності після катетерної абляції при стійкій ШТ слід взяти до уваги імплантацію ІКД у всіх пацієнтів з дисфункцією ЛШ (фракція викиду менше 45%) та стійкою ШТ.
7. Кардіоміопатії
Кардіоміопатії – це захворювання міокарда, що характеризуються структурними та функціональними аномаліями міокарда шлуночків, причинами яких є не тільки стеноз, що обмежує кровотік у коронарних артеріях, або умови навантаження, що виходять за межі норми348. Вони згруповані за морфологічними і функціональними характеристиками, з розподілом на сімейні і несімейні форми. Майже всі види кардіоміопатії можуть бути пов’язані зі шлуночковою аритмією і підвищеним ризиком раптової серцевої смерті, що варіює залежно від етіології і тяжкості хвороби.
7.1. Дилатаційна кардіоміопатія (ДКМП)
7.1.1. Визначення, епідеміологія та дані щодо виживаності
ДКМП визначається як дилатація ЛШ і систолічна дисфункція за відсутності патологічних умов навантаження або ішемічної хвороби серця (ІХС), достатньої, щоб викликати загальне систолічне порушення348. Деякі генетичні дефекти, які викликають ДКМП, також можуть спричинити систолічну дисфункцію без дилатації лівого шлуночка або призвести до утворення рубців міокарда, що можна виявити тільки за допомогою МРТ серцево-судинної системи.
ДКМП зустрічається у людей різного віку і різної етнічної приналежності. Серед дорослих ця хвороба частіше спостерігається у чоловіків, ніж у жінок, із загальною частотою 1 випадок на 2500 осіб та приблизно розрахованою щорічною захворюваністю 7 випадків на 100 000349. У дітей рівень щорічної захворюваності становить 0,57 випадку на 100 000350.
Потенційно патогенні генетичні мутації зустрічаються щонайменше у 20% дорослих із ДКМП, і у 10-20% родичів наявні ознаки хвороби при клінічному обстеженні351. Мутації генів білків саркомерів і десмосом є найбільш поширеними, але мутації в гені, що кодує ламін A/C (LMNA) і десмін, часто спостерігаються у пацієнтів з порушеннями провідності серця352, 353. Невелика частка пацієнтів мають зчеплене з Х-хромосомою захворювання, викликане мутацією в гені, що кодує дистрофін. Значний спектр набутих порушень можуть викликати ДКМП, у тому числі запальні, інфекційні і системні захворювання, а також різні лікарські засоби і токсини. У деяких випадках генетична схильність пацієнтів до розвитку ДКМП проявляється після впливу екзогенних провокуючих факторів, таких як інфекції, цитотоксичні лікарські засоби, алкоголь і вагітність.
7.1.2. Підхід до стратифікації та управління ризиками
Рівень загальної смертності у суцільній виборці дорослих пацієнтів з ДКМП значно знизився при використанні нейрогуморальних антагоністів і ресинхронізуючої терапії358. Рівень смертності у дітей з ДКМП є відносно високим протягом першого року життя, але згодом у багатьох із них відновлюється функція або їх стан залишається клінічно стабільним359. Основними серцево-судинними причинами смерті при ДКМП є прогресуюча СН і РСС, вторинні до ША або, рідше, брадиаритмії. Багато неінвазивних параметрів було запропоновано як прогностичні фактори раптової смерті, але в недавньому метааналізі 45 досліджень за участю 6088 пацієнтів за допомогою функціональних та електрокардіографічних параметрів було виявлено тільки помірну відмінність між пацієнтами з високим і низьким рівнем ризику. Найвище відношення шансів (ВШ) спостерігалося для фрагментованого комплексу QRS і альтернації зубця Т; жоден з тестів вегетативної нервової системи не був значущим прогностичним фактором115. Роль МРТ серцево-судинної системи оцінювали в метааналізі дев’яти досліджень у пацієнтів з неішемічною кардіоміопатією360, дійшовши висновку, що пізнє посилення гадолінієм у пацієнтів пов’язане з підвищеним ризиком загальної смертності, госпіталізації з приводу СН і РСС. Зростаюче значення пізнього посилення гадолінієм порівняно з іншими прогностичними маркерами потребує подальшого визначення.
Інвазивне EPS з ПСШ може бути доцільним у пацієнтів з ДКМП115.
7.1.2.1. Дослідження терапії із застосуванням імплантованого кардіовертера-дефібрилятора при дилатаційній кардіоміопатії
У низці досліджень порівнювали ІКД як монотерапію або в комбінації із СРТ порівняно з плацебо або аміодароном у пацієнтів з ДКМП64, 151-154, 313, 316, 317, 354. Більшість досліджень було проведено в період, коли в схему оптимального медикаментозного лікування почали включати інгібітори АПФ, бета-блокатори та АМР358. Перші рандомізовані клінічні дослідження ІКД мали недостатні можливості для виявлення клінічно значущих відмінностей у рівнях виживаності, а в деяких випадках (наприклад, дослідження DEFINITE) загальна смертність була нижчою, ніж очікувалося до включення. Період подальшого спостереження був відносно коротким у деяких дослідженнях, а також в інших умовах, співвідношення адекватних шоків до прогнозу все ще залишається невизначеним. У жодному дослідженні не здійснювалась проспективна оцінка переваг ІКД у підгрупах пацієнтів з ДКМП різної етіології.
7.1.2.2. Первинна профілактика
У чотирьох рандомізованих дослідженнях [Дослідження кардіоміопатії/CArdiomyopathy Trial (CAT)361, Аміодарон у порівнянні з ІКД: рандомізоване дослідження у пацієнтів з неішемічною дилатаційною кардіоміопатією і безсимптомною нестійкою шлуночковою тахікардією (AMIOVIRT)354, DEFINITE316 і SCD-HeFT64] досліджували дію ІКД тільки для первинної профілактики РСС. У подальшому дослідженні, COMPANION313, порівнювали терапію СРТ-Д (дефібрилятор), СРТ-К (кардіостимулятор) і аміодароном у пацієнтів з тяжкою СН (клас III або IV за NYHA) та інтервалом QRS >120 мс. Дослідження відрізняються за дизайном: CAT, AMIOVIRT і DEFINITE включали пацієнтів з неішемічною ДКМП, тоді як у дослідженнях SCD-HeFT і
COMPANION брали участь пацієнти з ішемічною і неішемічною дисфункцією ЛШ. Тільки в дослідженні COMPANION було продемонстровано статистично значуще зниження частоти раптової смерті при ІКД порівняно з оптимальною медикаментозною терапією. Рівень загальної смертності був нижчим у групі СРТ-Д, ніж у групі фармакологічної терапії [ВР 0,50 (95% ДІ 0,29-0,88), p=0,015], але був пов’язаний зі значно вищим ризиком помірних або тяжких побічних ефектів з будь-яких причин (69% порівняно з 61% у групі медикаментозної терапії, p=0,03). Об’єднаний аналіз п’яти досліджень первинної профілактики (1854 пацієнти з неішемічною ДКМП) показав статистично значуще зниження рівня загальної смертності на 31% для ІКД відносно медикаментозної терапії [ВР 0,69 (95% ДІ 0,55-0,87), р=0,002]317. Цей ефект зберігався при виключенні дослідження COMPANION [ВР 0,74 (95% ДІ 0,58-0,96), p=0,02]317. Рекомендації з терапії ІКД у зазначеному керівництві базуються на цих аналізах.
7.1.2.3. Вторинна профілактика
У трьох дослідженнях (AVID153, CASH152 і CIDS151; див. веб-табл. 5) досліджували терапію ІКД для вторинної профілактики у пацієнтів з попередженою зупинкою серця або симптоматичною ШТ в анамнезі. У дослідженні CASH пацієнти були спочатку рандомізовані в групу ІКД або в групу одного з трьох лікарських засобів: аміодарону, метопрололу або пропафенону, але терапію пропафеноном було достроково припинено у зв’язку з підвищенням рівня смертності. В остаточному аналізі було об’єднано дані з груп аміодарону і метопрололу. У три дослідження було включено всього 1963 пацієнти, з яких тільки 292 (14,8%) мали неішемічну кардіоміопатію. Ані в дослідженні AVID, ані в дослідженні CIDS не було зареєстровано значного зниження рівнів загальної смертності при застосуванні терапії ІКД в підгрупі пацієнтів з неішемічною кардіоміопатією; не було отримано результатів для цієї підгрупи в дослідженні CASH. Дослідження CASH також відрізнялося від AVID і CIDS в тому, що середнє значення ФВ ЛШ було вищим і >50% пацієнтів отримували епікардіальні системи ІКД. У подальшому метааналізі, в якому були об’єднані дані з досліджень AVID і CIDS, спостерігалося незначне зниження рівня загальної смертності відносно медикаментозної терапії – на 31%154.
7.1.2.4. Смертність, викликана конкретною причиною
У кількох дослідженнях вивчали прогноз або лікування при певних підтипах ДКМП. Найбільш докладно описано спостереження за приблизно 5-10% пацієнтів, у яких захворювання було викликано мутацією в гені LMNA71, 352. У випадку хвороб серця, пов’язаних з LMNA, спостерігається вікова пенетрантність з раннім початком передсердної аритмії, з подальшим розвитком порушення серцевої провідності і високим ризиком раптової смерті, часто тільки з дилатацією ЛШ слабкого ступеня і систолічною недостатністю. У багатоцентровому реєстрі, що включає 269 носіїв мутації LMNA, багатофакторний аналіз показав, що нсШТ під час амбулаторного моніторингу ЕКГ, ФВ ЛШ <45% при першій оцінці, чоловіча стать і не міссенс-мутації (інерція-делеція/ вкорочення або мутації, що впливають на сплайсинг) були незалежними факторами ризику злоякісної ША71. Злоякісна ША була наявна тільки в осіб із щонайменше двома з цих факторів ризику, при цьому в них спостерігався кумулятивний ризик для кожного додаткового фактора ризику.
7.1.2.5. Ведення шлуночкової аритмії при дилатаційній кардіоміопатії
Пацієнти з ДКМП і рецидивуючою ША мають отримувати оптимальну медикаментозну терапію інгібіторами АПФ, бета-блокаторами та АМР згідно з рекомендаціями ESC для хронічної СН8. Очевидні провокуючі фактори відносно ША (наприклад, прийом проаритмічних лікарських засобів, гіпокаліємія) або супутні захворювання (наприклад, захворювання щитовидної залози) слід, за можливості, виявляти і лікувати. У раніше стабільних пацієнтів із вперше виявленою ША з груп помірного або високого ризику ІХС слід розглядати можливість проведення коронарної ангіографії. Застосування аміодарону необхідно розглядати у пацієнтів з ІКД, які зазнали повторних адекватних шоків, незважаючи на оптимальне програмування пристроїв229, але не варто використовувати для лікування безсимптомних епізодів нсШТ. Використання блокаторів натрієвих каналів і дронедарону не рекомендується у пацієнтів з порушеною функцією ЛШ через їх потенційні проаритмічні ефекти129, 152, 357, 362, 363.
7.1.2.6. Абляція при шлуночковій тахікардії
Субстрат для ШТ при ДКМП є дуже складним, відображаючи численні причини захворювання. У звіті досліджень з оцінки різних стратегій абляції вогнища ШТ при ДКМП у кращому випадку повідомляють про скромний успіх, який не покращується при проведенні епікардіального і ендокардіального картування. У недавньому реєстровому дослідженні, в якому порівнювали 63 пацієнтів без ішемічної кардіоміопатії і 164 – з ішемічною дисфункцією ЛШ208, абляція вогнища клінічної ШТ була досягнута тільки в 18,3% випадків неішемічної кардіоміопатії. Таким чином, катетерну абляцію вогнища ШТ у хворих з ДКМП необхідно призначати пацієнтам з чітким механізмом ШТ (наприклад, реципрокна шлуночкова тахікардія за участю ніжок пучка Гіса) і здійснювати її в лікувальних центрах з досвідченим персоналом.
7.2. Гіпертрофічна кардіоміопатія
7.2.1. Визначення, епідеміологія та дані щодо виживаності
ГКМ характеризується збільшенням товщини стінки ЛШ, що не пояснюється лише патологічними умовами навантаження на ЛШ116. Це визначення використовують і щодо дітей, і щодо дорослих, без жодних припущень щодо етіології, але для цілей цього керівництва рекомендації з профілактики ГКМ стосуються пацієнтів без метаболічних, інфільтративних або інших захворювань, які мають дуже визначений перебіг хвороби та лікування.
У дослідженнях, проведених у Північній Америці, Європі, Азії та Африці, повідомляється про поширеність гіпертрофії ЛШ незрозумілої етіології в діапазоні 0,02-0,23% у дорослих, з набагато нижчими рівнями у пацієнтів віком <25 років116. Хоча ГКМ найчастіше передається як аутосомно-домінантна генетична ознака, у більшості досліджень повідомляється про незначно більшу поширеність цього порушення серед чоловіків, а частота ГКМ у різних расових групах є аналогічною116.
У цілому річний рівень смертності із серцево- судинних причин і рівень смертності або адекватного розряду ІКД для ШТ/ФШ у суцільній вибірці дорослих з ГКМ становили 1-2 і 0,81%, відповідно364, 365. Іншими основними причинами серцево-судинної смерті є СН, тромбоемболія і АВ-блокада.
7.2.2. Підхід до стратифікації та управління ризиками
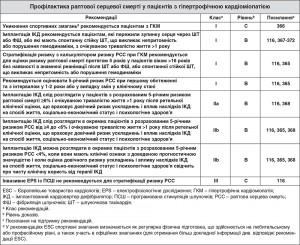
7.2.3. Шлуночкові аритмії при гіпертрофічній кардіоміопатії
При амбулаторному ЕКГ моніторингу нсШТ виявляється у ~25% пацієнтів373, 374. Її поширеність збільшується з віком і корелює з товщиною стінок ЛШ і пізнім посиленням гадолінієм на МРТ серцево-судинної системи375. Нестійка ШТ, виявлена при амбулаторному моніторингу, пов’язана з підвищеним ризиком РСС373. Документально підтверджена нсШТ протягом або відразу після фізичних навантажень зустрічається дуже рідко, але може бути пов’язаною з підвищеним ризиком РСС376.
Документально підтверджена стійка мономорфна ШТ (≥30 с) зустрічається нечасто, але може бути більш частою у пацієнтів з верхівковими аневризмами ЛШ. Наявність ІХС необхідно виключити у пацієнтів з тривалими або симптоматичними епізодами, якщо існують фактори ризику для коронарного атеросклерозу377. У пацієнтів, які погано переносять стійку ШТ, слід розглядати можливість проведення терапії ІКД та лікування бета-блокаторами або аміодароном, щоб попередити появу подальших епізодів. У пацієнтів з ознаками ШТ вогнищевого походження можна розглянути можливість проведення EPS і абляції.
7.2.4. Підхід до стратифікації та управління ризиками у дорослих пацієнтів
Історично ризик РСС у пацієнтів з ГКМ розраховували за допомогою простої оцінки на основі низки обраних клінічних параметрів367, 378, 379. Інші клінічні ознаки, такі як фіброз міокарда (що визначається за допомогою контрастної МРТ серцево-судинної системи), аневризми верхівки ЛШ і численні мутації гена білка саркомера, були запропоновані як ознаки, що можуть бути використані при проведенні терапії ІКД у окремих осіб з групи проміжного ризику, з незначною кількістю підтримуючих даних. У керівництві ESC щодо ГКМ рекомендується використовувати калькулятор (ризик РСС при ГКМ), за допомогою якого розраховують 5-річний ризик116.
Усі прогностичні змінні, що використовуються в моделі, пов’язані з підвищеним ризиком РСС у щонайменше одному опублікованому багатофакторному аналізі (http://doc2do.com/hcm/webHCM.html). Калькулятор призначений спеціально для використання в пацієнтів віком ≥16 років і не призначений для використання у професійних спортсменів або в осіб з метаболічними або інфільтративними захворюваннями (наприклад, хвороба Фабрі-Андерсона) і синдромами (наприклад, синдром Нунан). У моделі не використовують градієнти виносного тракту лівого шлуночка (ВТЛШ), індуковані фізичним навантаженням, і ця модель не була схвалена для використання до і після міоектомії або етанолової абляції міжшлуночкової перегородки.
Інвазивне EPS із ПСШ не допомагає при стратифікації ризику РСС у випадку ГКМ, і його регулярне використання у пацієнтів із синкопе або симптомами, що свідчать про наявність аритмії, не рекомендується116.
На відміну від недавно випущених керівництв щодо ГКМ116 ми не включили рекомендацію III класу для пацієнтів з розрахованим ризиком <4% на 5 років, з урахуванням ступеня невизначеності в оцінці ризику, що вимагає обережності при виключенні категорії пацієнтів з терапії ІКД.
7.2.5. Підхід до стратифікації та управління ризиками у пацієнтів дитячого віку
У пацієнтів віком <16 років імплантація ІКД (епікардіальна у разі необхідності) рекомендується після загрозливої для життя ША. Існує недостатньо даних щодо використання клінічних маркерів ризику при проведенні первинної профілактики, особливо в дуже маленьких дітей (<8 років). В існуючому керівництві ESC рекомендується розглядати тяжку гіпертрофію ЛШ (визначається як максимальна товщина стінки ЛШ ≥30 мм або Z-показник ≥6), непритомність незрозумілої етіології, нсШТ та раптову смерть у сімейному анамнезі як основні фактори ризику РСС у дітей116. Використання ІКД слід розглядати у дітей, які мають два або більше з цих основних факторів ризику. В окремих пацієнтів з одним фактором ризику можливість імплантації ІКД може бути розглянута після ретельної оцінки ризиків і переваг для дитини. Однокамерних дефібриляторів достатньо в більшості випадків, що знижує ймовірність ускладнень116.
7.2.6. Профілактика раптової серцевої смерті
7.2.6.1. Поради щодо медикаментозної терапії та способу життя
Пацієнтам з ГКМ слід рекомендувати уникати участі у спортивних змаганнях і інтенсивної фізичної активності, особливо за наявності у них визначених факторів ризику РСС або обструкції ВТЛШ. Відсутні рандомізовані клінічні дослідження антиаритмічних лікарських засобів у випадку ГКМ. Аміодарон, можливо, знижує частоту РСС у пацієнтів з нсШТ протягом амбулаторного ЕКГ-моніторингу, але часто не в змозі запобігти380, 381 РСС у багатьох дослідженнях. Дизопірамід і бета-блокатори використовуються для лікування обструкції ВТЛШ, але немає жодних доказів, що вони зменшують ризик РСС116. Аналогічно у цьому керівництві ESC щодо ГКМ не рекомендується проведення хірургічної міоектомії чи етанолової абляції міжшлуночкової перегородки для зменшення ризику РСС у пацієнтів з обструкцією ВТЛШ116.
7.2.6.2. Імплантований кардіовертер-дефібрилятор
Вторинна профілактика.
За відсутності досліджень терапії ІКД при ГКМ неекспериментальні когортні дослідження і метааналізи свідчать, що попереджена зупинка серця або стійка ШТ пов’язані з високим ризиком подальших летальних серцевих аритмій368. З цієї причини в цій невеликій групі пацієнтів рекомендується використання ІКД116.
Первинна профілактика.
Пацієнтам з ГКМ рекомендується пройти стандартизоване клінічне обстеження згідно з рекомендаціями ESC щодо ГКМ116. Воно має включати збір клінічного і сімейного анамнезу, 48-годинну амбулаторну ЕКГ, трансторакальну ехокардіографію (або МРТ серцево-судинної системи у разі неадекватних ехо-вікон) і тест з фізичним зусиллям до появи лімітуючих навантаження симптомів. Рекомендації для терапії ІКД ґрунтуються на 5-річному ризику РСС, розрахованому за допомогою моделі ризику РСС при ГКМ, з урахуванням віку і загального стану здоров’я пацієнта.
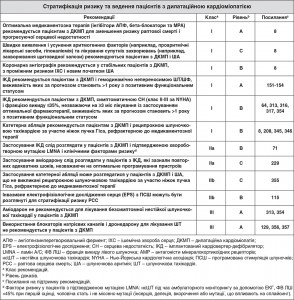
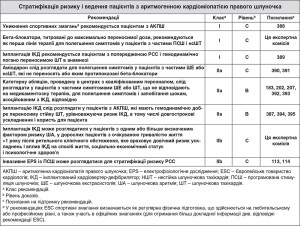
7.3. Аритмогенна кардіоміопатія правого шлуночка (АКПШ)
7.3.1. Визначення, епідеміологія та виживаність
АКПШ (або аритмогенна кардіоміопатія) – прогресуюче захворювання серцевого м’яза, що характеризується ША, СН і РСС382. Гістологічною ознакою захворювання є заміна кардіоміоцитів на жирову і фіброзну тканину382, 383. Клінічно АКПШ визначається структурними та функціональними аномаліями правого шлуночка, але залучення ЛШ спостерігається у >50% пацієнтів384. У поточних критеріях робочої групи використовують гістологічні, генетичні, електрокардіографічні та візуалізаційні параметри для класифікації пацієнтів у визначені, проміжні та можливі діагностичні категорії382.
У більшості випадків АКПШ успадковується як аутосомно-домінантна генетична ознака, викликана мутацією генів, що кодують десмосомальні білки (плакоглобін, десмоплакін, плакофілін-2, десмоглеїн-2 і десмоколін-2). Менша частина випадків спричинені мутаціями в генах, що не кодують десмосомальні білки, і рідкісними рецесивними формами (наприклад, синдром Карваяла і хвороба Наксоса), пов’язаними зі шкірним фенотипом долонно-підошовного гіперкератозу52.
За розрахунками, поширеність АКПШ становить від 1 з 1000 до 1 з 5000 в загальній популяції і є важливою причиною РСС у спортсменів і молодих дорослих385, 386. Клінічні прояви, у тому числі прискорене серцебиття, непритомність, ШТ і РСС, як правило, розвиваються у період між 20 і 40 роками. Прогресування захворювання може призвести до правошлуночкової або бівентрикулярної СН. Рівень щорічної смертності, зареєстрований в різних дослідженнях, значно варіює залежно від характеристик представлених когорт. За даними одного метааналізу, рівні щорічної серцевої смертності, несерцевої смертності та трансплантації серця становили 0,9, 0,8 і 0,9% відповідно387.
7.3.2. Підхід до стратифікації та управління ризиками
7.3.3. Шлуночкові аритмії при аритмогенній кардіоміопатії правого шлуночка
До двох третин пацієнтів мають ША у стані спокою або під час амбулаторного ЕКГ-моніторингу і тестування з фізичним навантаженням396-399. Ці ША, як правило, є правошлуночковими (тобто демонструють морфологію лівого пучка Гіса), але вісь QRS під час ШТ зазвичай відрізняється від осі QRS виносного тракту правого шлуночка (ВТЛШ)400, і багато пацієнтів мають численні морфології QRS. У недавньому проспективному реєстрі пацієнтів, які отримували переважно терапію ІКД, вона була найбільш відповідним методом лікування стійкої мономорфної ШТ401.
7.3.3.1. Лікування шлуночкової аритмії
Існують обмежені систематичні дані щодо ефективності антиаритмічних лікарських засобів при АКПШ, і вплив медикаментозної терапії на смертність невідомий. Спираючись головним чином на серію тестів із застосуванням ПСШ, бета-блокатори, зокрема соталол, традиційно рекомендуються як перший підхід у пацієнтів з частими шлуночковими ектопіями або нсША391. Втім, у недавньому неекспериментальному реєстрі ні бета-блокатори, ні соталол не зменшували частоту виникнення ША390; аміодарон мав кращі показники щодо запобігання ША в невеликій когорті пацієнтів390.
Інвазивне електрофізіологічне дослідження з амплітудним картуванням можна використовувати для ідентифікації ділянок фіброзно-жирової заміни і при застосуванні катетерної абляції вогнища ША202, 207, 392, 402. Гостра супресія ШТ частіше більш успішна у пацієнтів з однією або тільки кількома визначеними домінуючими морфологіями ШТ, і епікардіальна абляція може збільшити показник ефективності цього методу лікування.
Оскільки ні антиаритмічні лікарські засоби, ні катетерна абляція не забезпечують достатнього захисту від РСС, абляцію необхідно використовувати для зменшення частоти епізодів аритмії, а не для покращення прогнозу.
7.3.3.2. Обмеження фізичних навантажень
Тренування на витривалість на рівні спортивних змагань, ймовірно, посилює фенотипічний прояв АКПШ81, 403. Тому, оскільки відсутні контрольовані дослідження, що демонструють сприятливий ефект, рекомендується уникнення інтенсивного тренування на витривалість.
7.3.3.3. Імплантовані кардіовертери-дефібрилятори
Більшість досліджень із стратифікації ризику і терапії ІКД є ретроспективними, які включали певні і відносно невеликі когорти пацієнтів високого ризику, вибрані з окремих центрів. У багатьох дослідженнях також надається мало інформації про показання для використання ІКД. У недавньому систематичному огляді (24 дослідження) і метааналізі (18 досліджень) у 610 пацієнтів, подальше спостереження за якими тривало в середньому протягом 3,8 року387, річна частота адекватного втручання із застосуванням ІКД становила 9,5%. Ускладнене розміщення дроту ІКД спостерігалося у 18,4% випадків, при цьому несправність дроту, інфекції і зміщення траплялися в 9,8, 1,4 і 3,3% випадків відповідно. Щорічна частота неадекватного втручання із застосуванням ІКД становила 3,7%.
Пацієнти з наявністю в анамнезі попередженої РСС, погано переносимої ШТ і непритомності мають найбільший ризик РСС (до 10% на рік), і тому в цій групі рекомендується терапія ІКД387. Іншими факторами ризику для РСС або адекватного розряду ІКД, зареєстрованими у різних когортах, є документально підтверджена стійка ШТ, непритомність незрозумілої етіології, часті епізоди нсШТ, передчасна раптова смерть у сімейному анамнезі, значуще ураження ПШ, виражене подовження комплексу QRS, пізнє посилення гадолінієм на МРТ серцево-судинної системи (у тому числі залучення ЛШ), дисфункція ЛШ і індукція ШТ під час EPS113, 114, 387, 389, 395, 404-406. Складна або дигенна гетерозиготність спостерігається у >10% носіїв десмосомальної генної мутації, що викликає АКПШ і може бути фактором ризику для серйозних явищ аритмії і РСС407. Оскільки дослідження, присвячені результатам при АКПШ, настільки різноманітні, підготовка рекомендацій щодо ІКД для первинної профілактики викликає труднощі. Ґрунтуючись на наявних даних, досягнуто консенсусу в тому, що у пацієнтів з непритомністю незрозумілої етіології необхідно розглянути можливість проведення терапії ІКД. Для пацієнтів без непритомності можливість проведення терапії ІКД може розглядатися після ретельної клінічної оцінки, яка враховує сімейний анамнез, тяжкість ураження функції ПШ і ЛШ, довічний ризик ускладнень і вплив ІКД на спосіб життя, соціально-економічний статус і психологічне здоров’я.
7.4. Інфільтративні кардіоміопатії
7.4.1. Амілоїдоз серця
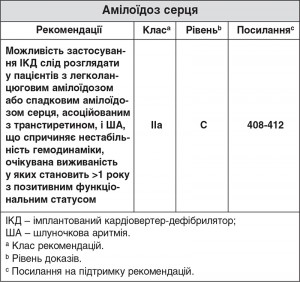
До двох основних типів амілоїдозу серця належать легколанцюговий амілоїдоз, викликаний відкладенням моноклональних легких ланцюгів, і спадковий амілоїдоз, асоційований з транстиретином, при якому нормальний (дикого типу) або мутантний транстиретин осідає в міокарді413, 414. До недавнього часу амілоїдоз серця пов’язували з дуже поганим прогнозом, із середньою тривалістю виживаності <1 року після появи симптомів СН, але розвиток методів терапії легколанцюгового амілоїдозу покращив виживаність415.
До половини всіх пацієнтів з амілоїдозом серця раптово помирають413, 416. Смерть часто пояснюється електромеханічною дисоціацією, але зареєстровано випадки успішного припинення стійкої ША за допомогою ІКД408. ША під час амбулаторного моніторингу спостерігається в >25% пацієнтів з амілоїдозом серця409-411, але її наявність, очевидно, не свідчить про РСС. Підвищені рівні серцевих тропонінів і N-кінцевого натрійуретичного пептиду про-B-типу є чутливими маркерами ураження серця, що свідчать про несприятливий результат у пацієнтів з легколанцюговим амілоїдозом, але немає жодних даних, щоб припустити, що ці біомаркери можуть бути використані для виявлення пацієнтів, які могли б отримати користь від терапії ІКД. Виходячи з таких обмежених даних, можливість застосування ІКД слід розглядати у пацієнтів з легколанцюговим амілоїдозом або спадковим амілоїдозом, асоційованим з транстиретином, у яких спостерігається стійка ША, а очікувана тривалість життя становить >1 року. Існує недостатньо даних для надання рекомендацій щодо первинної профілактики.
7.5. Рестриктивна кардіоміопатія
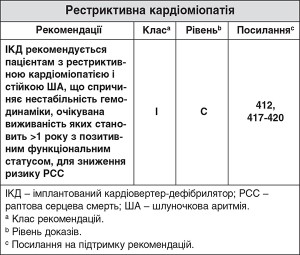
Термін «рестриктивна (обмежувальна) кардіоміопатія» стосується сердець з обмежувальною фізіологією, нормальним або зниженим діастолічним об’ємом одного або обох шлуночків, нормальним або зниженим систолічним об’ємом і нормальною товщиною стінки шлуночка. Рестриктивна кардіоміопатія є найменш поширеним типом кардіоміопатій і зумовлена низкою генетичних і набутих порушень412. У західних популяціях найтиповішою причиною цього порушення у дорослих є амілоїдоз з подальшими мутаціями в генах білків саркомерів і метаболічними розладами421.
У пацієнтів із рестриктивною кардіоміопатією, як правило, спостерігаються ознаки і симптоми бівентрикулярної СН, а діагноз встановлюється на основі характерних особливостей за допомогою неінвазивної візуалізації серця і серцевої катетеризації. Рестриктивна кардіоміопатія асоціюється з поганим довгостроковим прогнозом. У дітей рівні відсутності летальних випадків через 1, 2 і 5 років становлять 82, 80 і 68% відповідно417-420; відповідні значення для рівнів виживаності без трансплантатів становлять 48, 34 і 22%. Існує менше даних у дорослих, але зареєстровані рівні виживаності є аналогічними через 5 років. Фактори ризику загальної смертності включали функціональний клас за NYHA, розмір лівого передсердя і чоловічу стать417-420. У дітей ризик раптової смерті може бути вищим, особливо у пацієнтів з ЕКГ-ознаками ішемії міокарда.
Лікування рестриктивної кардіоміопатії в основному паліативне. Для лікування симптомів СН використовують діуретики, які допомагають контролювати серцевий ритм для оптимізації наповнення ЛШ. Антикоагулянти слід використовувати у всіх пацієнтів з ФП. Відсутні перспективні дані щодо профілактичного застосування ІКД у випадку рестриктивної кардіоміопатії, тому у пацієнтів із симптоматичною стійкою ША показання до ІКД мають бути подібні до показань у випадку іншого захворювання міокарда, з огляду на короткостроковий прогноз, пов’язаний із СН. Первинна профілактика має визначатися на основі вихідної етіології і наявності встановлених факторів ризику РСС.
7.6. Інші види кардіоміопатії
7.6.1. Некомпактність лівого шлуночка
Некомпактність пов’язана з наявністю виражених шлуночкових трабекуляцій і глибоких міжтрабекулярних заглиблень у лівому та/або правому шлуночку, які часто асоціюються з тонким ущільненим епікардіальним міокардіальним шаром422. У деяких пацієнтів некомпактність пов’язана зі шлуночковою дилатацією і систолічною дисфункцією. Некомпактність лівого шлуночка виникає внаслідок вроджених серцевих захворювань і в ізольованій формі. Сімейна хвороба зустрічається в 18-50% дорослих з ізольованою некомпактністю лівого шлуночка, в основному з аутосомно-домінантним типом успадкування. Повідомлялося про численні мутації в генах, що кодують білки саркомера, кальційзв’язувальні білки та інші гени, пов’язані з кардіоміопатією, такі як LMNA, LDB3 і тафазин423.
Багато пацієнтів з некомпактністю ЛШ є повністю безсимптомними, але у деяких спостерігається СН, тромбоемболія, аритмія або РСС. Старший вік, кінцевий діастолічний діаметр ЛШ на момент первинного обстеження, симптоматична СН, постійна або персистуюча ФП, блокада пучка Гіса і пов’язане нервово-м’язове захворювання є зареєстрованими прогностичними факторами підвищеної смертності, але існують обмежені дані, які б свідчили, що некомпактність ЛШ сама по собі є показанням для ІКД422-425. Визначення потреби в ІКД має базуватися на тяжкості систолічної дисфункції ЛШ і наявності стійкої ША з використанням тих самих критеріїв для ДКМП (див. розділ 7.1).
7.6.2. Кардіоміопатія Шагаса
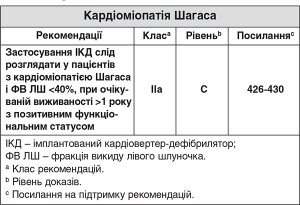
Хвороба Шагаса є захворюванням міокарда, що викликане паразитом Trypanosoma cruzi. За оцінками, 8-10 млн осіб у всьому світі нині інфіковані, а у 20-40% хронічне захворювання міокарда розвивається іноді через багато десятиліть після первинного інфікування. Патологія провідної системи, в тому числі блокада правої ніжки пучка Гіса і блокада передньої гілки лівої ніжки пучка Гіса, часто є найпершим проявом, з подальшими сегментарними порушеннями руху стінок, складною ША, дисфункцією синусового вузла і більш тяжкими порушеннями провідності. На більш пізніх стадіях захворювання спостерігається прогресуюча дилатація і систолічна дисфункція ЛШ426-430.
Зареєстрований рівень смертності пацієнтів з хворобою Шагаса варіює від 0,2 до 19,2%, що відображає характеристики різних досліджуваних популяцій. Найбільш послідовними незалежними прогностичними факторами смерті є дисфункція ЛШ, функціональний клас за NYHA і нсШТ. Ризик, пов’язаний з комбінацією нсШТ і дисфункції ЛШ, може бути в 15 разів вищим.
У першу чергу завдяки дослідженню Gali і співавт.430, у якому вивчали вплив ІКД у пацієнтів з хворобою Шагаса, були отримані дані про те, що найбільша користь спостерігається у пацієнтів з ФВ ЛШ <40%, хоча більшість пацієнтів з ІКД отримували відповідні методи лікування незалежно від показників систолічної функції ЛШ.
Список літератури знаходиться в редакції.