17 лютого, 2016
Благоприятные эффекты продолжительной внутривенной терапии карбоксимальтозой железа у пациентов с симптомной сердечной недостаточностью и дефицитом железа
Введение
При постоянно возрастающей распространенности и заболеваемости сердечная недостаточность (СН) в настоящее время становится эпидемической проблемой, сопровождающейся соответствующими медицинскими, социальными и экономическими последствиями [1]. Несмотря на последние достижения в ведении пациентов с СН, заболеваемость и смертность вследствие этого клинического синдрома остаются неприемлемо высокими, и многие пациенты страдают от изнуряющих симптомов, неблагоприятно влияющих на качество жизни [2-4]. Сердечно-сосудистая и не связанная с сердечно-сосудистой системой сопутствующая патология часто осложняет естественное течение СН, оказывая неблагоприятное влияние на клинический статус, симптомы и прогрессирование СН, выступая, таким образом, целью для потенциального вмешательства [2, 5].
Дефицит железа (ДЖ) является одним из наиболее распространенных алиментарных дефицитов в мире, поражая одну треть общей популяции [6]. Ряд хронических расстройств могут приобретать осложненное течение в присутствии ДЖ [6-9], но только недавно ДЖ стали рассматривать как частое сопутствующее состояние у пациентов со стабильной СН независимо от фракции выброса левого желудочка (ЛЖ) сердца, а также у пациентов, госпитализированных в связи с ухудшением течения СН [13]. Механизмы, обусловливающие развитие ДЖ при СН, изучены недостаточно, однако ДЖ может быть следствием нарушенной абсорбции железа, повышенной желудочно-кишечной потери, а также сниженной доступности утилизируемого железа из ретикулоэндотелиальной системы [14]. СН, осложненная ДЖ, ассоциирована с нарушенной функциональной способностью, плохим качеством жизни, повышенной смертностью [10, 11, 13-15]. Интересно, что в противоположность традиционному мнению неблагоприятные последствия ДЖ при синдроме СН не зависят от наличия анемии или других важных сопутствующих факторов (например, возраста, тяжести заболевания, функции почек) [10-15]. Поэтому коррекцию ДЖ можно рассматривать как привлекательную терапевтическую цель при СН, и эту гипотезу недавно проверили в нескольких клинических исследованиях [14, 16]. Указанные исследования имели, тем не менее, ряд недостатков: подавляющее большинство были одноцентровыми исследованиями с гетерогенным дизайном (открытые в сравнении с плацебо-контролируемыми, лечение только пациентов с анемией в сравнении со всеми пациентами с ДЖ и, как правило, с короткой продолжительностью терапии). Хотя внутривенная терапия препаратами железа пациентов с ДЖ при стабильной СН считается обоснованной [14, 16], остается неуточненным надлежащее применение препаратов железа при СН. В частности, такие неопределенные моменты включают сохранение благоприятных эффектов в долгосрочной перспективе, безопасность, потенциальное влияние на исходы. В связи с этим нами было спланировано исследование CONFIRM-HF (Ferric CarboxymaltOse evaluatioN on perFormance in patients with IRon deficiency in coMbination with chronic Heart Failure) с целью решения перечисленных вопросов.
Методы
Дизайн исследования и осуществление контроля
С сентября 2011 г. по февраль 2013 г. были включены 304 отобранных пациента из 41 исследовательского центра в 9 странах. Дизайн исследования был опубликован ранее [17]. Протокол был одобрен экспертными советами учреждений каждого принявшего участие исследовательского центра и проведен в соответствии с принципами Хельсинкской декларации (1996), Международной конференции по гармонизации Надлежащей клинической практики, а также с локальными и национальными предписаниями. Письменное информированное согласие получили от всех пациентов до выполнения каких-либо процедур, связанных с исследованием.
Участники
Подходящими для участия в исследовании считали пациентов со стабильной СН, находящихся на амбулаторном лечении, с функциональным классом (ФК) СН согласно классификации Нью-Йоркской ассоциации сердца (New York Heart Association – NYHA) II или III, с фракцией выброса ЛЖ сердца 100 пг/мл и/или уровнем N-терминального промозгового натрийуретического пептида >400 пг/мл), при наличии ДЖ, определенного по уровню ферритина сыворотки крови <100 нг/мл или 100-300 нг/мл при условии сатурации трансферрина (СТФ) <20%, а также при уровне гемоглобина <150 г/л (все показатели определяли при скрининговом визите). Нижнюю границу уровня гемоглобина не устанавливали, однако лица с неотложной потребностью в гемотрансфузии были исключены из исследования. Все участники должны были быть способными пройти пробу с 6-минутной ходьбой. Пациенты с неконтролируемой артериальной гипертензией, инфекцией, клинически подтвержденным онкологическим заболеванием на момент участия в исследовании, а также со значительно нарушенной функцией печени или почек были исключены. Верхнюю границу возраста не устанавливали. Детально все критерии включения/исключения представлены в рукописи, описывающей дизайн исследования [17].
Рандомизация
При исходном визите до назначения лечения у каждого пациента собирали клинический анамнез, проводили физикальное обследование, регистрировали электрокардиограмму в 12 отведениях, определяли ФК по NYHA, проводили пробу с 6-минутной ходьбой и оценивали качество жизни, связанное со здоровьем. Рандомизации достигали посредством использования центральной интерактивной системы с машинным речевым ответом для распределения пациентов в группы лечения и сведения к минимуму систематических ошибок отбора. Подходящие пациенты были рандомизированы в соотношении 1:1 для получения внутривенно препарата железа или плацебо (изотонического раствора). Участники были стратифицированы по исследовательским центрам и уровню гемоглобина (две страты): лица с уровнем гемоглобина <120 г/л и >120 г/л); стратификация была включена в данное исследование, чтобы помочь объяснить исходное соотношение уровня гемоглобина в группах лечения.
Лечение и ослепление
Внутривенный препарат железа представлял собой раствор карбоксимальтозы железа (КМЖ) (Ferinject®/ Injectafer® Vifor Pharma). Препарат исследования вводили в виде болюсных (в течение не менее 1 мин) инъекций без разведения в дозе 10 или 20 мл КМЖ, что эквивалентно 500 или 1000 мг железа соответственно. Изотонический раствор (0,9% раствор натрия хлорида) применяли в качестве плацебо в соответствии с инструкцией к активной терапии.
Дозу препарата исследования (КМЖ или плацебо) подбирали с учетом массы тела и уровня гемоглобина пациента при скрининговом исследовании, на основании составленной схемы расчета дозы [17]. Это относится к режиму применения препарата как в фазе коррекции, так и в фазе поддерживающей терапии. Итоговые дозы КМЖ находились в интервале 500-2000 мг железа или эквивалентного объема раствора плацебо в фазе лечения (введение исходно и спустя 6 нед) и в дальнейшем в поддерживающей фазе в дозе 500 мг железа для КМЖ или эквивалентного объема раствора плацебо на каждом визите спустя 12, 24 и 36 нед в случае, если ДЖ сохранялся (критерии ДЖ повторно оценивали при каждом визите).
Каждое введение препарата исследования происходило после завершения всех необходимых связанных с исследованием оценок (включая оценку качества жизни и забор образцов крови).
КМЖ представляет собой жидкость темно- коричневого цвета, и это вещество нельзя незаметно заменить физиологическим раствором в качестве плацебо. Поэтому неослепленный исследователь центра (по меньшей мере, один врач), не вовлеченный в любые оценки эффективности и безопасности, отвечал за приготовление и введение препарата исследования в шприцах черного цвета с применением занавески или аналогичного метода для сохранения ослепленного статуса участника исследования. Результаты центральной лаборатории относительно маркеров метаболизма железа и уровня гемоглобина направляли только неослепленным сотрудникам центров, отвечавшим за анализ этих данных, для последующего подбора дозы и/или при необходимости решения вопроса о других вмешательствах.
Конечные точки исследования
Первичной конечной точкой исследования было изменение дистанции по результатам пробы с 6-минутной ходьбой от исходного значения на 24-й неделе.
Детали пробы с 6-минутной ходьбой представлены в протоколе (см. Дополнительные материалы онлайн) или в описании дизайна [17]. В целом участникам был рекомендован только легкий прием пищи и исключение тяжелых нагрузок за 2 ч до пробы с 6-минутной ходьбой, проведение которой планировали вскоре после завтрака (то есть рано утром) или ланча (то есть в ранний период после полудня). Все пробы проводили на прямом ровном участке коридора с твердым покрытием пола протяженностью не менее 25 м и точками разворота, обозначенными двумя стульями на каждом конце отмеренного расстояния. До начала выполнения пробы измеряли основные физиологические показатели в положении больного сидя после отдыха в течение 10 мин, также осуществляли оценку утомляемости по соответствующей шкале (оценку проводили с использованием 10-балльной визуальной аналоговой шкалы, ранжируя ощущение утомления от 1 (отсутствие признака) до 10 (очень выраженная усталость). Участникам были даны инструкции ходить по обозначенному маршруту в привычном удобном режиме, стараясь, тем не менее, пройти максимально большое возможное расстояние за 6 мин. Лица, осуществляющие наблюдение за проведением пробы, неоднократно поощряли участников вербально. Пациентам разрешали отдыхать на стульях в процессе выполнения пробы, но призывали приступать к продолжению ходьбы, как только участник почувствует физическую способность это сделать. Регистрировали дистанцию, пройденную пациентом за 6 мин до ближайшей метки. Старались, чтобы один и тот же исследователь центра наблюдал за всеми пробами с 6-минутной ходьбой.
Вторичные конечные точки включали изменения ФК по NYHA, общую оценку пациента (Patient Global Assessment – PGA), дистанцию пробы с 6-минутной ходьбой, показатели шкалы утомляемости и качества жизни, связанного со здоровьем (оценка по опроснику кардиомиопатии Канзас-Сити (Kansas City Cardiomyopathy Question naire – KCCQ), Европейскому опроснику качества жизни 5D EQ-5D), установленные на 6, 12, 24, 36 и 52-й неделе. Кроме того, оценивали следующие вторичные конечные точки, связанные с исходами, в которых для анализа госпитализаций в связи с СН смерть была цензурирована [17]:
• частота случаев любой госпитализации, частота случаев госпитализации в связи с любой сердечно-сосудистой причиной, частота случаев госпитализации по поводу ухудшения течения СН;
• время до первой госпитализации по любой причине, время до первой госпитализации в связи с любой сердечно-сосудистой причиной и время до первой госпитализации по поводу ухудшения течения СН;
• время до наступления смерти от любой причины, время до наступления смерти от любой сердечно-сосудистой причины, время до наступления смерти вследствие ухудшения течения СН.
Стандартизированные определения случаев смерти и госпитализации были разработаны членами независимого Комитета по клиническим конечным точкам исследования CONFIRM-HF (для получения детальной информации см. описание дизайна [17]). Все такие случаи регистрировали в течение всего периода исследования, и они были изучены Комитетом по клиническим конечным точкам.
Дополнительными конечными точками были изменения от исходного на 6, 12, 24, 36 и 52-й неделе клинических лабораторных показателей (гематологических, биохимических, статуса в отношении железа, кардиологических биомаркеров). Анализ безопасности включал серьезные и незначительные неблагоприятные события, оценку которых проводили до 52-й недели включительно.
Статистический анализ
Расчет размера выборки для исследования CONFIRM-HF был основан на ожидаемом изменении дистанции пробы с 6-минутной ходьбой на 24-й неделе с учетом данных, представленных в исследовании FAIR-HF [18]. Среднее различие между группами для изменения дистанции пробы с 6-минутной ходьбой от исходного к 24-й неделе в исследовании FAIR-HF составило 29 м при стандартном отклонении (СО) 72 м. На основании этого допущения необходимый размер выборки для каждой группы составил 130 человек (то есть всего 260 пациентов), что было необходимо для выявления среднего значения эффекта терапии на уровне по меньшей мере 29 м на 24-й неделе с 90% мощностью с использованием a 0,05 (двусторонней). Размер выборки был увеличен до 150 пациентов в группе (всего 300) на случай утраты некоторых данных вследствие раннего прекращения исследования.
Первичный анализ эффективности был выполнен в соответствии с намерением использовать вмешательство (intention-to-treat – ITT) для всего массива данных, включая всех рандомизированных лиц, у которых начали применение терапии исследования и в отношении которых были получены данные о безопасности. Анализ пациентов проводили, учитывая группу лечения, к которой они принадлежали, то есть независимо от фактически получаемого лечения. Кроме того, был проведен дополнительный анализ с учетом данных о выполнении процедуры протокола исследования.
Первичная конечная точка эффективности – изменение дистанции пробы с 6-минутной ходьбой от исходного показателя до 24-й недели – включала условную оценку для пропущенных значений от лиц, которые на указанный момент были госпитализированы или умерли. Для госпитализированных пациентов в таком случае в анализ включали худший не нулевой результат пробы с 6-минутной ходьбой, полученный в ходе исследования. Для умерших включали значение «0». Первичный анализ эффективности выполняли с помощью модели ковариационного анализа (ANCOVA) в отношении изменения дистанции пробы с 6-минутной ходьбой от исходного показателя к 24-й неделе с коррекцией по исходному значению этой дистанции, уровню гемоглобина при скрининговом обследовании и по стране, участвующей в исследовании (Россия, Украина, Польша, а также другие страны Европы) для всего массива данных.
Дополнительные анализы проводили с учетом данных о выполнении процедуры протокола (то есть лиц, включенных в общий массив данных, но без значительных отклонений от выполнения протокола исследования) и случаев наблюдения (без включения данных пациентов, которые на момент оценки были госпитализированы или умерли).
Отсутствующие данные по ФК на основании классификации NYHA для пациентов, умерших на момент оценки, включали с применением худшего возможного показателя, то есть классифицировали как «ФК V», а для пациентов, госпитализированных на момент запланированной оценки, определяли ФК IV СН. Пропущенные данные по PGA вследствие наступившей смерти больного вводили как «умер», а для госпитализированных – как «значительно хуже».
Для анализа непрерывных переменных вторичных конечных точек ANCOVA применяли модели повторных измерений, а для анализа дискретных переменных – политомную регрессию повторных измерений. Анализ «время-до-события» выполняли с помощью оценок Каплана-Мейера и логранговых критериев. Отношение рисков (ОР) и соответствующий 95% доверительный интервал (ДИ) получали из пропорциональных моделей отношения рисков. Post hoc анализы чувствительности включали анализы «время-до-события» по композитным конечным точкам для смерти и любой первой госпитализации, смерти и первой госпитализации вследствие любой сердечно-сосудистой причины, смерти и первой госпитализации в связи с ухудшением течения СН. Последующие post hoc анализы чувствительности выполняли по вторичной конечной точке госпитализации вследствие ухудшения течения СН, используя модели отрицательной биноминальной регрессии, где были рассчитаны соотношения частоты случаев встречаемости между группами лечения с 95% ДИ и значениями р [18].
Анализы безопасности по суммарной статистике были выполнены для всего массива данных пациентов, которые получили по меньшей мере 1 дозу препарата исследования или плацебо. Последующее наблюдение для сбора ключевой информации по безопасности продолжалось до 30 сут после окончания исследования, то есть дольше, чем было необходимо для получения данных об эффективности. Данные пациентов анализировали, исходя из лечения, которое они реально получали.
Результаты
Всего было включено 304 пациента (группа КМЖ – 152 пациента и плацебо – 152 пациента) в 41 исследовательском центре 9 стран мира (Австрия, Италия, Польша, Португалия, Россия, Испания, Швеция, Соединенное Королевство, Украина). Все рандомизированные пациенты получили по меньшей мере 1 дозу препарата исследования. Из 304 рандомизированных пациентов трое были исключены из общего массива данных для анализа эффективности в связи с отсутствием каких-либо оценок эффективности после получения исходных данных, однако они продолжили участие в исследовании (примечание: для этих трех случаев не было зафиксировано ни одного эпизода госпитализации или смерти). Исходные клинические и лабораторные показатели, а также применение различных кардиологических препаратов на момент включения в исследование были сопоставимы между двумя группами лечения.
Последующее наблюдение
Из 150 пациентов, распределенных для получения КМЖ, 29 (19,3%) не завершили протокол исследования, из них 12 (8,0%) умерли. Из 151 пациента, рандомизированного для получения плацебо, 24 (15,9%) не завершили протокол исследования, из них 14 (9,3%) умерли. Два пациента группы плацебо были утеряны в процессе последующего наблюдения. Один пациент группы КМЖ умер в период 30-дневного последующего наблюдения после полного завершения протокола исследования.
Первичная конечная точка
Исходные значения (среднее, СО) дистанции пробы с 6-минутной ходьбой были сопоставимы для групп лечения: 288 (СО 98) м в сравнении с 302 (СО 97) м соответственно для групп КМЖ и плацебо. На 24-й неделе в группе КМЖ отмечали увеличение дистанции пробы с 6-минутной ходьбой на 18±8 м, тогда как в группе плацебо наблюдалось снижение этого показателя на 16±8 м (в обоих случаях среднее ± ошибка среднего, полученные с помощью метода наименьших квадратов). Это привело к статистически значимому различию дистанции пробы с 6-минутной ходьбой на 24-й неделе для группы КМЖ в сравнении с группой плацебо на 33±11 м (среднее значение по методу наименьших квадратов ± ошибка среднего; р=0,002).
Вторичные конечные точки
Применение КМЖ в сравнении с плацебо продемонстрировало достоверные преимущества в отношении показателя PGA, начиная с 12-й недели (р=0,035 на 12-й неделе, р=0,047 на 24-й неделе и р=0,001 на 36-й и 52-й неделе), а также ФК по NYHA, начиная с 24-й недели (р=0,004 на 24-й неделе и р<0,001 на 36-й и 52-й неделе) (рис. 1A и 1B). С помощью модели повторных измерений достоверное улучшение также было отмечено в различиях изменений дистанции пробы с 6-минутной ходьбой на 36-й неделе (42 м; 95% ДИ 21-62; p<0,001) и 52-й неделе (36 м; 95% ДИ 16-57; p<0,001). Зарегистрировано статистически значимое снижение показателя утомляемости, начиная с 12-й недели (р=0,009 на 12-й неделе, р=0,002 на 24-й и 52-й неделе, р<0,001 на 36-й неделе), в группе КМЖ по сравнению с таковым в группе плацебо.
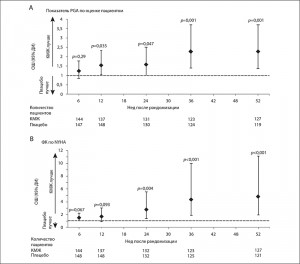 Рис. 1. Показатель PGA и ФК по NYHA в течение исследования (анализ всего массива данных). Данные представлены как отношение шансов (ОШ) для PGA (A) и ФК по NYHA (B) для группы КМЖ по сравнению с плацебо и демонстрируют лучшие характеристики как PGA (А), так и для ФК по NYHA (В). На этих панелях значения р приведены для сравнения между двумя группами исследования, а вертикальные ограниченные линии указывают 95% ДИ.
Рис. 1. Показатель PGA и ФК по NYHA в течение исследования (анализ всего массива данных). Данные представлены как отношение шансов (ОШ) для PGA (A) и ФК по NYHA (B) для группы КМЖ по сравнению с плацебо и демонстрируют лучшие характеристики как PGA (А), так и для ФК по NYHA (В). На этих панелях значения р приведены для сравнения между двумя группами исследования, а вертикальные ограниченные линии указывают 95% ДИ.
Благоприятный эффект на качество жизни по данным общего показателя KCCQ наблюдали в группе КМЖ на 12, 36 и 52-й неделе (р<0,05 для всех сравнений). Показатель Европейского опросника 5D также продемонстрировал преимущества терапии КМЖ по сравнению с плацебо на протяжении всего исследования, но статистической значимости это различие достигло только на 36-й неделе.
В ходе исследования 76 пациентов были госпитализированы по крайней мере один раз (группа КМЖ – 32 (21%), плацебо – 44 (29%) пациента). Анализ «время-до-события» продемонстрировал ОР 0,71 с 95% ДИ 0,45-1,12 (р=0,14) (табл. 1). Имели место 46 госпитализаций по любой причине в группе КМЖ и 69 в группе плацебо. Лечение КМЖ ассоциировалось со статистически значимым снижением риска госпитализации в связи с ухудшением течения СН на основании анализа «время-до-события», свидетельствующим об ОР 0,39; 95% ДИ 0,19-0,82 (р=0,009) (табл. 1, рис. 2). Частота случаев смерти от всех причин была сходной в обеих группах (группа КМЖ – 8,9; плацебо – 9,9 на 100 пациенто-лет с риском) (табл.).
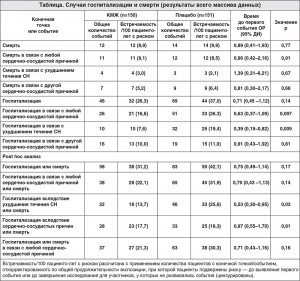
При выполнении post hoc анализа чувствительности нами установлено, что комбинированный риск первой госпитализации вследствие ухудшения течения СН или смерти от любой причины был достоверно ниже в группе КМЖ (ОР 0,53; 95% ДИ 0,30-0,95; р=0,03) (табл. 1). Рost hoc анализ чувствительности повторных событий по количеству госпитализаций вследствие ухудшения течения СН с помощью модели отрицательной биноминальной регрессии подтвердил положительный эффект терапии КМЖ с соотношением частоты случаев развития 0,30; 95% ДИ 0,14-0,64; р=0,0019 по сравнению с показателем группы плацебо (итого 10 госпитализаций в связи с ухудшением течения СН в группе КМЖ и 32 – в группе плацебо в течение исследования).
Значения лабораторных показателей уровня ферритина в сыворотке крови, СТФ и гемоглобина продемонстрировали повышение в группе КМЖ на 24-й и 52-й неделе и статистически значимо отличались от таковых в группе плацебо (все р<0,001). В целом средний эффект лечения в отношении уровня ферритина и СТФ (откорректированных по исходному значению) у пациентов, получавших КМЖ, по сравнению с группой плацебо составил 265±19 нг/мл и 8,9±1,1% на 24-й неделе и 200±19 нг/мл и 5,7±1,2% на 52-й неделе (все р<0,001).
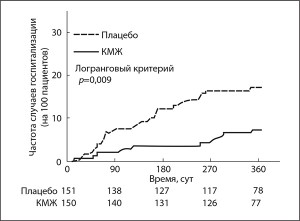 Рис. 2. Время до первой госпитализации в связи с ухудшением течения СН. Время до первой госпитализации в связи с ухудшением течения СН оценивали, применяя метод Каплана-Мейера, на общем массиве данных. Пациенты были цензурированы при наступлении смерти, завершении исследования или в момент досрочного прекращения участия.
Рис. 2. Время до первой госпитализации в связи с ухудшением течения СН. Время до первой госпитализации в связи с ухудшением течения СН оценивали, применяя метод Каплана-Мейера, на общем массиве данных. Пациенты были цензурированы при наступлении смерти, завершении исследования или в момент досрочного прекращения участия.Анализы подгрупп
Во всех изученных подгруппах эффекты лечения сохранились. Было продемонстрировано стабильное улучшение дистанции пробы с 6-минутной ходьбой на фоне терапии КМЖ по сравнению с плацебо. Для большинства подгрупп не выявили статистически значимого различия (рис. 3). Там, где взаимодействие между подгруппами было статистически значимым, то есть в подгруппах с/без сахарного диабета (р=0,04) и нарушенной/сохраненной функцией почек (р=0,038), выраженность преимущества КМЖ над плацебо варьирует, но не отмечено разнонаправленного эффекта для любой из этих подгрупп. Исходно было предопределено деление на подгруппы, исходя из базового уровня ферритина 100 нг/мл. Однако количество пациентов в последней подгруппе оказалось очень небольшим (14 для группы КМЖ и 18 для группы плацебо), что привело к невозможности интерпретировать полученные результаты. Поэтому мы провели анализ в post hoc формате, используя для разделения группы показатель медианы исходного уровня ферритина (рис. 3).
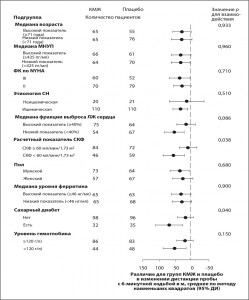 Рис. 3. Анализ в подгруппах для пробы с 6-минутной ходьбой. Представлены данные по изменению дистанции пробы с 6-минутной ходьбой от исходного к 24-й неделе, анализ проводили с помощью ANCOVA с каждой подгруппой в качестве ковариаты и лечением и взаимодействием между лечением и подгруппой в качестве ковариат. Средние значения для различий между группами КМЖ и плацебо, полученные методом наименьших квадратов, а также соответствующие 95% ДИ отражены для каждой подгруппы. Представлены также значения р относительно взаимодействия (лечения и подгрупп). МНУП – мозговой натрийуретический пептид; СКФ – скорость клубочковой фильтрации.
Рис. 3. Анализ в подгруппах для пробы с 6-минутной ходьбой. Представлены данные по изменению дистанции пробы с 6-минутной ходьбой от исходного к 24-й неделе, анализ проводили с помощью ANCOVA с каждой подгруппой в качестве ковариаты и лечением и взаимодействием между лечением и подгруппой в качестве ковариат. Средние значения для различий между группами КМЖ и плацебо, полученные методом наименьших квадратов, а также соответствующие 95% ДИ отражены для каждой подгруппы. Представлены также значения р относительно взаимодействия (лечения и подгрупп). МНУП – мозговой натрийуретический пептид; СКФ – скорость клубочковой фильтрации.В первичном анализе эффективности при коррекции по стране, в которой проводили исследование (Россию, Украину и Польшу рассматривали отдельно, остальные страны Европы объединили в один массив данных), не выявили статистически значимого взаимодействия (р=0,30), что свидетельствует о постоянстве результата пробы с 6-минутной ходьбой на 24-й неделе без больших региональных отклонений.
Анализ безопасности
Общая частота случаев развития зарегистрированных исследователями неблагоприятных событий, серьезных неблагоприятных событий и неблагоприятных событий, которые ведут к прекращению участия в исследовании, была сходной в обеих группах.
Не было сообщений о развитии тяжелых аллергических реакций, связанных с лечением в ходе исследования. Среди пациентов, получавших КМЖ и сообщавших об ассоциированных с лечением неблагоприятных событиях, у двоих отмечали изменение цвета кожных покровов в месте инъекции, у 4 – ощущение жара, и по одному – изменение цвета кожных покровов, аллергическую сыпь, высыпания на коже и эритему.
Не наблюдали различий между двумя группами лечения в отношении представленных исследователями неблагоприятных изменений лабораторных показателей.
Доза
В группе КМЖ среднее и медиана общей дозы соответствовали 1500 мг железа в течение однолетнего периода исследования с рангом дозы 500-3500 мг железа. Более 75% пациентов нуждались максимум в двух инъекциях КМЖ для коррекции и поддержания показателей железа.
Дискуссия
В исследовании CONFIRM-HF продемонстрировано, что лечение пациентов со стабильной симптомной СН с ДЖ внутривенным препаратом железа (КМЖ) приводит к стабильному улучшению функциональной способности по данным оценки пробы с 6-минутной ходьбой за однолетний период. Эти благоприятные результаты сохранялись для всех заранее определенных подгрупп, включая подгруппы наличия/отсутствия анемии. Благоприятные эффекты лечения КМЖ были подтверждены сопутствующим всему исследованию улучшением функционального статуса и качества жизни больных. Важно, что у пациентов, получавших КМЖ, отмечали достоверное снижение риска госпитализации в связи с ухудшением течения СН за однолетний период последующего наблюдения. Продолжительная коррекция ДЖ посредством КМЖ сопровождалась хорошей переносимостью и профилем безопасности.
Актуальные руководства Европейского кардиологического общества по ведению пациентов с СН рассматривают ДЖ как распространенную и имеющую клиническое значение сопутствующую патологию, осложняющую естественное течение заболевания, и рекомендуют активное выявление этого патологического состояния с помощью лабораторных показателей у всех больных с СН [2]. В то же время рекомендация по лечению ДЖ у таких пациентов относительно слабая, что в основном связано с недостаточностью основанных на принципах доказательной медицины данных, подтверждающих пользу терапии препаратами железа [2, 14]. В действительности существует только одно двойное слепое плацебо-контролируемое клиническое исследование с выборкой среднего размера (FAIR-HF), в котором показаны благоприятные эффекты терапии внутривенным препаратом железа (КМЖ) на функциональный статус, толерантность к физическим нагрузкам и качество жизни у пациентов с ДЖ и СН в течение 6-месячного периода последующего наблюдения [18]. Вне всякого сомнения, для более жесткого уровня рекомендации по ДЖ как валидной терапевтической цели у больных с СН необходимы дополнительные тщательно разработанные и контролируемые исследования с более продолжительным периодом наблюдения. С этой целью и было спланировано и проведено исследование CONFIRM-HF.
Необходимо отметить, что результаты исследования CONFIRM-HF следует рассматривать как дополнительную, расширяющую существующие знания и клинически значимую информацию по уже известным данным в отношении следующих аспектов:
a) выбор другой и, в сравнении с исследованием FAIR-HF, более объективной конечной точки (изменение дистанции пробы с 6-минутной ходьбой) в целях использования более надежного метода оценки клинического статуса пациента с СН;
б) регистрация стабильного благоприятного эффекта при лечении КМЖ с приемлемым профилем безопасности при продолжительном наблюдении (то есть в течение 12 мес в сравнении с 6 мес или менее в предшествующих исследованиях);
в) предоставление интересных данных о статистически значимом снижении риска госпитализации в связи с ухудшением течения СН;
г) предложение упрощенного и более клинически применимого метода терапии ДЖ с помощью КМЖ.
Все указанные аспекты будут кратко обсуждены ниже.
В исследовании FAIR-HF первичная конечная точка была основана на оценке ФК по NYHA и показателе PGA [18]. В исследовании CONFIRM-HF нами выбрано изменение дистанции пробы
с 6-минутной ходьбой в качестве первичной конечной точки, поскольку это более надежный метод оценки клинического статуса пациента с СН [21, 22]. Проба с 6-минутной ходьбой является хорошо отработанным, воспроизводимым методом оценки функциональной способности, чувствительным к изменениям симптомов, самостоятельно оцениваемых пациентом [22], который ранее многократно применяли в исследованиях по изучению СН для оценки эффектов различных вмешательств [23]. Мы ожидали, что посредством воздействия на ДЖ, который затрудняет транспорт кислорода и/или его утилизацию, мы могли бы улучшить толерантность пациентов к физическим нагрузкам [23]. В действительности наши результаты продемонстрировали, что лечение с помощью КМЖ достоверно улучшало функциональную способность пациентов. Благоприятные эффекты КМЖ отмечались уже на 6-й и 12-й неделе (сильная тенденция в пользу КМЖ), с достижением статистической достоверности различия на 24-й неделе и сохранением результата до конца однолетнего наблюдения. Выраженность эффекта лечения с помощью КМЖ на дистанцию пробы с 6-минутной ходьбой, превышавшая 30 м за последние 6 мес периода наблюдения, является надежным и клинически значимым результатом. В предыдущих исследованиях, посвященных вмешательствам, такие благоприятные эффекты наблюдали только при применении ресинхронизирующей терапии сердечной деятельности [23]. Важно, что увеличение дистанции пробы с 6-минутной ходьбой наблюдали во всех изученных подгруппах, включая пациентов с/без анемии, в отношении чего распространено традиционное мнение о связи неблагоприятных последствий ДЖ с анемией. Кардиопульмональное тестирование с физическими нагрузками и оценкой максимального потребления кислорода является другим методом, применяемым для изучения функциональной способности при СН, который может предоставить даже более объективную информацию относительно переносимости физических нагрузок, чем проба с 6-минутной ходьбой. В настоящее время продолжается исследование с использованием этого метода (www. clinicaltrial.gov: EFFECT-HF, NCT01394562), которое сможет предоставить полноценную информацию о преимуществах внутривенной терапии препаратом железа (КМЖ) у пациентов с ДЖ и СН.
Больные, включенные в это исследование, представляют современную популяцию со стабильной систолической СН и оптимизированной медикаментозной терапией. Интересно, что по сравнению с исследованием FAIR-HF мы включили примерно эквивалентное количество пациентов с ФК по NYHA II и III (в сравнении с 18% больных с ФК по NYHA II в исследовании FAIR-HF) с более высоким показателем фракции выброса ЛЖ сердца (среднее 37 в сравнении с показателем исследования FAIR-HF, равным 32%). Преимущество отмечали независимо от клинической тяжести заболевания (что подтверждено отсутствием взаимодействия между ФК по NYHA, фракцией выброса ЛЖ сердца, уровнем мозгового натрийуретического пептида и эффектом терапии), которое в дальнейшем расширяет клиническое применение наших результатов.
В подгрупповых анализах сахарный диабет и нарушенная функция почек взаимодействовали с эффектами лечения. Тем не менее эти взаимодействия касались не направления эффекта, а только его выраженности (с более выраженным преимуществом у более тяжелых пациентов с сахарным диабетом и нарушенной функцией почек). Интересно, что эти сведения могут обладать важным клиническим приложением, позволяя выявлять пациентов с СН, которые могут потенциально получить наибольшую пользу от внутривенной терапии препаратом железа. Недавно было продемонстрировано, что ДЖ является распространенным явлением среди пациентов с коронарным поражением артерий и сопутствующим сахарным диабетом 2 типа и независимо предсказывает неблагоприятный исход [9]. Пациенты с СН и дисфункцией почек склонны к развитию ДЖ, который часто сопровождается низкими значениями гемоглобина [24]. Терапия с применением внутривенных препаратов железа способна благоприятно повлиять на эти угрожающие патологии. J.E. Toblli и соавт. [25] продемонстрировали, что у пациентов с анемией и СН при наличии ДЖ и дисфункции почек кратковременная внутривенная терапия препаратом железа приводила к достоверному улучшению функции почек. Однако с этой точки зрения полученные интригующие сведения могут быть рассмотрены только в качестве генераторов гипотезы, в дальнейшем требующей проверки в проспективных клинических исследованиях.
В этом исследовании благоприятные эффекты коррекции ДЖ с помощью КМЖ были также подтверждены выявленным улучшением показателей функциональной способности (ФК по NYHA, PGA, шкала утомляемости), а также качества жизни в течение всего периода исследования. Это особенно важно, поскольку, несмотря на установленное улучшение в ведении СН, симптомы сохраняются у значительной доли пациентов. Таким образом, в долгосрочной перспективе методы лечения с хорошей переносимостью и профилем безопасности, приводящие к уменьшению симптомов, являются крайне ожидаемыми.
При оценке новых методов терапии в отношении хронической СН ожидается, что они будут улучшать клинический статус и качество жизни пациентов, снижать риск декомпенсации (то есть госпитализаций в связи с ухудшением течения СН) и, наконец, увеличивать продолжительность жизни. В недавних работах исследователи наблюдали разительное снижение смертности у пациентов с хронической СН при параллельном повышении частоты случаев госпитализации в связи с ухудшением течения СН [26]. Поскольку госпитализация вследствие ухудшения течения СН всегда связана с неблагоприятным исходом и нарушением качества жизни пациента, а также создает экономическое бремя для общества [27], существует насущная потребность в ее профилактике. В этом контексте результаты исследования CONFIRM-HF, согласно которым лечение с помощью КМЖ ассоциировалось с достоверным снижением частоты случаев первой госпитализации в связи с ухудшением течения СН, являются особенно интересными. Дополнительный анализ, учитывающий все случаи госпитализации по поводу СН, демонстрирует даже более выраженный эффект с соотношением частоты (КМЖ в сравнении с плацебо) 0,30. Среди недавно представленных фармакологических методов лечения только ивабрадин [28] продемонстрировал такие результаты. Хотя не было выявлено различий в количестве случаев смерти между группами, однолетнее последующее наблюдение может быть не адекватным по продолжительности для выявления какого-либо различия в смертности. Мы осознаем, что данное исследование не было спланировано изначально для изучения аспектов заболеваемости/смертности при терапии ДЖ с помощью КМЖ, но наши результаты представляют серьезное обоснование для того, чтобы такое исследование было проведено в ближайшем будущем.
Как и в предыдущих исследованиях [16, 18], популяция наших пациентов была определена на основании лабораторных биомаркеров ДЖ – ферритина и сатурации трансферрина. Тем не менее по сравнению с этими исследованиями мы использовали упрощенный режим применения КМЖ, недавно предложенный R. Evstatiev и соавт. [29], основанный на массе тела и уровне гемоглобина. Эти авторы продемонстрировали, что упрощенные режимы применения превосходят по эффективности подход расчета дозы по традиционной формуле А.М. Ganzoni [30] и имеют хороший профиль безопасности. В группе КМЖ медиана общей дозы препарата составила 1500 мг железа в течение однолетнего периода исследования (с рангом дозы 500-3500 мг железа), и более 75% пациентов нуждались максимум в двух инъекциях КМЖ для коррекции ДЖ и поддержании показателей железа в пределах нормальных значений. Кроме того, мы расширили накопленный ранее опыт терапии КМЖ больных с ДЖ без анемии, включающий пациентов с уровнем гемоглобина 95-135 г/л [18], поскольку в этом исследовании исключали только больных с уровнем гемоглобина более 150 г/л.
В большинстве последних исследований коррекцию ДЖ у пациентов с СН проводили внутривенными препаратами железа с положительными результатами. Так, возникает закономерный вопрос: будут ли отмечены сходные результаты при пероральной терапии? Этот непростой вопрос остается в настоящее время недостаточно изученным и не имеет ответа. Существует ряд предпосылок для преимущества внутривенных препаратов железа, и практичность представляется наиболее безоговорочной. Для компенсации ДЖ при СН, как правило, установленного на уровне, который превышает 1000 мг, необходимы несколько месяцев пероральной терапии с соответствующим риском плохой переносимости. В свою очередь, при применении КМЖ, которую изучали в исследованиях FAIR-HF и CONFIRM-HF, наблюдали низкий риск развития неблагоприятных эффектов, и требовалось лишь несколько инъекций для лечения ДЖ (в исследовании CONFIRM-HF более 75% пациентов требовалось максимум две инъекции КМЖ для коррекции и поддерживающей терапии ДЖ). Недавно полученные экспериментальные данные демонстрируют нарушение регуляторных механизмов дуоденальных систем трансформации железа у животных с индуцированными СН и ДЖ [31]. В то же время абсорбцию железа никогда не изучали у пациентов с СН, и в целом неизвестно, насколько данный феномен, описанный у грызунов, будет играть роль в клиническом плане при СН. Также существует склонность к связи ДЖ при СН с воспалением, и выдвинута гипотеза о ведущей роли повышенного уровня гепсидина, который также блокирует всасывание железа. В последних исследованиях, тем не менее, сообщают скорее о низком уровне гепсидина у пациентов с СН и об отсутствии связи между провоспалительной активацией (подтвержденной по уровню циркулирующего интерлейкина-6) и уровнем гепсидина [13, 32, 33]. Есть только одно небольшое исследование, в котором показано преимущество внутривенной терапии препаратом железа по сравнению с пероральным назначением в отношении способности переносить физические нагрузки у пациентов с СН и ДЖ с анемией [34]. Однако анализ данных всего 18 участников не дает возможности сделать сколько-нибудь значимые заключения. Поэтому существует необходимость в оценке эффективности пероральной терапии у пациентов с СН и ДЖ в адекватном по размеру проспективном рандомизированном клиническом исследовании. Насколько нам известно, такое исследование запланировано.
В заключение необходимо отметить, что лечение стабильных симптомных пациентов с СН и ДЖ с помощью КМЖ в течение одного года приводит к стабильному улучшению функциональной способности, симптомов и качества жизни, а также может уменьшать количество случаев госпитализаций в связи с ухудшением течения СН.
Список литературы находится в редакции.
Український медичний вісник/Therapia,
№ 1, 2015 г.
UA/XMP/1215/0038
Комментарий
руководителя отдела сердечной недостаточности Национального научного центра
«Институт кардиологии им. Н.Д. Стражеско» НАМН Украины,
президента Украинской ассоциации специалистов по сердечной недостаточности, профессора Л.Г. Воронкова
Представленный материал, посвященный описанию результатов мультицентрового исследования CONFIRM-HF, является весьма примечательным и важным для клиницистов, занимающихся оказанием помощи пациентам с хронической сердечной недостаточностью (ХСН). Пожалуй, впервые в результате апробации нового лечебного подхода к коррекции одного из видов сопутствующей патологии при ХСН (в данном случае – железодефицита) получен положительный результат в виде значимого улучшения тех «конечных точек», динамика которых имеет основополагающее значение для качества жизни таких пациентов, а именно – уровня физической работоспособности и риска возникновения клинической декомпенсации, влекущей за собой необходимость стационарного лечения. Весьма впечатляющие результаты представленного исследования еще раз (после сходных результатов ранее опубликованного испытания FAIR-HF) фокусируют внимание клиницистов на необходимости выявления и коррекции железодефицита при ХСН – вне зависимости от наличия у пациентов анемии, которая традиционно рассматривается как показание к лечению препаратами железа. При этом важно отметить, что выявление железодефицита и оценка его коррекции сегодня базируются на достаточно доступных лабораторных тестах (уровень ферритина в плазме и, в первую очередь, уровень насыщения трансферрина железом).
С другой стороны, вся история исследований в области проблемы железодефицита при ХСН – от установления его распространенности, клинического значения и до разработки клинически эффективного подхода к его коррекции в виде внутривенной терапии карбоксимальтозой железа (КМЖ) – является прекрасным примером результативности научного поиска в рамках современной клинической медицины. При этом необходимо сделать оговорку, что на данное время твердые доказательства благоприятного влияния препаратов железа на клиническое состояние пациентов с ХСН получены лишь относительно единственной его формы – внутривенной КМЖ.
Есть все основания предполагать, что энтузиазм практических врачей относительно вышеозначенного нового подхода к лечению пациентов с ХСН будет подкреплен его трансляцией в виде соответствующей терапевтической опции в текст новых рекомендаций по диагностике и лечению сердечной недостаточности Европейского кардиологического общества, выход которых ожидается в следующем 2016 году.


