14 січня, 2016
Аневризма висхідного відділу аорти: вікові особливості, критерії прогресування та стратифікація факторів ризику ускладнень
За останні роки як в Україні, так і за кордоном спостерігається тенденція до зростання частоти серцево-судинних захворювань (ССЗ) та смертності від них. Однією з найнебезпечніших патологій є аневризма аорти (АА). У 70-90% випадків вона характеризується поступовим збільшенням розмірів і такими ускладненнями, як розшарування, розрив, розвиток недостатності аортального клапана із суттєвими змінами внутрішньосерцевої гемодинаміки, порушеннями ритму та виникненням серцевої недостатності. Аневризма аорти – патологічний стан, який проявляється розширенням сегмента аорти, що перевищує нормальний діаметр на 50% і схильне до поширення та розриву. За даними різних авторів, частота виникнення АА становить від 0,16 до 1,06%; серед чоловіків частка хворих досягає 1,4-4,3%, серед жінок – 0,5-2,1%.
Згідно з рекомендаціями ACCF/AHA анатомічно в грудній частині аорти виділяють 4 відділи: корінь, висхідний відділ, дугу та низхідний відділ. За локалізацією розрізняють аневризму грудної аорти (висхідного відділу, дуги, низхідного відділу), черевної аорти, торакоабдомінальну аневризму; за формою – мішкоподібну і веретеноподібну. До її ускладнень належать розшарування, розрив, внутрішня кровотеча, гіповолемічний шок, тромбоз і тромбоемболії.
У цій статті акцент зроблено на аневризмі висхідного відділу аорти (АВВА), з огляду на те, що діагностика патології цієї локалізації є простішою – трансторакальна ехокардіографія (ЕхоКГ), а перебіг істотно залежить від віку пацієнтів.
Аневризми висхідного відділу аорти найчастіше мають веретеноподібну форму, при цьому на всьому протязі візуалізується дифузне розширення. У низці випадків веретеноподібна АВВА поєднується з недостатністю аортального клапана (АК). Це відбувається тоді, коли одночасно з утворенням АА розширюється фіброзне кільце АК, а його нормальної величини стулки не здатні повністю замикати розширений аортальний отвір. АВВА в поєднанні з вадою АК – одна з найтяжчих патологій серцево-судинної (СС) системи.
Розшаровуюча аневризма аорти (РАА) – окрема нозологічна одиниця, патологоанатомічною основою якої є утворення надриву інтими та частини середньої оболонки, через який кров із просвіту аорти нагнітається в товщу артеріальної стінки, при цьому формується інтрамуральна гематома, яка розділяє стінку на внутрішній і зовнішній шари. РАА безпосередньо висхідної частини зустрічається досить рідко. Найчастіше вона виникає у у хворих віком від 20 до 40 років.
Ризик розриву АА зростає із збільшенням її діаметра до 6 см і більше. В одному з великих досліджень розриви в таких випадках спостерігалися у 51% пацієнтів, у всіх була артеріальна гіпертензія (АГ). За даними J.A. Elefteriades, коли аневризма грудного відділу аорти досягає 6 см у діаметрі, її міцність зменшується в 10 разів, і у 34% хворих виявляють розшарування або розриви аорти, які найчастіше провокують фізичні навантаження.
За етіологією розрізняють вроджені й набуті АА. Вроджена АА найчастіше зустрічається в ділянці перешийка аорти і зазвичай поєднується з коарктацією аорти. До вроджених відносять також АВВА, які є проявом диференційованої (синдром Марфана) та недиференційованої дисплазії сполучної тканини (ДСТ), кістозного медіанекрозу.
Набуті АВВА поділяють на запальні, незапальні і травматичні. До перших належать аневризми при сифілісі, неспецифічному аортоартеріїті, інфекційному ендокардиті, мікотичні аневризми. Незапальні аневризми можуть бути зумовлені атеросклерозом.
Найчастіше причиною виникнення АВВА в осіб молодого віку є синдром Марфана. При цьому спостерігається дегенерація середньої оболонки аорти, так званий кістозний некроз. За отриманими даними, у пацієнтів віком 16-29 років АВВА, асоційована з ознаками диференційованої ДСТ, діагностується у 92% випадків. Розширення висхідного відділу аорти у молодих хворих поєднується з малими структурними аномаліями серця – міксоматозним пролапсом мітрального клапана (ПМК), аномальними хордами лівого шлуночка (АХЛШ), їх поєднанням, двостулковим аортальним клапаном (ДАК), синдромом Марфана та марфаноподібним синдромом. У пацієнтів віком 30-44 роки з АВВА ознаки ДСТ реєструють у 40% випадків, у хворих віком 45-59 років – тільки в 16%.
При виникненні аневризми у пацієнтів похилого віку майже в 50% усіх випадків провідна роль належить АГ. До факторів ризику виникнення АА відносять також гіперліпідемію, цукровий діабет і куріння (останній фактор підвищує частоту виникнення АА на 15-20%).
За даними літератури, частка АГ як причини АВВА відрізняється в різних вікових категоріях. Якщо в осіб молодого віку гіпертонічну хворобу (ГХ) було діагностовано тільки у 7,7% випадків, то у хворих зрілого віку (30-44 роки) частка ГХ підвищувалась до 60,5%. У пацієнтів віком 45-59 років ГХ було діагностовано у 75% випадків, тоді як у 15% пацієнтів було виявлено також ішемічну хворобу серця (ІХС). У хворих похилого віку (60-76 років) АВВА переважно асоціювалася з ГХ (81%), ІХС (43%) або їх поєднанням (24%); випадків ДСТ у хворих цієї групи не реєстрували. Тобто з віком АВВА асоціюється переважно з тяжкими органічними ураженнями серця.
Якщо АВВА спостерігається при різних формах ДСТ, то розшарування найчастіше виникає на тлі синдрому Марфана або при марфаноподібному синдромі (відсутність повного набору фенотипічних ознак, що характеризують синдром Марфана). РАА при синдромі Марфана зустрічається у 65-100% випадків, частіше на рівні кореня або висхідної частини аорти. Ураження безпосередньо аорти при синдромі Марфана визначає прогноз і тяжкість захворювання в основної частини пацієнтів. Серед дорослих хворих прогноз для життя несприятливий. Летальність при істинному синдромі Марфана висока: половина пацієнтів серед чоловіків віком до 40 років, а серед жінок – до 50 років помирають. Відзначають критичні періоди життя, коли існує високий ризик розриву аневризми, – це вік 15-18 і 40-45 років. Особливо високий ризик РАА спостерігається у жінок із синдромом Марфана під час вагітності. Іноді діагноз встановлюється вже після діагностики РАА в післяпологовому періоді.
Серед причин РАА у хворих працездатного віку (30-50 років) виділяють синдром Гзеля-Ердгейма – розшарування аорти внаслідок її медіанекрозу без ознак атеросклеротичного ураження стінки судини. За даними А.Р. Вергун, за останні роки цей синдром став «лідером» серед нозологічних форм розшарування аорти в осіб молодого віку, значно випередивши за кількістю випадків неспецифічний аортоартеріїт і синдром Марфана. При синдромі Гзеля-Ердгейма переважно уражається висхідний відділ аорти. Етіологія цього захворювання до сьогодні залишається остаточно не з’ясованою. Патогістологічно в середній оболонці визначаються численні відкладення кальційпозитивних речовин, множинні кистоподібні порожнини, великі вогнища медіанекрозу, смугоподібні без’ядерні ділянки і виражені зміни еластичного каркасу: зони дисхромії еластичних волокон, лізису, набухання, розволокнення, фрагментація окремих еластичних мембран, в адвентиції – лімфогістіоцитарна інфільтрація. Завершується захворювання розшаруванням аорти.
В 1% випадків у пацієнтів з АВВА виявляють ДАК. Доведено, що у хворих з ДАК спостерігається у 9 разів вищий ризик виникнення аневризми, ніж у пацієнтів з нормальним АК. Припускають, що зниження міцності стінки аорти в осіб з ДАК асоціюється з нестачею фібриліну-1 в ембріональному періоді. Порівняно з групою осіб із тристулковим АК в стінці аорти у хворих з ДАК виявляють значну інфільтрацію лімфоцитами та більш виражений апоптоз гладком’язових клітин; це дозволяє припустити, що стінки аневризм на тлі ДАК можуть бути слабшими, ніж при типових аневризмах. ДАК – найчастіша вроджена вада серця у дорослих. На основі даних проведених аутопсій та хірургічних операцій можна зробити висновок, що наявність ДАК значно збільшує ризик захворюваності та смертності внаслідок розвитку клапанної дисфункції та розшарування аорти. Канадські вчені здійснили тривале спостереження за великою когортою пацієнтів з ДАК для визначення частоти несприятливих СС-наслідків і виявлення їх незалежних предикторів. Спостереження проводили за 642 хворими з 1994 по 2001 р. Середній вік пацієнтів становив 35±16 років, з них 68% – чоловіки. Усі учасники на момент реєстрації для спостереження перебували на амбулаторному обліку й не мали клінічної симптоматики. 200 хворих (31%) мали один і більше факторів коронарного ризику (АГ, дисліпідемія, діабет, куріння, обтяжений сімейний анамнез), 159 – раніше встановлений діагноз коарктації аорти, 150 із цих хворих були прооперовані (за допомогою методу черезшкірного або традиційного хірургічного втручання). Період спостереження тривав 9±5 років. Протягом цього часу померли 28 пацієнтів, із них 17 – від серцевих причин. 142 хворим було виконано хірургічні втручання на клапані або висхідній аорті, в 11 виявлено РАА, 16 – госпіталізовані з приводу застійної серцевої недостатності, зафіксовано 13 випадків ендокардиту з ураженням АК і в 30 пацієнтів встановлено тяжкі порушення серцевого ритму. Під час динамічного ЕхоКГ-обстеження у 280 хворих візуалізовано розширення синусів Вальсальви та/або безпосередньо висхідного відділу аорти. Незважаючи на те що за 9 років спостереження виживаність пацієнтів була не нижчою, ніж у загальній популяції, автори дійшли висновку, що у хворих з ДАК ймовірність оперативного втручання на клапані та/або аорті постійно зростає і тому вони мають спостерігатися як пацієнти з високим ризиком ускладнень. Спадковий характер цієї патології розглянули у своїй роботі І.Н. Кравченко і співавт. M. Cecconi і співавт. висунули гіпотезу про загальну основу виникнення ДАК, розширення (дилатації, аневризми та розшарування) висхідного відділу аорти, кореня й синусів Вальсальви, а також синдрому недиференційованої ДСТ.
Хвороба Бехчета, як і інші форми васкулітів, частіше зумовлює розвиток обмеженої аневризми й перфорації, аніж розшарування аневризми. Проявом синдрому Кавасакі також є виникнення обмежених аневризм, тоді як при сифілісі можуть спостерігатися поширене потовщення стінки (аортит) та ознаки АВВА. Поширеність синдрому Кавасакі становить 135 випадків на 100 тис. дітей і 8-17 – на 100 тис. дітей, молодших 5 років. При цьому синдромі найчастіше виникає аневризма коронарної артерії, але залучаються й інші судини. При гігантоклітинному артеріїті можуть розвиватись аневризми грудної та черевної аорти. Застосування кокаїну й амфетамінів також може призводити до стоншення стінки аорти та виникнення аневризм.
Неспецифічний аортоартеріїт – хвороба молодих людей, частіше чоловіків, із характерним ураженням інтими грудної, рідше – черевної аорти. Утворюються білуваті циркулярні бляшки навколо гирла великих артерій, що відгалужуються від аорти. Ці бляшки звужують їх просвіт. Також на вільних ділянках інтими формуються виступаючі валикоподібні бляшки, які розташовуються вздовж судин і відрізняються від атеросклеротичних бляшок кольором і консистенцією: білі, еластичні, без осередків звапнення. Виділяють кілька варіантів локалізації неспецифічного аортоартеріїту. Ураження дуги та її гілок деякі автори пропонують розглядати як окрему нозологічну форму з чітко специфічною симптоматикою – аортит дуги аорти (синдром Такаясу).
При стенозі аорти можливим є розвиток постстенотичних аневризм, які мають здатність збільшуватися навіть після імплантації штучного АК. Після такої операції 2-4% хворих виконують повторне хірургічне втручання на корені аорти.
Ще одна важлива причина виникнення аневризм – травми, особливо автомобільні, які отримані після гальмування на високій швидкості руху; в 95% випадків ушкоджується перешийок аорти.
Ризик розриву АА зростає із збільшенням її діаметра. У стінці накопичуються запальні клітини і підвищується рівень цитокінів, які спричиняють збільшення вироблення матриксних металопротеїназ макрофагами і гладком’язовими клітинами. Існує залежність між ступенем інфільтрації стінки клітинами й активацією матриксних металопротеїназ.
Уявлення про патогенетичні механізми утворення АА є суперечливими. Медіа аорти складається з гладком’язових клітин і білків позаклітинного матриксу, насамперед еластину й колагену. Правильне співвідношення гладком’язових клітин і білків позаклітинного матриксу має велике значення для підтримки функціональних властивостей аорти, особливо її механічної розтяжності потоком крові. Порушення метаболізму, що призводять до надмірного руйнування позаклітинного матриксу, можуть викликати прогресуюче зниження міцності стінки аорти з подальшим виникненням випинання або розриву.
Інший механізм пов’язаний з матриксними металопротеїназами (це сімейство складається з більш ніж 20 цинк-залежних протеолітичних ферментів), які впливають на метаболізм позаклітинного матриксу і ремоделювання стінки аорти, а це може мати значення при утворенні істинних та розшаровуючих аневризм. У пацієнтів з АВВА виявляють підвищену експресію матриксної металопротеїнази. Отже, зрозуміло, чому її ген (ММП-9) на сьогодні активно досліджують, а поліморфізм гена (алель 8202A/G) пов’язують з АВВА, хоч функціональне значення цього алеля в експресії матриксної металопротеїнази-9 ще потребує вивчення.
Значною мірою виникнення АВВА асоціюється з генетичними порушеннями. Є три основні спадкові хвороби, які спричиняють захворювання аорти: синдром Марфана, синдром Елерса-Данло-Русакова та інші сімейні форми захворювань сполучної тканини. Найчастіше це «перехідні» форми не повністю клінічно сформованих синдромів ДСТ. Групою японських учених було з’ясовано, що формування аневризми грудної аорти кодується близько 200 генами, які відповідають за запалення, розпад специфічних білків та апоптоз клітин стінки аорти. Ще глибше вивчили це питання науковці Єльського центру захворювань грудної аорти, які дійшли такого висновку: аневризма грудної аорти є генетично зумовленим захворюванням з переважно аутосомно-домінантним типом успадкування, в патогенезі якого основну роль відіграє активація матриксної металопротеїнази. Залишається нез’ясованим питання, чому саме грудна аорта є генетично «чутливою». Це дослідження підтверджує гіпотезу про переважне ураження грудної аорти (кореня та висхідної частини) у молодих хворих, які найчастіше мають ознаки спадкової ДСТ або вроджених вад аорти.
Згідно з отриманими даними у пацієнтів молодого і зрілого віку аневризма локалізується переважно в ділянці кореня. Для підтвердження цього нами було використано співвідношення розмірів кореня аорти (КА) та висхідного відділу аорти (ВА) до розміру лівого передсердя (ЛП). У молодих хворих достовірно переважав коефіцієнт КА/ЛП над ВА/ЛП, що асоціювалося з високим ступенем зв’язку (Rsp >0,50) між віком пацієнта та дефіцитом маси тіла, ступенем ПМК, симптомами великого пальця і зап’ястка, аномалією верхніх кінцівок, підвищеною розтяжністю шкіри, гіпермобільністю суглобів, що свідчить про високу ймовірність ДСТ в етіології АВВА у хворих молодого та середнього віку.
Визначення етіології АА часто викликає значні труднощі не лише у клініцистів, а й у морфологів. В.П. Захарова і співавт. дослідили особливості морфогенезу АВВА різної етіології. Співставивши та проаналізувавши морфологічні, клінічні й анамнестичні дані 195 випадків АВВА, дослідники визначили два основні фактори, які зумовлюють розвиток АВВА: надмірне навантаження на стінку аневризми та ослаблення її механічної міцності. За секційними даними цього дослідження, АВВА є причиною смерті у 2-2,7% усіх аутопсій.
Під час патологоанатомічного дослідження у пацієнтів з АВВА виявляють типове кістозне переродження медії аорти, мукоїдну речовину і руйнування еластичних волокон. При синдромі Марфана й ануло-аортальній ектазії також найчастіше спостерігають руйнування еластичних волокон, відкладання мукополісахаридоподібної речовини і кістозні порушення. Однак кістозне переродження медії – загальна ознака розширення аорти при низці станів, у тому числі ДАК. У 75% хворих з ДАК, яким виконали протезування АК, при дослідженні матеріалу біопсії було виявлено кістозний некроз медії висхідної частини аорти порівняно з 14% пацієнтів із тристулковими АК, яких оперували.
В осіб старшого віку, у яких більшість АА мають атеросклеротичний ґенез, макроскопічно внутрішня поверхня аневризми представлена атероматозними бляшками, подекуди з виразками і кальцинатами. Всередині порожнини аневризми пристінково розташовуються ущільнені маси фібрину, вони становлять «тромботичну чашку». Спостерігається некроз еластичних і колагенових мембран, різке стоншення медії та адвентиції, потовщення інтими за рахунок атероматозних мас і бляшок – еластичний каркас стінки виявляється практично зруйнованим. Накопичуючись і спресовуючись під тиском крові, тромботичні маси можуть майже повністю заповнити аневризматичний мішок, залишивши тільки вузький просвіт для потоку крові. Через погіршення трофіки замість організації «тромботичної чашки» виникає її некроз у ділянці прилягання до стінок аневризми, ушкоджується і сама стінка.
Згідно з отриманими нами даними на основі зв’язків між віком, причинними факторами та локалізацією АВВА запропоновано коефіцієнт КА/ВА (відношення розміру кореня аорти до розміру висхідної аорти), за яким можна визначити домінуючий характер етіології аневризми. При КА/ВА >1,11 ймовірність диспластичного ґенезу аневризми становить 84%; при КА/ВА <0,88 ймовірність недиспластичного походження АВВА – 90%.
За даними різних авторів, 5-річне виживання при АВВА становить від 25 до 50%. Найнебезпечнішими ускладненнями АА є її розшарування і розрив. Приблизно у 70% хворих розрив є клінічним дебютом аневризми та локалізується переважно у висхідній частині аорти, у 10% – в дузі, у 20% – в низхідній частині грудної аорти. Рідко спостерігається надрив інтими черевної аорти, поширеність цього ускладнення становить 5-20 випадків на 1 млн населення на рік. У США щорічно діагностують 2 тис. випадків АА. При розтині пацієнтів, які раптово померли від нетравматичних причин, АА виявляють в 1,5% випадків.
Згідно з іншими даними РАА діагностують в одного на 10 тис. госпіталізованих хворих (проте значна частина пацієнтів помирає ще на догоспітальному етапі), в одному випадку на 400 аутопсій, в одного зі 100 хворих, які помирають раптово, у 3-4% раптових смертей від усіх ССЗ. РАА – найчастіша патологія серед гострих захворювань аорти. Летальність від розривів аорти становить 40-90%, а кількість розшарувань постійно зростає. Без лікування рання смертність при розшаруванні становить 1% на годину в перший день, 75% – протягом двох тижнів і понад 90% – упродовж першого року. Проте виживаність пацієнтів на сьогодні може значно підвищитися завдяки своєчасній діагностиці і ранньому лікуванню цього загрозливого стану. Ятрогенна АА є рідкісним ускладненням. Так, під час ретроспективного аналізу було встановлено, що після операції на серці аневризма розвивається лише в 0,12-0,16% випадків.
Як і гострий інфаркт міокарда, раптова серцева смерть і зупинка серця, аневризма підпорядковується циркадним і сезонним ритмам. Вона найчастіше розвивається зранку і в зимові місяці року. Ці зміни зазвичай корелюють з фізіологічними коливаннями рівня артеріального тиску.
АГ, стоншення стінки судини і розширення аорти – найважливіші фактори, що підвищують напруження стінки, яке призводить до розриву або розшарування аорти. Діаметр аорти – показник ризику, але він не завжди збільшений. При захворюваннях сполучної тканини розширення аорти, яке перевищує норму, виникає в 40% випадків, при інших формах такий ступінь розширення виявлено лише в 10% випадків.
РАА у людей старших вікових груп зазвичай виникає на тлі атеросклерозу. АГ спостерігається приблизно у 84% хворих з РАА. Пік частоти РАА припадає на 6-7-ме десятиліття життя, чоловіки страждають у 2-3 рази частіше, ніж жінки. Провокуючими чинниками є гіпертонічний криз, інтенсивні фізичні навантаження, травми грудної клітки, ятрогенні фактори. Розшарування АВВА діагностують у 70-80% морфологічно підтверджених випадків під час операції або аутопсії.
Згідно з отриманими нами даними найбільш асоційовані зі ступенем розширення аорти такі фактори: у молодих пацієнтів – ПМК ≥2 ступеня, наявність додаткової хорди ЛШ, дефіцит маси тіла ≥20%, гіпермобільність суглобів та деформація грудної клітки і2 ступеня. У хворих зрілого віку – гіпермобільність суглобів, підвищена розтяжність шкіри, наявність міопії, маса міокарда ЛШ (ММЛШ) <235 г. В осіб середнього віку найбільший вплив на ступінь АВВА мали показники структурного стану міокарда: товщина міжшлуночкової перегородки ≥10 мм, відносна товщина стінок ЛШ ≥0,41. У похилому віці характерним є зв’язок ступеня АВВА із фракцією викиду (ФВ) <46% та ММЛШ >270 г. Чинниками, асоційованими з негативною динамікою ЕхоКГ-показників та прогресуванням ступеня розширення аорти, виявилися вік >58 років, маса тіла >86 кг, функціональний клас серцевої недостатності >1.
Отже, АВВА має чітку тенденцію до розвитку ускладнень – розривів та розшарувань з високою летальністю. Її перебіг пов’язаний як із структурою самої аневризми, так і з «причинними» захворюваннями, які відрізняються залежно від віку. Крім того, аневризми саме цієї локалізації мають найбільш доведений зв’язок із генетичними чинниками та ДСТ.
Діагностика АА, незважаючи на швидкий розвиток нових візуалізаційних методів і методик, є досить складною. За даними більшості дослідників, правильний діагноз встановлюється лише в 50% випадків, а своєчасний – лише в третині випадків.
Клінічна картина і діагностика аневризми залежать від її локалізації, розмірів, форми та напрямів збільшення. При невеликих аневризмах клінічних проявів може не бути, для аневризм середніх та великих розмірів характерним є біль, зумовлений тиском на навколишні тканини і розтягуванням нервових сплетінь аорти. При АВВА у пацієнтів може спостерігатися біль за грудиною. Якщо аневризма стискає верхню порожнисту вену, то виникає головний біль, набряк обличчя, ядуха. Нерідко хворі скаржаться на задишку і кашель, які спричинені тиском аневризматичного мішка на трахею і бронхи. Іноді виникає утруднення дихання, що посилюється в горизонтальному положенні. Проте в низці випадків навіть значні за величиною АВВА можуть мати безсимптомний перебіг і виявляються випадково під час рентгенологічного дослідження або аутопсії. Аневризма великих розмірів може стискати прилеглі легеневу артерію, праве передсердя, верхню порожнисту вену з розвитком застійних явищ вище місця стиснення.
Частим симптомом АА є систолічний шум, який при аневризмах висхідної аорти і дуги аорти вислуховується в другому міжребер’ї праворуч від грудини. Нерідко спостерігається недостатність АК з діастолічним шумом на аорті, вираженою пульсацією сонних артерій, збільшенням пульсового тиску, капілярним пульсом. Зрідка аневризма висхідної аорти стискає верхню порожнисту вену і лімфатичні судини грудної порожнини.
Аортальна недостатність, яка виникла гостро, діагностується у 50% пацієнтів з проксимальним розшаруванням і може бути спричинена розширенням кільця аорти або істинним розривом стулок аортального клапана. Тампонада серця і поява плеврального випоту – ознаки можливого розриву аневризми. Виникнення плеврального випоту, найчастіше зліва, може бути наслідком як розриву в порожнину плеври, так і пропотівання рідини з аорти в результаті запальної реакції на розшарування.
Додатковими ознаками є синдром Горнера, спричинений стисненням шийного симпатичного ганглія, та інфаркт міокарда при поширенні розшарування на коронарні артерії. Найчастіше уражається права коронарна артерія, інфаркт міокарда виникає в 1-2% осіб з АА. При дистальному розшаруванні може розвинутися тяжка гіпертензія (до 160 мм рт. ст.). Гіпотензія – серйозний симптом, який спостерігається приблизно в 1/5 хворих з розшаруванням висхідної частини грудної аорти і свідчить про зовнішній розрив або тампонаду перикарда.
У 90% випадків аномалія аорти візуалізується на оглядовій рентгенограмі грудної клітини. Найтиповішою ознакою є розширення аорти і тіні середостіння, а найспецифічнішою – виявлення на рентгенограмі відокремлених відкладень солей кальцію, що містилися в інтимі, від зовнішньої межі несправжнього просвіту. У нормі ця відстань не має перевищувати 0,5 см. Відстань понад 1 см з великою ймовірністю вказує на АА – так званий симптом кальцію. При ятрогенних розшаруваннях рентгенологічні ознаки менш надійні. Візуалізація розширеного середостіння, змінений контур аорти, наявність клаптя інтими або прохідного несправжнього просвіту зустрічаються приблизно удвічі рідше, ніж при спонтанному розшаруванні.
За даними Y. Kodolitsch і співавт., чутливість рентгенографії при виявленні як аневризми, так і її ускладнень (розшарування, розриви, тромбози) становить 64%, а специфічність – 86%, при ураженні висхідної частини аорти чутливість становить 47%, низхідної – 77%. На основі отриманих даних авторами було зроблено висновок про обмеженість інформативності рентгенографії аорти, особливо висхідного відділу, і особливо при «гострій аортальній хворобі». Це зумовлює необхідність проведення контрастної томографії, чутливість та специфічність якої сягають 92 і 98% відповідно. Комп’ютерна томографія (КТ) дає змогу визначити локалізацію та розміри аневризм, наявність у порожнині аневризматичного мішка тромботичних мас.
За даними літератури, трансторакальна ЕхоКГ дозволяє виявляти 80% випадків РАА із специфічністю 95%. На сьогодні особливе значення в діагностиці РАА має черезстравохідна ЕхоКГ (ЧСЕхоКГ), яку вважають одним із найінформативніших і найточніших методів. Так, за результатами багатоцентрового дослідження за участю 164 хворих з передбачуваним РАА, діагностична чутливість та специфічність ЧСЕхоКГ становили відповідно 94 і 98%, що не поступається аналогічним показникам КТ (83 і 100%) та аортографії (88 і 94%). Крім того, метод ЧСЕхоКГ є відносно недорогим, практично не інвазивним, не супроводжується опромінюванням пацієнта і не вимагає введення контрасту. ЧСЕхоКГ можна проводити безпосередньо біля ліжка хворого, у разі необхідності навіть інтраопераційно, або здійснювати з її допомогою моніторинг хірургічних втручань, причому протягом тривалого періоду.
Золотим стандартом серед діагностичних методів ще донедавна вважався метод ангіографії за Сельдінгером, яку доцільно виконувати у двох проекціях із введенням контрастної речовини у висхідну частину аорти. Але це дорогий та інвазивний метод, застосування якого асоціюється з ризиком розвитку небезпечних ускладнень. Саме тому клініцисти не завжди використовують його у разі підозри на РАА, особливо за відсутності клінічних проявів або при атиповій симптоматиці.
Складною є діагностика розшарування аорти. Найхарактернішим проявом РАА є раптовий початок захворювання. Деякі характеристики болю можуть допомогти відрізнити аневризму від інших захворювань, насамперед від інфаркту міокарда. Сильний біль, який виник раптово, зазвичай свідчить про розшарування аневризми; він спостерігається у 90% пацієнтів. Біль розпираючого характеру, що локалізується в передніх відділах грудної клітки і поширюється на спину, безперервний, іноді мігрує за ходом розшарування. Навпаки, біль при інфаркті міокарда поступово наростає і часто описується як відчуття стиснення або розпирання.
При ятрогенному розшаруванні клінічна картина може не відповідати вищезгаданій. Різкий біль менш імовірний, він не мігрує. Безбольове розшарування дуже часто буває ятрогенним і супроводжується ішемією та гіпотонією.
При фізикальному дослідженні хворий з РАА може виглядати, як шоковий. Однак у понад половини пацієнтів з дистальним розшаруванням артеріальний тиск підвищений. Гіпотонія свідчить про тампонаду перикарда (розрив у порожнину перикарда), розрив у плевральну або черевну порожнини, оклюзію плечових артерій, що призводить до неістинної гіпотонії. Відсутність периферичного пульсу є важливим симптомом при діагностиці АА. Він спостерігається приблизно в половині випадків проксимального розшарування і вказує на ураження брахіоцефальних судин. При дистальному розшаруванні тільки в одного з 6 хворих визначається ослаблення периферичного пульсу.
Лабораторні дані зазвичай не інформативні. Внаслідок крововтрати в несправжній просвіт аорти або в розрив у пацієнта розвивається анемія, а в результаті гемолізу зростає рівень лактатдегідрогенази та білірубіну. Можливий помірний лейкоцитоз – до 10-14×109/л.
ЕКГ може бути інформативною з огляду на відсутність ішемічних змін у хворого із сильним болем у грудях. Це має наштовхнути на думку про РАА. Однак, як зазначалося вище, при ятрогенних розшаруваннях ішемія може бути яскраво вираженою. Отже, наявність ішемічних змін не виключає діагнозу АА.
Ехокардіографія (трансторакальна і черезстравохідна) стала важливим методом діагностики РАА. Вона дає змогу швидко оцінювати стан хворого і може виконуватися де завгодно. Діагноз аневризми ґрунтується на виявленні клаптя інтими, що розділяє істинний і несправжній просвіти аорти. У 75% пацієнтів з аневризмою типу А інформативною є трансторакальна ЕхоКГ; при розшаруванні типу В цей метод є цінним лише в 40% випадків. ЕхоКГ дозволяє також оцінювати клапанну функцію (недостатність АК), наявність перикардіального випоту і стан шлуночків. У більшості випадків для підтвердження діагнозу і визначення джерела розшарування застосовують додаткові методи дослідження.
Черезстравохідну ЕхоКГ використовують для вивчення стану грудної аорти при ускладненнях: під час виявлення розриву інтими і розшарування висхідної частини аорти чутливість методу становить 86%, а специфічність – 96%. За допомогою ЧСЕхоКГ можна швидко обстежити нестабільного хворого в умовах відділення невідкладної допомоги, реанімаційного відділення або в операційній. Під час операції зазначений метод дає можливість отримувати додаткову інформацію щодо стану АК, і якщо необхідне протезування, то можна оцінити його успішність. Додатково можна визначити наявність і поширеність атеросклеротичного процесу в аорті. Через це, а також завдяки компактності і транспортабельності апаратури ЧСЕхоКГ стає дедалі популярнішим методом обстеження хворих з підозрою на РАА.
Інші візуалізаційні методи (традиційна КТ, надшвидка КТ, магнітно-резонансна томографія – МРТ та ангіографія) досить інформативні, але вимагають, щоб хворий перебував у відносно стабільному стані. КТ часто застосовують для діагностики захворювань грудної аорти. Це неінвазивний метод, який є дуже корисним для виявлення інтрамуральної гематоми і перфоруючих атеросклеротичних виразок грудного відділу аорти. Крім того, КТ дозволяє виявити АА у вигляді двох каналів в просвіті силуету аорти. Однак діагностична точність КТ становить щонайбільше 85%, крім того, процедура потребує внутрішньовенного введення контрастних препаратів, які можуть викликати погіршення функції нирок, тому КТ найчастіше проводять для спостереження за пацієнтами з уже встановленим діагнозом АА, яких лікують консервативно. МРТ має високу точність і специфічність щодо діагностики можливого розшарування аорти. Цей метод забезпечує відмінне зображення при обох типах розшарування і дозволяє точно визначити місце розриву інтими, дає можливість вивчати стан основних гілок аорти без використання внутрішньовенних контрастів. Додаткові відомості, які можуть бути отримані за допомогою МРТ, – це інформація про стан АК, перикарда і функцію ЛШ. Застосування методу обмежується нездатністю хворих, що перебувають у критичному стані, переносити цю тривалу процедуру.
Аортографія є кінцевим методом діагностики РАА і зазвичай проводиться всім пацієнтам, яким призначено оперативне втручання. Вона дозволяє виявити локалізацію розшарування і його протяжність, цілісність основних артеріальних стовбурів, що відходять від аорти. У більшості випадків вдається виявити як несправжній, так і істинний просвіти аорти. Ознаками розшарування на ангіограмі є лінійне просвітлення, відповідне інтимі та медії аорти, що розділяє два канали, розділення колонки контрастної речовини і зворотний потік крові або стаз в аорті. Чутливість та специфічність аортографії становлять 77-88 і 95% відповідно. Так, несправжній хід візуалізується у 87% хворих, інтимальний клапоть – у 70%, місце початкового розриву інтими – лише у 50% пацієнтів з РАА.
Таким чином, АА, особливо висхідного відділу, – патологія з високою летальністю, але методи її швидкої діагностики досить обмежені і потребують стабільного стану хворого та часу для проведення й інтерпретації даних.
У клінічній практиці використовують два варіанти лікування АА: консервативний та оперативний. Консервативний метод передбачає комплексне немедикаментозне та медикаментозне лікування і включає: відмову від куріння, за наявності АГ – призначення β-блокаторів, верапамілу, дилтіазему, ІАПФ, сартанів, при необхідності – статинів (для зниження рівня холестерину ліпопротеїнів низької щільності <1,8 ммоль/л) – у разі атеросклерозу аорти, β-блокаторів при ДСТ, що, як правило, супроводжуються дисбалансом вегетативної нервової системи. Є дані про ефективність блокатора рецепторів ангіотензину II лосартану при синдромі Марфана.
Оцінка необхідності проведення терапевтичних заходів при АА на тлі ДСТ значно відрізняється від такої при атеросклеротичному та гіпертензивному ґенезі аневризми та визначається клінічною формою ДСТ. Проблема лікування надзвичайно складна і вимагає врахування клінічних проявів ДСТ. Якщо ДСТ характеризується ураженням різних органів і систем, слід використовувати комплексний підхід, що передбачає немедикаментозні і медикаментозні методи лікування.
З немедикаментозних методів застосовують психологічну підтримку, індивідуалізацію режиму дня, лікувальну фізкультуру, фізіотерапію і масаж. Важливою є і дієтотерапія, що враховує підвищену потребу пацієнта в білках, незамінних амінокислотах і мікроелементах. Варто зазначити, що при вже наявній аневризмі ефективність немедикаментозної терапії не висока.
До медикаментозних методів належать препарати, що стимулюють колагеноутворення, – аскорбінова кислота, препарати мукополісахаридів (хондроїтинсульфат), вітаміни групи В (В1, В2, В3, В6) і мікроелементи (мідь, цинк, магній). На особливу увагу заслуговує терапія препаратами, що містять магній, оскільки цей мікроелемент входить до складу понад 300 ферментів, бере участь у внутрішньо- і позаклітинному дозріванні колагену та інших структурних елементів сполучної тканини. Важливо зазначити, що дефіцит іонів магнію – надзвичайно поширена проблема, що зумовлює поглиблення ДСТ. На сьогодні накопичено багато даних, які свідчать про ефективність використання препаратів магнієвої солі оротової кислоти для лікування хворих з ДСТ та ПМК. У більшості клінічних досліджень наголошують на ефективності профілактичного застосування β-адреноблокаторів для запобігання розшаруванню аорти.
Хірургічне лікування передбачає відкриту реконструкцію та ендоваскулярне протезування аорти. При РАА пацієнта переводять у відділення інтенсивної терапії для цілодобового моніторингу артеріального тиску, серцевого ритму, діурезу, загального стану та проявів захворювання, а також лікування.
Вибір оптимальних термінів для планової операції є складним, оскільки віддалені результати хірургічного втручання вивчені недостатньо, багато хворих помирають від супутніх ССЗ, а ризик операції в низці випадків (особливо при аневризмах дуги і низхідного відділу аорти) переважає її потенційну користь.
Показаннями до оперативного втручання при АВВА є: діаметр аорти ≥55 мм (>50 мм – у чоловіків, >45 мм – у жінок, що курять, з АГ), прогресуюче збільшення розмірів аневризми (>0,5 см на рік), тяжка аортальна регургітація та наявність симптомів, незалежно від діаметра аорти, розшарування аорти. У пацієнтів із синдромом Марфана, з огляду на високий ризик розриву або РАА, хірургічне втручання доцільно виконувати при АА будь-якої локалізації діаметром ≥5,5 см.
Проте є й інші думки щодо критичних розмірів аорти, при яких необхідне оперативне втручання. Абсолютний розмір аорти не завжди визначає ризик розвитку ускладнень. John A. Elefteriades як приклад наводить статистичні дослідження, проведені в Єльському університеті за останні 10 років. Аналіз бази даних хворих з аневризмою грудної аорти дав змогу розробити критерії для проведення хірургічного втручання. База містила дані 1600 пацієнтів з грудною аневризмою і розшаруванням, що включає 3000 серійних зображень і 3000 пацієнто-років подальших спостережень. По-перше, це темпи зростання: аневризма грудної аорти збільшується в середньому зі швидкістю 0,1 см на рік (0,07 для висхідної і 0,19 для низхідної). По-друге, критичні розміри: переломні точки для природних ускладнень АА (розрив або розшарування), коли діаметр становить 6,0 см для висхідної аорти і 7,0 см для низхідної. До того часу, коли аневризми досягли цих критичних розмірів, ймовірність розриву або розшарування становила 31% для висхідної і 43% для низхідної аорти. По-третє, це щорічні темпи подій: хворий з аортою, яка досягла діаметра 6 см, має такі річні темпи розвитку руйнівних побічних ефектів – розрив (3,6%), розшарування (3,7%), смерть (10,8%); розрив, розшарування або смерть (14,1%). Хірургічні ризики: ризик смерті від оперативного втручання на грудному відділі аорти – 2,5% для висхідної і дуги та 8% – для низхідної і торакоабдомінальної аорти. Важливим виявився генетичний аналіз – дані родоводів підтвердили, що 21% пробандів з аневризмою грудної аорти мають членів родини першого порядку з артеріальною аневризмою. Результати цього дослідження свідчать на користь оперування безсимптомної аневризми грудної аорти для попередження розриву і розшарування. Автори рекомендують хірургічне втручання для висхідної аорти при діаметрі 5,5 см, для низхідної – при 6,5 см. У разі хвороби Марфана або сімейної аневризми грудної аорти рекомендованим є більш раннє втручання: при діаметрі 5,0 см для висхідної і 6,0 см – для низхідної аорти. Симптоматичні аневризми необхідно оперувати незалежно від розміру. Має бути проведена оцінка ризику і для членів сім’ї.
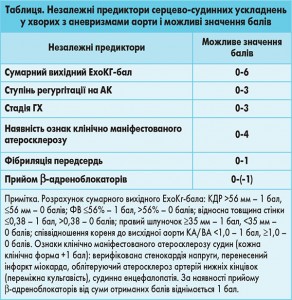
Згідно з отриманими даними як незалежні інформативні предиктори СС-ускладнень у хворих з АВВА, визначені на підставі результатів динамічного дворічного спостереження, можливо розглядати: сумарний ЕхоКГ-бал (розрахований на основі показників ремоделювання ЛШ та коефіцієнта КА/ВА), ступінь аортальної регургітації, стадію ГХ, наявність ознак клінічно маніфестованого атеросклерозу, наявність фібриляції передсердь та відсутність постійного прийому β-блокаторів (табл.). З урахуванням особливостей цих критеріїв розроблено бальну оцінку предикторів ускладнень і показано, що найоптимальнішою для прогнозу є сума балів 7, при перевищенні якої істотно збільшується ризик ускладненого перебігу захворювання і доцільним є вирішення питання про вибір більш жорсткої тактики лікування, у тому числі про призначення хірургічної корекції АВВА.
Отже, незважаючи на значну поширеність АА, досі недостатньо вивчені механізми її виникнення та розвитку ускладнень, роль СС-ремоделювання в прогнозі захворювання, недостатньо оцінені можливості консервативної терапії, немає чітко визначених предикторів розшарування, не визначено тактику лікування при стабільному перебігу аневризми в різних вікових категоріях, що зумовлює доцільність детального вивчення цих питань. Не остаточно вирішені завдання щодо тактики ведення пацієнтів з АА, критеріїв розподілу за групами для консервативного та хірургічного лікування, зважаючи на те, що навіть при однакових розмірах аневризми ризик розвитку ускладнень може відрізнятись у пацієнтів з різними етіологією, супутніми факторами та віком.
Список літератури знаходиться в редакції.




