18 квітня, 2020
Новые возможности диагностики и лечения урологических заболеваний
По материалам конгресса Ассоциации урологов Украины
Летом прошлого года в Киеве состоялся конгресс Ассоциации урологов Украины. В мероприятии принимали участие и отечественные, и зарубежные спикеры. Были представлены доклады, посвященные как общеизвестным актуальным вопросам в урологии, так и новым тенденциям современной медицины. Честь открывать конгресс была предоставлена член-корреспонденту НАМН Украины, д. мед. н., профессору С.О. Возианову, который выступил с приветственной речью и пожелал докладчикам и слушателям плодотворной роботы.
 С докладом «Актуальные вопросы урологии» выступил заведующий отделом реконструктивной и гериатрической урологии ГУ «Институт урологии НАМН Украины» (г. Киев), доктор медицинских наук, профессор А.В. Шуляк.
С докладом «Актуальные вопросы урологии» выступил заведующий отделом реконструктивной и гериатрической урологии ГУ «Институт урологии НАМН Украины» (г. Киев), доктор медицинских наук, профессор А.В. Шуляк.
Докладчик начал свое выступление с обсуждаемого и острого вопроса в практической урологии – заболеваний предстательной железы и роли биохимических исследований в их диагностике.
Рак предстательной железы (РПЖ) – одно из наиболее распространенных злокачественных новообразований у мужчин. Ежегодно в мире выявляется свыше 400 тыс. случаев РПЖ. В ряде стран в структуре онкологических заболеваний он занимает 2-3-е место после рака легких и желудка. В связи с большим ростом заболеваемости в целях ранней диагностики рекомендовано проводить ежегодный скрининг РПЖ. Начиная с 1987 года в диагностике данного заболевания широко используется определение уровня простатспецифического антигена (ПСА). Известно, что проведение ПСА-скрининга приводит к снижению смертности от РПЖ и уменьшает количество пациентов с отдаленными метастазами.
Отвечая на вопрос, целесообразно ли определять уровень ПСА у всех мужчин, обратившихся за помощью к урологу, профессор отметил, что показанием к проведению этого исследования является наличие повышенного риска развития РПЖ. В первую очередь исследованию подлежат:
- мужчины старше 50 лет;
- мужчины старше 45 лет, имеющие в семейном анамнезе РПЖ;
- представители негроидной расы старше 45 лет.
В случае получения негативных результатов дальнейшие исследования следует проводить с частотой 1 раз в 2 года для мужчин группы риска: при ПСА >1 нг/мл в возрасте 40 лет и при ПСА >2 нг/мл в возрасте 60 лет.
Для дифференциальной диагностики РПЖ и доброкачественной гиперплазии предстательной железы (ДГПЖ) выполняют МРТ-таргетную и стандартную биопсию. Мультицентровое рандомизированное контролируемое исследование FUTURE (Wegelin O. et al., 2018) показало, что существуют статистически достоверные отличия в информативности этих двух методов в пользу МРТ-таргетной биопсии. Информативность последней повышается при ее комбинации с рандомизированной биопсией.
Переходя к вопросу использования маркеров для диагностики доброкачественных и злокачественных образований почки, докладчик отметил, что на сегодняшний день большое значение придается анализу микро-РНК (Heinzelmann J. et al., 2014). В последние годы обнаружено несколько микро-РНК, которые могут претендовать на роль маркера рака почки. Чувствительность этого маркера достигает 77,4%, специфичность – 37,6%. По данным М. Redova et al. (2012), одновременное определение концентраций miR‑378 и miR‑451 в сыворотке крови позволяет идентифицировать почечно-клеточную карциному у исследуемых пациентов с чувствительностью 81% и специфичностью 83%.
Внедрение новых технологий дало возможность использовать магнитно-резонансную спектроскопию в диагностике рака почки. Молекулярная визуализация позволяет на основании метаболической активности определить гистологический тип новообразования.
В последние два года все больше внимания стало уделяться вопросу диагностики рака мочевого пузыря. Современным методом обследования является одновременное выполнение цитологического исследования мочи и метилирования генов ДНК CFTR, SALL3, TWIST1. Чувствительность такого метода составляет 96%, специфичность – 40%, позитивная и негативная прогностическая ценность – 56 и 92% соответственно. Применение данной методики позволяет избежать 36% ненужных цистоскопий в процессе мониторинга этих пациентов (van der Heijden A. G. et al., 2018).
Еще одной новостью в урологии стала публикация результатов исследования UPSTREAM, в котором изучали значимость уродинамического исследования перед проведением операций по поводу ДГПЖ. Результаты показали, что выполнение подобных предварительных исследований не влияет на результаты операции, но в общем влияет на эквивалентное улучшение симптомов. Также был сделан вывод о нецелесообразности оперирования пациентов с индексом качества жизни (QoL) 1‑2 балла.
При ведении пациентов с неметастатическим кастрационно-рефрактерным РПЖ и быстрым ростом уровня ПСА лечение энзалутамидом привело к клинически значимому и достоверному снижению риска развития метастазов и увеличению времени до начала прогрессирования болезни. Также существует небольшая тенденция к более низкой выживаемости при применении постоянной терапии из-за риска сердечно-сосудистых осложнений.
Эффективным вариантом таргетной терапии рака почки является применение препарата сутент (сунитиниб). Сутент является мощным ингибитором тирозинкиназ – белков, с помощью которых происходит передача сигналов внутри клетки. По результатам международных клинических исследований выявлена высокая эффективность препарата по сравнению с цитокинами. Было доказано, что при использовании сунитиниба и интерферона α в первой линии терапии полная и частичная регрессия опухоли соответственно составила 31 и 6% (р<0,00001), а сравнительная безрецидивная выживаемость – 11 и 5 мес в пользу больных, принимавших сунитиниб (р<0,00001).
Также докладчик сообщил, что при выполнении трансуретральной резекции простаты поточная терапия ацетилсалициловой кислотой не продемонстрировала значительного влияния на осложнения проведенной операции. При этом применение клопидогреля или фенпрокумона ассоциируется с повышенным риском кровотечения и, как следствие, необходимостью в переливании крови, а также с увеличением длительности госпитализации.
ДГПЖ (ранее используемый термин «аденома предстательной железы») – доброкачественное образование, развивающееся из железистого эпителия либо стромального компонента простаты.
К факторам риска прогрессирования ДГПЖ относятся:
- суммарная оценка по Международной шкале простатических симптомов (IPSS) >7 баллов;
- объем простаты >30 см3;
- уровень ПСА >1,4 нг/мл;
- максимальная скорость потока мочи (Qmax) <12 мл/с (по данным урофлоуметрии).
Каждый из этих показателей повышает риск прогрессирования ДГПЖ в 3‑4 раза.
Прогрессирование ДГПЖ проявляется наличием таких признаков, как:
- усиление симптомов нижних мочевыводящих путей (СНМП);
- увеличение размеров простаты;
- затрудненное мочеиспускание (Qmax);
- острая задержка мочи;
- появление симптомов ДГПЖ, являющихся показанием к оперативному вмешательству.
Докладчик сообщил, что в клинических исследованиях, проведенных в Новой Зеландии, показал свою эффективность инновационный и минимально инвазивный метод удаления гиперплазированной ткани предстательной железы с помощью холодной струи физиологического раствора. Так, в двойном слепом проспективном рандомизированном исследовании с участием 181 мужчины с СНМП вследствие ДГПЖ сравнивали исходы акваабляции простаты и стандартной трансуретральной резекции с электрокоагуляцией. Через год после прохождения процедур показатели улучшения симптомов были сходными в обеих группах (отмечалось снижение на 15,1 балла по шкале IPSS). Также в обеих группах наблюдалось заметное повышение Qmax: на 10,3 и 10,6 см3/с при проведении акваабляции и трансуретральной резекции соответственно. Среднее уменьшение объема остаточной мочи составило 52 и 63 см3 соответственно.
Еще одним сравнительно новым методом оперативного лечения ДГПЖ является установка временно имплантируемого нитинолового устройства TIND (производства компании Medi-Tate, Израиль). Прибор предназначен для реконструкции шейки мочевого пузыря и простатической части уретры. TIND состоит из удлиненных стенок и анкерного листа нитинола. Под прямой визуализацией TIND разворачивается внутри предстательной железы в расширенной конфигурации. Механизм его действия заключается в сжатии обструктивной ткани расширительным прибором – тем самым применяется радиальная сила, которая приводит к ишемическому некрозу в определенных зонах. TIND остается в таком положении в течение 5 дней. В дальнейшем прибор удаляется в амбулаторных условиях при проведении стандартной уретроскопии. Совсем недавно в урологическую практику был введен имплантат второго поколения – іTIND, который состоит из трех удлиненных стенок и закрепляющего листа.
Следующий инновационный метод оперативного лечения ДГПЖ – минимально инвазивная простая простатэктомия (MISP) – включает лапароскопическую (LSP) и робот-ассистированную (RASP) простую простатэктомию. Методика LSP впервые была описана в 2002 году, а первый случай выполнения RASP был упомянут в 2008 году. Оба способа используются в разных персонализированных вариантах, разработанных на основе транскапсулярных (Millin) или трансвезикальных (Frezer) техник. Для LSP в большинстве случав используют внеперитонеальный доступ, в то время как при RASP – трансперитонеальный.
Невзирая на внедрение новых методик оперативного лечения ДГПЖ, не следует забывать о ценности медикаментозной терапии, которая по-прежнему предполагает назначение:
- α1-адреноблокаторов (доксазозин, альфузозин, теразозин, тамсулозин, силодозин);
- ингибиторов 5α-редуктазы (финастерид, дутастерид);
- М-холиноблокаторов;
- ингибиторов фосфодиэстеразы 5-го типа (ФДЭ‑5);
- агонистов β3-адренорецепторов (мирабегрон);
- десмопрессина;
- растительных экстрактов.
Для усиления эффекта рекомендовано применение таких рациональных комбинаций, как:
- α1-адреноблокаторы и ингибиторы 5α-редуктазы;
- α1-адреноблокаторы и М-холиноблокаторы;
- ингибиторы ФДЭ‑5 и ингибиторы 5α-редуктазы;
- ингибиторы ФДЭ‑5 и α1-адреноблокаторы.
Результаты исследований MTOPS и CombAT показали, что комбинированная терапия α1-адреноблокаторами и ингибиторами 5α-редуктазы более эффективна, чем любой из вариантов монотерапии в отношении купирования клинических проявлений ДГПЖ и повышения Qmax, и более результативна относительно снижения риска острой задержки мочи и необходимости хирургического вмешательства.
В последнее время была получена информация о возможности финастерида приводить к морфологическим и функциональным нарушениям почек. Об этом заявили специалисты из Померанского медицинского университета (г. Щецин, Польша). Именно поэтому пациенты с почечной дисфункцией или трансплантацией почек в анамнезе, получающие этот препарат, должны пребывать под особым контролем и регулярно исследовать функцию почек (Baig M. S. et al., 2019).
Подводя итог своему выступлению, профессор А. В. Шуляк отметил следующее. Несмотря на новые тенденции в ведении урологических больных, выбор лечения должен зависеть от состояния пациента, его индекса качества жизни и наличия факторов риска прогрессирования заболевания. Значительно увеличилась роль комбинированного медикаментозного лечения ДГПЖ. Хирургическое вмешательство обычно требуется в случаях, когда у больного присутствует рецидивирующая задержка и недержание мочи, рецидивирующие инфекции мочевыводящих путей, рефрактерная к лечению макроскопическая гематурия или дилатация мочевыводящих путей. В каждом отдельном случае терапия должна быть подобрана индивидуально.
Доклад на тему «Лечение рецидивирующих инфекций мочевых путей у женщин в постменопаузальном периоде» предложил вниманию присутствующих врач-уролог высшей категории И.В. Радьков (Беларусь).
Согласно данным статистики, около 11% женщин страдают рецидивирующими инфекциями мочевых путей, не поддающимися традиционной антибактериальной терапии. Последние характеризуются волнообразным течением с периодами обострения и ремиссии. Приблизительно у 30% больных обострения происходят на фоне симптомов гиперактивного мочевого пузыря.
Основными звеньями патогенеза урогенитальных расстройств являются:
- нарушение кровоснабжения стенки мочевого пузыря, мочеиспускательного канала, стенки влагалища;
- развитие ишемии детрузора и уменьшение транссудации;
- недостаточная пролиферация эпителия влагалища и мочеиспускательного канала;
- снижение синтеза гликогена и коллагена;
- изменение характера влагалищного секрета;
- дефицит лактобацилл, повышение показателя рН;
- возможное присоединение вторичной инфекции.
Сочетание указанных изменений приводит к развитию симптомов вагинальной и цистоуретральной атрофии и влияет на развитие стрессового недержания мочи и гиперактивного мочевого пузыря.
Интенсивность всех симптомов урогенитальных расстройств определяется по 5-балльной шкале D. Barlow:
1 балл – минимальные нарушения, не влияющие на повседневную жизнь;
2 балла – дискомфорт, периодически влияющий на повседневную жизнь;
3 балла – умеренные нарушения функции урогенитального тракта;
4 балла – выраженные нарушения;
5 баллов – крайне выраженные нарушения.
Особенно чувствительными к рецидивирующим инфекциям мочевых путей и возобновлению симптомов нарушения функции урогенитального тракта являются пациентки в периоде поздней менопаузы. Эта категория лиц обычно обращается к урологам, а терапия в подавляющем большинстве случаев носит традиционный характер (антибактериальные средства, инстилляции мочевого пузыря, физиопроцедуры, растительные уросептики), что усугубляет клиническую картину заболевания. Лечение этой группы больных является сложной задачей и связано с устранением атрофических изменений не только в вагинальном эпителии, но и в уротелии.
В связи с этим докладчиком и его коллегами на базе Института урологии было проведено исследование эффективности комплексного лечения рецидивирующей инфекции урогенитального тракта у женщин путем использования местной заместительной гормональной терапии (ЗГТ). В ходе исследования применяли эстриол, содержащийся в препарате эстринорм.
В исследование были включены 30 женщин в возрасте от 52 до 76 лет в постменопаузе с симптомами вагинальной, цистоуретральной атрофии и рецидивирующими инфекциями мочевых путей. Длительность менопаузы пациенток составляла от 6 до 28 лет (в среднем 15,03±6,1 года), а число рецидивов заболевания колебалось от 3 до 8 эпизодов в год. В анамнезе все они получали лечение антибиотиками, на момент обращения ни одной из них не назначали гормональную терапию.
В исследование не включались женщины, имеющие:
- заболевания верхних мочевых путей (мочекаменная болезнь [МКБ], пиелонефрит, опухоли почек);
- внутрипузырную обструкцию, вызванную органическими причинами;
- заболевания, приводящие к нарушению иннервации мочевого пузыря (сахарный диабет, энцефалопатии различной этиологии, заболевания позвоночного столба и спинного мозга, болезни Альцгеймера, Паркинсона, нарушение мозгового кровообращения).
До лечения и в конце 3-го месяца терапии всем участницам, включенным в исследование, проводились клинические анализы (общий анализ крови и мочи), комплексное микробиологическое исследование мочи, определение интенсивности симптомов вагинальной и цистоуретральной атрофии по 5-балльной шкале D. Barlow, комплексное уродинамическое исследование, цистоскопия, осмотр гинеколога.
Пациентки были разделены на две группы (по n=15), сопоставимые по возрасту и клинической картине заболевания. Женщины 1-й группы получали комплексную традиционную терапию с добавлением к ней локальной ЗГТ в виде суппозиториев эстринорм 0,5 мг по 1 свече ежедневно в течение 15 дней, затем по 1 свече 1 раз в 2 дня в течение 10 нед и в дальнейшем – по 1 свече 1 раз в неделю сроком до года. Женщинам 2-й группы проводили обычное традиционное лечение. Эффективность терапии оценивали к концу 3-го месяца ее проведения по таким параметрам, как редукция симптомов вагинальной и цистоуретральной атрофии, уменьшение числа рецидивов циститов.
Эстринорм (FarmaPrim SRL) – вагинальные суппозитории, содержащие эстриол 0,5 мг, который способствует восстановлению нормального влагалищного эпителия при его атрофических изменениях в пре- и постменопаузе, нормализует микрофлору влагалища, тем самым повышая сопротивляемость его эпителия к инфекционным и воспалительным процессам, не обладает системным действием.
В 1-й группе пациенток при осмотре наблюдалось значительное улучшение состояния слизистой вульвы и влагалища, отмечалась их бледно-розовая окраска, появление складчатости, достаточная увлажненность, имели место и изменения при цистоскопии. При расширенном исследовании определялось значительное улучшение состояния вагинального эпителия, незначительное истончение слизистой влагалища; просвечивание немногочисленных капилляров в подслизистом субэпителиальном слое отмечалось в единичных случаях. При выполнении пробы Шиллера окраска слизистой оболочки влагалища раствором Люголя была равномернай. Оценка симптомов вагинальной и цистоуретральной атрофии по 5-балльной шкале D. Barlow у пациенток 2-й группы составила 2-3 балла, 1-й группы – 0-1 балл. У 12,3% больных 2-й группы в течение 1-го месяца терапии возникли рецидивы циститов, потребовавшие повторного лечения и назначения местной ЗГТ. У женщин 1-й группы за время наблюдения рецидивов не наблюдалось.
Подводя итоги по результатам исследования, И.В. Радьков отметил, что развитие рецидивирующих инфекций на фоне урогенитальной атрофии относят к тяжелой форме ее проявления, а необдуманное и нерациональное назначение курсов антибактериальной терапии приводит к еще большему нарушению микробиоценоза у пациенток. Последнее обусловливает развитие дисбиоза как во влагалище, так и в желудочно-кишечном тракте и, вероятно, может быть одной из причин рецидивов заболевания.
При предварительном сравнении эффективности традиционной и комбинированной терапии с эстринормом через 3 мес лечения отмечена разница в объективных показателях вагинального исследования и выполненной цистоскопии. Так, на фоне традиционного лечения во 2-й группе у 12,3% пациенток в течение 1-го месяца возникли рецидивы циститов, тогда как в 1-й группе за время наблюдения рецидивов не выявлено.
Таким образом, использование локальной ЗГТ является основой в лечении женщин в постменопаузе с рецидивирующими инфекциями урогенитального тракта. Это позволяет улучшить их самочувствие и качество жизни. Применение вагинальных суппозиториев эстринорм является объективно предпочтительным и безопасным, так как препарат не обладает системным действием и позволяет быстрее восстановить цистоуретральный и вагинальный эпителии, вагинальную микроэкологию, активируя защитное действие лактобацилл.
Свой следующий доклад И.В. Радьков посвятил вопросу сепсиса в урологии, а именно роли использования прокальцитонина (ПКТ) как маркера эффективности в лечении острой урологической патологии.
Сепсис – системная воспалительная реакция на инвазию микроорганизмов – характеризуется наличием очага инфекции и двух или более признаков синдрома системного воспалительного ответа. К последним относятся:
- температура тела >38 °С или <36 °С;
- ЧСС ≥90 уд./ мин;
- ЧД >20 вдох/мин или гипервентиляция (РаСО2 <32 мм рт. ст.);
- лейкоциты в крови >12×109/мл или 10%.
Как известно, сепсис был и остается серьезной проблемой здравоохранения, а его частота повышается на 10-15% ежегодно. Такой рост встречаемости сепсиса обусловлен:
- щироким использованием инвазивных методик диагностики и лечения;
- улучшением выживаемости тяжелых пациентов;
- увеличением количества иммунологически скомпрометированных лиц;
- ростом полирезистентности флоры и увеличением количества случаев ассоциации микроорганизмов.
Если на фоне сепсиса сохраняется потребность во введении вазопрессоров для достижения среднего артериального давления (АД) ≥90 мм рт. ст. при адекватной инфузионной терапии, речь идет о септическом шоке. Септический шок трактуется теперь как вариант сепсиса с выраженными расстройствами гемодинамики и стойкой гипотензией (среднее АД 65 мм рт. ст.), требующий инфузии вазопрессоров для поддержания АД, либо повышения уровня лактата крови >2 мкмоль/л (>18 мг/дл) при сохраняющейся нормоволемии. Термин «тяжелый сепсис» не рекомендуется использовать как определение.
Для оценки выраженности органной дисфункции рекомендуется использовать шкалу Sequential Organ Failure Assessment (SOFA). Эта шкала оценивает степень отклонения функционирования систем органов от нормы и учитывает терапевтические вмешательства . В последние годы расширяется применение ПКТ в качестве биомаркера крови для более эффективного лечения пациентов с сепсисом.
ПКТ – это предшественник кальцитонина, который синтезируется в С-клетках щитовидной железы. У здоровых людей концентрация ПКТ низкая, а повышение ее происходит при невирусных инфекциях. Значительное увеличение уровня ПКТ обнаруживают у лиц с бактериальным сепсисом, особенно при тяжелом сепсисе и/или септическом шоке. При генерализации бактериальной инфекции происходит резкая экстратиреоидальная выработка ПКТ в нейроэндокринных клетках легких, в поджелудочной железе, печени, макрофагах, моноцитах и других тканях. Уровень ПКТ в сыворотке крови возрастает в течение 6-12 ч после генерализации инфекции. Его синтез стимулирует бактериальные экзо- и эндотоксины при участии цитокинов. При этом не происходит повышения уровня кальцитонина.
Тест на ПКТ – хороший критерий контроля эффективности лечения сепсиса, а также прогностический маркер. Период его полураспада – 25-30 ч. Поэтому после успешного оперативного лечения или антибиотикотерапии уровень ПКТ в крови быстро снижается – на 30-50% за сутки. При сохраняющемся повышении уровня ПКТ более 4 дней необходима коррекция терапии. Если после лечения не наблюдается быстрого снижения уровня ПКТ, прогноз заболевания сомнительный, а постоянно повышающиеся его показатели свидетельствуют о плохом прогнозе заболевания.
Уровень ПКТ четко коррелирует с тяжестью воспалительного процесса:
- ПКТ <0,5 нг/мл – низкий риск тяжелого сепсиса и/или септического шока;
- ПКТ от 0,5 до 2 нг/мл – умеренный синдром системного воспалительного ответа (ССВО) – «серая зона». Поставить диагноз сепсиса с уверенностью нельзя, рекомендуется повторить измерение в течение 6-24 ч;
- ПКТ >2 нг/мл – тяжелый ССВО, высокий риск тяжелого сепсиса и/или септического шока (чувствительность – 85%, специфичность – 93%);
- ПКТ ≥10 нг/мл – выраженный ССВО практически всегда вследствие тяжелого бактериального или септического шока. Такие уровни ПКТ часто связаны с синдромом полиорганной недостаточности и указывают на высокий риск летального исхода.
Чтобы доказать или опровергнуть диагностическую ценность ПКТ как маркера оценки эффективности лечения у пациентов с острой урологической патологией, И.В. Радьковым и коллегами было проведено исследование. В основе его лежат результаты лечения 30 больных с ССВО при инфекциях мочевыводящих путей. Данная группа пациентов поступила в больницу скорой медицинской помощи в тяжелом и средней степени тяжести состоянии. Все были обследованы в полном объеме в условиях приемного отделения. Из них с обструктивным пиелонефритом на фоне МКБ было 24 (73%) больных, с острым пиелонефритом без нарушения уродинамики – 4 (18%) и 2 (9%) пациента – с острым эпидидимоорхитом; из них 12 мужчин, 18 женщин, что составило 45 и 55% соответственно. У всех больных данной группы при поступлении брали общий анализ крови одновременно с ПКТ, причем диапазон ПКТ составлял от 0,58 до 25,8. Антибактериальную терапию проводили эмпирически, в основном с использованием антибиотиков цефалоспоринового ряда 3-го поколения, фторхинолонов, препаратов группы нитроимидозолов, аминогликозидов, которые, как правило, назначали в комбинации. Контроль эффективности лечения проводили путем лабораторного исследования: общий анализ крови в динамике и контроль ПКТ на 2-е сутки после назначенного лечения.
В результате исследования было установлено, что диапазон ПКТ у данной группы лиц, поступивших в стационар с ССВО, составлял от 0,58 до 25,8. Всем им при поступлении была назначена эмпирическая комбинация антибактериальных препаратов и по показаниям производились хирургические вмешательства: 18 пациентам выполнено дренирование мочевыводящих путей (6 – пункционная нефростомия, 12 – стентирование мочеточника), 2 – нефрэктомии, 4 – пиелолитотомии с декапсуляцией почки. Контроль назначенного лечения производили на 2-е сутки – во всех случаях отмечалось снижение уровня ПКТ. При неполном снижении уровня ПКТ до нормы выполняли коррекцию лечения с последующим контролем.
Пациентов с сепсисом следует максимально быстро поместить в специализированное отделение. Тактика интенсивной терапии должна включать следующее.
- Устранение причины сепсиса:
- хирургическая коррекция инфекционного очага;
- антибактериальная терапия.
- Интенсивную терапию:
- коррекция волемических нарушений;
- респираторная поддержка;
- инотропная поддержка;
- улучшение микроциркуляции.
При сепсисе необходимо стремиться к быстрому достижению (в первые 6 ч после поступления) целевых значений следующих параметров:
- центральное венозное давление – 8-12 мм рт. ст.;
- АД >90 мм рт. ст.;
- диурез – 0,5 мл/кг/ч;
- гематокрит >30%;
- сатурация крови в верхней полой вене или в правом предсердии – не менее 70%.
Использование данного алгоритма повышает выживаемость при сепсисе и септическом шоке (категория доказательства В).
Начальную инфузионную терапию следует проводить с использованием кристаллоидных растворов (1В). При этом необходимо избегать назначения гидроксиэтилкрахмала. Лицам, требующим массивной инфузионной нагрузки кристаллоидами для поддержки адекватных показателей гемодинамики, дополнительно можно назначать введение альбумина. Инотропная поддержка нужна при систолическом АД <65 мм рт. ст., и стартовым препаратом следует выбирать норэпинефрин (норадреналин). Эпинефрин (адреналин) рекомендовано добавлять для усиления эффекта последнего при наличии показаний. Больным, которые не отвечают на адекватную инфузионную и вазопрессорную терапию, следует назначать гидрокортизон со схемой дозирования 200-300 мг/cут внутривенно. Высокие дозы глюкокортикоидов не рекомендуется назначать пациентам с сепсисом и септическим шоком.
Также должна быть применена эмпирическая антибиотикотерапия с использованием как минимум двух антибиотиков разных групп широкого спектра. Такую терапию не рекомендуется продолжать более 2-3 дней. В дальнейшем необходимо применять деэскалационный метод назначения антибиотиков согласно профилю антибиотикограммы.
В заключение докладчик отметил следующее. ПКТ – информативный биологический маркер, дополняющий клинические и биологические исследования. Данный показатель должен использоваться как биомаркер системного воспалительного ответа и применяться как параметр эффективности назначенной терапии. Используя ПКТ, можно сократить длительность назначения неэффективного лечения, в т.ч. антибактериальной терапии, не ухудшая состояния больного.
С докладом «Особенности применения экстракорпоральной ударно-волновой литотрипсии у детей с мочекаменной болезнью» выступил заведующий отделением рентген-эндоурологии и литотрипсии ГУ «Институт урологии НАМН Украины» (г. Киев), кандидат медицинских наук А.О. Шевчук.
МКБ считается полиэтиологическим заболеванием, связанным со сложными физико-химическими процессами, происходящими как в целом в организме, так и на уровне мочевыделительной системы врожденного или приобретенного характера. Среди детей МКБ встречается с частотой от 1 до 5% и составляет от 2 до 15% всех патологий детского урологического стационара.
К основным проявлениям уролитиаза относятся боль, дизурия, гематурия, пиурия и отхождение кристаллов мочевых солей и конкрементов. Лишь последний из симптомов является абсолютным. Боль выступает наиболее частым симптомом при нефролитиазе. В зависимости от величины, формы, расположения, степени подвижности камня боль может иметь разнообразный характер. У пациентов с конкрементами в почках может отмечаться рвота и (иногда) повышенная температура тела. Возможно бессимптомное течение заболевания.
 В качестве первичной диагностической процедуры рекомендуется проводить ультразвуковое исследование (УЗИ) органов мочевой системы как основной метод визуализации у детей (рисунок). Его преимущество – отсутствие лучевой нагрузки и необходимости в анестезии. Чувствительность метода составляет 45%, специфичность для камней мочеточника – 94%, для камней в почках – 88%.
В качестве первичной диагностической процедуры рекомендуется проводить ультразвуковое исследование (УЗИ) органов мочевой системы как основной метод визуализации у детей (рисунок). Его преимущество – отсутствие лучевой нагрузки и необходимости в анестезии. Чувствительность метода составляет 45%, специфичность для камней мочеточника – 94%, для камней в почках – 88%.
Эффективными методами удаления конкрементов у детей в настоящее время являются дистанционная ударно-волновая литотрипсия (ДУВЛТ), контактная литотрипсия с литоэкстракцией, чрескожная нефролитотрипсия.
Показаниями к выполнению ДУВЛТ являются:
- наличие камней <2,0 см в мочевыводящих путях при сохраненной функции почек;
- отсутствие нарушения проходимости мочеточника ниже уровня стояния камня;
- отсутствие активного воспаления почек.
- Противопоказания к проведению ДУВЛТ:
- нарушение свертывающей системы крови, что может привести к кровотечению;
- активный воспалительный процесс в мочевыводящих путях;
- резкое угнетение функции почки с явлениями почечной недостаточности;
- кисты почек, которые расположены по ходу распространения ударной волны;
- врожденные или приобретенные изменения мочевыводящих путей, которые требуют оперативной коррекции.
ДУВЛТ зарекомендовала себя как безопасный и эффективный метод лечения МКБ у взрослых, а также она может быть использована для устранения урологических камней у детей. К сожалению, производители литотрипторов не указывают параметры ДУВЛТ для детей, а только для взрослых пациентов.
В связи с этим докладчик представил результаты исследования, цель которого заключалась в определении оптимального количества и интенсивности ударов при ДУВЛТ камней почек и мочеточников у детей. В ходе исследования было визуализировано конкременты почек и мочеточников у 75 детей. Из всех случаев нефролитиаза 27 камней были изъяты во время открытого хирургического вмешательства (пиелолитомия, уретеролитотомия), 25 фрагментированных конкрементов выявлено после ДУВЛТ и 23 – с помощью спиральной компьютерной томографии у детей с МКБ. Камни в количестве 27 шт., удаленные у детей путем открытой хирургии, подвергали ДУВЛТ в искусственных контейнерах, погруженных в нативную мочу, пытаясь имитировать природные условия. Все камни хорошо фрагментировались при меньшей энергии ударно-волновых импульсов. Эти данные свидетельствуют о том, что применение пониженной энергии при выполнении ДУВЛТ и меньшего количества импульсов являются эффективными при лечении детей с МКБ.
Эффективность и безопасность изучаемых параметров ДУВЛТ анализировали при лечении 348 детей, которым было выполнено данное вмешательство в ГУ «Институт урологии НАМН Украины» в период с 2008 по 2019 год. Контрольную группу составили взрослые пациенты (n=75) в возрасте от 20 до 60 лет с камнями почек и мочеточника размером от 0,6 до 1,8 см. Всем больным ДУВЛТ выполняли с использованием литотриптора Siemens Modularis. Результаты проведенного исследования показали, что у детей значительно меньше плотность камней (205-663 НU; в среднем – 154-434 НU) по сравнению со взрослыми (186-1567 НU; в среднем – 348-867 НU).
Детям (n=347) с наличием камней в почках и мочеточнике была выполнена ДУВЛТ с применением вышеуказанных параметров. Размер камней в мочевыводящих путях составлял: в почке от 0,37 до 2,5 см (в среднем 0,7-1,45 см), в мочеточнике от 0,18 до 1,7 см (в среднем 0,6-1,15 см). Фрагментация камней была обнаружена во всех 347 (100%) случаях. Полная фрагментация была произведена у 328 (94,5%) пациентов, частичная – в 19 (5,5%) случаях. Не выявлено ни одного случая возникновения гематомы. Взрослым (n=75) пациентам в возрасте 20-60 лет была выполнена экстракорпоральная ударно-волновая литотрипсия с параметрами, рекомендованными производителем. Полная фрагментация была обнаружена у 57 (76%) лиц, частичная – у 15 (20%); отсутствие фрагментации имело место у 3 (4,0%) пациентов.
Таким образом, ДУВЛТ является эффективным методом лечения детей с камнями почек и мочеточника. Конкременты у них имеют более низкую плотность, чем у взрослых, что дает возможность применять при терапии более слабую энергию и меньшее количество ударов.
Доклад, посвященный опыту применения мини-перкутанной нефролитотрипсии (мини-ПНЛТ) в хирургии нефролитиаза, представил слушателям доцент кафедры урологии Национальной медицинской академии последипломного образования им. П.Л. Шупика (г. Киев), доктор медицинских наук А.И. Сагалевич.
ПНЛТ уже много лет прочно обосновалась в арсенале урологов и является золотым стандартом лечения крупных и коралловидных камней. В то же время последнее десятилетие ознаменовалось технической миниатюризацией нефроскопического инструментария. Это привело к возникновению нового метода в лечении МКБ – мини-ПНЛТ.
Мини-ПНЛТ – это ПНЛТ, выполняемая с использованием дилататора, диаметр которого меньше традиционного. В настоящее время широко обсуждается вопрос об эффективности удаления камней почек с применением инструмента меньшего диаметра в сравнении со стандартной ПНЛТ, что связано с желанием хирургов уменьшить число и степень интра- и послеоперационных осложнений на фоне повышения эффективности лечения нефролитиаза.
Докладчик представил результаты ретроспективного анализа исходов 500 стандартных ПНЛТ, осуществленных на базе кафедры урологии Донецкого национального медицинского университета им. М. Горького (Донецкая областная клиническя больница) за период 2011-2014 гг. (1-я группа), а также 521 мини-ПНЛТ, выполненных на базе кафедры урологии НМАПО им. П.Л. Шупика (Киевская областная клиническя больница) за период 2016-2019 гг. (2-я группа). Исследовались пациенты с солитарным, коралловидным и множественным нефролитиазом. Размеры конкрементов почки составляли от 1,0 до 5,5 см; количество перкутанных доступов во время проведения ПНЛТ в обеих группах – от 1 до 4. Для объективной оценки анлизировали результаты выполнения операций одним хирургом. Обе группы больных сравнивали по таким характеристикам, как частота избавления от камней, число интра- и послеоперационных осложнений, длительность пребывания в стационаре.
По результатам исследования было установлено, что стандартная ПНЛТ и мини-ПНЛТ у больных с солитарными и коралловидными камнями почек явились одинаково высокоэффективными методами лечения. Однако использование мини-ПНЛТ показало более высокий процент излеченности (99,2±0,7%) в сравнении со стандартной ПНЛТ (93,3±1,3%) (р<0,05). При этом на результативность лечения влияет показатель повторных операций у пациентов с резидуальными фрагментами (>5 мм). Так, в 1-й группе он составил 7,5±1,4%, а во 2-й – 0,8±0,2%. Особое внимание уделяли таким грозным осложнениям, как интраоперационное кровотечение, гипертермия, снижение уровня гемоглобина >30 г/л, послеоперационная атака пиелонефрита. В 1-й группе интраоперационное кровотечение отмечено у 4,5±1,1% пациентов, а послеоперационное обострение пиелонефрита – у 11,2±1,5%. Эти показатели оказались статистически более низкими (р<0,05) среди больных 2-й группы: 1,2±0,3 и 7,2+1,7% соответственно. При анализе результатов исследования отмечено и различие между обеими группами в средних сроках послеоперационного пребывания в стационаре, которые в 1-й и 2-й группах составили 7,2±2,4 и 2,2±1,2 дня соответственно (р<0,05).
При использовании дилататоров с диаметром от 11 до 24 Fr площадь повреждения паренхимы практически одинакова и составляет от 11,6 мм2, в то же время при использовании дилататоров от 24 до 30 Fr площадь повреждения возрастает втрое и равняется 32,8 мм2; при этом баллонная дилатация является более травматичной.
Показания к мини-ПНЛТ:
- наличие нефролитиаза размером 1,0-1,5 см (плотность >800 HU) при неблагоприятных условиях для дистанционной литотрипсии и ретроградной интраренальной хирургии – узкий и извитый мочеточник, острый инфундибуло-пельвикальный угол, длинные и узкие шейки чашечек почек;
- любые конкременты почки размерами >1,5 см;
- множественные камни в почках;
- камни дивертикулов чашечек;
- мультидоступ в лечении коралловидных камней.
Преимуществами операции мини-ПНЛТ являются:
- меньшее количество интра-/послеоперационных осложнений;
- чаще удается достичь «состояния, свободного от камней» (stone free rate, SFR);
- больше возможности для выполнения бездренажных методик;
- сокращение сроков послеоперационной госпитализации;
- меньшая потребность в обезболивании в послеоперационном периоде.
В конце выступления докладчик резюмировал следующее:
- Мини-ПНЛТ – безопасный и эффективный эндоскопический метод лечения всех форм нефролитиаза.
- При применении мини-ПНЛТ имеет место более низкая частота осложнений в сравнении со стандартной ПНЛТ, даже на фоне мультидоступных вариантов ее применения у пациентов со сложными и коралловидными камнями.
- Использование мини-ПНЛТ позволяет сократить послеоперационное пребывание в стационаре при сопоставимом состоянии SFR при солитарных конкрементах и превосходящем состоянии SFR при коралловидных и множественных конкрементах почки в сравнении со стандартной ПНЛТ.
- Использование нефроскопа меньшего диаметра ассоциируется с большей длительностью операции.
Следующий, не менее интересный доклад «Влияние условно-патогенной флоры, выделенной из мочи, на процессы камнеобразования. Особенности лечения» представил специалист урологического отделения Черкасской областной больницы, кандидат медицинских наук Д.В. Коваль.
Как известно, МКБ стабильно занимает второе место в структуре всех причин смертности в урологии. Согласно данным ВОЗ, в большинстве развитых стран мира от МКБ страдает 1-3% взрослого населения в возрасте 20-50 лет. В Украине в период с 2014 по 2015 год количество зарегистрированных больных уролитиазом увеличилось на 7080 (3%) случаев.
На фоне современных достижений диагностики и лечения МКБ обращает на себя внимание повышение смертности среди больных этой патологией, что является весьма тревожным показателем.
Учитывая, что МКБ достаточно часто осложняется инфекцией мочевыводящих путей, дополнительного изучения требует установка видового спектра микроорганизмов, одновременно вызывающих воспалительный процесс в почках. Ведущую роль в развитии воспалительных процессов в почках, особенно при калькулезном пиелонефрите, играют грамотрицательные бактерии – преимущественно представители энтеробактерий (Escherichia coli, Proteus spp., Klebsiella spp.), реже – стафилококки и энтерококки.
Представители рода Enterobacteriaceae, которых справедливо называют уропатогенами (E. coli, Klebsiella pneumoniae, Proteus spp.), чаще всего вызывают развитие калькулезного пиелонефрита. Указанные микроорганизмы в первую очередь имеют высокие адгезионные свойства к эпителию почки и могут образовывать биопленки (адгезия и колонизация микроорганизмов) на отслоившемся эпителии и солевых кристаллах, на которые могут оседать новые кристаллы солей. С другой стороны, среди энтеробактерий существуют представители таких родов, как Proteus (Proteus mirabilis, Proteus vulgaris, Proteus penneri), обладающих тропностью к уротелию и выраженной уреазной активностью. Такие биологические свойства, присущие Proteus, позволяют рассматривать их не только как возбудителей пиелонефрита, но и одновременно как инициаторов камнеобразования.
Большинство специалистов в области изучения процессов уролитиаза рассматривают инфекцию мочевыводящих путей как один из основных факторов этого процесса при отсутствии нарушения обмена веществ и анатомических изменений в мочевыводящей системе. Таким образом, в урологии появилось понятие «инфекционные конкременты».
На базе Черкасской областной больницы было проведено исследование, цель которого состояла в повышении эффективности лечения больных МКБ, осложненной воспалительным процессом почек, путем выявления основных факторов воспалительного процесса, сопоставления спектра возбудителей с химическим составом конкрементов и применения адекватной персонифицированной терапии.
В исследовании принимали участие 132 пациента, которые пребывали на стационарном лечении в урологическом отделении в период 2014-2018 гг. Всем им были проведены общеклинические обследования: общие анализы крови и мочи, биохимический анализ крови, УЗИ, обзорную и внутривенную урографию. Одновременно было выполнено микробиологическое исследование мочи для определения спектра и показателя микробного числа выделенных бактериальных культур методом посева биологического материала и установления чувствительности возбудителей к антибактериальным препаратам. Проведен анализ мочи методом полимеразной цепной реакции (ПЦР) для амплификации ДНК Chlamydia trachomatis, Mycoplasma hominis, Ureaplasma spp.
У всех пациентов был диагностирован нефролитиаз разной формы и локализации. Также в 100% случаев регистрировались инфекционные процессы в мочевыводящих путях разной степени активности. Бактериурия была выявлена у 83 (62,8%) больных. Это можно объяснить длительным применением ими антибактериальных препаратов перед взятием биоматериала (мочи) для выполнения бактериологического исследования.
При анализе спектра выделенных из мочи бактерий установлена следующая их частота:
- E. coli – 36%;
- P. mirabilis – 22%;
- K. pneumoniae – 18%;
- Pseudomonas aeruginosa – 11%;
- Enterococcus faecalis – 6%;
- Staphylococcus epidermidis – 4%;
- Candida albicans – 3%.
Сравнительный анализ возбудителей воспалительного процесса в почках по видовому спектру и гендерной принадлежности больных нефролитиазом не выявил существенных различий в его структуре и продемонстрировал ее идентичность.
Результаты молекулярно-генетической диагностики мочи, соскобов со слизистой оболочки мочеиспускательного канала и канала шейки матки свидетельствуют о высокой частоте амплификации ДНК уреаплазм, а именно биовара Ureaplasma urealyticum. ДНК M. hominis и Ch. trachomatis были амплифицированы только у двух больных и в дальнейшем их не определяли.
При сопоставлении видового спектра выделенных энтеробактерий (E. coli, P. mirabilis, K. pneumoniae), U. urealyticum и минерального состава удаленных конкрементов установлено, что при кальций- и магнийсодержащих фосфатах выделяли преимущественно P. mirabilis (46,2%) и U. urealyticum (73,1%), а при оксалатах – E. coli (28,3%) и U. urealyticum (37,0%). Другие микроорганизмы встречались довольно редко. Установлено, что протеи- и уреаплазмы, особенно в ассоциации, ощелачивают мочу до рН 7,7, что вызывает образование фосфатов, а уреаплазмы ощелачивают мочу только до рН 6,44-6,85 (слабощелочная реакция) и обусловливают при ее перенасыщении щавелевой кислотой усиление кристаллизации и агрегации кальция оксалата.
После удаления конкрементов и проведения персонифицированной антибиотикотерапии лицам с мочевым уреаплазмозом (29 пациентам из 36) дополнительно был назначен курс противоуреаплазмозной терапии, в состав которой входил доксициклин по 100 мг 2 раза в сутки в сопровождении антимикотика флуконазола по 50 мг ежедневно в течение 9 суток. После окончания курса дополнительной антибиотикотерапии был назначен пробиотик биоспорин по 2 дозы 2 раза в сутки в течение 20 дней. Женщинам было рекомендовано применять интравагинальные пробиотики сроком 10 дней. Одновременно назначали иммунотерапию жидкими иммуноглобулинами человека уреаплазма-иммун по 3 мл внутримышечно, 7 инъекций каждые 48 часов.
Предложенная схема лечения больных калькулезным пиелонефритом, обусловленным преимущественно энтеробактериями и уреаплазмами, способствовала элиминации последних и предупреждала рецидив камнеобразования в 94,5% случаев за 6 мес наблюдения.
С докладом «Возможности использования газово-оптической среды при лечении различных камней мочевого пузыря» выступил профессор кафедры урологии Донецкого национального медицинского университета им. М.Горького, доктор медицинских наук Ю.В. Рощин.
Он отметил, что камни МП занимают 5% в структуре уролитиаза. Согласно статистике, заболевание встречается чаще у мужчин, а пик заболеваемости наступает к 60 годам. Говоря о причинах возникновения камней МП, их принято разделять на первичные и вторичные. Первичные причины, как правило, связаны с метаболическими нарушениями. Основными метаболическими нарушениями у больных МКБ являются гиперурикемия, гиперурикурия, гипероксалурия, гиперкальциурия, гиперфосфатурия, изменения ацидификации мочи. К вторичным причинам относятся: инфравезикальная обструкция, нарушения оттока мочи, обусловленные неполной обструкцией или изменением уродинамики нейрогенного происхождения, доброкачественной гиперплазией простаты. Стаз мочи повышает концентрацию мочевых солей, задерживает отхождение слизи, патогенных бактерий.
К основным проявлениям уролитиаза относятся боль, дизурия, гематурия, пиурия, а также отхождение кристаллов мочевых солей и конкрементов. Характерными симптомами наличия камня в МП следует считать наличие прерывистой струи при мочеиспускании и поллакиурию.
До внедрения в практику трансуретральных эндоскопических методов для удаления камней МП прибегали к открытым, инвазивным оперативным вмешательствам. В современной урологической практике предпочтение отдается малоинвазивным методам избавления пациентов от камней в МП. Основным методом удаления камней из МП в настоящее время является их эндоскопическое дробление – ДУВЛТ и контактная цистолитотрипсия. В зависимости от того, какая энергия используется для дробления, цистолитотрипсия может быть механической, пневматической, ультразвуковой, электроимпульсной и лазерной.
В то же время сегодня четких показаний к применению открытых или эндоскопических операций не существует. По данным ряда авторов (Нагиев Р.Л., Низамов И.Г., Галеев Р.Х., 2007), эффективность цистолитотрипсии и цистолитотомии одинакова (93,8%). Однако при прочих равных условиях преимущество должно отдаваться намного менее инвазивному методу – трансуретральной контактной цистолитотрипсии.
Несмотря на очевидные преимущества перед цистолитотомией, у контактной цистолитотрипсии имеется ряд собственных недостатков, основными из которых являются:
- повышенная мобильность конкремента в водной среде;
- гипермобильность отдельных фрагментов за счет потока промывной жидкости;
- сложность фиксации отдельных осколков;
- ухудшающаяся визуализация за счет разной степени геморрагии, а также взвеси от конкремента;
- при крупных камнях значительно увеличивается длительность операции.
Докладчик сообщил, что на основании проведенных наблюдений впервые предложен способ оперативного эндоскопического удаления крупных и множественных камней МП. Таковой заключается в применении в качестве ирригационного вещества углекислого газа (СО2). Для подтверждения эффективности такого метода автором и его командой было проведено исследование, целью которого являлось изучение возможности применения СО2 для создания оптической среды в ходе проведения контактной цистолитотрипсии. Оценивались эффективность и безопасность данной методики, а также возможности ее применения в рутинной практике у больных с камнями в МП.
В исследовании с участием 31 пациента с камнями в МП 13 лиц составили группу, которым выполнялась газовая цистоскопия; в контрольную группу вошли 18 участников для проведения цистоскопии, в которой использовалась ирригационная жидкость. Возраст пациентов варьировался от 25 до 72 лет.
Критериями оценки эффективности метода являлись:
- время, затраченное на проведение литотрипсии;
- масса извлеченных фрагментов;
- мобильность конкремента и его фрагментов;
- качество визуализации;
- длительность пребывания пациента в стационаре.
Предоперационная подготовка, вид обезболивания и положение больного не отличались от таковых при стандартных трансуретральных вмешательствах. Осуществлялась уретроцистоскопия в жидкой ирригационной среде, после чего по тубусу МП опорожнялся, затем в него нагнетался СО2 (давление 13 мм рт. ст.) до расправления. После этого выполняли цистоскопию в газовой среде с визуализацией конкремента. Далее зонд литотриптера подводили к конкременту и осуществляли его дробление до мелких фрагментов с последующим их отмыванием. На одну операцию использовали в среднем от 2 до 30 л СО2 и около 2 л физиологического раствора для отмывания фрагментов. Давление СО2 составляло 13-16 мм рт. ст. Такое давление СО2 является безопасным и используется также в абдоминальной эндоскопической хирургии.
Особенностями проведенной операции являются:
- возможность изменять давление и объем МП без потери качества изображения;
- пониженное давление в МП от 6 до 12 мм рт. ст.;
- литотомическое положение с опущенным каудальным концом;
- форма МП грушевидная, вытянутая, с нижней точкой в области шейки МП и приподнятой межмочеточниковой складкой с образованием кармана.
Кроме того, при выполнении данной работы оценивали безопасность нового метода. Главный вопрос состоял в том, насколько безопасно введение СО2 в МП и может ли это привести к каким-либо осложнениям, поскольку в настоящее время сформулированы четкие требования, предъявляемые к газам, применяемым при лапароскопии. Газ, используемый для инсуффляции в брюшную полость, должен быть бесцветным, не поддерживающим горение, химически инертным, устойчивым, недорогим в производстве, доступным, растворимым в плазме. СО2 соответствует перечисленным требованиям.
Результаты проведенного исследования представлены в таблице.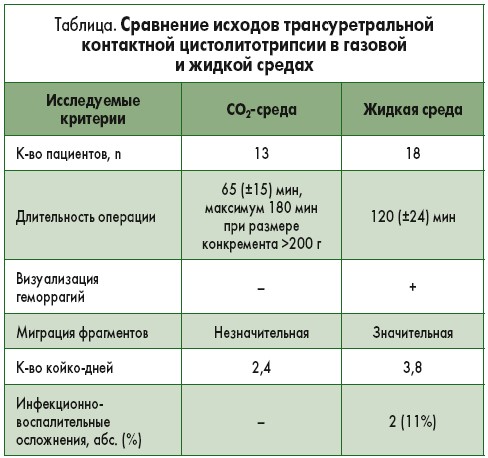
Однако при дроблении конкрементов небольшой массы (10-20 г) не было получено достоверной разницы при сравнении конечных точек.
Таким образом, контактная литотрипсия конкрементов МП в газовой оптической среде является безопасным и эффективным методом, позволяет улучшить визуализацию, уменьшить миграцию конкрементов при дроблении и сократить время проведения операции.
С докладом «Состояние иммунитета у пациентов с хроническим абактериальным простатитом, обусловленным герпесвирусной инфекцией» выступил специалист Лечебно-диагностического центра Св. Луки (г. Ивано-Франковск) А.И. Федорив.
Хронический простатит не является прямой угрозой жизни пациента, но значительно ухудшает качество его жизни, поскольку негативно влияет на семейные взаимоотношения и трудоспособность. Согласно данным статистики, только 5-10% случаев хронического простатита обусловлены бактериальной природой, и все чаще причина последнего связана с вирусной инфекцией. При проведении цитологической и иммунологической диагностики секрета простаты у 204 пациентов с абактериальным простатитом герпесвирусная инфекция как этиологический фактор была подтверждена в 68,6% случаев (Strockij A.V. et al., 2015). В другом исследовании у лиц, подвергшихся трансуретральной резекции простаты, патогистологически выявляли цитомегаловирусную инфекцию (Tan S.K. et al., 2019).
Обширный тканевой тропизм, способность к персистенции и латенции в организме инфицированного больного являются уникальными биологическими свойствами герпесвирусов. Они обладают феноменальной способностью вырабатывать белки в фазе репликации, которые блокируют рецепторы лимфоцитов и координируют иммунный ответ.
Различают два вида иммунного ответа:
1. Неспецифический (врожденный):
- гуморальный (система комплемента, лизоцим, интерлейкины, интерфероны [IFN]);
- клеточный (моноциты, макрофаги, нейтрофилы, базофилы, дендритные клетки, натуральные киллеры).
2. Специфический (приобретенный):
- гуморальный (В-лимфоциты, плазматические клетки, специфические антитела);
- клеточный (Т-лимфоциты хелперы I и II типов, Т-супрессоры, Т-лимфоциты регуляторные).
IFN – общее название ряда белков со сходными свойствами, выделяемых клетками организма в ответ на вторжение вируса, некоторые бактериальные вещества и низкомолекулярные химические соединения. IFN индуцируют либо активируют определенные клеточные белки, блокирующие репликацию вируса.
В настоящее время известно более 20 IFN, различающихся по структуре, биологическим свойствам и преобладающему механизму действия. Их подразделяют на три типа.
- Тип I – известный как вирусный IFN, включает IFN-α (лейкоцитарный, синтезируется активированными моноцитами и В-лимфоцитами), IFN-β (фибробластный, синтезируется фибробластами, эпителиальными клетками и макрофагами) и пр. Первому типу (IFN-α, IFN-β) главным образом присущи антивирусный и антипролиферативный эффекты, в меньшей степени – иммуномодулирующий.
- Тип II – иммунный, включает IFN-γ (синтезируется активированными Т-лимфоцитами и NK-клетками). Главное действие IFN-γ – участие в реакциях иммунитета. Он начинает вырабатываться на последующих этапах инфекционного процесса уже сенсибилизированными Т-лимфоцитами и активно участвует в каскаде специфического иммунного ответа.
- Тип III был обнаружен позже I и II типов; информация о нем свидетельствует о его участии в иммунном ответе при некоторых видах вирусных инфекций.
Исходя из знаний о взаимосвязи герпетической инфекции и хронического абактериального простатита, влиянии ее на иммунитет, докладчиком и его коллегами было проведено исследование. Его цель заключалась в оценке роли вируса простого герпеса и цитомегаловируса в этиологии хронического абактериального простатита.
Было обследовано 98 пациентов с хроническим абактериальным простатитом категории IIIБ, группу сравнения составили 40 здоровых мужчин. С целью подтверждения вирусной этиологии всем больным проводили дополнительное специфическое обследование: определяли серологические (антитела классов IgМ и IgG методом ИФА), а также вирусологические (ДНК вирусов в секрете простаты или эякуляте методом ПЦР) маркеры. Для установления давности инфекции определяли индекс авидности антител класса IgG.
Были определены критерии активности вирусной инфекции: IgМ, низкоавидные IgG, ДНК вируса в секрете простаты или эякуляте. По результатам проведенного исследования у 20 (25,9%) больных среди всех серопозитивных пациентов по данным специфического обследования выявлен один или несколько критериев активности вирусной инфекции. Это свидетельствует о недавнем инфицировании или активации герпесвирусной инфекции (герпесвирус + цитомегаловирус), что может объяснять клиническую картину хронического простатита. Основным критерием диагностики хронического абактериального простатита герпетической и цитомегаловирусной этиологии стало выявление ДНК вируса в секрете простаты или эякуляте методом ПЦР.
Оценка состояния иммунной системы у лиц, принимающих участие в исследовании, проводилась путем определения IFN-γ в сыворотке крови и уровней иммуноглобулинов основных классов. Было установлено достоверное снижение концентрации IgА в сыворотке крови больных по сравнению с контрольной группой (1,79±0,2 против 1,92±0,07 г/л). Дефицит IgА был наиболее выражен у пациентов с тяжелым течением герпетической инфекции, у которых рецидивы болезни наблюдались от 6 до 12 раз в год (1,46±0,5 против 1,87±0,46 г/л при легком течении и 1,82±0,54 г/л при среднетяжелом течении). Общее содержание IgМ в сыворотке больных герпетическим простатитом было существенно выше, чем в контрольной группе (1,46±0,24 против 1,20±0,7 г/л; р<0,05); в то же время содержание IgМ в сыворотке крови пациентов с герпетической инфекцией было недостоверно выше показателей у здоровых лиц (14,1±2,1 против 12,58±2,02 г/л; р>0,05). Была зафиксирована тенденция к повышению уровня IgG в сыворотке крови у пациентов с длительностью инфекционного процесса до 2 лет (15,2±2,3 против 13,6±2,6 г/л с длительностью от 2 до 7 лет и 14,4±2,8 г/л с длительностью >7 лет).
При оценке фагоцитарного звена выявлено, что спонтанная микробицидная активность нейтрофилов у больных герпетическим простатитом снижена, резервные потенции нейтрофилов редуцированы, что выявляется в стимулированном НСТ-тесте, а также верифицируется согласно данным коэффициента стимуляции. При анализе фагоцитарного звена не установлено различий в основных его показателях у лиц с различной степенью тяжести и длительностью инфекционного процесса.
Отсюда следует, что у пациентов с хроническим абактериальным простатитом, причиной которого является герпесвирусная инфекция, существуют достоверные изменения в иммунном статусе как на системном, так и на местном уровне. Более высокие показатели иммуносупрессии были диагностированы у больных с поражением простаты вирусом простого герпеса и цитомегаловирусом. Таким образом, определение вирусной этиологии хронического простатита дает возможность пересмотреть подходы к патогенетическому лечению заболевания.
Современные подходы к лечению почечной колики осветил в своем докладе заведующий кафедрой урологии Ивано-Франковского национального медицинского университета, доктор медицинских наук, профессор Н.В. Зеляк.
Почечная колика (ПК) представляет собой одну из наиболее тяжелых форм боли человека. Такая интенсивность болевого синдрома обусловлена повышением внутрилоханочного давления и спазмом гладких мышц верхних мочевых путей. Несмотря на существующий обширный диагностический и терапевтический арсенал, ПК является одной из ведущих проблем современной медицины. В странах Европы ее диагностируют у 7-9% пациентов, обратившихся за медицинской помощью по поводу болевого синдрома (Kober A. et al., 2003). ПК является одним из наиболее распространенных состояний в урологической практике. Так, пациенты с ПК ежегодно составляют в среднем 42% от общего числа больных урологических стационаров, преобладающее большинство которых – лица трудоспособного возраста (Бойко А.И., 2003; Белый Л.Е., 2009).
Типичным симптомом ПК является сильная, нестерпимая боль в поясничной области с иррадиацией к лонному сочленению, внешним половым органам и внутренней поверхности бедер. В случае локализации камня в уретре боль распространяется в надлобковую область. Последняя возникает, когда конкремент проталкивается через узкий просвет мочеточника, вызывая его нефизиологический спазм. ПК может сопровождаться тошнотой и рвотой, позывами к мочеиспусканию и учащенным мочеиспусканием с малым количеством мочи, ознобом и лихорадкой (при наличии инфекции мочевых путей), гипотензией и обмороком (при очень сильной боли), гематурией. При физикальном осмотре определяется болезненность в области почки на стороне колики и повышенное напряжение мышц на больной стороне.
Наиболее ценными методами диагностики ПК являются УЗИ почек, МП и органов брюшной полости, экскреторная урография, мультиспиральная компьютерная томография, магнитно-резонансная урография и пр., позволяющие выявить конкремент и изменения мочевых путей, а также расширение лоханки и чашечек почечной паренхимы.
Профессор Н.В. Зеляк отметил, что за период 21-летней работы в урологическом отделении Ивано-Франковской ЦГКБ было зарегистрировано 3612 случаев ПК, при этом возраст обратившихся за медицинской помощью пациентов варьировался от 7 до 72 лет. К счастью, большинство из них не имели полной обструкции мочевыводящих путей, поэтому риск ухудшения функции почек был минимальным.
Терапия ПК преследует две основных цели: устранение боли и обструкции. В первую очередь она должна быть направлена на купирование болевого синдрома, а лишь затем – на выведение камня из верхних мочевых путей. Устранение боли свидетельствует об эффективности проводимой терапии (Amat C.M., Romero P.P., 1994; Гузенко В.Н. и соавт., 2004).
Препаратами первой линии для купирования ПК являются нестероидные противовоспалительные препараты (НПВП). Действие последних обусловлено торможением синтеза простагландина Е2, редукцией почечного кровотока и уменьшением образования мочи, что обеспечивает длительный аналгезирующий эффект. Несмотря на то что эффект опиоидных анальгетиков в купировании ПК наступает в течение до 10 мин, уже через 20-30 мин разницы в обезболивающем эффекте между НПВП и морфином не наблюдается.
После появления селективных ингибиторов ЦОГ-2 препараты этой группы стали с энтузиазмом применять для купирования ПК. Однако позже в исследовании VIGOR было продемонстрировано, что эти средства оказывают негативное влияние на почечную функцию и состояние сердечно-сосудистой системы. Применение рофекоксиба ассоциировалось с 5-кратным повышением риска возникновения инфаркта миокарда, также повышался риск возникновения церебральной тромбоэмболии.
Неизменным традиционным методом лечения, который целесообразно и безопасно применять для купирования ПК, является внутримышечное введение папаверина гидрохлорида, метамизола натрия, фенпивериния бромида, но-шпы, баралгина. В качестве дополнительной терапии широко применяют тепловые процедуры на область живота и нижней части спины, эффективность которых показана в исследовании А. Kober et al. (2003). Показаны сидячие ванны (температура воды – 37-39 °С, 10-20 мин), можно с добавлением в воду нескольких стаканов отвара хвоща полевого; лежачие ванны без покрытия водой области сердца (температура воды – 37-38 °С, 15-20 мин). Однако следует учитывать, что тепловые процедуры противопоказаны при наличии макро- и микрогематурии, опухоли любой локализации, а также у пациентов с сердечно-сосудистой недостаточностью и лиц пожилого возраста (Зозуля И.С., 2008).
Ввиду того что ПК представляет собой одну из наиболее тяжелых форм боли человека, крайне важными у этой категории пациентов являются быстрая диагностика и адекватное обезболивание. На сегодня использование НПВС и опиоидных анальгетиков выступает эффективным методом купирования ПК. Также возможно комбинированное влияние на механизм боли посредством назначения различных спазмолитиков, грелок и горячих ванн.
Доклад «Гуморальная реактивность к Hsp60 человека сыворотки женщин с хроническими воспалительными заболеваниями органов малого таза и сексуальными дисфункциями» представила главный научный сотрудник отдела сексопатологии и андрологии ГУ «Институт урологии НАМН Украины», доктор медицинских наук, профессор О.В. Ромащенко.
Воспалительные заболевания органов малого таза (ВЗОМТ) – наиболее распространенные и весьма серьезные инфекционные заболевания, встречающиеся у женщин репродуктивного возраста. К ним относятся воспалительные процессы матки, маточных труб, яичников и тазовой брюшины. Изолированное воспаление различных отделов полового тракта в клинической практике встречается весьма редко.
Спектр осложнений ВЗОМТ достаточно широк и включает в себя:
- нарушение соматического и психоэмоционального состояния;
- невынашивание и другие осложнения беременности;
- доброкачественные опухоли и онкологические заболевания;
- нарушения сексуального здоровья пары;
- гинекологические и андрологические расстройства;
- бесплодность пары.
К сожалению, сегодня две трети случаев ВЗОМТ не диагностируются своевременно, что приводит к снижению эффективности лечения на поздних стадиях заболевания. В связи с этим актуальным является вопрос о поиске дополнительных плазматических маркеров для диагностики и контроля эффективности лечения ВЗОМТ, а также для определения репродуктивной перспективы.
В последнее время в сфере диагностики различных инфекций человека наблюдается повышенный интерес к определению анти-Hsp60 антител. Это связано с тем, что выработка последних является неспецифической защитной реакцией организма против патогенов. Многочисленные инфекции, вызываемые бактериями, грибами, могут запускать иммунную реакцию против микробного Hsp60 с образованием анти-Hsp60 антител.
Hsp60 (heat shock protein 60) – белок теплового шока, присущий всем живым организмам – от бактерий до человека, а его синтез возрастает в стрессовых ситуациях. Hsp60 принимает участие в обеспечении белкового гомеостаза (правильный холдинг белков, деградация неправильно сложенных белков, формирование олигомерных белковых комплексов, внутриклеточный транспорт белков) и защищает клетки от апоптоза (Higgins et al., 2005).
О.В. Романенко представил результаты исследования, цель которого заключалась в изучении гуморальной реактивности к Hsp60 человека сыворотки женщин с ВЗОМТ, осложненными диспареунией.
Диспареуния – это боль в области малого таза или наружных половых органов, испытываемая во время полового акта. Боль может возникать и при врожденных, травматических повреждениях половых органов, вследствие хирургического вмешательства на наружных половых органах, при эндометриозе, опухоли органов малого таза, спайках, которые сформировались после болезни органов малого таза или операции, а также при различных ВЗОМТ.
В ходе исследования было проведено комплексное гинекологическое, сексологическое, психологическое обследование 61 женщины в возрасте от 26 до 48 лет с ВЗОМТ (длительность заболевания составляла от 2 до 15 лет). С помощью метода допплерографии проведено ультрасонографическое исследование анатомических структур органов малого таза и сосудов зоны клитора. Иммунореактивность сыворотки к Hsp60 человека определяли у 16 женщин с ВЗОМТ, осложненными диспареунией, и у 20 пациенток репродуктивного возраста без нарушений репродуктивного и сексуального здоровья с использованием метода иммуноферментного анализа (ELISА и Вестерн-блоттинг).
Согласно полученным результатам, у 55,73% (34/61) обследованных женщин с ВЗОМТ обнаружено диспареунию разной степени. В 82,35% (28/34) случаев диспареуния сочеталась с нарушением репродуктивной функции: трубное бесплодие – в 55,88% (19/34), невынашивание беременности – в 23,53% (8/34), внематочная беременность – в 2,94% (1/34). Самая высокая стадия диспареунии установлена у пациенток с ВЗОМТ (длительность более 5 лет), осложненными невынашиванием беременности, внематочной беременностью. При проведении исследования сосудов зоны клитора с использованием метода допплерографии выявлено повышение показателей индекса резистентности (IR=0,78±0,82) с одновременным снижением систолической линейной скорости кровотока (Vs=6,5±9,0 см/с) у женщин с диспареунией и нарушением репродуктивной функции. Высокую реактивность сыворотки к Hsp60 человека обнаружено у 12,5 и 75,0% (2/16 и 12/16) женщин, обследованных с помощью методов ELISА и Вестерн-блоттинга соответственно. По результатам Вестерн-блоттинга, все образцы сыворотки пациенток с диспареунией, в анамнезе которых были невынашивание беременности и внематочная беременность, имели высокую реактивность к исследуемому антигену.
Хотя высокая гуморальная реактивность сыворотки к Hsp60 человека может быть обусловлена и перекрестно-реагирующими антителами против бактериального Hsp60, это не дает оснований исключать наличие ВЗОМТ.
Таким образом, формирование диспареунии на фоне ВЗОМТ сочетается с нарушениями репродуктивной функции женщин и требует своевременной адекватной коррекции. Определение реактивности сыворотки к Hsp60 человека у женщин с ВЗОМТ может быть дополнительным диагностическим подходом к выявлению риска нарушений репродуктивной и сексуальной функций.
Подготовила Иванна Садивская
Тематичний номер «Урологія. Нефрологія. Андрологія» № 1 (18) 2020 р.


