29 квітня, 2020
Фармакологічне лікування остеопорозу в жінок у постменопаузі
Керівництво з клінічної практики Європейського ендокринологічного товариства
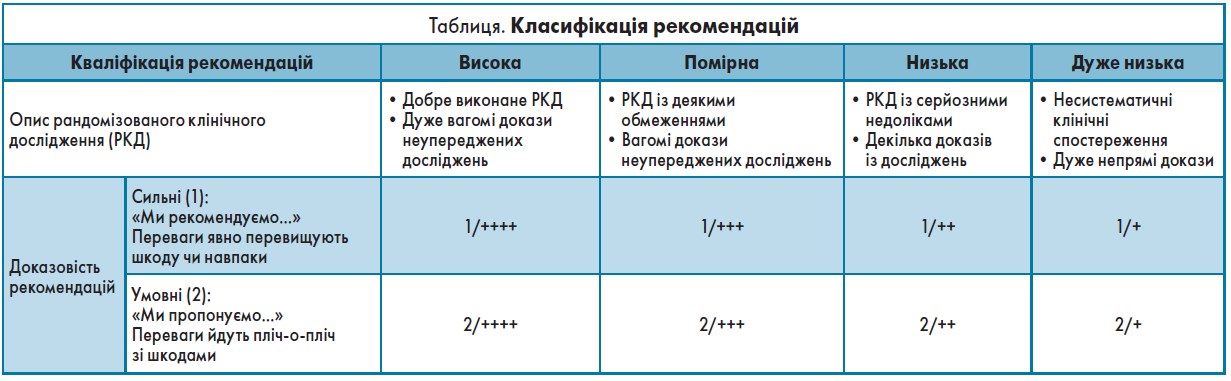
Процес розробки рекомендацій Європейським ендокринологічним товариством (далі – Товариство) об’єднує елементи структури GRADE [167], які вважаються придатними для рідкісних ендокринних захворювань у разі, коли наукові дані обмежені або відсутні. Товариство застосовує кроки в рамках GRADE для дослідження актуальних питань ендокринологічних захворювань (табл.). У цих випадках GRADE дає методологічний і статистичний аналіз, що забезпечує надійні рекомендації, які класифікуються з використанням якості доказів і сили рекомендацій (Guyatt et al. [168]).
Якщо докази вкрай обмежені і/або систематично не аналізуються, Товариство надає рекомендації, засновані на експертній оцінці обмежених даних. Цей процес менш систематичний, ніж методологічна основа GRADE; проте ці рекомендації також чітко класифіковані за системою класифікації GRADE.
1. Рекомендації
1.1. Ми рекомендуємо за допомогою фармакологічної терапії лікувати жінок у постменопаузі – через високий ризик переломів або тих, хто нещодавно переніс перелом, оскільки переваги перевищують ризики. (1/++++)
Доказовість
Метою застосування фармакологічної терапії в лікуванні низької мінеральної щільності кісток (МЩК) або остеопорозу (ОП) в жінок у постменопаузі є зниження ризику великих остеопорозних переломів. Для оцінки лікування ОП зазвичай використовували Т-критерій і систему FRAX поперекового відділу хребта, загального стегна та шийки стегна. Фармакологічне лікування має розпочатися негайно в пацієнтів із недавніми переломами, аби запобігти їх більшій кількості. Беручи до уваги результати дослідження Horizon [34], ми запропонували почати терапію через ≥2 тиж після перелому стегна.
2. Бісфосфонати
2.1. У жінок у постменопаузі з високим ризиком переломів рекомендують початкове лікування бісфосфонатами (алендронатом, ризедронатом, золендроновою кислотою чи ібандронатом), аби знизити ризик переломів. (1/++++)
Примітка. Ібандронат не рекомендується для зниження ризику переломів хребців та стегон.
2.2. У жінок у постменопаузі з ОП, які приймають бісфосфонати, рекомендують переглянути ризик переломів через 3-5 років. У жінок, в яких залишається високий ризик переломів, треба продовжити терапію, тоді як у пацієнток із низьким або середнім ризиком необхідно розглянути доцільність «бісфосфонатних канікул». (1/++)
Примітка. Бісфосфонатні канікули – тимчасове припинення прийому бісфосфонатів на термін до 5 років. Цей термін може бути довшим залежно від МЩК та клінічних обставин окремих пацієнтів. У рандомізованих дослідженнях отримано більш вагомі докази щодо користі бісфосфонатних канікул для алендронату та золендронової кислоти.
Доказовість
Лікування бісфосфонатами до 5 років
Три пероральні бісфосфонати доступні на міжнародному фармацевтичному ринку: алендронат (щотижня), ібандронат (щомісяця) і ризедронат (щотижня або щомісяця). Крім того, є два препарати для внутрішньовенного введення: золендронова кислота, яку вводять щорічно, та ібандронат, який вводять щоквартально.
У ході метааналізу ефективності алендронату проти плацебо (рис. 1) було продемонстровано зниження ризику переломів хребта на 44%, стегна – на 40%, хребців – на 17%. Метаналіз порівняння ризедронату з плацебо – на 36%, 26% і 20% відповідно; золендронової кислоти з плацебо – на 56%, 42% та 18% відповідно.
Лікування бісфосфонатами понад 5 років
Бісфосфонати відрізняються від інших методів лікування ОП тим, що їхня позитивна дія зберігається протягом декількох років після припинення лікування. Було проведено 2 рандомізованих плацебо-контрольованих дослідження: у першому вивчалась ефективність алендронату (1099 жінок; 10 років проти 5), у другому – золендронової кислоти (1233 жінки, 6 років проти 3). У пацієнток, які продовжували лікування бісфосфонатами, ризик переломів хребців значно знизився, але вираженого зниження переломів хребців або стегон зазначено не було.
Бісфосфонатні канікули
Ризик виникнення остеонекрозу щелепи (ОНЩ) та атипових переломів стегнової кістки (АПСК), особливо на тлі тривалого застосування бісфосфонатів (>5 років), викликав стурбованість щодо визначення курсу лікування. Цільова група Американського товариства з досліджень кісток і мінералів (ASBMR) з приводу довгострокового лікування за допомогою бісфосфонатів зазначила, що в пацієнтів із низьким ризиком переломів ризик ОНЩ може бути зменшений шляхом тимчасових канікул через 5 років прийому пероральних бісфосфонатів і після 3 років внутрішньовенного введення бісфосфонатів [40]. Результати двох згаданих вище довгострокових рандомізованих досліджень ефективності алендронату і золендронової кислоти дають можливість припустити, що після припинення будь-якого з цих методів лікування зростання МЩК зберігається, але повільно втрачається протягом 3-5 років.
Важливе припущення щодо значення бісфосфонатних канікул полягає в тому, що ризик ОНЩ буде знижений. Одне велике обсерваційне дослідження продемонструвало, що ОНЩ зменшується на >80% через 3 роки після припинення прийому бісфосфонатів [42].
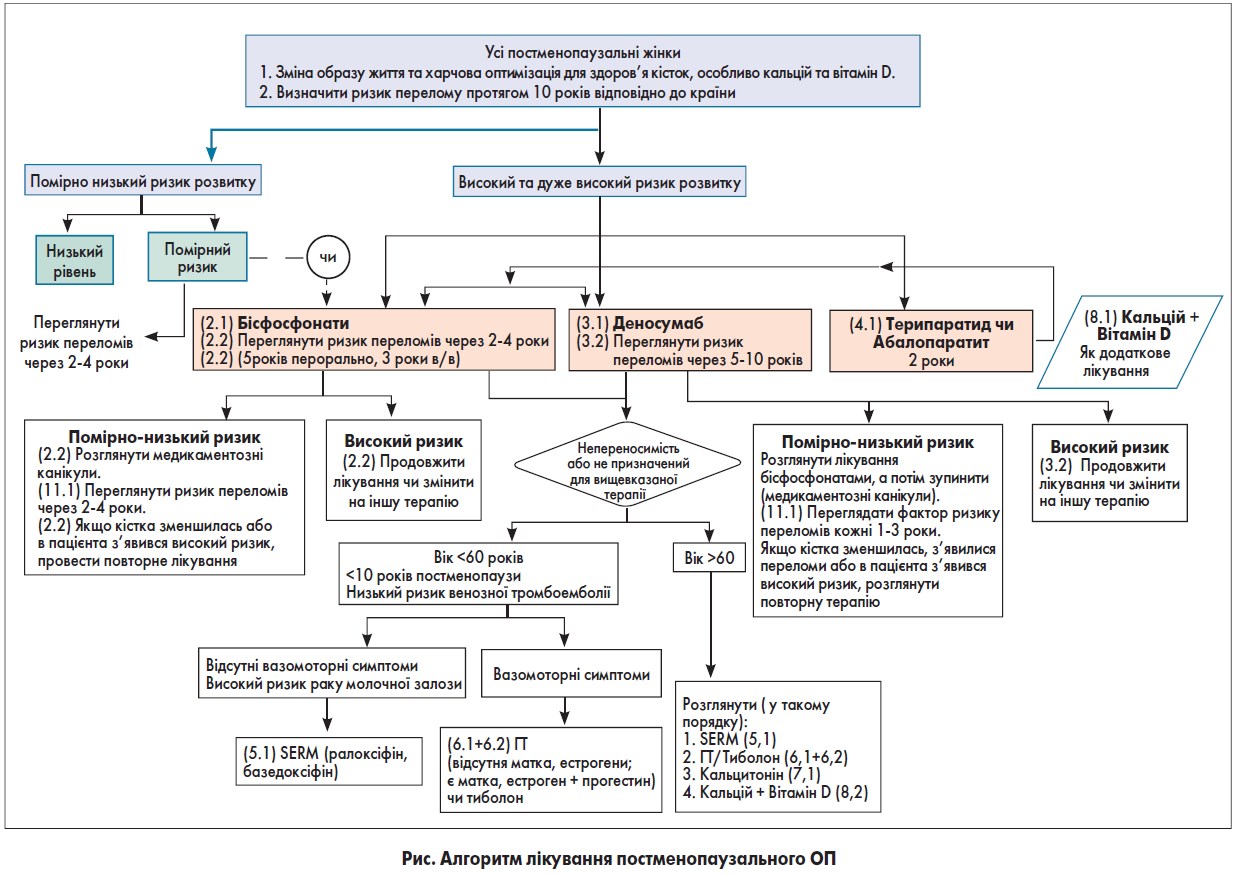
Цільова група ASBMR передбачає, що пацієнтам із низьким і середнім ризиком переломів доцільно почати бісфосфонатні канікули, тоді як особам із високим ризиком слід продовжити прийом бісфосфонатів або перейти на іншу терапію (рис.) [40].
Значуще зниження МЩК може призвести до повторної ініціації терапії ОП, залежно від ризику переломів у пацієнта до завершення 5-річної максимальної відпустки.
Зверніть увагу, що в цьому алгоритмі дослідники вважали, що визначення ризику переломів включатиме вимір МЩК поперекового відділу хребта, стегна, введення загального значення МЩК стегна або шийки стегна в інструмент FRAX (інструмент оцінки ризику руйнування). При використанні алгоритму FRAX визначають наступні категорії ризику: «низький ризик» включає відсутність попередніх переломів стегна або хребта, T-показник МЩК на стегні й хребті вище -1,0, 10-річний ризик перелому стегна <3% і 10-річний ризик серйозних остеопоротичних переломів <20%; «помірний ризик» включає відсутність попередніх переломів стегна або хребта, Т-критерій МЩК на стегні і хребті вище -2,5, або 10-річний ризик перелому стегна <3%, або ризик серйозних остеопоротичних переломів <20%; «високий ризик» включає попередній перелом хребта або тазостегнового суглоба або Т-критерій МЩК на тазостегновому суглобі або хребті ≤-2,5, або 10-річний ризик перелому стегна ≥3%, або ризик серйозного ризику остеопоротичних переломів ≥20%; «дуже високий ризик» включає множинні переломи хребта і Т-показник МЩК на стегні або хребті ≤-2,5.
Хоча є дані про те, що більш низька доза алендронату (5 мг/добу) після 5 років прийому його повної дози так само ефективна для підтримки МЩК і рівнів мінералізації кісток (РМК), як і повна доза (10 мг/добу) [36], достовірно невідомо, чи зменшує ризик розвитку АПСК зниження дози. Подальше вивчення цього питання допоможе встановити, чи здатне зниження дози через 5 років стати альтернативою канікулам бісфосфонатів.
Корисно чи ні
Перші проблеми щодо прийому пероральних бісфосфонатів були пов’язані з подразненням верхніх відділів шлунково-кишкового тракту. Однак на практиці ці побічні ефекти можуть бути зведені до мінімуму завдяки ретельному дотриманню правильних процедур дозування навіть у пацієнтів із захворюваннями стравоходу [12, 44]. При внутрішньовенному введенні золедронової кислоти часто (приблизно в 1 з 4 пацієнтів) спостерігається реакція гострої фази (симптоми грипу, наприклад: гіпертермія та біль у м’язах), зазвичай – тільки після першої інфузії, і триває від 1 дня до 7 днів. Частота й тяжкість можуть бути знижені попереднім прийомом таких препаратів, як ацетамінофен або ібупрофен. Через ризик розвитку ниркової токсичності бісфосфонати показані лише в пацієнтів зі швидкістю клубочкової фільтрації (ШКФ) >30 мл/хв для ризедронату і ібандронату і >35 мл/хв для алендронату та золедронової кислоти [45]. Метааналіз впливу лікування бісфосфонатами на фібриляцію передсердь продемонстрував, що дещо збільшувати ризик може золедронова кислота, але не інші бісфосфонати [46].
У 2003 р. уперше було описано два випадки ОНЩ та АПСК у жінок, які приймали бісфосфонати [47]. Але, незважаючи на проведені епідеміологічні дослідження [48], переваги терапії бісфосфонатами протягом 5 років значно перевищують будь-які ризики АПСК у жінок у постменопаузі з високим ризиком переломів [79].
3. Деносумаб
3.1. У жінок у постменопаузі з ОП, схильних до високого ризику остеопоротичних переломів, ми рекомендуємо використовувати деносумаб в якості альтернативного початкового лікування. (1/++++)
Примітка. Рекомендована доза – 60 мг підшкірно кожні 6 місяців. Ефекти деносумаба на ремоделювання кістки відображені в РМК та змінюються через 6 міс, якщо препарат приймають не за графіком. Таким чином, з цим засобом не рекомендується проводити «канікули» або переривання лікування.
3.2. У жінок у постменопаузі з ОП, які приймають деносумаб, ми пропонуємо переглядати ризик перелому через 5-10 років; жінкам зі збереженим високим ризиком переломів слід або продовжити прийом деносумабу, або вдатися до інших методів лікування ОП. (2/+)
3.3. У жінок у постменопаузі з ОП, яким призначено деносумаб, не рекомендується ані відкладати, ані припиняти його прийом без подальшого антирезорбційного лікування (наприклад, бісфосфонати, гормональна терапія (ГТ) або селективний модулятор рецептора естрогену) чи іншої терапії для запобігання порушенням в обміні кісток і зменшенню ризику швидкої втрати МЩК та підвищеному ризику переломів.
Доказовість
У процесі метааналізу, в якому порівнювали деносумаб із плацебо (рис.), було зазначено зниження ризику переломів хребта на 68%, зниження переломів стегна на 39% і ризику переломів хребців на 19% [12].
Одним із обмежень у використанні деносумабу є ризик гіпокальціємії через супутні захворювання, такі як мальабсорбція або хронічна хвороба нирок (ХХН). На відміну від бісфосфонатів деносумаб може призначатися пацієнтам із ХХН і пацієнтам зі ШКФ ≤35 мл/хв/1,73 м², але з обережністю, оскільки препарат швидко і значуще знижує кістковий обмін та блокує мобілізацію кальцію з кістки для захисту від гіпокальціємії [53, 54]. Тому всім пацієнтам, схильним до гіпокальціємії та порушень мінерального балансу, протягом 14 днів після введення деносумабу рекомендовано проводити клінічний моніторинг рівнів кальцію, магнію та фосфору в сироватці (зведені дані характеристики продукту (SmPC) Європейської агенції з лікарських засобів [55]). У подальших рекомендаціях SmPC наголошується важливість виявлення пацієнтів із ризиком розвитку гіпокальціємії та усунення цього ризику шляхом забезпечення адекватного споживання кальцію й вітаміну D до початку терапії. Рівні кальцію в сироватці крові можна перевіряти перед кожною дозою деносумабу.
Небажані реакції, оцінені в III фазі дослідження FREEDOM, включали інфекції, запальні захворювання та злоякісні пухлини, а також ОНЩ, АПСК і гіпокальціємію [56]. Інфекцій, про які повідомлялося як про серйозні небажані реакції дослідження FREEDOM, включали кілька ділянок тіла, шлунково-кишковий і сечовий тракти, серце, шкіру та вухо, чисельно було вище в групі деносумабу проти групи плацебо, але відмінності були статистично не значущими [60].
У дослідженні задоволеності терапією, прихильності до деносумабу (DAPS) повідомлялося, що незалежно від послідовності лікування протягом 24 міс (алендронат упродовж 12 міс, а потім деносумаб протягом 12 міс або навпаки) учасники дослідження найчастіше обирали для подальшого лікування деносумаб, ніж алендронат (визначено на основі анкет) [69, 70].
Примітка. Ін’єкції деносумабу необхідно робити кожні 6 (±1) місяців. Якщо інтервали між дозами триваліші, ефект препарату слабшає, і швидкість резорбції кістки швидко зростає [62, 63].
4. Терипаратид і абалопаратид (гормон паращитоподібної залози (ПТГ) і аналог білка, гормону паращитоподібної залози).
4.1. У жінок у постменопаузі з ОП і дуже високим ризиком переломів, наприклад з тяжкими або множинними переломами хребців, ми рекомендуємо лікування терипаратидом або абалопаратидом до 2 років для зменшення хребцевих та нехребцевих переломів. (1/+++)
4.2. У жінок у постменопаузі з ОП, які пройшли курс лікування терипаратидом або абалопаратидом, ми рекомендуємо застосування антирезорбційної терапії ОП для підтримки збільшення щільності кістки. (1/++)
Доказовість
Анаболічні агенти збільшують МЩК завдяки утворенню кісткової тканини при їхньому періодичному введенні (тобто щодня). Сьогодні є 2 ліцензованих пептиди, які вважаються анаболічними для кістки: ПТГ [1-34] (терипаратид) і аналог білка, зв’язаного з ПТГ (абалопаратид). Метааналіз порівняння терипаратиду з плацебо (рис.) продемонстрував зниження ризику переломів хребта і переломів хребців на 74 і 39% відповідно [12]. У дослідженні VERO (лікування переломів хребта в жінок з ОП) у пацієнток із дуже високим ризиком переломів терипаратид зменшував хребетні та клінічні переломи порівняно з ризедронатом [72].
Побічні ефекти застосування терипаратиду (20 мг) порівняно з плацебо включали більш часті запаморочення й судоми в ногах [73], а небажаними явищами на тлі прийому абалопаратиду, які привели до припинення дослідження, були нудота, постуральна гіпотензія, запаморочення, головний біль і серцебиття [74]. Також у ході метааналізу показано, що терипаратид і абалопаратид несуттєво підвищують уміст кальцію в сироватці крові та можуть призвести до гіперкальціємії. Тому рекомендується оцінювати рівень кальцію в сироватці крові перед його використанням, аби жоден з агентів не застосовувався в пацієнтів із підвищеним рівнем кальцію в сироватці.
Дослідження антирезорбційних препаратів, які призначають після скасування анаболічних, показали, що перші здатні зберігати і, можливо, навіть трохи підсилювати їхні анаболічні ефекти [74, 75, 77-79]. Оскільки переваги анаболічної терапії швидко втрачаються після припинення лікування, більшість клінічних настанов рекомендують призначати після курсу терипаратиду або абалопаратиду (до 2 років) бісфосфонати, ралоксифен, деносумаб або менопаузальну ГТ.
Терипаратид і абалопаратид – єдині анаболічні агенти, схвалені сьогодні для лікування ОП. Інші анаболічні агенти (наприклад, ромосозумаб) пройшли або проходять випробування і можуть бути доступні в майбутньому.
Лікування цими препаратами потребує щоденної ін’єкції, цього не завжди вдається дотримуватися: через або небажання деяких пацієнтів, або неможливість чи складність дотримання такого режиму.
5. Селективні модулятори рецепторів естрогену (SERM)
5.1. У жінок у постменопаузі з ОП із високим ризиком переломів і нижченаведеними характеристиками рекомендують застосовувати ралоксифен або базедоксифен для зниження ризику переломів хребців. (1 /++++)
Характеристики пацієнта. З низьким ризиком тромбозу глибоких вен (ТГВ) і ті, яким не підходять бісфосфонати або деносумаб, або з високим ризиком раку молочної залози (РМЗ).
Доказовість
Метааналіз, у ході якого порівнювали ралоксифен із плацебо (рис.), показав зниження ризику переломів хребта на 40%, але водночас відсутність істотного впливу на зниження ризику переломів тазостегнового суглоба чи хребців [12]. Кілька побічних ефектів, зокрема венозна тромбоемболія, приливи та судоми ніг, обмежують використання цих препаратів [83].
6. Менопаузальна ГТ і тиболон
6.1. У жінок у постменопаузі з високим ризиком переломів та нижченаведеними характеристиками пропонують менопаузальну ГТ, в якій естроген використовується тільки в жінок із гістеректомією, для запобігання всім типам переломів. (2/+++)
Характеристики пацієнта. Вік – <60 років або <10 років після менопаузи; з низьким ризиком ТГВ; яким не підходить лікування бісфосфонатами або деносумабом; з настирливими вазомоторними симптомами; з додатковими клімактеричними симптомами; без протипоказань; без попереднього інфаркту міокарда (ІМ) або інсульту; без РМЗ; згодний пройти менопаузальну ГТ.
6.2. У жінок у постменопаузі з ОП із високим ризиком переломів та нижченаведеними характеристиками ми пропонуємо тиболон для запобігання хребцевим та нехребцевим переломам. (2/+++)
Характеристики пацієнта. Вік – <60 років або <10 років після менопаузи; з низьким ризиком ТГВ; ті, яким не підходять бісфосфонати або деносумаб; з настирливими вазомоторними симптомами; з додатковими клімактеричними симптомами; без протипоказань; без попереднього ІМ або інсульту або високого ризику серцево-судинних захворювань; без РМЗ; згодний приймати тиболон.
Доказовість
Метааналіз, в якому порівнювали менопаузальну ГТ (естроген із прогестагеном або без нього) з плацебо (рис.), продемонстрував зниження ризику: переломів хребта – на 34%, переломів стегна – на 29% і переломів хребців – на 21% [12].
Кілька потенційних побічних ефектів, включаючи венозну тромбоемболію, інсульт, ІМ, рак (молочної залози, ендометрію, яєчника), деменцію, хворобу жовчного міхура і нетримання сечі, обмежують застосування цієї терапії [98].
Метааналіз, в якому порівнювали тиболон із плацебо (рис.), показав зниження ризику переломів хребта на 44%, відсутність значного впливу на зниження ризику переломів стегна і зниження ризику переломів хребців на 27% [12]. Кілька побічних ефектів, зокрема інсульт, виділення з піхви і кровотеча, обмежують використання цього препарату.
Комітет Європейського товариства ендокринологів не віддає перевагу естрогену і тиболону; численні дані щодо ГТ засновані на показаннях пацієнток із низьким ризиком переломів, тоді як дані щодо тиболону – пацієнток із їх високим ризиком. Переваги та ризики естрогену й тиболону необхідно оцінювати окремо для кожного конкретного випадку [102]. Співвідношення ризиків та користі відрізняється в різних жінок залежно від їх потреб у лікуванні. Якщо менопаузальна ГТ здійснюється на тлі ОП і її припиняють, необхідно застосовувати альтернативні методи лікування ОП.
7. Кальцитонін
7.1. У постменопаузі пацієнткам із високим ризиком перелому на тлі ОП пропонують призначати назальний спрей кальцитонін, але лише тим, хто не переносить ралоксифен, бісфосфонати, естрогени, деносумаб, тиболон, абалопаратид або терипаратид, або тим, кому ці методи лікування не вважаються придатними. (2 /+)
Випробування з кальцитоніном для назального спрея ніколи не спричиняли зниження ризику переломів; проте дослідження «Запобігання рецидивам остеопоротичних переломів» (PROOF) показало ефективність зниження перелому хребця (при дозі 200 МО, але не 100 або 400 МО кальцитоніну для назального спрея в день) [104].
Недавні дослідження змусили засумніватися в безпеці довгострокового прийому кальцитоніну у вигляді назального спрея через підвищений ризик (перехресні та когортні дослідження, метааналіз) раку передміхурової залози, печінки та інших злоякісних новоутворень, хоча патофізіологічна теорія невідома [106, 107].
8. Кальцій та вітамін D
8.1. У жінок у постменопаузі з низьким МЩК і високим ризиком переломів на тлі ОП пропонують використовувати кальцій та вітамін D в якості доповнення до терапії ОП. (2/++)
8.2. У жінок у постменопаузі з високим ризиком переломів на тлі ОП, які не переносять бісфосфонати, естрогени, селективні модулятори рецепторів естрогену, деносумаб, тиболон, терипаратид і абалопаратід, рекомендують щоденний прийом добавки кальцію та вітаміну D для запобігання переломам стегна. (1/+++)
Усі жінки в постменопаузі з підтвердженим діагнозом ОП мають проходити скринінг із рівнем 25-гидроксівітаміну D у сироватці. Перевага полягає в тому, що адекватний рівень 25-гидроксівітаміну D у сироватці в жінок з ОП має становити не менше 20 нг/мл (50 нмоль/л), як зазначено в європейських довідниках, хоча в рекомендаціях Товариства рекомендується поріг у 30 нг/мл (75 нмоль/л), який часто можна спостерігати на тлі прийому вітаміну D 1000 МО на день.
9. Підхід до лікування або вибір із затверджених методів лікування
Метою лікування є зменшення переломів, зумовлених ОП. Таким чином, загальний підхід полягає в рекомендаціях із підтримки здоров’я кісток. До них належать: адекватне споживання кальцію та вітаміну D, вправи на стійкість і рівновагу, відмова від куріння, обмежене вживання алкоголю, відмова від наркотиків та оптимізація супутніх станів, які можуть спровокувати пошкодження кісток у всіх жінок у постменопаузі. Пацієнтам із високим ризиком переломів рекомендується лікування препаратами, погодженими для застосування за такими показаннями. Особам із низьким і середнім ризиком переломів рекомендують дотримуватися специфічних для тої чи іншої країни рекомендацій з лікування, оскільки ризики переломів, значущість та вартість лікування варіюють залежно від рівня доходів.
У клінічній практиці виникнення одного перелому на тлі ефективної терапії в прихильного до лікування пацієнта підвищить доцільність зміни терапії. У таких випадках ми пропонуємо перейти на один з альтернативних методів лікування, які було згадано вище.
Алгоритм, запропонований на рис., може застосовуватися до окремої жінки в постменопаузі при розгляді терапії ОП. Ми розглядали жінок із високим ризиком переломів із попереднім переломом хребта або тазостегнового суглоба, або Т-показник МЩК ≤-2,5 на стегні або хребті, або 10-річний ризик перелому стегна ≥3% в рік або ризик значного остеопоротичного перелому ≥20%.
10. Оптимальна тривалість терапії і канікули медикаментозного лікування
Є достатньо доказів щодо мінімального ризику лікування від 3 до 5 років за допомогою вищезгаданих методів. Однак побоювання з приводу АПСК і ОНЩ зумовили перегляд оптимальної тривалості терапії.
Вплив припинення небісфосфонатної терапії
Є дані, які демонструють, що ефекти всіх небісфосфонатних терапій (деносумаб, абалопаратид, терипаратид, селективний модулятор рецепторів естрогену, ГТ, тиболон і кальцитонін) зникають із припиненням терапії. Тобто приріст МЩК, який спостерігався протягом лікування цими речовинами, у разі припинення терапії швидко втрачається. Припинення прийому деносумабу асоційовано зі зменшенням МЩК на 6,6% в поперековому відділі хребта і на 5,3% – у загальному тазостегновому суглобі протягом перших 12 міс після припинення лікування [126, 127]. Фактично, є дані, які дають можливість припустити, що припинення застосування деносумабу, потужної антирезорбційної терапії може призвести до збільшення переломів хребців [128-131]. Кілька досліджень продемонстрували, що використання алендронату після анаболічного лікування збереже і, можливо, збільшить приріст МЩК [36, 136], і тому після анаболічної терапії зазвичай призначається алендронат.
Остеонекроз щелепи
ОНЩ – це незагоєна рана на слизовій оболонці порожнини рота з оголеною кісткою, яка триває >8 тиж і зазвичай пов’язана з інвазивною стоматологічною процедурою, такий як видалення зуба або імплантація, але також може виникати de novo [47]. Міжнародна цільова група з ОНЩ повідомила про асоціацію терапії бісфосфонатами і ОНЩ; абсолютний ризик ОНЩ у пацієнтів з ОП варіювався від 1 з 10 000 до 1 з 100 000 (або від 0,001 до 0,01%) [137]. Більш високі дози і більш часте використання бісфосфонатів і деносумабу були пов’язані з більш високим ризиком ОНЩ у разі онкопатології [138], але в цих пацієнтів є інші фактори ризику, такі як хіміо- і променева терапія. На сьогодні Американська стоматологічна асоціація не рекомендує зупиняти бісфосфонати для здійснення стоматологічних процедур; проте, якщо видалення або імплантація зуба заплановані або тривають, початок сильної антирезорбційної терапії може бути відкладено до загоєння місця пошкодження [141]. І навпаки, Американська асоціація оральних і щелепно-лицевих хірургів рекомендує 2-місячну відпустку ліків для тих, хто понад 4 років приймав бісфосфонати [140]. Рутинна стоматологічна допомога також важлива для профілактики ОНЩ у пацієнтів, які отримують потужну антирезорбційну терапію (142, 143).
Консервативне лікування, таке як антибактеріальне полоскання рота, рекомендується в якості початкової терапії при ОНЩ від 0 до 2-ї стадії, тоді як хірургічне лікування і резекція рекомендується для 3-ї стадії ОНЩ [140]. Хоча були повідомлення про випадки використання терипаратиду, а також інших методів терапії в успішному лікуванні ОНЩ, аби встановити ефективність і достовірність, необхідно провести додаткові контрольовані дослідження [140].
Атипові переломи стегна
АПСК – це стресові переломи стегнової кістки, які розвиваються при нормальному або фізіологічному навантаженні. Перші такі випадки зафіксовані приблизно в 2007 р. [144, 145], тоді ж було озвучено думку про їхній можливий зв’язок із використанням бісфосфонатів. Ці переломи мають специфічні рентгенологічні характеристики, які були формалізовані ASBMR у визначенні випадку захворювання [146, 147] на підставі рентгенографічних критеріїв і низької травми. АПСК були найбільш вивчені відносно використання бісфосфонатів, але були зазначені з іншими ліками від ОП, включаючи деносумаб, оданакатиб і ромосозумаб [48]. Пацієнти часто відчувають біль у стегні або паху під час або після навантажень. Патогенез цих переломів незрозумілий, хоча висунуто низку гіпотез, де згадуються такі фактори, як форма стегна, генетичні та етнічні особливості [48].
11. Моніторинг
11.1. У жінок у постменопаузі з низьким МЩК і високим ризиком переломів, яких лікують від ОП, запропоновано проводити моніторинг МЩК за допомогою двохенергетичної рентгенівської абсорбціометрії в хребті й стегні кожні 1-3 роки для оцінки відповіді на лікування. (2 /+)
Технічне зауваження: Моніторинг РМК є альтернативним методом виявлення поганої відповіді або недотримання терапії.
Деякі експерти рекомендують вимірювати РМК до і через 3-6 міс після початку лікування [165]. Якщо зміна маркерів перевищує найменш значущу зміну (~40%), то однієї мети було досягнуто. Якщо маркери не змінюються, є кілька варіантів, які включають опитування пацієнта про прийом ліків, загальний стан, перевірка на наявність причин вторинного ОП або зміна ліків чи шляху введення.
Eastell et al. Osteoporosis in Postmenopausal Women. J Clin Endocrinol Metab, May 2019, 104(5):1595-1622.
doi: 10.1210/jc.2019-00221.
Переклад з англ. Юлії Золотарьової
Тематичний номер «Діабетологія, Тиреоїдологія, Метаболічні розлади» № 1 (49) 2020 р.