1 травня, 2020
Аминогликозиды как компонент антибактериальной терапии в гинекологии
В статье изложены общие принципы антибактериальной терапии в гинекологии, приведена современная классификация антимикробных средств. Описаны фармакокинетические свойства, механизм действия, особенности применения препаратов группы аминогликозидов, лекарственные взаимодействия, принципы дозирования, диагностика и коррекция осложнений при использовании.
Ключевые слова: антибактериальная терапия, антибактериальные препараты, аминогликозиды, гентамицин, амикацин, тобрамицин, сизомицин, нетилмицин.
Воспалительные заболевания половых органов у женщин (ВЗПО) составляют 60% случаев среди амбулаторных и около 30% среди стационарных больных и представляют собой одну из основных медицинских проблем в гинекологии, поскольку оказывают существенное негативное влияние на здоровье женщин детородного возраста. За последнее десятилетие во всех странах мира отмечается рост ВЗПО на 13% в общей популяции женщин репродуктивного периода и на 25% – у лиц, использующих внутриматочные контрацептивы. Кроме того, в три раза увеличилась частота тубоовариальных образований воспалительной этиологии.
По данным многочисленных исследований, у больных с ВЗПО в 10 раз чаще, чем у здоровых женщин, наблюдается хронический болевой синдром, в 6 раз чаще – эндометриоз, в 20‑40% случаев – бесплодие. Пациенток, имеющих ВЗПО, в 10 раз чаще оперируют по поводу внематочной беременности, им в 8 раз чаще, чем в общей популяции, производится гистерэктомия. Экономические затраты, связанные с самим заболеванием и его последствиями, также являются немаловажным фактором.
Особенности антимикробной активности антибиотиков
Как известно, ведущим механизмом развития ВЗПО является микробный фактор (микробная инвазия). Значительное место в этиологии гнойно-воспалительного процесса занимают провоцирующие факторы, приводящие к повреждению или ослаблению барьерных механизмов защиты организма, что способствует формированию входных ворот для патогенной микрофлоры и ее дальнейшему распространению. К таким факторам относятся менструация, роды (физиологические факторы), аборты, введение внутриматочных средств, гистероскопия, гистеросальпингография, оперативные вмешательства (ятрогенные факторы) и пр.
Анализ результатов многочисленных бактериологических исследований показал произошедшую в последние годы смену микроорганизмов – возбудителей гнойно-воспалительных процессов в гинекологии. Большинство исследователей единодушны во мнении, что ведущим инициатором ВЗПО являются ассоциации неспорообразующих грамотрицательных и грамположительных анаэробных микроорганизмов, аэробной грамотрицательной, реже – грамположительной, микробной флоры. Вызванная ими микст-инфекция имеет персистирующее длительное течение и склонность к частым рецидивам (Коханевич Е. В. и соавт., 2003).
Ассоциации патогенных возбудителей гнойного процесса включают:
- грамотрицательные неспорообразующие анаэробные бактерии: Bacteroides fragilis, Prevotella species, Prevotella bivia, Prevotella disiens, Prevotella melaninogenica;
- грамположительные анаэробные стрептококки Peptostreptococcus spp., грамположительные анаэробные спорообразующие палочки рода Clostridium;
- аэробные грамотрицательные бактерии семейства Enterobacteriaceae, такие кaк Escherichia coli, Proteus;
- аэробные грамположительные кокки (энтеро-, стрепто- и стафилококки);
- инфекции, передаваемые половым путем, – Neisseria gonorrhoeae, Chlamydia trachomatis, Mycoplasma hominis, Mycoplasma genitalium, Ureaplasma urealyticum.
Нередким компонентом микробного пейзажа являются гонококки, трихомонады, хламидии, вирусы. Роль вирусов в гнойном воспалении гениталий опосредована, их действие остается недостаточно ясным и связывается, по-видимому, с иммунодефицитом. Принято считать, что у больных, страдающих рецидивирующими вирусными заболеваниями, отмечается дефицит компонентов специфического антивирусного иммунитета – специфический иммунодефицит.
Не подлежит сомнению, что основой медикаментозного лечения любого воспалительного процесса вообще и ВЗПО в частности является антибактериальная терапия, значение которой в современной медицине трудно переоценить. Вряд ли представитель любой врачебной специальности в своей практической деятельности может обойтись без применения антибиотиков – веществ, избирательно угнетающих жизнедеятельность микроорганизмов.
Под избирательным действием понимают активность только в отношении микроорганизмов при сохранении жизнеспособности клеток хозяина и воздействие не на все, а на определенные виды микроорганизмов. Традиционно антибактериальные препараты делятся на природные (собственно антибиотики, например общеизвестный пенициллин), полусинтетические (продукты модификации природных молекул, например амоксициллин или цефазолин) и синтетические (например, сульфаниламиды, нитрофураны).
По мнению Л. С. Страчунского и соавт. (2000), такое деление давно утратило актуальность, так как ряд природных антибиотиков получают путем синтеза (хлорамфеникол), а некоторые препараты, иногда не совсем правильно именуемые антибиотиками, фактически являются синтетическими соединениями. Уникальность антибиотиков заключается в том, что, в отличие от большинства других лекарственных средств, их мишень-рецептор находится не в тканях человека, а в клетке микроорганизма.
С избирательностью действия тесно связано понятие о широте спектра активности антибактериальных препаратов. Однако с позиций сегодняшнего дня деление антибиотиков на препараты широкого и узкого спектра действия представляется во многом условным и подвергается серьезной критике из-за отсутствия критериев для такого деления. Более целесообразно рассматривать антибиотики с точки зрения клинической эффективности при инфекциях определенной органной локализации, так как клинические доказательства эффективности, полученные в хорошо контролируемых испытаниях (сравнительных, рандомизированных, проспективных), имеют несомненно более важное значение, чем условный «ярлык» (Майоров М. В., 2005).
 Безусловно, в каждом конкретном случае необходим строго индивидуализированный подход к выбору того или иного препарата, его дозировки, способа и кратности введения, продолжительности терапии, сочетания с прочими антибактериальными препаратами, а также с другими лекарственными средствами, действующими на различные звенья патологического процесса. В настоящее время зарегистрировано несколько сотен антибактериальных препаратов более чем 20 различных классов, а также 8 классов противогрибковых, 8 классов противовирусных и 12 классов противопротозойных средств. Современная классификация антибактериальных препаратов представлена в таблице.
Безусловно, в каждом конкретном случае необходим строго индивидуализированный подход к выбору того или иного препарата, его дозировки, способа и кратности введения, продолжительности терапии, сочетания с прочими антибактериальными препаратами, а также с другими лекарственными средствами, действующими на различные звенья патологического процесса. В настоящее время зарегистрировано несколько сотен антибактериальных препаратов более чем 20 различных классов, а также 8 классов противогрибковых, 8 классов противовирусных и 12 классов противопротозойных средств. Современная классификация антибактериальных препаратов представлена в таблице.
Механизм действия аминогликозидов
Одной из наиболее давно известных является группа антибиотиков – аминогликозидов, код АТХ J01GB. Полная расшифровка кода: Анатомо-терапевтическо-химическая классификация лекарственных средств (ATC) / Противомикробные препараты для системного использования /Антибактериальные препараты для системного использования/ Аминогликозиды.
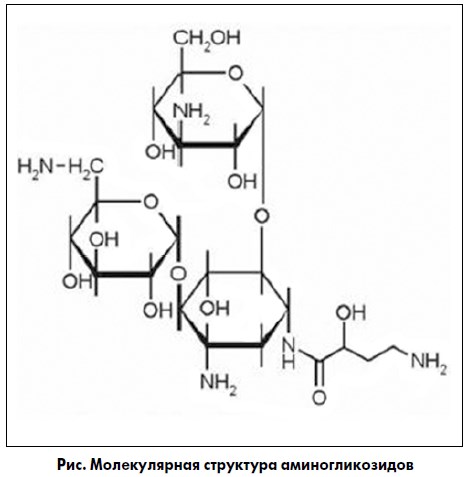 Название данной группы обусловлено молекулярной структурой, в основе которой присутствуют аминосахара, связанные гликозидной связью с агликоновой частью молекулы (рисунок). В эту группу входят: тобрамицин, гентамицин, канамицин, неомицин, амикацин, нетилмицин, сизомицин, дибекацин, рибостамицин, ристомицин, изепамицин, арбекацин, беканамицин. Появление аминогликозидных антибиотиков ведет свой отсчет с открытия исследовательской группой Зельмана Ваксмана в 1943 году стрептомицина – первого препарата, активного в отношении Mycobacterium tuberculosis. За столь выдающееся открытие Ваксман в 1952 году был удостоен Нобелевской премии. Впоследствии на основе природных структур, продуцируемых различными представителями актиномицетов (природные антибиотики), и в ряду их полусинтетических производных была разработана большая группа антибактериальных препаратов.
Название данной группы обусловлено молекулярной структурой, в основе которой присутствуют аминосахара, связанные гликозидной связью с агликоновой частью молекулы (рисунок). В эту группу входят: тобрамицин, гентамицин, канамицин, неомицин, амикацин, нетилмицин, сизомицин, дибекацин, рибостамицин, ристомицин, изепамицин, арбекацин, беканамицин. Появление аминогликозидных антибиотиков ведет свой отсчет с открытия исследовательской группой Зельмана Ваксмана в 1943 году стрептомицина – первого препарата, активного в отношении Mycobacterium tuberculosis. За столь выдающееся открытие Ваксман в 1952 году был удостоен Нобелевской премии. Впоследствии на основе природных структур, продуцируемых различными представителями актиномицетов (природные антибиотики), и в ряду их полусинтетических производных была разработана большая группа антибактериальных препаратов.
В настоящее время выделяют три поколения аминогликозидов:
- 1-е поколение – стрептомицин, неомицин, канамицин и мономицин (применение на современном этапе ограничено вследствие их токсичности);
- 2-е поколение – гентамицин, тобрамицин, сизомицин и нетилмицин;
- 3-е поколение – амикацин и изепамицин.
Механизм действия аминогликозидов связан с необратимым угнетением синтеза белка на уровне рибосом у чувствительных к ним микроорганизмов. В отличие от других ингибиторов синтеза белка они оказывают не бактериостатическое, а бактерицидное действие. Аминогликозиды 2-го и 3-го поколений обладают широким спектром антимикробного действия, в первую очередь – в отношении большинства грамотрицательных микроорганизмов семейства Enterobacteriaceae (E. coli, Proteus spp., Klebsiella spp., Enterobacter spp., Serratia spp. и др.), а также неферментирующих грамотрицательных палочек (Pseudomonas aeruginosa, Acinetobacter spp.). Аминогликозиды также проявляют свою активность в отношении Staphylococcus aureus, за исключением метициллин-резистентных штаммов. Отдельные представители класса различаются между собой по активности и спектру действия. В частности, представители 1-го поколения (стрептомицин, канамицин) проявляют наибольшую активность в отношении M. tuberculosis, мономицин обладает эффективностью против некоторых простейших. Все аминогликозиды 2-го и 3-го поколений активны в отношении P. aeruginosa; при этом тобрамицин проявляет наивысшую активность. Сизомицин характеризуется большей активностью, чем гентамицин, в отношении Proteus spp., Klebsiella spp., Enterobacter spp.
Группа аминогликозидов объединяет родственные по химическому строению, антимикробному спектру, фармакокинетическим свойствам, характеру вызываемых ими побочных явлений антибиотики олигосахаридной (или псевдоолигосахаридной) природы. Внедрение в практику гентамицина (2-е поколение) связано с возникновением устойчивых штаммов микроорганизмов к аминогликозидам 1-го поколения и высокой активностью этого препарата в отношении синегнойной палочки. Препараты 3-го поколения (тобрамицин, сизомицин, амикацин, дидезоксиканамицин В, нетилмицин и т. д.) созданы в то время, когда были раскрыты молекулярные механизмы резистентности, обнаружены и выделены специфические ферменты, инактивирующие данные антибиотики. Аминогликозиды 2-го и 3-го поколений отличает более высокая антибактериальная активность, более широкий спектр антимикробного действия, и они постепенно вытесняют препараты 1-го поколения из традиционных областей их применения. По степени убывания силы антимикробного действия аминогликозиды располагаются в следующем порядке: нетилмицин → сизомицин → гентамицин → тобрамицин → неомицин → канамицин → мономицин.
Устойчивость к аминогликозидам у клинических штаммов микроорганизмов частично перекрестная. Стрептомицин-устойчивые штаммы стафилококков и грамотрицательных микроорганизмов в большинстве случаев чувствительны ко всем другим аминогликозидам.
Резистентные к канамицину возбудители чаще всего устойчивы к мономицину, но многие из них чувствительны к неомицину. Микроорганизмы, устойчивые к аминогликозидам 1-го поколения, чувствительны к гентамицину и другим более новым аминогликозидам. Однако гентамицин-устойчивые штаммы в большинстве случаев резистентны к препаратам 1-го поколения, тогда как представители 3-го поколения активны в отношении микроорганизмов, устойчивых к гентамицину.
Резистентность к аминогликозидам у микроорганизмов обусловлена их способностью продуцировать специфические ферменты (аминогликозидацетилтрансферазы, N-фосфаттрансферазы, О-нуклеотидилтрансферазы), инактивирующие эти антибиотики. В настоящее время детально изучены и описаны три механизма энзиматической инактивации аминогликозидов: ацетилирование Н2-группы, аденилирование и фосфорилирование.
Для всех аминогликозидов характерно избирательное нейро- и нефротоксическое действие, что определяет необходимость четкого обоснования показаний к их назначению и тщательного контроля концентрации их в крови, почечной функции и снятия аудиограммы не реже одного раза в неделю. По степени снижения общей токсичности препараты можно расположить следующим образом: сизомицин, гентамицин, тобрамицин, нетилмицин, неомицин, стрептомицин, мономицин, канамицин.
Аминогликозиды назначаются при тяжелых грамотрицательных бациллярных инфекциях (особенно тех, которые обусловлены P. aeruginosa), они активны при большинстве инфекций, вызванных грамотрицательными аэробными и факультативно-анаэробными микроорганизмами, но им не хватает активности против анаэробов и большинства грамположительных бактерий, за исключением стафилококков.
В число аминогликозидов с активным действием в отношении P. aeruginosa входят тобрамицин, гентамицин и амикацин. Стрептомицин, неомицин и канамицин не действуют на P. aeruginosa. У гентамицина и тобрамицина сходные антибактериальные спектры действия на грамотрицательные бациллы, но тобрамицин более активен против P. aeruginosa, а гентамицин более эффективен против Serratia marcescens. Амикацин часто обладает активным воздействием на гентамицин- и тобрамицин-резистентные патогенные микроорганизмы.
Аминогликозиды редко используются как монотерапия, за исключением случаев чумы и туляремии. Они обычно назначаются наряду с β-лактамами широкого спектра при тяжелой инфекции, вызванной штаммами грамотрицательных бацилл. Однако при увеличении резистентности к аминогликозидам фторхинолоны могут заменить их на начальных этапах эмпирического лечения, а при восприимчивости патогена к сопровождающему антибиотику прием аминогликозидов может быть прекращен спустя 2‑3 дня, за исключением случаев чувствительности к ним P. aeruginosa. Чтобы достичь бактерицидного синергизма, выбор аминогликозидов должен основываться на оценке чувствительности in vitro. Чувствительность только к высоким уровням аминогликозидов in vitro предсказывает совместные действия, когда лечение низкими дозами сочетается с препаратом, активным против клеточной стенки. Если штамм резистентен к высоким уровням гентамицина и стрептомицина, предпочтителен гентамицин, поскольку уровни сыворотки могут быть быстро определены, а токсичность уменьшается. Энтерококковая резистентность высокого уровня к гентамицину in vitro не исключает чувствительность этих штаммов к высоким уровням стрептомицина; в таких случаях должен использоваться последний.
Применение стрептомицина ограничено резистентностью и токсичностью. Он используется для лечения туляремии и чумы, а в сочетании с другими антибиотиками – туберкулеза. Из-за токсичности назначение неомицина и канамицина ограничено местным применением в небольших количествах. Неомицин можно применять для глаз, ушей, перорально и ректально, а также для инстилляции мочевого пузыря. Перорально неомицин используется иногда для нормализации кишечной микрофлоры для подготовки кишечника перед операцией.
Назначение во время беременности и кормления грудью
Применение аминогликозидов при беременности относится к категории D (есть доказательства риска для человека), так как они проходят через плаценту и могут оказывать нефротоксическое действие на плод. Имеются сообщения о развитии необратимой двухсторонней врожденной глухоты у детей, матери которых получали аминогликозиды (стрептомицин, тобрамицин) во время беременности, поэтому применение у беременных возможно только по жизненным показаниям. Аминогликозиды проникают в грудное молоко в низких концентрациях, возможно их влияние на микрофлору кишечника ребенка, находящегося на грудном вскармливании. Неомицин противопоказан при лактации, поскольку отсутствуют данные о безопасности его использования в этот период. Другие аминогликозиды следует применять с осторожностью.
Особенности применения
Все препараты данной группы обладают почечной токсичностью (часто обратимой), вестибулярной и слуховой токсичностью (часто необратимой), способностью продления эффекта нейромышечных блокаторов. Симптомами и признаками вестибулярного поражения являются головокружение и атаксия.
Факторы риска при почечной, вестибулярной и слуховой токсичности следующие: частое применение или очень большие дозы, очень высокие уровни препарата в крови, длительная терапия (особенно более 3 дней), пожилой возраст, нарушение функции почек в анамнезе, одновременное назначение ванкомицина, циклоспорина или амфотерицина B, при нефротоксичности – одновременное назначение контрастных веществ. При ототоксичности – генетическая предрасположенность, обуславливающая проблемы со слухом, и одновременное назначение петлевых диуретиков. Длительный прием в высоких дозах обычно вызывает большую вероятность нефротоксичности, но даже низкие дозы, принимаемые в течение короткого времени, могут ухудшить функцию почек.
Пациенты, получающие аминогликозиды более 2 нед, и те, кто относится к группе риска из-за опасности вестибулярной и слуховой токсичности, должны быть обследованы при помощи аудиографии в динамике. При первых же признаках токсичности прием препарата следует прекратить либо дозировка должна быть соответственно снижена. Аминогликозиды способны продлевать действие нейромышечных блокаторов (например, миорелаксанта сукцинилхолина, применяемого при общем обезболивании для тотальной миоплегии) и увеличивать слабость при нарушениях, затрагивающих нейромышечную передачу (например, миастения gravis). Такие воздействия особенно вероятны, когда препарат вводят внутривенно слишком быстро или уровни его в сыворотке чрезмерно высоки. Другие неврологические эффекты включают парестезию и периферическую невропатию. Аллергические реакции весьма редки, за исключением контактного дерматита в связи с местным применением неомицина. Высокие пероральные дозы последнего могут вызвать нарушение его всасывания.
Правила дозирования аминогликозидов
У взрослых пациентов могут осуществляться два режима назначения: традиционный, когда их вводят 2‑3 раза в сутки (например, стрептомицин, канамицин и амикацин – 2 раза; гентамицин, тобрамицин и нетилмицин – 2‑3 раза), и однократное введение всей суточной дозы. Второй вариант позволяет оптимизировать терапию препаратами данной группы. Многочисленные клинические испытания показали, что эффективность лечения при однократном режиме назначения аминогликозидов такая же, как и при традиционном, а нефротоксичность выражена в меньшей степени. Однако данный режим назначения не должен использоваться при лечении инфекционного эндокардита. На выбор дозы влияют такие факторы, как масса тела пациента, локализация и тяжесть инфекции, функция почек.
При парентеральном введении дозы всех аминогликозидов должны рассчитываться на килограмм массы тела, с учетом того, что эти препараты плохо распределяются в жировой ткани: у пациентов с массой тела, превышающей идеальную более чем на 25%, должна быть проведена коррекция дозы. При этом рассчитанную на фактическую массу тела суточную дозу следует эмпирически снизить на 25%. В то же время у истощенных пациентов доза увеличивается на 25%. При менингите, сепсисе, пневмонии и других тяжелых инфекциях назначают максимальные дозы, при инфекциях МВП – минимальные или средние; максимальные дозы не следует назначать людям пожилого возраста. У пациентов с почечной недостаточностью дозы аминогликозидов обязательно должны понижаться, что достигается либо уменьшением разовой дозы, либо увеличением интервалов между введениями. Поскольку токсичность аминогликозидов более зависима от продолжительности терапевтических уровней, чем от пиковых, а эффективность – более от концентрации, чем от времени, следует избегать частого приема доз. Предпочтительно назначение этих препаратов 1 раз в день внутривенно при большинстве заболеваний, кроме энтерококкового эндокардита. Внутривенный способ предполагает медленное (в течение 30‑45 мин) введение при дозировке 1 раз в день.
У пациентов с нормальной почечной функцией разовая доза для гентамицина или тобрамицина составляет 5 мг/кг (7 мг/кг, если пациенты находятся в критическом состоянии) каждые 24 ч, а для амикацина – 15 мг/кг каждые 24 ч. Если у пациентов присутствует клинический ответ на дозу гентамицина 7 мг/кг и почечная функция продолжает оставаться в норме, ежедневная доза может быть уменьшена до 5 мг/кг после первых нескольких дней лечения. У пациентов в критическом состоянии пиковые уровни сыворотки должны быть определены после первой дозы. У всех пациентов измеряют пиковые и пороговые уровни после второй или третьей дозы (когда ежедневная доза дробная) или когда терапия длится более 3 дней, а также после изменения дозы. Каждые 2‑3 дня измеряют уровень креатинина в сыворотке, и, если он устойчив, уровни аминогликозидов в сыворотке не следует измерять снова. Пиковая их концентрация – это уровень спустя 60 мин после внутримышечной инъекции или спустя 30 мин после 30-минутной внутривенной инфузии. Пороговые уровни измеряются за 30 мин до введения следующей дозы; желательно достичь пиковых уровней в сыворотке, по крайней мере в 10 раз превышающих максимальное потребление кислорода. Подбор дозы осуществляют с целью гарантированного достижения терапевтического пикового сывороточного уровня (для обеспечения зависимой от концентрации активности) и нетоксичных остаточных уровней. У пациентов в критическом состоянии, которым назначают более высокие начальные дозы, целевые пиковые уровни в сыворотке составляют 16‑24 мг/ мл для гентамицина и тобрамицина и 56‑64 мг/ мл для амикацина. Для гентамицина и тобрамицина остаточные уровни должны быть <1 мг/мл спустя 18‑24 ч после первой дозы при разовом назначении и в диапазоне 1‑2 мг/мл при разделенной ежедневной дозировке.
У пациентов с почечной недостаточностью ударная доза – та же самая, что и у пациентов с нормальной почечной функцией; обычно увеличивают интервал дозирования, а не снижают дозу.
Если пациенты получают большую дозу β-лактама (например, пиперациллин, тикарциллин) и аминогликозиды, высокие уровни β-лактама в сыворотке могут инактивировать последние, что доказано in vitro в образцах сыворотки, полученных для определения уровней препарата. Если пациенты с почечной недостаточностью принимают одновременно β-лактам в большой дозе и аминогликозид, уровень последнего в сыворотке может быть ниже, потому что взаимодействие в естественных условиях продлевается.
Терапевтические схемы, включающие ампициллин и гентамицин, имеют спектр антибактериального действия, аналогичный таковому для антибиотиков в сочетании с ингибиторами β-лактамазы (например, ампициллин/сульбактам). В рекомендациях Американской коллегии акушеров и гинекологов (ACOG, 2017) в качестве одного из основных антибиотиков предлагается препарат группы аминогликозидов гентамицин. Вместе с тем известно, что более чем полувековое использование аминогликозидов, часто необоснованное, привело к возникновению и распространению устойчивых к ним штаммов микроорганизмов. Так, согласно результатам исследования динамики антибиотикорезистентности (2014‑2015) основных возбудителей тяжелой интраабдоминальной инфекции (Бойко В. В. и соавт., 2016), у нозокомиальных штаммов Klebsiella spp. и E. coli выявлена высокая частота резистентности к гентамицину (75,2 и 53,9% соответственно).
Среди наиболее эффективных на сегодняшний день аминогликозидов 3-го поколения отдельного внимания заслуживает тобрамицин (браксон). Он подобен гентамицину, однако более активен в отношении большинства штаммов P. aeruginosa. Многие полирезистентные штаммы P. aeruginosa, в том числе устойчивые к гентамицину, сохраняют чувствительность к тобрамицину. Этот антибиотик имеет широкий спектр действия и особенно эффективен в отношении грамотрицательной флоры и S. aureus. При тяжелом течении инфекций и необходимости немедленного химиотерапевтического вмешательства тобрамицин в комбинации с β-лактамными антибиотиками можно назначать эмпирически. По мнению Р. А. Ткаченко (2017), в настоящее время наиболее адекватной комбинацией антибиотиков при терапии госпитальных инфекций является сочетание аминогликозида, карбапенема и линезолида (линелид). Такое сочетание препаратов может быть эффективным почти в 90% случаев. В группе аминогликозидов наиболее действенными являются тобрамицин и амикацин. По ширине спектра действия, степени эффективности в отношении грамотрицательной микрофлоры, золотистого стафилококка и других бактерий эти препараты сопоставимы.
Лекарственное взаимодействие
Аминогликозиды нельзя смешивать в одном шприце либо в одной инфузионной системе с β-лактамными антибиотиками или гепарином ввиду их физико-химической несовместимости. Они несовместимы с пенициллинами, цефалоспоринами, гепарином натрия, хлорамфениколом (выпадают в осадок). Нельзя назначать одновременно, а также в течение 2‑4 нед после терапии аминогликозидами ототоксичные (фуросемид, этакриновая кислота, полимиксины, гликопептиды, ацетилсалициловая кислота и др.) и нефротоксичные (метициллин, уреидо- и карбоксипенициллины, полимиксины, ванкомицин, цефалоспорины 1-го поколения, ацикловир, ганцикловир, амфотерицин В, препараты платины и золота, декстраны, индометацин и др.) средства. Миорелаксанты усиливают вероятность паралича дыхания. Индометацин, фенилбутазон и другие нестероидные противовоспалительные препараты, нарушающие почечный кровоток, могут замедлять выведение аминогликозидов из организма. При одновременном и/или последовательном применении двух и более аминогликозидов (неомицин, гентамицин, мономицин и тобрамицин, нетилмицин, амикацин) их антибактериальное действие ослабляется (конкуренция за один механизм «захвата» микробной клеткой), а токсические эффекты усиливаются. При одновременном применении со средствами для ингаляционного наркоза, в том числе с метоксифлураном, курареподобными препаратами, опиоидными анальгетиками, магния сульфатом и полимиксинами для парентерального введения, а также при переливании больших количеств крови с цитратными консервантами усиливается нервно-мышечная блокада.
Важно информировать пациентов, получающих аминогликозиды, о необходимости обращать внимание на любые изменения со стороны органов слуха, вестибулярного аппарата или мочевыводящей системы: появление шума или звона в ушах, головокружение, нарушение координации движений или неустойчивость, снижение слуха, значительное увеличение или уменьшение количества мочи, повышенная жажда.
Литература
- Майоров М. В., Жуперкова Е. А., Жученко С. И., Черняк О. Л. Вагинальный биоценоз. Современные представления о норме и патологии // Медицинские аспекты здоровья женщины. – 2017. – № 6 (111). – С. 1‑8.
- Майоров М. В., Жуперкова Е. А., Жученко С. И., Черняк О. Л. Воспалительные заболевания органов малого таза: роль комбинированной терапии // Медицинские аспекты здоровья женщины. – 2017. – № 2 (107). – С. 58‑64.
- Решедько Г.К., Хайкина Е. В. Группа аминогликозидов. Практическое руководство по антиинфекционной химиотерапии / Под ред. Л. С. Страчунского, Ю. Б. Белоусова, С. И. Козлова. – М., 2007. – С. 88‑94.
- Страчунский Л. С., Козлов С. Н. Современная антимикробная химиотерапия: Руководство для врачей. – М.: Боргес; 2002. Практическое руководство по антиинфекционной химиотерапии / Под ред. Л. C. Cтpaчунского, Ю. Б. Белоусова, С. Н. Козлова. – М., 2002. – 381 с.
- Ткаченко Р. А., Каминский В. В. Послеоперационные инфекции в акушерстве и гинекологии: профилактика, диагностика и лечение // Акушерство. Гинекология. Генетика. – 2017. – Том 3. – № 1. – С. 54‑65.
- Ткаченко Р. А. Проблема антибиотикорезистентности в акушерской практике и пути ее решения // Медичні аспекти здоров’я жінки. – № 3 (108). – 2017. – С. 30‑33.
- Трещинский А. И. Состояние лечения больных с инфекционными осложнениями в отделениях интенсивной терапии Украины // Біль, знеболювання та інтенсивна терапія. – 2001. – № 3 (16). – С. 50‑65.
- Фомина И. П. Современные аминогликозиды. Значение в инфекционной патологии и особенности действия // Русcкий медицинский журнал. – 1997; 5 (21): 1382‑139.
- Харченко Л. Н. Амикацин: эффективность применения в интенсивной терапии // Медицина невідкладних станів. – 2008. – № 4 (17).
- Яковлев С. В., Яковлев В. П. Современная антимикробная терапия в таблицах // Consilium medicum. – 2007. – № 1.
- Cone L. A. A survey of prospective, controlled clinical trials of gentamicin, tobramycin, amikacin, and netilmicin // Clin Ther. 1982; 5 (2): 155‑162.
- Gastmeier P. Nosocomial urinary tract infection: many unresolved questions // Clin. Microbiol. Infect., 2001. – Vol. 7. – P. 521‑523.
- Hammond J. M., Potgieter P. D., Hamslo D. et al. The etiology and antimicrobial susceptibility patterns of microorgamisms in acute community-acquired lung abscess // Chest. 1995; 108: 937‑941.
- Peterson D. L., Rice L. B. Empirical antibiotic choice for the seriously ill patient: are minimisation of selection of individual outcome mutually exclusive? // Din. Infect. Dis., 2003. – T. 36. – № 8. – P. 1006‑1012.
- Richards M., Thursky K. M., Buising K. Epidemiology, Prevalence and Sites of Infections in Intensive Care Units // Semin Respir Crit Care Med. 2003; 24: 3‑22.
- Siegenthaler W. E., Bonetti A., Luthy R. Aminoglycoside antibiotics in infectious diseases // Am J Med. 1986; 80: 2‑14.


