7 травня, 2020
Метастатичне ураження легень: клінічний випадок внутрішньопечінкової холангіокарциноми, асоційованої з цирозом та HBV- і HCV-інфекцією
 Рак є загальним терміном для великої групи захворювань і посідає друге місце серед основних причин смерті у світі. Так, у 2018 р. від цього захворювання померло 9,6 млн людей, найбільше – від раку легень (1,76 млн випадків), товстої та прямої кишки (862 тис), шлунка (783 тис), печінки (782 тис) та молочної залози (627 тис) [36]. До 25% випадків раку в країнах із низьким і середнім доходом зумовлено вірусом гепатиту та вірусом папіломи людини (ВПЛ) [21]. Канцерогенні інфекції, зокрема Helicobacter pylori, ВПЛ, вірус гепатиту B (Hepatitis B virus – HBV), вірус гепатиту C (Hepatitis C virus – HCV) і вірус Епштейна–Барр (EBV) були названі причиною 15% випадків раку, діагностованих у 2012 р. [21].
Рак є загальним терміном для великої групи захворювань і посідає друге місце серед основних причин смерті у світі. Так, у 2018 р. від цього захворювання померло 9,6 млн людей, найбільше – від раку легень (1,76 млн випадків), товстої та прямої кишки (862 тис), шлунка (783 тис), печінки (782 тис) та молочної залози (627 тис) [36]. До 25% випадків раку в країнах із низьким і середнім доходом зумовлено вірусом гепатиту та вірусом папіломи людини (ВПЛ) [21]. Канцерогенні інфекції, зокрема Helicobacter pylori, ВПЛ, вірус гепатиту B (Hepatitis B virus – HBV), вірус гепатиту C (Hepatitis C virus – HCV) і вірус Епштейна–Барр (EBV) були названі причиною 15% випадків раку, діагностованих у 2012 р. [21].
Рак виникає внаслідок перетворення нормальних клітин на пухлинні в ході багатоступеневого процесу, який зазвичай прогресує від передракового ураження до злоякісної пухлини. Однією з визначальних особливостей раку є швидке утворення аномальних клітин, які виростають і можуть поширитися на сусідні частини тіла та інші органи; останній процес називають метастазуванням [7, 36].
Метастатичне ураження легень
Грудна клітка – поширене місце метастазування різних видів раку з ураженням лімфатичних вузлів, кісток, легень, плеври, м’язів, серця та перикарду, проте іноді важко відрізнити первинний рак легень від метастазів інших пухлин [7]. Метастази в легені виникають у 20-30% випадків усіх злоякісних новоутворень і зазвичай зумовлені гематогенним поширенням пухлинних клітин, рідше – лімфогенним метастазуванням (карцинома шлунка, рак підшлункової та молочної залози), та спочатку можуть не спричинювати симптомів [35]. Метастазування в легені є летальною детермінантою при багатьох ракових захворюваннях [9] та основною причиною смерті хворих на рак [18].
Різні типи пухлин метастазують із різною частотою (табл. 1). Класифікація метастатичних уражень базується на характері їхнього росту. Візуалізація за допомогою рентгенологічного обстеження грудної клітки виявляє наступні зміни: міліарне ураження, ізольовані (солітарні) легеневі вузли, крупні вузлові утворення, легеневий карциноматозний лімфангіїт, пневмонічна та перибронхіальна картина, метастатичне ураження плеври, карциноматоз плеври, ендобронхіальне поширення [35].
Ендобронхіальні метастази є нечастою ознакою за винятком первинних пухлин голови та шиї, молочної залози та нирок (табл. 2) [7].
Незважаючи на достатньо вивчену проблему метастатичного ураження при різних типах пухлин, метастази в легені внаслідок раку жовчовивідних шляхів є вкрай рідкісними, а особливості та прогноз для пацієнта – недостатньо відомі [12], також мало повідомлень про легеневі метастази від холангіокарциноми (ХК) [31]. За даними одного з досліджень (n=981), найпоширенішим місцем метастазів унаслідок ХК була печінка (57,9), далі – легені, кістки та мозок [33]. В одному з інших досліджень у пацієнтів, яким провели хірургічну резекцію ХК (n=681), було показано, що 407 пацієнтів зазнали рецидиву захворювання, у 46 (11,3%) з яких розвинулися легеневі метастази. З цих 46 пацієнтів перенесли резекцію легень 9, в інших 37 резекцію не проводили. Виживаність після операції при первинному раку та після рецидиву була значно кращою в першій групі, ніж у другій (після первинного раку: 66,7% проти 0% за 5 років, р<0,001; після рецидиву: 40,0% проти 8,7% за 3 роки, р=0,003) [31].
Епідеміологія внутрішньопечінкової ХК
Внутрішньопечінкова ХК (ВХК) є доволі рідкісною онкологічною патологією жовчних протоків, частота якої становить приблизно 3% від усіх випадків злоякісних новоутворень травного тракту, 8-10% – ХК і 10-20% – усіх первинних пухлин печінки [23].
Анатомічно можна виділити внутрішньопечінкові, перигілярні та дистальні типи, що відрізняються не лише своїм розташуванням, а й етіологією, походженням, патогенезом і лікуванням [2, 23].
Нещодавно запропонована класифікація ХК поділила ці пухлини на звичайні, жовчно-протокові, внутрішньопротокові новоутворення та рідкісні варіанти (комбінована гепатоцелюлярна ХК, недиференційована ХК, плоскоклітинний/аденосквамозний тип). Загальноприйнятий поділ ХК розглядає малий протоковий, або периферійний, і великий протоковий, або перигілярний, тип [23].
Відповідно до критеріїв класифікації Всесвітньої організації охорони здоров’я (ВООЗ) ХК можуть бути аденокарциномами або муцинозними карциномами. Проведені дослідження показали, що трансформовані гепатоцити, гепатобласти можуть спричинити широкий спектр пухлин печінки, починаючи від ХК до гепатоцелюлярної карциноми (ГЦК). Отримані дані свідчать, що не лише холангіоцити, а й інші типи клітин трансформуються у ХК [23]. З незрозумілих причин в останні десятиліття спостерігається зростання захворюваності на ВХК у Північній Америці, Європі, Азії, Японії та Австралії [19]. Захворюваність на ВХК у США за останні 30 років зросла на 165% і становить 0,95 випадку на 100 тис населення [3, 8]. Ризик захворюваності зростає з віком. Середній вік діагнозу ВХК становить 50-65 років і є рідкісним у хворих до 40 років, за винятком пацієнтів із первинним склерозуючим холангітом (СХ) [6, 23].
У світі зазначається великаа різниця в захворюваності на ВХК із переважанням її в країнах Східної Азії порівняно з розвинутими країнами. Показник коливається в широких межах – від 113 випадків на 100 тис осіб у Таїланді до 0,1 випадку на 100 тис в Австралії [8, 23]. Така географічна специфічність поширення ВХК може бути зумовлена як факторами ризику цієї патології, так і певною генетичною схильністю до захворювання. У Сполучених Штатах латиноамериканці та азіати мають найвищий рівень захворюваності (2,8 та 3,3 випадку на 100 тис населення відповідно), тоді як афроамериканці – найнижчий (2,1 випадку на 100 тис населення). Афроамериканці також мають нижчу смертність порівняно з білими (1,4 випадку проти 1,7 на 100 тис населення) [23].
Патологія виникає частіше в жінок; за іншими даними, чоловіки мають дещо вищу захворюваність і смертність від цього виду раку, ніж жінки [23]. Смертність, зумовлена ВХК, становить до 20% від усіх летальних випадків, пов’язаних зі злоякісними новоутвореннями гепатобіліарної зони [23].
Фактори ризику розвитку ВХК
Підтвердженими факторами ризику виникнення ВХК є вплив хімічних речовин, таких як торотраст, азбест і радон. Нещодавно ВООЗ віднесла речовини 1,2-дихлорпропану (1,2-DCP) і дихлорметану (DCM), що їх використовували в поліграфії, до канцерогенів, які, імовірно, можуть спричинювати ХК [8]. Куріння, уживання алкоголю асоціюються з підвищеним ризиком виникнення ВХК, хоча доказової бази бракує [23]. Хронічні ураження паразитами Opisthorchis viverrini та Clonorchis sinensis також асоціюють із виникненням ВХК у 8-10% пацієнтів. Жовчно-кам’яна хвороба, вроджена патологія біліарної системи (хвороба Каролі та фіброзно-кістозна хвороба печінки) є факторами ризику ВХК у 15% хворих старшого віку. Первинний склерозуючий холангіт у 5-10% пацієнтів є причиною виникнення ВХК у найближчі роки з моменту встановлення діагнозу [8].
Нещодавні дослідження в Європі та Азії показали, що цироз, HBV- та HCV-інфекція були основними факторами ризику виникнення ВХК [2, 8, 11, 22, 23, 26, 27, 34]. В японському дослідженні ВХК розвинулась у 2,3% пацієнтів із цирозом та HCV, що було вище, ніж у контрольній групі [14]. Корейськими вченими виявлено зв’язок між HBV та ВХК; встановлено, що цироз є важливим фактором ризику розвитку пухлини. Італійське дослідження також продемонструвало зв’язок між вірусними гепатитами та ВХК. У хворих на ВХК виявляли HСV та HВV у 23,1% та 11,5% відповідно порівняно з 6,1% та 5,5% у контрольній групі [6].
У дослідженні, проведеному в США, виявлено нуклеїнові кислоти HCV або HBV у 27% зразках ВХК, що підтверджує зв’язок цих вірусів із канцерогенезом [20]. Водночас американськими дослідниками продемонстровано вищий ризик ВХК у пацієнтів із HCV-інфекцією, ніж з HBV-інфекцією [29]. Проте в більшості китайських досліджень зазначається саме роль HBV у виникненні ВХК [11, 17, 27, 34].
Також було зауважено, що виявлення HBV, на відміну від HCV-інфекції, може свідчити про більш сприятливий прогноз із меншою швидкістю метастазування в лімфатичні вузли в пацієнтів із ВХК [6, 27]. Пацієнти з HBV-асоційованою ВХК мали значно кращу виживаність, ніж пацієнти без хронічної HBV-інфекції.
Клініко-патологічні особливості захворювання в цієї групи хворих значно відрізняються від таких у пацієнтів з ВХК без HBV. Пухлини, асоційовані з HBV, характеризуються масоутворюючим ростом і мають сприятливіший прогноз [30]. Зараження HBV-інфекцією корелює з молодшим віком пацієнтів, високими рівнями аспартатамінотрансферази (АсАТ) в сироватці крові та альфа-фетопротеїну (АФП), нижчим рівнем сироваткового вуглеводного антигену 19-9 (СА19-9), ніж у хворих без HBV-інфекції. Більше того, високий рівень вірусемії HBV сприяв агресивнішому перебігу ВХК [26, 28, 30, 32]. Проте в одному з досліджень зазначено, що виживаність пацієнтів із ВХК з HBsAg і без нього не залежала від серології HBV [1]. Пацієнти з HBsAg-/HBcAb+ також мали ризик її виникнення [34]. Інтегративна форма HBV була виявлена в 40% зразків пухлинної тканини і включала HBx та HBV-генетичні послідовності генів. Отримані результати свідчать про розвиток ВХК навіть у випадках з окультною інфекцією [22].
Клінічні прояви ВХК
Як уже зазначалось, клінічні ознаки ХК залежать від локалізації пухлини. Характерним є тривалий безсимптомний перебіг хвороби. На момент встановлення діагнозу у 85,7% хворих вже є метастатичне ураження печінки й лімфатичних вузлів. Характерними скаргами при ВХК є неспецифічні симптоми, такі як біль у животі, кахексія, нездужання, стомлюваність і нічна пітливість. Надалі виникають свербіж шкіри, жовтяниця, гарячка, асцит.
Діагностика
Методи візуалізації, у тому числі комп’ютерна томографія високої роздільної здатності (КТВРЗ) та магнітно-резонансна томографія (МРТ), значуще допомагають у проведенні діагностики. Обидва методи мають аналогічну ефективність в оцінці розмірів пухлини та виявленні супутніх уражень, однак КТВРЗ може бути кращою для виявлення позапечінкових метастазів, ураження судин і визначення можливості проведення резекції печінки. Використання контрасту покращує чутливість МРТ для виявлення ВХК, оскільки ці пухлини зазвичай характеризуються прогресивним поглинанням контрастної речовини під час венозної фази.
Визначення онкомаркера СА19-9 у сироватці крові може допомогти в діагностиці, але його чутливість при ВХК становить лише 62% і специфічність – 63%. Рівень СА19-9 ≥1000 ОД/мл пов’язують із метастазуванням ВХК, тому цей аналіз може бути використаний і для визначення прогресування захворювання [5, 10, 23]. У пацієнтів з HBV-асоційованою ВХК, як правило, зазначають нижчий рівень CA19-9 [17]. Підвищення рівня АФП у сироватці крові спостерігали приблизно у 20% пацієнтів із ВХК, і частіше на тлі інфікування HBV. Однак рівень АФП у сироватці крові >10 000 нг/мл було зазначено лише в кількох пацієнтів із ВХК [17, 26]. При багатовимірному аналізі було встановлено, що рівень АФП ∼ 20 нг/мл, разом із чоловічою статтю, Т-стадією, множинними пухлинами, пов’язаний із поганим прогностичним перебігом ВХК [4, 10].
Для остаточного діагнозу ВХК необхідне проведення біопсії печінки з наступним гістологічним дослідженням [23].
Лікування
Терапією вибору при ВХК є хірургічна резекція, після якої середній термін життя без захворювання становить 26 місяців. Приблизно 60% пацієнтів виживають протягом 5 років після резекції. Частота рецидивів сягає 60-65% [23]. Збільшення частоти ускладнень і зниження виживаності після резекції печінки в пацієнтів із ВХК пов’язують і з реактивацією HBV. Антивірусна терапія перед резекцією печінки зменшувала ризик післяопераційної реактивації вірусу [16]. Водночас терапія аналогами нуклеозидів (t) хронічної HBV-інфекції значною мірою пов’язана зі зниженням ризику виникнення ВХК [15].
Дані щодо трансплантації печінки при ВХК є суперечливими, оскільки рецидиви зазначали в 70% пацієнтів упродовж 5 років після трансплантації, а середній час виживання без хвороби становив 8 міс [23]. Локальна терапія, зокрема трансартеріальна хіміоемболізація та радіочастотна абляція, викликає інтерес як варіант терапії для пацієнтів із неоперабельною ВХК. У запущеній стадії методом лікування є системна хіміотерапія [23].
Клінічний випадок
Пацієнтка В., 1996 р. н., інвалід із дитинства ІІІ групи внаслідок аварії на Чорнобильській АЕС, поступила в приймальне відділення Волинської обласної клінічної лікарні (ВОКЛ) зі скаргами на кашель, виділення харкотиння з домішками крові, задишку, біль у грудній клітці, виражену загальну слабкість.
З анамнезу захворювання відомо, що хвора з 10.02.2019 р. лікувалась у центральній районній лікарні зі скаргами на підвищення температури тіла до 37,7°С, задишку в спокої, сухий кашель. Після погіршення стану хворої 18.02.2019 р. скерована до ВОКЛ. Пацієнтка з 2007 р. перебуває на обліку в педіатра та дитячого гастроентеролога з приводу захворювання печінки «криптогенний гепатит». Тривалий час отримувала пероральні глюкокортикостероїди. У 2009 р. був встановлений діагноз «Цироз печінки». Щорічно проходила курси стаціонарного лікування в гастроентерологічному відділенні ВОКЛ.
Беручи до уваги результати комплексного обстеження, був встановлений діагноз: «Криптогенний цироз печінки, клінічна стадія В (за Чайлдом–Пью) з портальною гіпертензією ІІ ступеня, варикозним розширенням вен стравоходу І ступеня, гепатолієнальним синдромом з гіперспленізмом (анемія, лейкопенія, тромбоцитопенія), гепатоцелюлярною недостатністю ІІ ступеня, хронічним панкреатитом з рецидивним перебігом, диспептично-больовою формою в стадії загострення з порушенням екскреторної функції підшлункової залози, зниження живлення І ступеня».
Об’єктивне обстеження
Загальний стан хворої при поступленні тяжкий унаслідок інтоксикаційного синдрому, дихальної недостатності, симптомів гіперспленізму. Вага під час госпіталізації 58 кг, зріст 170 см, індекс маси тіла 20,1. Свідомість ясна. Спостерігалася блідість шкіри обличчя з жовтушним відтінком. Грудна клітка правильної форми, під час перкусії в нижніх відділах легень зазначалося притуплення легеневого звуку. Дихання при аускультації везикулярне, ослаблене в задньо-нижніх відділах, супроводжується поодинокими інспіраторними хрипами, переважно справа. Частота дихання – 32 за 1 хв, SpO2 при диханні кімнатним повітрям становила 86%, 94% – на тлі інсуфляції зволоженого кисню. Тони серця ритмічні, частота серцевих скорочень – 115 за 1 хв, артеріальний тиск 135/70 мм рт. ст. Живіт правильної форми, не болючий при поверхневій пальпації. Печінка збільшена, виступає з-під реберної дуги на 4 см. Селезінка виступає на 3 см. Щитоподібна залоза, суглоби не змінені.
Результати лабораторних та інструментальних досліджень
Загальний аналіз крові: гемоглобін – 87 г/л, еритроцити – 3,0×1012/л, КП – 0,87, гематокрит – 0,3, лейкоцити – 12,7×109/л, тромбоцити – 64×109/л, гранулоцити – 64%, сегментоядерні – 90%, лімфоцити – 4%, моноцити – 5%, ШОЕ – 20 мм/год. Гіпохромія, анізопойкілоцитоз, токсична зернистість лейкоцитів.
Біохімічне дослідження крові (при поступленні): АлАТ – 360,3 МО/л, АсАТ – 235,9 МО/л, ГГТ – 323, лужна фосфатаза – 158, загальний білірубін – 178,4 мкмоль/л, прямий білірубін – 138,5 мкмоль/л, загальний білок – 57,1 г/л, альбумін – 28,2 г/л, креатинін – 74 ммоль/л, сечовина – 87 ммоль/л. Електроліти: кальцій – 1,3 ммоль/л, натрій – 134 ммоль/л, калій – 6,1 ммоль/л. Глюкоза крові натще – 6,09 ммоль/л, при багаторазовому визначенні показники коливалися в діапазоні 7,6-12,7 ммоль/л, глікований гемоглобін – 4,5%, 6,09%.
Коагулограма (03.03.2019): протромбіновий індекс – 40%, міжнародне нормалізоване відношення (МНВ) – 2,92, АЧТЧ (активований частковий тромбіновий час) – 210, фібриноген – 1,13 г/л.
Загальний аналіз сечі: простежувалася прогресуюча протеїнурія на мінімальному рівні (0,079-0,133 г/л).
Імунологічні обстеження: HBsAg – позитивний результат, анти-Hbcor (сумарні) – позитивний результат, анти-HBe – позитивний результат, анти-HCV (сумарні антитіла) – позитивний результат.
ПЛР-дослідження крові: ДНК HBV не виявлена, РНК HCV не виявлена, експрес-тест на ВІЛ 1/2 – негативний результат.
Антинуклеарні антитіла (АНА) <1:100, антимітохондріальні антитіла (АМА) <1:100, антитіла сумарні до мікросом печінки та нирок <1:100, антитіла IgG до мікросом печінки та нирок <2 од/мл, антитіла до гладенької мускулатури <1:100, антитіла до розчинного антигену печінки <0,024, антитіла IgG до цитозольного антигену печінки типу 1 – 0,11; рівень у сироватці загального IgM – 5,08 г/л, IgG – 12,04 г/л (норма 7,0-16,0 г/л), IgE – 69,06 (норма до 100 г/л), С3-компонент комплементу – 0,47 г/л (норма 0,9-1,8 г/л), С4-2-компонент комплементу – 0,1 г/л (норма 0,1-0,4 г/л), АФП крові 1,57 г/л (норма до 7,0 г/л), α2-макроглобулін – 1,57 г/л, гаптоглобін <0,001 г/л, аполіпопротеїн А‑1 – 0,83 г/л.
Імунограма: Т-лімфоцити (CD3+CD19) – 68,9% (норма 54-89%), Т-хелпери/Т-індуктори (CD4+CD8) – 40% (норма 26-58%), Т-супресори/Т-цитотоксичні клітини (CD4, CD8+) – 19,1% (норма 21-35%), імунорегуляторний індекс – 2,1 (норма 1,2-2,3), цитотоксичні клітини (CD3+CD56+) – 7,4% (норма 3-8%), NK-клітини (CD3-, CD56+) – 4,6% (норма 5-15%), В-лімфоцити (CD3, CD19+) – 20,2% (норма 5-14%), моноцити/макрофаги (CD14) – 10,1% (норма 6-13%), загальний лейкоцитарний антиген (CD45) – 99,4% (норма 95-100%), циркулюючі імунні комплекси (середні) – 92 (норма 60-90), циркулюючі імунні комплекси (дрібні) – 169 (норма 130-160).
Аналіз мокротиння від 21.02.2019 р.: запах відсутній, колір сірий із домішками крові, лейкоцити – 8-30 у полі зору, еритроцити – на все поле зору, місцями епітелій – значна кількість, альвеолярні клітини – поодинокі, кислотостійки паличкі (КСП) не виявлені. Результати від 25.02.2019 р.: колір сірий, в’язкий слиз без крові, лейкоцити – 2-4 в полі зору (у слизу 12-150 у полі зору), епітелій плоский – значна кількість, виявлені КСП (?), грибкова флора в значній кількості.
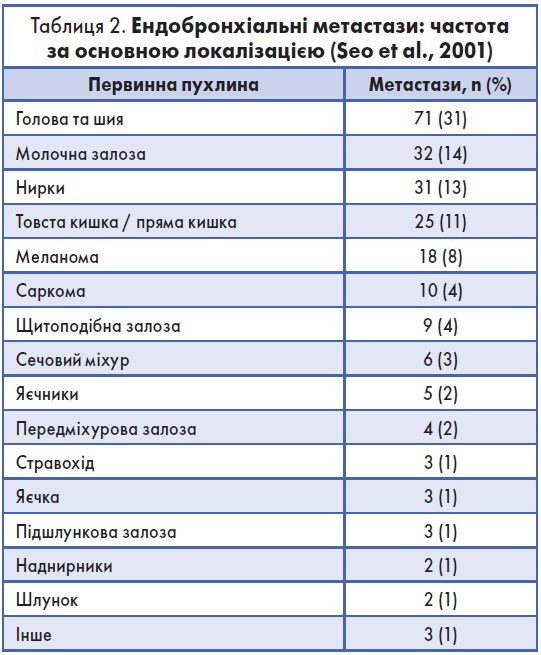
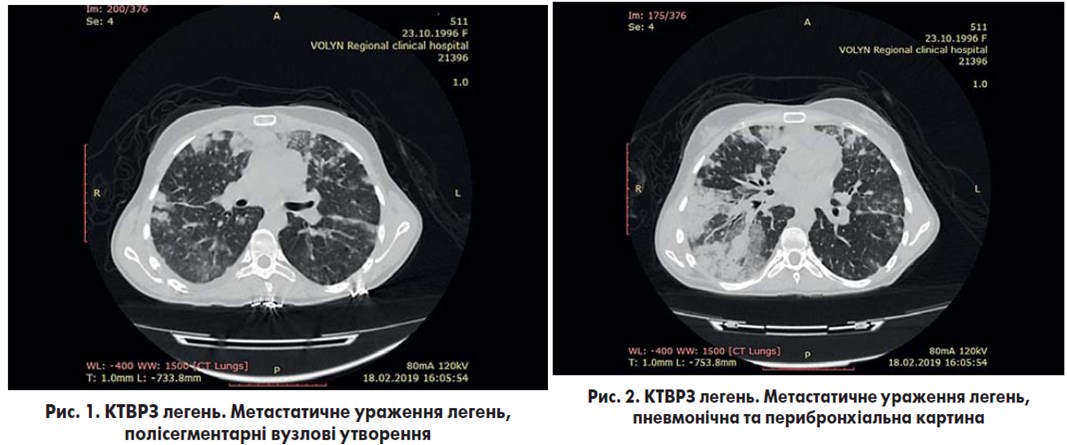
КТВРЗ грудної клітки (рис. 1, 2): в обох легенях виявлені множинні вогнища неоднорідної інфільтративної щільності зливного характеру, розміщені в периферійних відділах і ділянці легеневого поля з тотальним ураженням нижньої частки справа (окрім частини сегмента S6), у проекції сегмента S5 середньої частки паракардіально – м’яко-тканинне вогнище розміром 25×44 мм; патологічних змін у плевральних порожнинах немає.
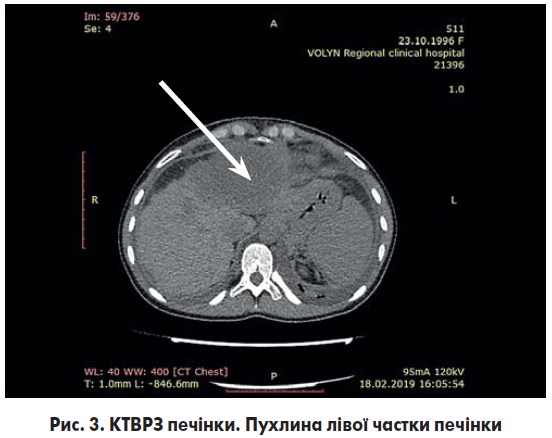
КТВРЗ черевної порожнини (рис. 3): у печінці – об’ємне додаткове патологічне ураження лівої частки розміром 64×75 мм.
Фібробронхоскопію не проводили в зв’язку з тяжкою дихальною недостатністю.
Фіброезофагодуоденоскопія (архівні дані): у нижній третині стравоходу поодинокі варикозно розширені вени синюшнього кольору до 3 мм у діаметрі, слизова над ними не змінена.
Ультразвукове дослідження органів черевної порожнини: печінка збільшена за рахунок лівої частки, печінковий край закруглений, контур нерівний, грубо горбистий; у лівій частці візуалізовано утворення неправильної форми розміром 88×73 мм, ехогенність знижена; ворітна вена діаметром 14 мм, у проекції воріт печінки та очеревини – множинні варикси; вільної рідини в черевній порожнині не виявлено; жовчний міхур не збільшений; селезінка збільшена, довжиною 16,8 мм, у проекції воріт візуалізовані множинні варикси.
19.02.2019 р. проведено пункційну біопсію утвору лівої частки печінки. Патогістологічне заключення прижиттєвої пункційної біопсії печінки: у біоптаті переважно поля некротичної тканини (можливо, пухлинної), в одній із ділянок виявлено життєздатну тканину – низькодиференційована (G3) скірозна аденокарцинома (холангіокарцинома).
На період тяжкого стану пацієнтка знаходилася на лікуванні у відділенні анестезіології та інтенсивної терапії № 1 ВОКЛ; 20.02.2019 р. була переведена до пульмонологічного відділення ВОКЛ. У клінічній картині зазначалися загальна слабкість, задишка при мінімальному фізичному навантаженні, кашель із виділенням мокротиння, яке періодично мало геморагічний характер. Від 26.02.2019 р. спостерігалося поступове погіршення загального стану до тяжкого, наростали ознаки респіраторної недостатності та біль у грудях і животі.
Отримане лікування: постійна киснева терапія через носовий катетер, антибактеріальна терапія (меропенем, цефоперазон/сульбактам, бісептол), ітраконазол, стоматидин, пантопразол, дексаметазон, етамзилат, фуросемід, верошпірон, лактулоза, налбуфін та інфузії альбуміну. Незважаючи на проведену терапію, на тлі наростання проявів респіраторної недостатності пацієнтка померла, після чого було проведено патологоанатомічне дослідження.
Консиліумом лікарів у складі пульмонолога, фтизіатра, інфекціоніста, гастроентеролога, торакального хірурга, онколога був встановлений заключний діагноз: «Аденокарцинома лівої частки печінки (холангіокарцинома?) T2NXM1, G3, ст. 4. Цироз печінки, клінічна стадія В (за Чайлдом-П’ю) з портальною гіпертензією 2 ступеня, варикозним розширенням вен стравоходу І ст. Хронічний вірусний гепатит В + С. Позагоспітальна двобічна полісегментарна пневмонія, група ІV, тяжкий перебіг. Метастатичне ураження легень? Дихальна недостатність ІІ ст. Ракова інтоксикація. Набутий імунодефіцит (ятрогенний?). Вторинна анемія. Тромбоцитопенія».
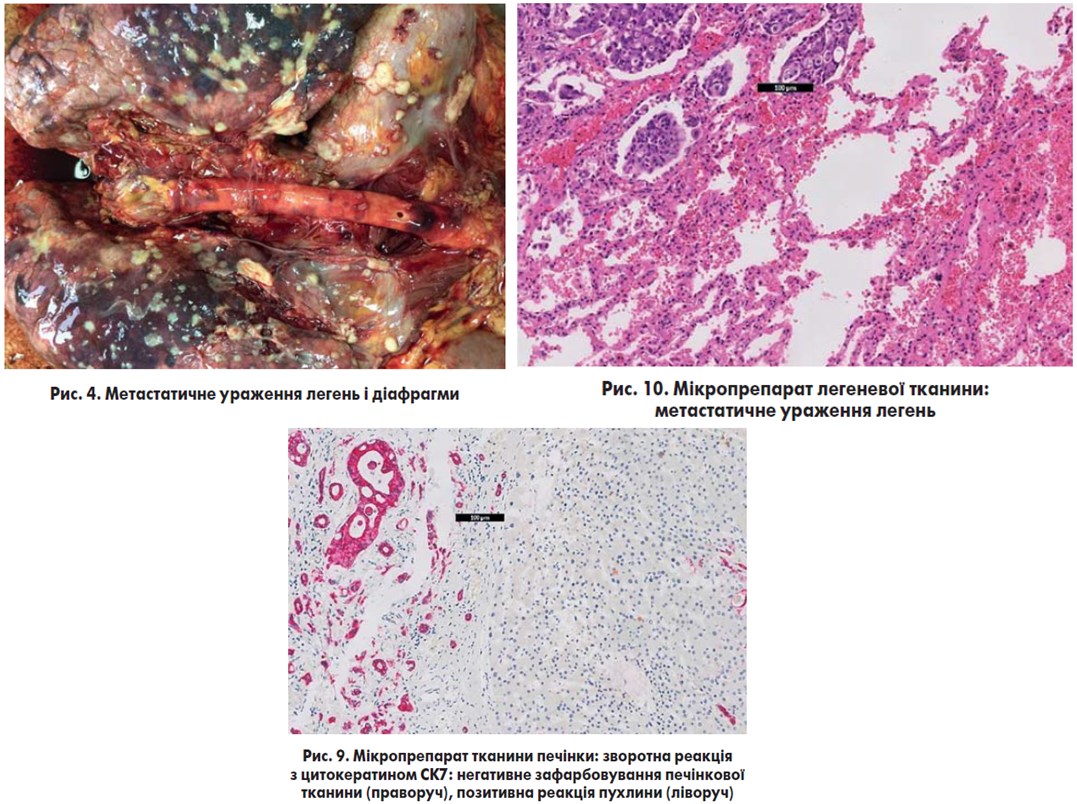
Патологоанатомічний діагноз: «Рак печінки (гістологічно холангіокарцинома) з реактивним гепатитом і переходом у цироз печінки (рис. 5-9), ускладнений раковою інтоксикацією з метастазами в парієтальну плевру, легені та діафрагму (рис. 4, 10), перикард, ворота печінки та селезінки; асцит; хронічний ерозивний дуоденіт».
Даний клінічний випадок ілюструє складність ранньої діагностики ХК та запізню діагностику HBV- та HCV-інфекцій. Клінічні прояви пухлини цієї локалізації неспецифічні, а найчастішими ранніми симптомами, коли ще можливе радикальне хірургічне втручання, є схуднення, нездужання, втома, нічна пітливость, а основним синдромом – больовий і жовтяниця. Під час нашого клінічного спостереження в пацієнтки жовтяниця була слабко виражена, у клінічній маніфестації на момент поступлення до ВОКЛ переважали неспецифічні симптоми пухлинної прогресії з метастатичним ураженням легень та інших органів на термінальній стадії захворювання на тлі імуносупресії та тяжкої анемії з тромбоцитопенією.
Висновки
Своєчасне застосування діагностичних методів діагностики (КТВРЗ, МРТ-холангіопанкреатикографія з контрастуванням, біопсія печінки, обстеження на HBV- та HCV-інфекцію) за наявності діагнозів «криптогенний гепатит» і «криптогенний цироз» дали б змогу своєчасно встановити пацієнтці точний діагноз і покращити прогноз захворювання. Окрім того, у разі підозри на метастатичне ураження легень необхідно проводити диференційну діагностику з онкологічною патологією, дифузними захворюваннями паренхіми легень (ДЗПЛ), інфекцією, легеневою емболією, лімфопроліферативною патологією за допомогою КТВРЗ грудної клітки, позитронної емісійної томографії (РЕТ/СТ) та інших методів діагностики [7, 24, 37]. У тих випадках, коли потрібне гістологічне підтвердження діагнозу (онкологічна патологія, ДЗПЛ), проводиться трансторакальна біопсія легень та плеври, а біопсія легень шляхом бронхоскопії з трансбронхіальною біопсією є процедурою вибору [38].
Література
- Ahn CS, Hwang S, Lee YJ, Kim KH, Moon DB, Ha TY, Song GW, Lee SG. Prognostic impact of hepatitis B virus infection in patients with intrahepatic cholangiocarcinoma. ANZ J Surg. 2018 Mar;88(3):212–217. doi: 10.1111/ans.13753. Epub 2016 Sep 6. PMID: 27598539.
- Aishima S, Kuroda Y, Nishihara Y, Iguchi T, Taguchi K, Taketomi A, Maehara Y, Tsuneyoshi M. Proposal of progression model for intrahepatic cholangiocarcinoma: clinicopathologic differences between hilar type and peripheral type. Am J Surg Pathol. 2007 Jul;31(7):1059–67. PMID:17592273.
- Boris Blechacz. Cholangiocarcinoma: Current Knowledge and New Developments. Gut Liver. 2017 Jan;11(1):13–26. Published online 2016 Dec 8. doi: 10.5009/gnl15568. PMID: 27928095.
- Chi CT, Chau GY, Lee RC, Chen YY, Lei HJ, Hou MC, Chao Y, Huang YH. Radiological features and outcomes of combined hepatocellular-cholangiocarcinoma in patients undergoing surgical resection. J Formos Med Assoc. 2019 March 12. doi: S0929–6646 (18) 30861–1. doi: 10.1016 / j.jfma.2019.02.012. PMID: 30876788.
- Chu KJ, Lu CD, Dong H, Fu XH, Zhang HW, Yao XP. Hepatitis B virus-related combined hepatocellular-cholangiocarcinoma: clinicopathological and prognostic analysis of 390 cases. Eur J Gastroenterol Hepatol. 2014 Feb;26(2):192–9. doi: 10.1097/MEG.0b013e3283625df9. PMID: 24370644.
- Donato F, Gelatti U, Tagger A, Favret M, Ribero ML, Callea F, Martelli C, Savio A, Trevisi P, Nardi G. Intrahepatic cholangiocarcinoma and hepatitis C and B virus infection, alcohol intake, and hepatolithiasis: a case-control study in Italy. Cancer Causes Control. 2001 Dec;12(10):959–64. PMID: 11808716.
- ERS handbook. Respiratory Medicine/2nd Edition. 2013.
- Gupta A, Dixon E. Epidemiology and risk factors: intrahepatic cholangiocarcinoma. HepatoBiliary Surg Nutr 2017;6(2):101–104. doi: 10.21037/hbsn.2017.01.02 http://dx.doi.org/10.21037/hbsn.2017.01.02. PMID: 28503557.
- Headley MB et al. Visualization of immediate immune responses to pioneer metastatic cells in the lung. Nature. 2016 Mar 24;531(7595):513–7. doi: 10.1038/nature16985. Epub 2016 Mar 16.
Повний список літератури, що включає 38 джерел, знаходиться в редакції.
Клінічна імунологія. Алергологія. Інфектологія, № 8 (121), 2019 р.