2 жовтня, 2015
Биологические маркеры в диагностике, прогнозировании и оценке эффективности терапии сердечной недостаточности с сохраненной и сниженной контрактильной функцией

Хроническая сердечная недостаточность (ХСН) сохраняет свое значение как потенциально фатальная стадия любого кардиоваскулярного заболевания, демонстрируя устойчивый рост частоты в общей популяции, что сопровождается прогрессивным увеличением экономических затрат системы здравоохранения в отношении улучшения клинического статуса пациентов, повышения качества их жизни, снижения риска смерти [48, 53].
В исследованиях последних лет показано существенное снижение вероятности 5-летней выживаемости у пациентов с ХСН по сравнению с лицами без таковой независимо от этиологической причины, непосредственно вызвавшей возникновение дисфункции миокарда [12, 66]. К сожалению, современные методы лечения ХСН пока не в состоянии обеспечить снижение уровня смертности таких больных до популяционного порога независимо от возраста пациентов и этиологической природы заболевания [57, 78]. В данном контексте ранняя диагностика ХСН, адекватная оценка кардиоваскулярного риска, выбор стратегии лечения рассматриваются как основные детерминанты повышения выживаемости и качества жизни больных с ХСН. При этом роль биологических маркеров для пациентов с различными фенотипами ХСН недостаточно точно определена.
Настоящий обзор посвящен обсуждению роли биологических маркеров в оценке эволюции, патофизиологических и прогностических различий ХСН с сохраненной и сниженной фракцией выброса левого желудочка (ФВ ЛЖ).
Определение фенотипов ХСН
Хроническая сердечная недостаточность определяется как синдром, развивающийся в результате возникновения и прогрессирования различных заболеваний, включая кардиоваскулярные, приводящих к неспособности сердца обеспечить системный кровоток, адекватный метаболическим потребностям организма, что сопровождается внутрисердечными и периферическими гемодинамическими сдвигами, кардиоваскулярным ремоделированием и нарушениями нейрогуморальной регуляции кровообращения [49, 79].
К настоящему времени сложилось довольно устойчивое представление о существовании фенотипических особенностей ХСН, отражающихся в формировании дисфункции миокарда со сниженной или сохраненной ФВ ЛЖ [1]. Оба фенотипа ХСН значительно отличаются не только по этиологии, патогенезу, отчасти клиническим проявлениям, но и по причинам наступления неблагоприятных клинических исходов и общей продолжительности жизни пациентов [2, 3].
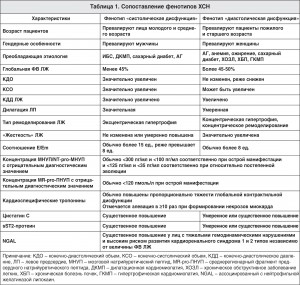
Результаты предшествующих обсервационных, популяционных и клинических исследований свидетельствовали о том, что ХСН со сниженной ФВ ЛЖ чаще встречается у пациентов с ишемической болезнью сердца (ИБС) после перенесенного инфаркта миокарда (около 2/3 всех больных), пациентов с кардиомиопатиями с дилатационным фенотипом (табл. 1).
Напротив, у лиц с эссенциальной и симптоматической артериальной гипертензией (АГ), ожирением, сахарным диабетом 2 типа, а также легочной АГ (ЛАГ) частота встречаемости ХСН со сниженной ФВ ЛЖ существенно меньше [44, 48, 49, 59, 79]. При этом около половины всех пациентов с ХСН имеют сохраненную ФВ ЛЖ, несмотря на наличие клинических признаков дисфункции миокарда [42].
Интересно, что этот фенотип ХСН превалирует в женской популяции, у лиц пожилого возраста, пациентов с АГ, анемией, ожирением, ХБП, сахарным диабетом 2 типа, ХОЗЛ [4]. Большинство экспертов, отмечая коморбидность в качестве одного из факторов, способствующих формированию различных фенотипов ХСН, придерживаются сдержанной позиции в отношении непосредственной роли экстракардиальных факторов в патоморфозе дисфункции миокарда и ее клинической эволюции. Это объясняется отсутствием существенных различий в частоте встречаемости большинства коморбидных состояний между обоими фенотипами ХСН [29].
С другой стороны, необходимость распределения пациентов с ХСН в когорты в зависимости от величины ФВ ЛЖ объясняется существованием серьезных различий в ожидаемой 5-летней выживаемости и риске повторных госпитализаций [28, 65]. Несмотря на то что оба фенотипа ХСН, ассоциированные с различной величиной ФВ ЛЖ, характеризуются неблагоприятным прогнозом, установлено, что риск наступления летального исхода для больных со сниженной ФВ ЛЖ по сравнению с пациентами с сохраненной ФВ ЛЖ значительно выше [5, 9, 51].
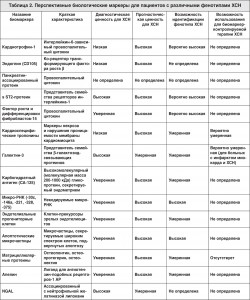
Заслуживает внимания тот факт, что клиническая оценка тяжести ХСН, основанная на верификации функционального класса (ФК) по классификации NYHA, часто не ассоциируется с величиной глобальной ФВ ЛЖ и уровнем прогностических биологических маркеров, таких как NT-фрагмент мозгового натрийуретического пептида (NT-pro-МНУП), галектин-3, sST2-протеин, фактор роста и дифференцировки фибробластов-15, кардиоспецифические тропонины, ассоциированный с нейтрофильной желатиназой липокаин (neutrophil gelatinase-associated lipocalin – NGAL) [2, 33, 34, 80].
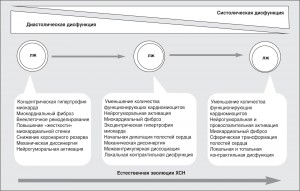
ХСН может являться результатом относительно длительной эволюции кардиоваскулярного заболевания. Вместе с тем прогрессирование ХСН может проявляться либо внезапным, либо постепенным усилением или появлением новых клинических симптомов дисфункции миокарда [44]. Острая декомпенсация ХСН, повлекшая за собой госпитализацию, как правило, обусловлена сочетанием нескольких факторов, а именно: прогрессированием дисфункции миокарда, нейрогуморального дисбаланса, системного воспаления [79]. При этом остро декомпенсированная ХСН рассматривается как самостоятельный синдром вне острой СН [28]. Рациональность выделения остро декомпенсированной ХСН как еще одного фенотипа ХСН вызывает сомнения. Доминирующий подход к фенотипированию ХСН основывается на представлениях о естественной эволюции ХСН (рис. 1).
При этом оба фенотипа представляют собой разные патогенетические стадии эволюции ХСН [17], причем различия в величине ожидаемой продолжительности жизни, показателях смертности и потребности в госпитализации у пациентов с обоими фенотипами ХСН не зависели от этиологии дисфункции миокарда [6, 16, 24, 26, 31, 65].
Однако вышеописанные особенности в популяциях пациентов с ХСН с различными типами тотальной контрактильной дисфункции нивелировались при пролонгации наблюдения за ними [8]. Интересно, что среди больных со сниженной ФВ ЛЖ краткосрочная выживаемость была существенно выше в том случае, когда в результате терапевтических вмешательств удавалось добиться повышения значений ФВ ЛЖ. Эти данные повлекли за собой изменения в клинических рекомендациях Американской коллегии кардиологии/Американской ассоциации сердца (American College of Cardiology Foundation/American Heart Association, ACCF/AHA) по ХСН, которые сегодня рассматривают возможность дополнительной стратификации таких больных как устойчиво ответивших на традиционное лечение [79]. С другой стороны, было бы неправомерно считать, что сохраненная ФВ ЛЖ при ХСН исключает глобальные контрактильные нарушения в принципе. Так, используя метод оценки деформации стенок миокарда, удалось продемонстрировать наличие нарушений глобальной контрактильности ЛЖ у пациентов с сохраненной ФВ ЛЖ [40]. При этом большинством исследователей была подтверждена тесная ассоциация между величиной глобальной ФВ ЛЖ и степенью снижения скорости продольной и/или циркулярной деформации ЛЖ даже после коррекции данных в зависимости от традиционных показателей диастолической функции (допплерографический индекс, E' и E/Em), давления наполнения ЛЖ, а также циркулирующего уровня NT-pro-МНУП [15, 40, 45]. Существуют данные о наличии прямой ассоциации между выраженностью глобальной механической диссинергии ЛЖ и циркулирующим уровнем NT-pro-МНУП [56]. Кроме того, степень уменьшения продольной, радиальной и циркулярной деформации стенки ЛЖ обладает независимой от ФВ ЛЖ предикторной ценностью у пациентов с ХСН в отношении кардиоваскулярной смерти и повторных госпитализаций [15, 81]. Однако нарушение скорости деформации стенок ЛЖ не обеспечивает повышение предикторной ценности ФВ ЛЖ у больных с ХСН со снижением последней [81]. Напротив, снижение продольной деформации ЛЖ тесно ассоциируется с показателем общей смертности [30, 54]. При этом предсказующая ценность глобальных диссинхроний стенок миокарда у пациентов с ХСН не зависит от этиологической природы дисфункции миокарда [7, 21, 67].
В целом сформировалась точка зрения о том, что ранние стадии дисфункции миокарда тесно связаны с формированием диастолических нарушений вследствие повышения «жесткости» миокарда, что отражается в появлении механических диссинергий стенок желудочков при сохранении величины глобальной ФВ ЛЖ. Клинические признаки ХСН, возникающие у пациентов с изолированными диастолическими нарушениями, свидетельствуют о формировании диастолической ХСН. В дальнейшем прогрессирование дисфункции миокарда неразрывно связано с ухудшением механических качеств стенок желудочков, влекущим за собой сферическую трансформацию полостей сердца, редукцию величины глобальной ФВ ЛЖ и дисрегуляцию межвентрикулярного взаимодействия. Принято считать, что на этапе возникновения глобальной контрактильной дисфункции миокарда доминирование диастолических нарушений исчезает, а прогрессирующее снижение ФВ ЛЖ является индикатором тяжести ХСН (рис. 1).
Новая парадигма формирования ХСН с сохраненной ФВ ЛЖ
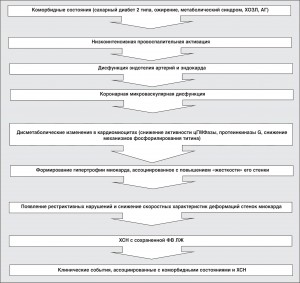
На протяжении последних десятилетий представления о формировании ХСН с сохраненной ФВ ЛЖ в значительной мере поддерживались доказательствами тесной взаимосвязи между так называемой перегрузкой давлением ЛЖ, с одной стороны, и нарушениями его структуры и функции – с другой [58]. Экспериментальные исследования, выполненные на различных моделях ХСН, позволили установить превалирование концентрической гипертрофии или концентрического ремоделирования ЛЖ над эксцентрическими формами ремоделирования на фоне выраженного экстрацеллюлярного фиброза, приводящего к нарушениям релаксационной функции [18]. При этом фенотипический ответ в виде ХСН с сохраненной ФВ ЛЖ формируется вследствие доминирования низкоинтенсивной системной провоспалительной активации, индуцированной коморбидными состояниями, которые в свою очередь рассматриваются как непосредственная причина ХСН (сахарный диабет 2 типа, АГ, ожирение) (рис. 2).
Системный провоспалительный ответ способствует снижению биодоступности эндогенных вазодилататоров, таких как оксид азота, стимулируя повышение активности оксидативного стресса [18, 22]. Это, в свою очередь, способствует формированию дисфункции эндотелия артерий и эндокарда, которые рассматриваются в качестве основных условий для возникновения микроваскулярной дисфункции кардиомиоцитов [22, 73]. Формирующиеся дисметаболические нарушения в последних, индуцируемые как системным воспалительным ответом, так и вторичной ишемией миокарда, обусловливают снижение эффективности функционирования мембран-зависимых ионных насосов, приводя к дефектам процессов фосфорилирования ряда ключевых внутриклеточных ферментов, сигнальных молекул и структурных протеинов, таких как фосфоламбан, циклический ГМФ, протеинкиназа G и титин. В результате активации внутриклеточных сигнальных систем (Akt-STAT2-, митоген-активируемой киназы) и повышения транскрипционного потенциала ядерных факторов формируется гипертрофия миокарда, ассоциированная с повышением его «жесткости», а нарушение фосфорилирования структурного протеина титина приводит к ухудшению релаксационной способности миокарда, возникновению механической диссинергии и межвентрикулярной диссоциации. Клиническим эквивалентом этого процесса является ХСН с сохраненной ФВ ЛЖ.
В свою очередь клиническая неоднородность пациентов ХСН с сохраненной ФВ ЛЖ привела к попыткам представить возможное разнообразие как фенотипические варианты (рис. 3).
Действительно, среди больных с ХСН и сохраненной ФВ ЛЖ можно было бы выделить три основных фенотипа: фенотип «А» (асимптомная дисфункция), связанный с формированием диастолической дисфункции ЛЖ, которая манифестирует при избыточных физических нагрузках; фенотип «В», при котором диастолическая дисфункция ЛЖ ассоциируется с ретенцией жидкости и «объемной» перегрузкой правого желудочка (ПЖ), и фенотип «С», ассоциированный с клинически значимой ЛАГ и систолической дисфункцией ПЖ [27]. Условность подобной градации очевидна, а ее концепция также основана на представлениях о естественной эволюции дисфункции миокарда ЛЖ. Однако авторы не рассматривают трансформацию ХСН с сохраненной ФВ ЛЖ в ХСН со сниженной ФВ ЛЖ как облигатный этап прогрессирования заболевания, соглашаясь, таким образом, с идеей о независимости существования различных фенотипов ХСН, предоминантно определяющих риск неблагоприятного исхода и продолжительность жизни пациентов [20].
Сопоставление концепций формирования различных фенотипов ХСН
Принципиальным отличием новой концептуальной модели формирования ХСН с сохраненной ФВ ЛЖ от предыдущей является изменение представлений о доминирующей роли экстракардиальных механизмов, таких как «перегрузка» ЛЖ объемом или давлением, в направлении кардиоваскулярных – коронарной микроваскулярной дисфункции воспалительного происхождения и асимптомной ишемии. При этом вентрикулярное ремоделирование при ХСН с сохраненной ФВ ЛЖ существенно отличается от такового при ХСН со сниженной ФВ ЛЖ. В основе этих различий лежат инициальные процессы, которые для ХСН со сниженной ФВ ЛЖ сопряжены с ранней и относительно быстрой потерей количества функционирующих кардиомиоцитов, тогда как при ХСН с сохраненной ФВ ЛЖ ведущее значение в патогенезе приобретают так называемые фибропролиферативные процессы, а именно: концентрическая гипертрофия, внеклеточное ремоделирование с распространенным фиброзом [59]. Последние в настоящее время рассматриваются в качестве потенциальных молекулярных мишеней для реализации новой стратегии терапии ХСН с сохраненной ФВ ЛЖ, исходящей из допущения, что фокусировка направления будущего вмешательства должна непосредственно затрагивать интерстиций и механизмы реализации его ремоделирования [62, 77].
В целом новая парадигма формирования ХСН с сохраненной ФВ ЛЖ не является радикально альтернативной традиционному взгляду на этот процесс и, скорее, представляет собой ответ на изменившиеся возможности для будущих стратегий лечения [69, 70]. При этом два фенотипических ответа в виде ХСН с различной величиной ФВ ЛЖ отражают скорость естественной прогрессии и могут быть сопряжены с одинаковыми инициальными причинами. Не исключено, что формирование того или иного фенотипа ХСН может быть связано с некими генетическими предпосылками, такими как полиморфизм генов цитокиновой оси, NO-синтетазы, АПФ, суперсемейств факторов роста фибробластов, фактора некроза опухоли альфа, рецепторов к эндогенным катехоламинам и др. [13, 14, 55]. Однако это не исключает факт трансформации изолированных диастолических нарушений в глобальную систолическую дисфункцию, хотя эта эволюция, скорее, представляется как частный случай естественной прогрессии ХСН (рис. 4).
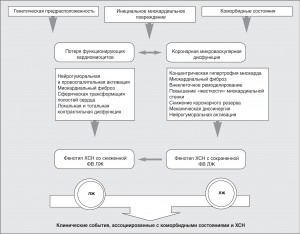 Рис. 4. Принципиальная концепция формирования и прогрессирования ХСН исходя из существования двух фенотипов миокардиальной дисфункции
Рис. 4. Принципиальная концепция формирования и прогрессирования ХСН исходя из существования двух фенотипов миокардиальной дисфункцииРоль биологических маркеров в идентификации фенотипов ХСН и вероятности манифестации неблагоприятных клинических событий
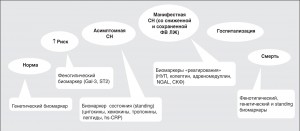
Попытки представить универсальный высокоспецифичный диагностический биомаркер или комбинацию нескольких биологических индикаторов отдельно для обоих фенотипов ХСН пока что не увенчались успехом [19, 33]. В соответствии с действующими клиническими соглашениями натрийуретические пептиды (МНУП, NT-pro-ПНУП, MR-pro-ПНУП, галектин-3, sST2-протеин) сохраняют свое значение как достаточно чувствительные биомаркеры ХСН на любом этапе кардиоваскулярного континуума (рис. 5).
Вместе с тем высокое значение соотношения правдоподобности отрицательного результата теста свидетельствует о том, что наибольшая диагностическая ценность представителей натрийуретических пептидов достигается при их нормальных показателях [38, 41]. Тем не менее существуют сведения о том, что циркулирующий пул МНУП и NT-pro-ПНУП у пациентов с ХСН и сохраненной ФВ ЛЖ достоверно ниже, чем у лиц со сниженной ФВ ЛЖ [12, 61, 74]. Аналогичные данные получены и для фактора роста и дифференциации фибробластов-15 (growth differentiation factor 15 – GDF-15), кардиоспецифических тропонинов и sST-2 протеина [61, 72]. При этом только МНУП и NT-pro-МНУП сохраняют свое прогностическое значение для пациентов с ХСН независимо от величины ФВ ЛЖ. Означает ли это, что существует потенциальная возможность биомаркерной идентификации различных фенотипов ХСН, не вполне ясно [2]. Интересно, что кроме мозговых натрийуретических пептидов предикторной ценностью для больных с ХСН со сниженной ФВ ЛЖ обладают кардиоспецифические тропонины (тропонин Т) и высокочувствительный С-реактивный протеин. С другой стороны, прогностическая ценность таких биологических маркеров, как GDF-15, цистатин С, а также альбуминурии установлена только для фенотипа ХСН с сохраненной ФВ ЛЖ [11, 61, 72].
В целом прогностические возможности биомаркерной идентификации пациентов с различными фенотипами ХСН также неоднозначны [64]. Для больных со сниженной ФВ ЛЖ доказана высокая предсказующая ценность маркеров миокардиального повреждения (кардиоспецифичные тропонины) и маркеров биомеханического стресса (натрийуретические пептиды, копептин, [про]адреномедуллин), тогда как фенотипические биологические маркеры, характеризующие экспансию внеклеточного матрикса (галектин-3, GDF15), в большей мере помогают реклассифицировать риск у пациентов с сохраненной ФВ ЛЖ [22]. При этом NGAL, sST2-протеин и цистатин С, вероятно, описывают либо популяционную составляющую риска (sST2-протеин), либо тяжесть сопутствующих гемодинамических нарушений и почечной дисфункции (NGAL, цистатин С), очевидно, не проявляя необходимой специфичности к фенотипам ХСН [10].
Можно предположить, что биомаркеры, отражающие характер экспансии внеклеточного матрикса, метаболизма его компонентов или экспрессии прекурсоров последнего, вероятно, могли бы проявлять более высокую чувствительность и специфичность к идентификации риска у пациентов с различными фенотипами ХСН [2]. Действительно, данные, полученные в ходе непосредственного измерения объема внеклеточного матрикса, подтверждают наличие тесной ассоциации между последним и отдаленным прогнозом пациентов с ХСН с сохраненной ФВ ЛЖ [76].
Однако в целом персонализированная оценка риска пациентов с ХСН в зависимости от характера предсуществующего фенотипа дисфункции миокарда с помощью биомаркерных моделей не разработана [63]. Ожидается, что именно биомаркерная стратегия позволит лучше оценивать эффективность терапевтических программ, что особенно актуально для пациентов с ХСН и сохраненной ФВ ЛЖ.
Биомаркерконтролируемая терапия у пациентов с различными фенотипами ХСН
К настоящему времени установлено, что эволюция ХСН может ассоциироваться с изменениями в содержании соответствующих индикаторов, определяемых с достаточно высокой точностью в биологических жидкостях и отражающих стадию заболевания, риск прогрессирования последнего или вероятность неблагоприятных клинических исходов. Биомаркерконтролируемая терапия ХСН основана на допущении, что динамика некоторых биологических индикаторов может ассоциироваться с так называемым ответом на лечение. Соответственно, мониторирование уровня этих биомаркеров могло бы оказаться полезным с точки зрения оценки как эффективности лечения, так и перспектив достижения пациентом приемлемого уровня индивидуального риска. Действительно, если учесть, что любой больной с ХСН является «потенциальным кандидатом» для будущей ургентной/повторной госпитализации вследствие прогрессирования дисфункции миокарда и при этом его клинический статус будет прогрессивно ухудшаться с каждым новым эпизодом декомпенсации, то динамика биомаркеров, оцененная с определенным интервалом после выписки из стационара, может послужить индикатором адекватности проводимого лечения [10, 47].
Первоначально казалось, что маркеры повреждения миокарда (кардиоспецифические тропонины), биомеханического стресса (натрийуретические пептиды, копептин, адреномедуллин), провоспалительной активации (галектин-3, sST2-протеин) будут близки к идеальным для проведения биомаркерконтролируемой терапии [10, 32, 33]. Было установлено, что МНУП или NT-pro-МНУП-контролируемая терапия ХСН действительно позволяет добиться лучших успехов в повышении выживаемости и предотвращении неблагоприятных клинических исходов у пациентов с различными фенотипами дисфункции миокарда [35, 36, 43]. Однако согласованной позиции в отношении выбора целевого уровня этих биомаркеров, достижение которых могло бы быть определено как оптимальное для больных с ХСН, выработать не удалось, хотя современные клинические рекомендации (преимущественно AHA/ACC, 2013) указывают на возможность проведения МНУП/NT-pro-МНУП-контролируемой терапии ХСН [79]. В дальнейшем оказалось, что мониторирование уровня галектина-3 обладает дополнительной предсказующей ценностью только для пациентов с ХСН, развившейся вследствие ишемических причин [50]. В остальных случаях пиковая концентрация этого биомаркера по сравнению с серийными измерениями последнего обладает большей предсказующей ценностью для идентификации пациентов высокого риска. Динамический прирост концентрации копептина имеет прогностическую ценность для пациентов с острой, а не хронической сердечной недостаточностью, тогда как фактор роста и дифференциации фибробластов тестировался в основном для лиц со стабильной ИБС и высоким риском возникновения ХСН [71, 75]. Содержание ST-2-протеина ассоциируется с риском возникновения ХСН, ее тяжестью и потребностью в назначении максимально переносимых доз бета-адреноблокаторов [25]. Однако повторные измерения циркулирующего уровня ST-2-протеина не могли повлиять на чувствительность процедуры стратификации пациентов в группу лиц с более высоким риском наступления летального исхода. Это, в частности, означает, что не все биомаркеры одинаково эффективны в отношении возможности проведения биомаркерконтролируемой терапии. Фактически только МНУП/NT-pro-МНУП-контролируемая терапия ХСН в ограниченных исследованиях доказала свою клиническую эффективность [46, 52, 79].
В связи с этим можно сформулировать несколько нерешенных вопросов, относящихся к терапии ХСН, проводимой под контролем биомаркеров.
• Зависит ли выбор биомаркера для возможной биомаркерконтролируемой терапии от этиологии ХСН, ФВ ЛЖ, возраста больных и сопутствующих коморбидных состояний?
• Будет ли одинаково эффективна МНУП/NT-pro-МНУП-контролируемая терапия у больных с различными фенотипами ХСН?
• Нужно ли согласовывать выбор предпочтительного биомаркера у больного с ХСН со стратегией фармакологического лечения?
• Насколько целесообразным является самоизмерение биологических маркеров у пациентов с ХСН, и какой интервал является оптимальным для оценки эффективности терапии?
• Насколько экономически обоснованными выглядят рекомендации по внедрению биомаркерконтролируемой терапии ХСН в рутинную клиническую практику?
Все это создает основу для поиска новых биомаркеров и их сочетаний с целью повышения стратификации больных в группу высокого риска возникновения неблагоприятных клинических событий и улучшения эффективности лечения ХСН. Таблица 2 содержит далеко не полный перечень биологических маркеров, роль которых в идентификации пациентов высокого риска с ХСН широко обсуждается.
В заключение необходимо отметить, что характер первичного фенотипического ответа у пациентов с ХСН, вероятно, является основной детерминантой естественной эволюции дисфункции миокарда и в значительной мере определяет риск наступления неблагоприятных клинических исходов в краткосрочной перспективе. Возможность использования биологических маркеров с целью стратификации пациентов с ХСН в группу риска возникновения неблагоприятных клинических исходов выглядит привлекательно, однако оптимальный выбор биомаркеров для больных с различными фенотипами ХСН, сопутствующими коморбидными состояниями не вполне определен. Биомаркерконтролируемая терапия ХСН возможна с учетом наличия доказательств влияния серийных измерений циркулирующего уровня натрийуретических пептидов на принятие решения о модификации фармакологической стратегии. Роль других биомаркеров, включая галектин-3, sST2-протеин, в оценке эффективности терапии ХСН не установлена и активно обсуждается. Вероятно, требуется больше усилий в проведении специально спланированных клинических исследований с высокой статистической мощностью, посвященных уточнению места и роли биологических маркеров в диагностике и лечении пациентов с различными фенотипами ХСН.
Литература
1. Березин А.Е. Систолическая и диастолическая сердечная недостаточность: две стороны одного процесса? Укр. мед. часопис. 2014; 3: 91-96.
2. Березин А.Е. Биологические маркеры кардиоваскулярных заболеваний. Часть 4. Диагностическое и прогностическое значение биомаркеров в стратификации пациентов с сердечной недостаточностью. Lambert Academic Publishing GmbH. Москва, 2015. – 329 с.
3. Воронков Л.Г., Яновский Г.В, Устименко Е.В., Семененко О.И. Предикторы 5-летней выживаемости больных и индивидуальное прогнозирование течения клинически манифестированной хронической сердечной недостаточности. Укр. мед. часопис. 2003; 6(38) :106-109.
4. Alagiakrishnan K., Banach M., Jones L.G. et al. Update on diastolic heart failure or heart failure with preserved ejection fraction in the older adults. Ann Med. 2013; 45(1): 37-50.
5. Alsamara M., Alharethi R. Heart failure with preserved ejection fraction. Expert Rev. Cardiovasc. Ther. 2014 Apr 19. [Epub ahead of print].
6. Ambedkar A.V., Fonarrow G.C., Hernandez A.F. et al. Characteristics and in-hospital outcomes for non-adherant patients with heart failure: get with the Guidelines-Heart Failure (GWTG-HF). Am. Heart J. 2009; 158: 644-652.
7. Bertini M., Ng A.C., Antoni M.L. et al. Global longitudinal strain predicts long-term survival in patients with chronic ischemic cardiomyopathy. Circ Cardiovasc Imaging. 2012; 5: 383-391.
8. Blais C., Dai S., Waters C. et al. Assessing the burden of hospitalized and community-care heart failure in Canada. Can J Cardiol. 2014; 30(3): 352-358.
9. Blecker S., Agarwal S.K., Chang P.P. et al. Quality of care for heart failure patients hospitalized for any cause. J. Am. Coll. Cardiol. 2014; 63(2): 123-130.
10. Borlaug B.A. In Search of New Targets and Endpoints in Heart Failure With Preserved Ejection Fraction. JACC Heart Fail. 2015; 3(6): 475-7.
11. Brouwers F.P., de Boer R.A., van der Harst P. et al. Incidence and epidemiology of new onset heart failure with preserved vs. reduced ejection fraction in a community-based cohort: 11-year follow-up of PREVEND. Eur. Heart J.; 2013. 34:1424-1431.
12. Brouwers F.P., de Boer R.A., van der Harst P. et al. Incidence and epidemiology of new onset heart failure with preserved vs. reduced ejection fraction in a community-based cohort: 11-year follow-up of PREVEND. Eur. Heart J. 2013; 34: 1424-1431.
13. Burkly L.C., Michaelson J.S., Zheng T.S. TWEAK/Fn14 pathway: an immunological switch for shaping tissue responses. Immunol. Rev. 2011; 244(1): 99-114.
14. Chacon M.R., Richart C., Gomez J.M. et al. Expression of TWEAK and its receptor Fn14 in human subcutaneous adipose tissue. Relationship with other inflammatory cytokines in obesity. Cytokine. 2006; 33(3): 129-137.
15. Cho G.Y., Marwick T.H., Kim H.S. et al. Global 2-dimensional strain as a new prognosticator in patients with heart failure. J Am Coll Cardiol. 2009; 54: 618-624.
16. Cleland J.C.F., Sewdberg K., Cohen-Solal A. et al. The Euro Heart Failure Survey of The EUROHEART Survey Programme: a survey on the quality of care among patients with heart failure in Europe. Eur. J. Heart Fail. 2000; 2: 123-132.
17. Curtis J.P., Sokol S.I., Wang Y. et al. The association of left ventricular ejection fraction, mortality, and cause of death in stable outpatients with heart failure. J. Am. Coll. Cardiol. 2003; 42: 736-742.
18. de Haas H.J., Arbustini E., Fuster V. et al. Molecular imaging of the cardiac extracellular matrix. Circ Res. 2014; 114(5): 903-915.
19. Dunlay S.M., Pereira N.L., Kushwaha S.S. Contemporary Strategies in the Diagnosis and Management of Heart Failure. Mayo Clin Proc. 2014 Mar 29. pii: S0025-6196(14)00053-6. [Epub ahead of print]
20. Dupuis J., Guazzi M. Pathophysiology and clinical relevance of pulmonary remodelling in pulmonary hypertension due to left heart diseases. Can J Cardiol. 2015; 31(4): 416-29.
21. Ersbоll M., Valeur N., Andersen M.J. et al. Early echocardiographic deformation analysis for the prediction of sudden cardiac death and life-threatening arrhythmias after myocardial infarction. JACC Cardiovasc Imaging. 2013; 6(8): 851-860.
22. Eschalier R., Fertin M., Fay R. et al. Extracellular matrix turnover biomarkers predict long-term left ventricular remodeling after myocardial infarction: insights from the REVE-2 study. Circ Heart Fail. 2013; 6(6): 1199-1205.
23. Eschalier R., Rossignol P., Kearney-Schwartz A. et al. Features of cardiac remodeling, associated with blood pressure and fibrosis biomarkers, are frequent in subjects with abdominal obesity. Hypertension. 2014; 63(4): 740-746.
24. Fonorrow G.C., Yancy C.W., Albert N.M. et al. Improving the use of evidence based heart failure therapies in the outpatient settings: the IMPROVE HF performance improvement registry. Am. Heart J. 2007; 154: 12-38.
25. Gaggin H.K., Motiwala S, Bhardwaj A. et al. Soluble concentrations of the interleukin receptor family member ST2 and b-blocker therapy in chronic heart failure. Circ Heart Fail. 2013; 6(6): 1206-1213.
26. Grzywa-Celinska A., Szmygin-Milanowska K., Dyczko M. et al. Comorbidity of chronic heart failure and chronic obstructive pulmonary disease. Pol. Merkur. Lekarski. 2013; 35(209): 251-253.
27. Guazzi M. Pulmonary hypertension in heart failure preserved ejection fraction: prevalence, pathophysiology, and clinical perspectives. Circ Heart Fail. 2014; 7(2): 367-77.
28. Gupta A., Ghimire G., Hage F.G. Guidelines in review: 2013 ACCF/AHA Guideline for the Management of Heart Failure. J. Nucl. Cardiol. 2014; 21(2): 397-399.
29. Hogg K., Swedberg K., McMurray J. Heart failure with preserved left ventricular systolic function; epidemiology, clinical characteristics, and prognosis. J. Am. Coll. Cardiol 2004; 43: 317-327.
30. Hung C.L., Verma A., Uno H. et al. VALIANT investigators. Longitudinal and circumferential strain rate, left ventricular remodeling, and prognosis after myocardial infarction. J Am Coll Cardiol. 2010; 56: 1812-1822.
31. Iyngkaran P., Thomas M., Majoni W. et al. Comorbid heart failure and renal impairment-epidemiology and management. Cardiorenal Med. 2012; 2: 281-297.
32. Januzzi J.L.Jr. The role of natriuretic peptide testing in guiding chronic heart failure management: review of available data and recommendations for use. Arch Cardiovasc Dis. 2012; 105(1): 40-50.
33. Jarolim P. Overview of cardiac markers in heart disease. Clin Lab Med. 2014; 34(1):1-14.
34. Jarolim P. High sensitivity cardiac troponin assays in the clinical laboratories. Clin Chem Lab Med. 2015; 53(5): 635-52.
35. Jhund P.S., Anand I.S., Komajda M., et al. Changes in N-terminal pro-B-type natriuretic peptide levels and outcomes in heart failure with preserved ejection fraction: an analysis of the I-Preserve study. Eur J Heart Fail. 2015 [Epub ahead of print]
36. Jourdain P., Jondeau G., Funck F. et al. Plasma brain natriuretic peptide-guided therapy to improve outcome in heart failure: the STARS-BNP Multicenter Study. J. Am. Coll. Cardiol. 2007; 49(16): 1733-1739.
37. Kelder J.C., Cowie M.R., McDonagh T.A. et al. Quantifying the added value of BNP in suspected heart failure in general practice: an individual patient data meta-analysis. Heart 2011; 97: 959-963.
38. Kelder J.C., Cramer M.J., Verweij W.M. et al. Clinical utility of three B-type natriuretic peptide assays for the initial diagnostic assessment of new slow-onset heart failure. J. Card. Fail. 2011; 17: 729-734.
39. Komamura К. Similarities and Differences between the Pathogenesis and Pathophysiology of Diastolic and Systolic Heart Failure. Cardiology Research and Practice. 2013; Article ID 824135, http://dx.doi.org/10.1155/2013/824135
40. Kraigher-Krainer E., Shah A.M., Gupta D.K. et al. PARAMOUNT Investigators. Impaired systolic function by strain imaging in heart failure with preserved ejection fraction. J. Am. Coll. Cardiol. 2014; 63(5): 447-456.
41. Krishnaswamy P., Lubien E., Clopton P. et al. Utility of B-natriuretic peptide levels in identifying patients with left ventricular systolic or diastolic dysfunction. Am. J. Med. 2001; 111: 274-279.
42. Lam C.S., Donal E., Kraigher-Krainer E., Vasan R.S. Epidemiology and clinical course of heart failure with preserved ejection fraction. Eur. J. Heart Fail. 2011; 13: 18-28.
43. Li P., Luo Y., Chen Y.M. B-type natriuretic peptide-guided chronic heart failure therapy: a meta-analysis of 11 randomised controlled trials. Heart Lung Circ. 2013; 22(10): 852-860
44. Lindenfeld J., Albert N.M., Boehmer J.P. et al. Executive Summary: HFSA 2010 Comprehensive Heart Failure Practice Guideline. J. Card. Fail. 2010; 16: 475-539.
45. Ma C., Chen J., Yang J. et al. Quantitative assessment of left ventricular function by 3-dimensional speckle-tracking echocardiography in patients with chronic heart failure: a meta-analysis. J. Ultrasound. Med. 2014; 33(2): 287-295.
46. Maisel A., Mueller C., Nowak R. et al. Mid-region pro-hormone markers for diagnosis and prognosis in acute dyspnea: results from the BACH (Biomarkers in Acute Heart Failure) trial. J. Am. Coll. Cardiol. 2010; 55: 2062-2076.
47. Mant D., Hobbs F.R., Glasziou P. et al. Identification and guided treatment of ventricular dysfunction in general practice using blood B-type natriuretic peptide. Br. J. Gen. Pract. 2008; 58(551): 393-399.
48. McMurray J.J. Clinical practice. Systolic heart failure. N. Engl. J. Med. 2010; 362: 228-238.
49. McMurray J.J.V., Adamopoulos S., Anker S.D. et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012. The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur. Heart J. 2012; 33, 1787-1847.
50. Meijers W.C., van der Velde A.R., de Boer R.A. The ARCHITECT galectin-3 assay: comparison with other automated and manual assays for the measurement of circulating galectin-3 levels in heart failure. Expert Rev. Mol. Diagn. 2014; 14(3): 257-266.
51. Meta-analysis Global Group in Chronic Heart Failure (MAGGIC). The survival of patients with heart failure with preserved or reduced left ventricular ejection fraction: an individual patient data meta-analysis. Eur. Heart J. 2012; 33: 1750-1757.
52. Moe G.W., Ezekowitz J.A., O'Meara E. et al. Focus Update: anemia, biomarkers, and recent therapeutic trial implications. The 2014 Canadian Cardiovascular Society Heart Failure Management Guidelines. Can J Cardiol. 2015; 31(1): 3-16.
53. Mosterd A., Hoes A.W. Clinical epidemiology of heart failure. Heart 2007; 93: 1137-1146.
54. Motoki H., Borowski A.G., Shrestha K. et al. Incremental prognostic value of assessing left ventricular myocardial mechanics in patients with chronic systolic heart failure. J Am Coll Cardiol. 2012; 60: 2074-2081.
55. Novoyatleva T., Schymura Y., Janssen W. et al. Deletion of Fn14 receptor protects from right heart fibrosis and dysfunction. Basic Res. Cardiol. 2013; 108(2):325.10.1007/s00395-012-0325-x.
56. Obaid F.A., Maskon O., Abdolwahid F. Systolic Function and Intraventricular Mechanical Dyssynchrony Assessed by Advanced Speckle Tracking Imaging with N-terminal Prohormone of Brain Natriuretic Peptide for Outcome Prediction in Chronic Heart Failure Patients. Sultan Qaboos Univ Med J. 2013; 13(4): 551-559.
57. Oudejans I., Mosterd A., Bloemen J.A. et al. Clinical evaluation of geriatric outpatients with suspected heart failure: value of symptoms, signs, and additional tests. Eur. J. Heart Fail 2011; 13: 518-527.
58. Ouzounian M., Lee D.S., Liu P.P. Diastolic heart failure: mechanisms and controversies. Nature Clinical Practice Cardiovascular Medicine. 2008; 5: 375-386.
59. Paulus W.J., Tschоpe C. A novel paradigm for heart failure with preserved ejection fraction: comorbidities drive myocardial dysfunction and remodeling through coronary microvascular endothelial inflammation. J. Am. Coll. Cardiol. 2013; 62(4): 263-271.
60. Paulus W.J., Tschope C., Sanderson J.E. et al. How to diagnose diastolic heart failure: a consensus statement on the diagnosis of heart failure with normal left ventricular ejection fraction by the Heart Failure and Echocardiography Associations of the European Society of Cardiology. Eur. Heart J. 2007; 28: 2539-2550.
61. Santhanakrishnan R., Chong J.P., Ng T.P. et al. Growth differentiation factor 15, ST-2, high-sensitivity troponin T, and N-terminal pro brain natriuretic peptide in heart failure with preserved vs. reduced ejection fraction. Eur. J. Heart Failure. 2012; 14: 1338-1347.
62. Schelbert E.B., Fonarow G.C., Bonow R.O. et al. Therapeutic Targets in Heart Failure: Refocusing on the Myocardial Interstitium. J. Am. Coll. Cardiol. 2014. pii: S0735-1097(14)01397-7.
63. Seliger S.L., de Lemos J., Neeland I.J., et al. Older Adults, «Malignant» Left Ventricular Hypertrophy, and Associated Cardiac-Specific Biomarker Phenotypes to Identify the Differential Risk of New-Onset Reduced Versus Preserved Ejection Fraction Heart Failure: CHS (Cardiovascular Health Study). JACC Heart Fail. 2015; 3(6): 445-55.
64. Shah K.S., Maisel A.S. Novel biomarkers in heart failure with preserved ejection fraction. Heart Fail Clin. 2014; 10(3): 471-9.
65. Snyder M.L., Love S.A., Sorlie P.D. et al. Redistribution of heart failure as the cause of death: the Atherosclerosis Risk in Communities Study. Popul. Health Metr. 2014; 12(1): 10.
66. Stewart S., MacIntyre K., Hole D.J. et al. More 'malignant' than cancer? Five-year survival following a first admission for heart failure. Eur. J. Heart Fail. 2001; 3: 315-322.
67. Su H.M., Lin T.H., Hsu P.C. et al. Global left ventricular longitudinal systolic strain as a major predictor of cardiovascular events in patients with atrial fibrillation. Heart. 2013; 99(21): 1588-96.
68. Subzposh F., Gupta A., Hankins S.R., Eisen H.J. Management of ACCF/AHA Stage A and B patients. Cardiol. Clin. 2014; 32(1): 63-71.
69. Tarone G., Balligand J.L., Bauersachs J. et al. Targeting myocardial remodelling to develop novel therapies for heart failure: A position paper from the Working Group on Myocardial Function of the European Society of Cardiology. Eur. J. Heart Fail. 2014 Mar 17. doi: 10.1002/ejhf.62. [Epub ahead of print]
70. Toprak G., Yuksel H., Demirpenсe O. et al. Fibrosis in heart failure subtypes. Eur Rev Med Pharmacol Sci. 2013; 17(17): 2302-9.
71. Udell J.A., Morrow D.A., Jarolim P. et al. Fibroblast Growth Factor-23, Cardiovascular Prognosis, and Benefit of Angiotensin-Converting Enzyme Inhibition in Stable Ischemic Heart Disease. J. Am. Coll. Cardiol. 2014 Mar 27
72. van Kimmenade R.R.J., Januzzi J.L.Jr. Emerging biomarkers in heart failure. Clinical Chemistry. 2012; 58 (1): 127-138.
73. van Linthout S., Miteva K., Tschоpe C. Crosstalk between fibroblasts and inflammatory cells. Cardiovasc Res. 2014; 102(2): 258-269.
74. van Veldhuisen D.J., Linssen G.C., Jaarsma T .et al. B-type natriuretic рeptide and prognosis in heart failure patients with preserved and reduced ejection fraction. J. Am. Coll. Cardiol. 2013; 61 (14): 1498-1506.
75. Wannamethee S.G., Welsh P., Whincup P.H. et al. N N-terminal pro brain natriuretic peptide but not copeptin improves prediction of heart failure over other routine clinical risk parameters in older men with and without cardiovascular disease: population-based study. Eur J Heart Fail. 2014; 16(1): 25-32.
76. Wong T.C., Piehler K.M., Kang I.A. et al. Myocardial extracellular volume fraction quantified by cardiovascular magnetic resonance is increased in diabetes and associated with mortality and incident heart failure admission. Eur Heart J. 2014; 35(10): 657-664.
77. Yamaguchi Y., Feghali-Bostwick C.A. The role of endostatin in fibroproliferative disorders.-as a candidate for anti-fibrosis therapy. Nihon Rinsho Meneki Gakkai Kaishi. 2013; 36(6): 452-458.
78. Yamamoto K., Sakata Y., Ohtani T. et al. Heart failure with preserved ejection fraction: what is known and unknown. Circulation Journal, 2009; 73 (3): 404-410.
79. Yancy C.W., Jessup M., Bozkurt B. et al.; American College of Cardiology Foundation; American Heart Association Task Force on Practice Guidelines. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation /American Heart Association Task Force on Practice Guidelines. J. Am. Coll. Cardiol. 2013; 62(16): e147-239.
80. Yin Q.S., Shi B., Dong L., Bi L. Comparative study of galectin-3 and B-type natriuretic peptide as biomarkers for the diagnosis of heart failure. J. Geriatr. Cardiol. 2014; 11(1): 79-82.
81. Zhang K.W., French B., May Khan A. et al. Strain improves risk prediction beyond ejection fraction in chronic systolic heart failure. J. Am. Heart Assoc. 2014; 3(1): e000550.