2 жовтня, 2015
Возможности эхокардиографии в диагностике аритмогенной кардиомиопатии правого желудочка
Аритмогенная кардиомиопатия правого желудочка (АКМП) – заболевание мышцы сердца, характеризующееся частичным или полным прогрессирующим фиброзно-жировым замещением миокарда правого желудочка (ПЖ) и ассоциированными аритмиями, возникающими из ПЖ. Заболевание возникает вследствие генетического дефекта десмосом и наследуется по аутосомно-доминантному типу. Классические проявления заболевания (правожелудочковые аритмии) отмечаются между вторым и четвертым десятилетием жизни, у около 80% пациентов заболевание впервые проявляется синкопой или внезапной сердечной смертью, симптомы обычно связаны с физическими нагрузками. Носители мутации могут оставаться бессимптомными всю жизнь [1].
Со времени первого описания в 1982 г. считается, что локальные нарушения при АКМП локализуются в диафрагмальной, верхушечной и инфундибулярной областях – так называемом «треугольнике дисплазии» [2]. Первые диагностические критерии АКМП были опубликованы в 1994 г., однако они не были специфическими, в значительной степени зависели от качественных параметров, что часто приводило к ложноположительной диагностике, и были нечувствительны к обнаружению болезни на ранних стадиях [3]. В 2010 г. диагностические критерии были пересмотрены и дополнены, что позволило улучшить их специфичность путем включения количественных параметров для диагноза АКМП, а также повысить чувствительность диагностики у лиц с высокой вероятностью унаследованной/генетической болезни [4]. Диагноз АКМП основывается на комбинации больших и малых критериев – необходимо наличие двух больших или одного большого и двух малых или четырех малых критериев.
Визуализационные подходы, используемые сегодня для диагностики АКМП, включают эхокардиографию (ЭхоКГ), сердечно-сосудистую магнитно-резонансную томографию (МРТ) и ангиографию ПЖ. С помощью ЭхоКГ возможно определение глобальных или региональных нарушений функции либо структурных нарушений, среди которых к большим критериям относятся регионарная акинезия, дискинезия или аневризма ПЖ и один из следующих: конечно-диастолический размер выносящего тракта ПЖ по длинной оси ≥32 мм (скорригированный к площади поверхности тела (индекс) ≥19 мм/м2) или конечнодиастолический размер выносящего тракта ПЖ по короткой оси ≥36 мм (индекс выносящего тракта ≥21 мм/м2), или фракционное изменение площади ПЖ ≤33%.
Точный диагноз при МРТ подтверждается дилатацией полости ПЖ, аномалией сокращения стенки ПЖ, наличием фестончатой или выпуклой свободной стенки ПЖ, а также выявлением миокардиального жира [5].
Приводим собственное клиническое наблюдение. Пациентка 42 лет, проживающая в Сумской области, была направлена в ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины с жалобами на прогрессирующую одышку при небольшой физической нагрузке, подъеме на один этаж, повышение артериального давления (АД) до 160/100 мм рт. ст. с диагнозом «метаболическая кардиомиопатия на фоне аутоиммунного тиреоидита». Месяц назад по месту жительства в ходе ЭхоКГ-исследования впервые обнаружены снижение фракции выброса (ФВ) до 40%, небольшая дилатация ПЖ. Из семейного анамнеза известно, что родной брат пациентки внезапно умер в возрасте 22 лет.
При обследовании на ЭКГ определялась фибрилляция предсердий (ФП) с частотой 65-90 уд/мин, неполная блокада правой ножки пучка Гиса, единичная желудочковая экстрасистолия. Проконсультирована эндокринологом, диагностированы аутоиммунный тиреоидит, гипотиреоз в стадии декомпенсации.
При проведении ЭхоКГ обнаружено увеличение размера ПЖ: индекс площади в диастолу 18,3 см2/м2 (норма до 11,5 см2/м2), продольный размер ПЖ 8,6 см (норма ≤8,3 см), поперечный размер ПЖ в базальном отделе 4,5 см (норма ≤4,1 см), диаметр выносящего тракта ПЖ по длинной оси 4,2 см (норма ≤3 см), индекс выносящего тракта ПЖ 21,3 мм/м2, стенка ПЖ в верхушечном отделе истончена до 1,8-2,5 мм) (рис. 1). Обнаружены зоны дискинеза и аневризмы в верхушечном и среднем отделе свободной стенки ПЖ в четырехкамерной позиции (рис. 2). Выявлены значительные нарушения систолической функции ПЖ: фракционное изменение площади ПЖ 22%, систолическая скорость движения кольца трехстворчатого клапана 5,6 см/с (рис. 3). В области верхушки ПЖ отмечена повышенная трабекулярность.
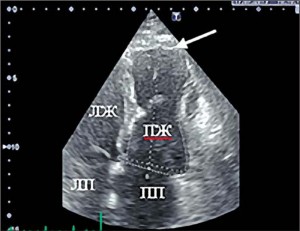 Рис. 1. 2D режим, четырехкамерная позиция сердца: диастола. Стрелка – истончение стенки ПЖ до 2,5 мм
Рис. 1. 2D режим, четырехкамерная позиция сердца: диастола. Стрелка – истончение стенки ПЖ до 2,5 мм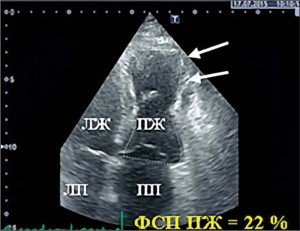 Рис. 2. 2D режим, четырехкамерная позиция сердца: систола. Стрелки указывают на аневризмы ПЖ в верхушечном и среднем отделе ФСП ПЖ – фракционное изменение площади правого желудочка.
Рис. 2. 2D режим, четырехкамерная позиция сердца: систола. Стрелки указывают на аневризмы ПЖ в верхушечном и среднем отделе ФСП ПЖ – фракционное изменение площади правого желудочка.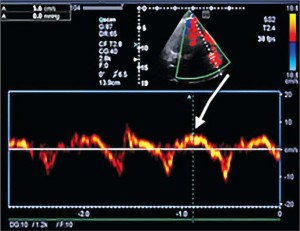 Рис. 3. 2D режим, четырехкамерная позиция сердца: режим тканевой допплерографии. Снижение систолической скорости смещения кольца трехстворчатого клапана (5,6 cм/с)
Рис. 3. 2D режим, четырехкамерная позиция сердца: режим тканевой допплерографии. Снижение систолической скорости смещения кольца трехстворчатого клапана (5,6 cм/с)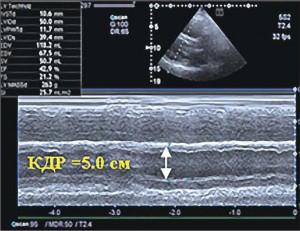 Рис. 4. М-режим, парастернальный доступ. ЛЖ не дилатирован (КДО 118 мл), легкое снижение систолической функции (ФВ ЛЖ 43%)
Рис. 4. М-режим, парастернальный доступ. ЛЖ не дилатирован (КДО 118 мл), легкое снижение систолической функции (ФВ ЛЖ 43%)Левый желудочек (ЛЖ) не увеличен (конечно-диастолический объем – КДО 116 мл) с легким снижением глобальной систолической функции (ФВ ЛЖ 43%) (рис. 4). Отмечены нарушения локальной сократимости ЛЖ (гипокинез межжелудочковой перегородки в средней и базальной части). Определялась концентрическая гипертрофия ЛЖ с толщиной стенок 11-12 мм, индекс массы миокарда ЛЖ составлял 133 г/м2. Отмечена дилатация левого (площадь 24 см2) и правого (площадь 26 см2) предсердий. Значимых нарушений клапанного аппарата сердца не выявлено (физиологический обратный ток на митральном клапане, легкая регургитация трикуспидального клапана). ЭхоКГ-признаки врожденных пороков сердца не обнаружены. Систолическое давление в легочной артерии не увеличено – 25 мм рт. ст.
При проведении кардио-МРТ отмечен глобальный гипокинез стенок ПЖ и локальный акинез по передней стенке средней трети и верхушки ПЖ. ПЖ увеличен в размерах, стенка неравномерна с несколько закругленными контурами в виде аневризматических выпячиваний и локальными утончениями до 1-2 мм на высоте выпячиваний и на верхушке. Признаки значительного увеличения размера ПЖ и его структурные изменения – истончение стенок, изменение их контура по типу аневризм, гетерогенный сигнал от миокарда и повышенная трабекулярность – соответствовали АКМП.
Исследования демонстрируют, что поражение ПЖ при АКМП может проявляться как регионарными нарушениями кинеза его стенки, так и глобальной дисфункцией ПЖ. Вовлечение ЛЖ отмечается в 50-67% случаев и обычно возникает на более поздней стадии заболевания, что приводит к бивентрикулярной недостаточности. Прогрессирование и клиническая картина АКМП зависят от двух факторов: анатомической распространенности поражения, определяющей функцию сердца, и электрической нестабильности миокарда, что может привести к внезапной смерти в результате фатальных аритмий.
Возможности ЭхоКГ в оценке ПЖ существенно ограничены из-за его сложной геометрии; вследствие невысокой распространенности АКМП визуализационные центры имеют недостаточный опыт диагностики этой патологии. В данном клиническом случае трудности диагностики АКМП обусловлены отсутствием типичных проявлений АКМП и наличием сопутствующей патологии – гипертонической болезни и аутоиммунного тиреоидита, что, вероятно, внесло вклад в ремоделирование ЛЖ и возникновение ФП, что не является характерным для АКМП.
Представленный клинический случай демонстрирует возможность диагностики АКМП с помощью визуализационных методов, используя модифицированные критерии диагностики заболевания. Точный диагноз АКМП установлен по двум большим эхокардиографическим критериям: индекс выносящего тракта ПЖ 21,3 мм/м2 и фракционное изменение площади ПЖ 22%. Большим критерием также является преждевременная внезапная смерть (в возрасте моложе 35 лет) вследствие подозрения на АКМП у родственников первой линии.
Литература
1. Rigato I., Bauce B., Rampazzo A. et al. Compound and digenic heterozygosity predicts lifetime arrhythmic outcome and sudden cardiac death in desmosomal gene-related arrhythmogenic right ventricular cardiomyopathy. Circ Cardiovasc Genet 2013, 6: 533-42.
2. Marcus F.I., Fontaine G.H., Guiraudon G. et al. Right ventricular dysplasia: a report of 24 adult cases. Circulation 1982, 65: 384-398.
3. McKenna W.J., Thiene G., Nava A. et al. Diagnosis of arrhythmogenic right ventricular dysplasia/cardiomyopathy. Task Force of the Working Group Myocardial and Pericardial Disease of the European Society of Cardiology and of the Scientific Council on Cardiomyopathies of the International Society and Federation of Cardiology. Br Heart J 1994, 71: 215-8.
4. Marcus F.I., McKenna W.J., Sherrill D. et al. Diagnosis of arrhythmogenic right ventricular cardiomyopathy/dysplasia: proposed modification of the Task Force criteria // Circulation. – 2010. – Vol. 121 (13). – P. 1533-1541.
5. Лутай М.И., Федькив С.В., Голикова И.П. и др. Отложение жировой ткани в миокарде в норме и при патологии. Клинический случай липоматозной гипертрофии правого желудочка // УКЖ. – 2015. – № 3. – С. 84-93.


