6 липня, 2015
Сучасні аспекти профілактики серцево-судинних ускладнень у хворих на цукровий діабет 2 типу: фокус на гіпоглікемічну терапію
 Відомо, що розвиток і прогресування цукрового діабету (ЦД) 2 типу супроводжуються істотним збільшенням ризику фатальних кардіоваскулярних подій у 2-6 разів. При цьому головною причиною смертності є ускладнення ішемічної хвороби серця (ІХС). З огляду на те що ризик коронарної смерті при ЦД є співставним з таким після перенесеного інфаркту міокарда (ІМ) у осіб без цієї ендокринної патології (T.K. Schramm et al., 2008), ЦД 2 типу вважається еквівалентом ІХС. В основі розвитку фатальних і нефатальних кардіоваскулярних ускладнень ЦД лежить тяжке ураження всіх відділів артеріального русла (макро- і мікроциркуляторного) внаслідок взаємодії чотирьох потужних пошкоджуючих чинників: артеріальної гіпертензії – АГ (механічний стрес), діабетичної дисліпідемії (ДЛП), гіперактивації процесів зсідання крові та хронічної гіперглікемії.
Відомо, що розвиток і прогресування цукрового діабету (ЦД) 2 типу супроводжуються істотним збільшенням ризику фатальних кардіоваскулярних подій у 2-6 разів. При цьому головною причиною смертності є ускладнення ішемічної хвороби серця (ІХС). З огляду на те що ризик коронарної смерті при ЦД є співставним з таким після перенесеного інфаркту міокарда (ІМ) у осіб без цієї ендокринної патології (T.K. Schramm et al., 2008), ЦД 2 типу вважається еквівалентом ІХС. В основі розвитку фатальних і нефатальних кардіоваскулярних ускладнень ЦД лежить тяжке ураження всіх відділів артеріального русла (макро- і мікроциркуляторного) внаслідок взаємодії чотирьох потужних пошкоджуючих чинників: артеріальної гіпертензії – АГ (механічний стрес), діабетичної дисліпідемії (ДЛП), гіперактивації процесів зсідання крові та хронічної гіперглікемії.
ЦД часто перебігає приховано, у зв’язку з чим у значної частини хворих його діагностують пізно, коли виникають незворотні зміни з боку артерій і серйозні клінічні прояви макросудинних ускладнень. За даними дослідження Euro Heart Survey (4196 пацієнтів з ІХС, 2107 – з підозрою на ІМ), майже половина хворих, які звертаються до кардіолога з приводу ІХС, мають супутній ЦД. Зокрема, під час обстеження вперше виявлений ЦД діагностують у кожного четвертого-п’ятого пацієнта з гострим коронарним синдромом і у 14% – зі стабільними формами ІХС. Ще у 36-37% хворих виявляють порушення толерантності до глюкози. Таким чином, лише у третини пацієнтів з ІХС не реєструють порушень обміну глюкози (М. Bartnik et al., 2004).
Доведено пряму залежність між рівнями глікемії (натще або після їди) і глікозильованого гемоглобіну (НbА1с) у хворих на ЦД, з одного боку, та серцево-судинною (СС-) захворюваністю і смертністю – з іншого. За даними дослідження UKPDS, збільшення рівня НbА1с на кожен 1% призводить до зростання частоти розвитку ІМ на 14%, інсульту – на 12%, порушень периферичного кровообігу та необхідності проведення ампутацій – на 43% (I.M. Stratton et al., 2000). Збільшення ризику СС-подій спостерігається вже при рівні НbА1с >5,5% у 1,5 раза, при рівні >7,0% він зростає у понад 5 разів (K.T. Khaw et al., 2004). Навіть у осіб без діабету поступове підвищення концентрації HbA1c також супроводжується поступовим збільшенням ризику кардіоваскулярних ускладнень, особливо за наявності інших метаболічних розладів, зокрема АГ, ДЛП, надмірної ваги тощо (J. Meigs et al., 2008). Безпечний та ефективний контроль глікемії – один із найважливіших компонентів терапії, спрямованої на зниження СС-ризику.
Стратифікація СС-ризику у хворих на ЦД 2 типу
Європейську шкалу оцінки сукупного СС-ризику (SCORE) у пацієнтів із ЦД не використовують, оскільки вони автоматично належать до груп високого або дуже високого СС-ризику.
Згідно з рекомендаціями ESC 2012 року з кардіоваскулярної профілактики (J. Perk et al., 2012):
• дуже високий СС-ризик мають усі пацієнти з ЦД 1 або 2 типу + ≥1 фактор ризику (ФР) або ≥1 ураження органів-мішеней, або з верифікованим серцево-судинним захворюванням (ССЗ);
• високий СС-ризик – усі інші хворі на ЦД 1 або 2 типу (без ФР або ураження органів-мішеней).
У хворих з нещодавно діагностованим ЦД, коли відсутні явні ознаки ССЗ, кардіоваскулярний ризик переважно недооцінений. У таких випадках особливу увагу слід звертати на асимптомні ураження органів-мішеней і насамперед на зниження швидкості клубочкової фільтрації (ШКФ) та альбумінурію (у тому числі мікроальбумінурію), яку виявляють у понад половини пацієнтів, що свідчить про дуже високий СС-ризик. Корисним вважається також визначення кісточково-плечового індексу, товщини комплексу інтима-медіа сонних артерій і/або виявлення бляшок, жорсткості стінки артерії за даними вимірювання швидкості пульсової хвилі тощо – маркерів асимптомного атеросклерозу. У таблиці 1 представлено алгоритм ведення хворого на ЦД з підозрою на асимптомні і симптомні серцево-судинні ураження або пацієнта із ССЗ та підозрою на ЦД.
Цільові рівні контролю факторів високого СС-ризику при ЦД 2 типу
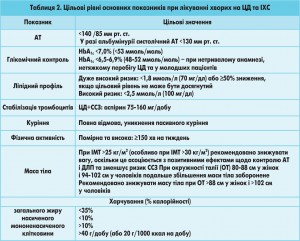
Під час лікування хворих на ЦД з метою зниження ризику розвитку ССЗ або їх ускладнень рекомендовано дотримуватися комплексного підходу щодо контролю всіх ФР. У таблиці 2 наведено цільові рівні артеріального тиску (АТ), глікемічного профілю, ліпідного обміну та головні напрями змін способу життя у пацієнтів з ЦД та ІХС.
Основні заходи програми втручання щодо зниження ризику СС-ускладнень у хворих на ЦД
Рекомендації з модифікації способу життя у пацієнтів із ЦД
• Категорична відмова від куріння.
• Обов’язкові регулярні фізичні навантаження.
• Дієта: дробне збалансоване харчування – 6 разів на добу (невеликими порціями), обмеження вмісту в раціоні простих вуглеводів – цукру, меду, фруктових соків (сувора низьковуглеводна дієта не рекомендується), зниження калорійності харчування при надмірній масі тіла (≤1800 ккал), збільшення споживання клітковини (≥40 г/добу), обмеження вживання алкоголю внаслідок високої калорійності і підвищеного ризику розвитку гіпоглікемії (<30 г/добу).
Контроль АТ у пацієнтів із ЦД
Цільовий рівень АТ – <140/85 мм рт. ст., у разі альбумінурії цільовим є рівень систолічного АТ (САТ) <130/80 мм рт. ст. (2013 ESH/ESC). Фармакотерапію слід розпочинати при рівні САТ >140 мм рт. ст., негайно – при >160 мм рт. ст.
Будь-який лікарський засіб (ЛЗ), що достатньою мірою знижує АТ, загалом є корисним. Однак при лікуванні АГ у хворих на ЦД перевагу надають інгібіторам ренін-ангіотензин-альдостеронової системи – РААС (інгібіторам ангіотензинперетворювального ферменту – ІАПФ або блокаторам рецепторів ангіотензину II – БРА), особливо за наявності протеїнурії або мікроальбумінурії. Не рекомендується застосування комбінації цих ЛЗ. Хворим на АГ з метаболічним синдромом слід уникати використання ЛЗ з негативними метаболічними наслідками, особливо комбінації діуретика і блокатора β-адренорецепторів, як першої лінії терапії.
Корекція діабетичної дисліпідемії
Дисліпідемія є одним із найпотужніших ФР розвитку ССЗ для пацієнтів із ЦД. Їй властива надзвичайно висока атерогенність навіть при невисоких, наближених до норми показниках загального холестерину (ЗХС) і холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ). Для діабетичної ДЛП характерна так звана атерогенна тріада: підвищений вміст дрібних щільних частинок ХС ЛПНЩ й апо-В, низький рівень холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ) та підвищена концентрація тригліцеридів – ТГ (гіпертригліцеридемія).
Результати численних досліджень і метааналізів свідчать про необхідність контролю ліпідного профілю статинами для зниження СС-ризику (CTT Collaboration, 2008). В абсолютній більшості досліджень доведено високу пріоритетність статинів у подоланні діабетичної ДЛП і, відповідно, – зменшенні сукупного кардіоваскулярного ризику на тлі застосування симвастатину та аторвастатину (4S, HPS, ASCOT-LLA, CARE, TNT, ASPEN, CARDS). Згідно з чинними європейськими рекомендаціями з лікування ДЛП (ESC/EAS, 2011) для зниження СС-ризику і покращення атерогенного ліпідного профілю всім пацієнтам із ЦД 2 типу та метаболічним синдромом призначають тривалу статинотерапію з використанням більш активних статинів (ІІІ-IV покоління). Рекомендовано такі цільові рівні ліпідів крові:
1. Зниження рівня ХС ЛПНЩ (мінімум на 30%):
• ЦД 1 типу + хронічна хвороба нирок – ХХН (ШКФ <60 мл/хв і/або протеїнурія), незалежно від вихідного рівня ХС ЛПНЩ;
2. ХС ЛПНЩ <1,8 ммоль/л, ХС-не-ЛПВЩ* <2,6 ммоль/л, апо-B <80 мг/дл:
• ЦД 2 типу + ССЗ;
• ЦД 2 типу + ХХН (ШКФ <60 мл/хв і/або протеїнурія);
• ЦД 2 типу у пацієнтів віком понад 40 років без ССЗ, але з ≥1 ФР і/або ≥1 ураженням органів-мішеней;
3. ХС ЛПНЩ <2,5 ммоль/л, ХС-не-ЛПВЩ* <3,3 ммоль/л, апо-B <100 мг/дл:
• для всіх інших хворих на ЦД 2 типу.
* Рівень ХС-не-ЛПНЩ розраховується як різниця між рівнем ЗХС і ХС ЛПВЩ.
При гіпертригліцеридемії ≥2,3 ммоль/л пацієнтам із ЦД 2 типу в комбінації зі статинами (у невисоких дозах!) слід призначити фенофібрат (ESC/EAS, 2011), який, окрім зниження рівня ТГ і підвищення концентрації ХС ЛПВЩ, має позитивний вплив на мікроциркуляторне русло: знижує ризик розвитку діабетичної ретинопатії, нефропатії і діабетичної стопи. У пацієнтів віком >50 років із ЦД і діабетичною хворобою нирок, яку діагностують при зниженні ШКФ <60 мл/1,73 м2 і/або альбумінурії, рекомендовано застосування ЛЗ, здатних знижувати рівень ХС ЛПНЩ: статинів або комбінації симвастатин/езетиміб для зниження частоти великих СС-подій, у тому числі у хворих після трансплантації нирок (KDOQI Diabetes Guideline, 2012; KDOQI Lipid Management, 2013).
Антиагрегантна терапія при ЦД
Застосування аспірину з метою первинної профілактики ССЗ не рекомендується у пацієнтів із ЦД без ССЗ, однак таку можливість можна розглянути у хворих дуже високого ризику або індивідуально, зокрема призначення низьких доз аспірину (75-160 мг/добу) у чоловіків віком >50 років і жінок віком >60 років з ФР (куріння, АГ, дисліпідемія, сімейний анамнез раннього розвитку ССЗ, альбумінурія). З метою вторинної СС-профілактики пацієнти з ЦД і ССЗ мають отримувати антитромбоцитарну терапію (аспірин 75-160 мг/добу) (Joshua A. Beckman, 2013).
Контроль глікемії.
Вимоги до гіпоглікемічних препаратів
Результати дослідження UKPDS продемонстрували достовірні переваги зниження рівня глікемії у хворих на ЦД. Зменшення HbA1с на 1% супроводжується істотним зниженням ризику розвитку ІМ – на 14%, мікроваскулярних ускладнень – на 37%, порушень периферичного кровообігу – на 43%. Доведено, що будь-яке зниження HbA1c зменшує кардіоваскулярний ризик. При цьому найнижчим він є в осіб зі значенням HbA1c у межах норми (<6,0%) (I.M. Stratton et al., 2000). Водночас після завершення дослідження ACCORD, у якому взяли участь хворі на ЦД 2 типу дуже високого СС-ризику (з клінічними проявами атеросклерозу, альбумінурією, гіпертрофією лівого шлуночка та/або ≥2 додатковими ФР), з’ясувалося, що інтенсивний контроль глікемії (НbА1с <6,0%), порівняно зі стандартною гіпоглікемічною стратегією (НbА1с 7-7,9%), може призводити до збільшення у них загальної (на 22%) та кардіоваскулярної смертності (на 35%) за відсутності суттєвого зниження частоти основних кардіоваскулярних подій (нефатальний ІМ, інсульт). Особливо високий ризик загальної смерті на фоні інтенсивної гіпоглікемічної терапії виявлено у пацієнтів зі встановленими ССЗ, більш тривалим перебігом діабету (розвиток до 65 років) і вищим НbА1с (>8%) (ACCORD Study Group, 2008), що пов’язано з істотним зростанням частоти гіпоглікемічних станів у 2,0-2,5 раза (у тому числі тяжких) та збільшенням маси тіла (в середньому на 2,5 кг більше, ніж у групі контролю) (T.N. Kelly et al., 2009; K.K. Ray et al., 2009; F.M. Turnbull et al., 2009). Водночас деяке покращення кардіоваскулярного прогнозу на тлі більш інтенсивної гіпоглікемічної терапії все-таки спостерігали, однак лише серед хворих без попереднього анамнезу макросудинних ускладнень та в осіб з нетяжким перебігом діабету (НbА1с <8%) (ACCORD Study Group, 2008).
Гіпоглікемізуюча терапія є необхідним компонентом лікування пацієнтів із ЦД 2 типу. Однак сучасна доказова база дозволяє зробити висновок про необхідність диференційованого підходу щодо її інтенсивності з урахуванням віку, коморбідних станів, стадії діабету та ризику розвитку гіпоглікемій. Контроль глікемії має бути індивідуалізованим, а його інтенсивність визначається тривалістю діабету, наявністю супутньої патології та віком (ADA/EASD, 2013).
Критерії ефективного глікемічного контролю:
• рівень HbА1с <7,0% (ADA/EASD, 2013; ADA, 2014) рекомендований більшості пацієнтів із ЦД з метою зниження ризику розвитку мікросудинних ускладнень (ідеальний рівень глікемії натще – <7,2 ммоль/л; постпрандіальної – <10 ммоль/л) (ADA/ EASD, 2013; ADA, 2014);
• рівень HbА1с <6,5-6,9% (ADA/EASD, 2013) і навіть 6,0-6,5% (ADA, 2014) – для молодих пацієнтів, переважно без ССЗ, з нетривалим перебігом ЦД, якщо такого показника можна досягти без розвитку гіпоглікемії;
• у пацієнтів похилого віку з епізодами тяжкої гіпоглікемії, тяжкими ускладненнями і супутніми захворюваннями рекомендованим є рівень HbA1c <8,0% або навіть вище (ADA, 2014).
У наш час арсенал ЛЗ для гіпоглікемічної терапії значно розширився завдяки впровадженню у клінічну практику нових груп препаратів.
Лікарські засоби для контролю глікемії за точками прикладання поділяють на такі групи:
1) інсулін та його регулятори (інсулін, похідні сульфонілсечовини, меглітиніди, GLP-1-аналоги, інгібітори дипептидилпептидази-4 – DPP-4);
2) ЛЗ, які підвищують чутливість до інсуліну (бігуаніди – метформін); PPAR-γ агоністи – глітазони (піоглітазон);
3) інгібітори всмоктування глюкози (інгібітор альфа-глікозидази – акарбоза; інгібітори натрій-глюкозного котранспортера 2 типу – SGLT2).
ЛЗ, які застосовуються для контролю глікемії у пацієнтів із ЦД
Інсуліни:
• швидкодіючі (прості), тривалість дії 6-8 год;
• середньої тривалості дії, тривалість дії від 10-16 до 18-24 год (тривалої дії, тривалість дії – 28-36 год.
Бігуаніди (метформін)
PPAR-γ агоністи – глітазони (тіазолідиндіони) – піоглітазон, розиглітазон, ривоглітазон.
Похідні сульфонілсечовини:
• I генерації (толбутамід, гліклазид);
• II генерації (гліпізид, глібенкламід, гліквідон);
• III генерації (глімепірид).
Поcтпрандіальні регулятори секреції інсуліну – меглітиніди (натеглінід, репаглінід, мітиглінід).
GLP-1-аналоги (екзенатид, ліраглютид, албіглютид).
Інгібітори дипептидилпептидази-4 (DPP-4), гліптини (алогліптин, лінагліптин, саксагліптин, сітагліптин, вілдагліптин)
Подвійні PPAR-γ агоністи (алеглітазар, мураглітазар, тезаглітазар)
Селективні інгібітори натрій-глюкозного котранспортера 2 типу (інгібітори SGLT2) – дапагліфлозин, ремогліфлозин, сергліфлозин
ЛЗ, що сповільнюють всмоктування вуглеводів, – інгібітори α-глюкозидази (акарбоза, міглітол, гуарова смола)
Під час вибору препаратів для гіпоглікемічної терапії слід враховувати як побічні ефекти (ризик гіпоглікемії), так і їх вплив насамперед на постпрандіальну глікемію з огляду на її більше прогностичне значення щодо розвитку атеросклерозу, ІМ та смертності (M. Hanefeld et al., 1999). Надмірно підвищена концентрація глюкози після їди, яка не нормалізується перед наступним прийомом їжі, призводить до зростання рівня глікемії натще. У дослідженні DECODE (Diabetic Epidemiology Collaborative Analysis Of Diagnostic Criteria in Europe; DECODE study group, 1999) оцінювали ризик смерті при різних варіантах гіперглікемії у понад 25 тис. пацієнтів. Було виявлено, що ризик смерті від будь-яких причин достовірно збільшувався при постпрандіальній глікемії, тоді як підвищення рівня глюкози натще мало менше прогностичне значення. Рівень глікемії понад 8-9 ммоль/л збільшує ризик СС-смертності у 2 рази, а >14 ммоль/л – утричі.
Щодо побічних ефектів, то найпоширенішою проблемою безпеки гіпоглікемічної терапії є ризик розвитку гіпоглікемічних станів, які супроводжуються гіперактивністю симпатоадреналової системи, збільшенням частоти серцевих скорочень, зростанням ризику аритмій, раптової смерті та гострих коронарних подій, посиленням прогресування серцевої недостатності, підвищенням частоти церебральних ускладнень (ішемічних атак, деменції) тощо (Ahrеn Bo, 2013). Згідно з результатами аналізу побічних ефектів гіпоглікемічної терапії у 2074 хворих на ЦД 2 типу, лікованих більш ніж одним пероральним препаратом, що проводився на основі даних інформаційної бази суспільного здоров’я США (2006-2008), симптоми гіпоглікемії є найпоширенішими і спостерігаються у 57,2% випадків. Їх реєструють удвічі частіше, ніж, наприклад, шлунково-кишкові розлади (28%) та інші небажані ефекти будь-якої фармакотерапії (M.F. Pollack et al., 2010). Відносний ризик макроваскулярних ускладнень при виникненні навіть нетяжкої гіпоглікемії становить 3,53, тяжкої – 4,05; мікроваскулярних – відповідно 2,19 та 2,39; загальної смерті – 3,27 і 4,86; кардіоваскулярної смерті – 3,79 та 4,84; некардіоваскулярних ускладнень – 2,80 і 4,82 (S. Zoungas et al., 2010). Найчастіше епізоди гіпоглікемій розвиваються на тлі лікування інсуліном, меглітинідами та препаратами сульфонілсечовини (ESC Guidelines on diabetes, 2013). Порівняно з іншими групами пероральних цукрознижувальних ЛЗ, наприклад бігуанідами чи тіазолідиндіонами, застосування препаратів сульфонілсечовини зумовлює збільшення ризику розвитку гіпоглікемій у 2-4 рази, особливо тяжких. Зокрема, за даними чотирирічного спостереження у рамках дослідження ADOPT, епізоди гіпоглікемії реєстрували у 9,8% хворих, які приймали розиглітазон, у 11,6% – на тлі використання метформіну та у 38,7% – при лікуванні глібенкламідом (S.E. Kahn et al., 2006). Було продемонстровано здатність препаратів сульфонілсечовини збільшувати СС-ризик порівняно з іншими ЛЗ (I. Tzoulaki, 2009). Вважається, що застосування препаратів сульфонілсечовини останніх поколінь асоціюється з нижчим ризиком виникнення епізодів гіпоглікемій, проте цей показник залишається суттєво вищим, ніж при використанні інших груп ЛЗ.
Іншою несприятливою особливістю гіпоглікемічної терапії є збільшення маси тіла пацієнтів, що погіршує їх метаболічний статус та зумовлює підвищення кардіоваскулярного ризику. Збільшення ваги спостерігається при застосуванні препаратів сульфонілсечовини, тіазолідиндіонів і глінідів.
Таким чином, основними вимогами до гіпоглікемічного препарату у хворих на ЦД 2 типу є ефективний контроль рівня глікемії (насамперед, постпрандіальної), мінімальний ризик розвитку гіпоглікемії та відсутність несприятливого впливу на масу тіла, сприятливий кардіоваскулярний профіль і зручність застосування.
На сьогодні запропоновано декілька алгоритмів вибору гіпоглікемічної фармакотерапії при ЦД. Згідно з більшістю сучасних рекомендацій ЛЗ першої лінії для лікування хворих на ЦД 2 типу є метформін. Дозу метформіну підбирають залежно від тяжкості порушень вуглеводного обміну (від 500 мг 1 раз на добу до 850-1000 мг 2 рази на добу). За потреби можна використовувати комбінацію двох або трьох гіпоглікемічних пероральних ЛЗ з різним механізмом дії.
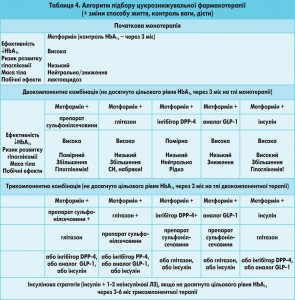
Серед ЛЗ, які відповідають сучасним вимогам до ефективної та безпечної гіпоглікемічної терапії, у тому числі для осіб дуже високого СС-ризику, особливе місце посідають інгібітори дипептидилпептидази-4 (DPP-4) – алогліптин, ситагліптин, лінагліптин, саксагліптин, вілдагліптин. Застосування цих препаратів дозволяє скоригувати характерне для ЦД 2 типу зниження другої фази секреції інсуліну, тобто зробити профіль інсулінової секреції у таких хворих більш фізіологічним. Глюкозозалежний механізм дії цих препаратів поряд з доведеною цукрознижувальною ефективністю істотно знижує ризик розвитку гіпоглікемій і має потенційно сприятливий кардіоваскулярний профіль. Першим і найбільш вивченим інгібітором DPP-4 є ситагліптин, дозволений для широкого використання в лікарській практиці з кінця 2006 року. Згідно з результатами нещодавно опублікованого метааналізу 19 досліджень (10 246 хворих на ЦД 2 типу) при лікуванні ситагліптином порівняно із застосуванням інших протидіабетичних препаратів спостерігається достовірно менша кількість побічних ефектів, насамперед унаслідок суттєво нижчої частоти розвитку гіпоглікемії (3,5 проти 7,5 на 100 пацієнто-років). Відносний ризик кардіоваскулярних подій у пацієнтів, лікованих ситагліптином, становив 0,67-0,68 і виявився на третину нижчим, ніж у групі плацебо (D. Williams-Herman et al., 2010). Результати низки клінічних досліджень свідчать також про додаткові плейотропні кардіопротекторні властивості інгібіторів DPP-4 (J.A. Davidson, 2009), імовірно, пов’язані з опосередкованою стимуляцією рецепторів до глюкагоноподібного пептиду-1, розташованих у клітинах не тільки підшлункової залози, а й нирок, легень, мозку, серця. Встановлено їх здатність покращувати ліпідний обмін, контроль АТ (G.C. Mistry et al., 2008), знижувати рівень С-реактивного протеїну (G. Derosa et al., 2010), зберігати ШКФ та покращувати деякі показники внутрішньосерцевої гемодинаміки при серцевій недостатності (N. Gomez et al., 2012). Згідно із сучасними принципами вибору ЛЗ для гіпоглікемічної терапії у хворих на ЦД 2 типу інгібітори DPP-4 можуть призначатися як препарати першої лінії (у тому числі за наявності протипоказань до застосування метформіну), а також у комбінації з метформіном або іншими ЛЗ в якості другого або третього препарату (табл. 4).
Висновки
Основною метою лікування хворих на ЦД 2 типу є максимальне зниження СС-ризику, що забезпечують суворий контроль АГ й ліпідного обміну, антиагрегантна терапія та індивідуалізований контроль глікемії (рівень HbА1с – 7-8%). Під час вибору препаратів для гіпоглікемічної терапії слід враховувати ризик побічних кардіоваскулярних ефектів (насамперед ризик розвитку гіпоглікемій) і їх вплив на постпрандіальну глікемію з огляду на її суттєво більше прогностичне значення щодо розвитку атеросклерозу, ІМ та смертності. Інгібітори DPP-4 – ефективні гіпоглікемічні ЛЗ з фізіологічною дією на постпрандіальну глікемію, що не збільшують ризик розвитку гіпоглікемії, не підвищують масу тіла і мають потенційно сприятливий СС-профіль. Вони можуть використовуватися як у моно-, так і у складі комбінованої гіпоглікемічної терапії хворих на ЦД 2 типу з високим і надвисоким СС-ризиком.