1 квітня, 2015
Диагностическая ценность галектина-3 как биомаркера сердечной недостаточности
В настоящее время сердечная недостаточность (СН) является одной из актуальных проблем здравоохранения во многих странах мира, при этом в большинстве из них точные данные о заболеваемости и распространенности СН отсутствуют.
СН ассоциируется со значительной стоимостью лечения больных, высоким уровнем их инвалидизации и смертности. Следует отметить, что иногда определить причину СН не удается, поэтому особое внимание уделяется поиску биомаркеров для дифференциальной диагностики, которые могут применяться как для идентификации стадии СН, так и для оценки риска, прогноза заболевания и дальнейшего мониторирования эффективности терапии.
К настоящему времени определено большое количество (свыше 100) биомаркеров, которые имеют тесную связь с развитием СН, однако интерпретация таких аналитов и клиническое значение очень часто далеки от идеала [7]. К биологическим маркерам предъявляются не только такие требования, как точность, надежность, воспроизводимость, чувствительность и специфичность, – желательно, чтобы они не зависели от возрастных, расовых и половых отличий, а также, что чрезвычайно важно, предполагали однозначную интерпретацию результатов. Сейчас обсуждают потребность в новых маркерах, которые не только обнаруживаются при патологическом процессе, но и непосредственно участвуют в патогенезе сердечно-сосудистых заболеваний, что повышает прогностическую ценность указанных маркеров и делает их потенциальными мишенями для терапевтического воздействия.
Одним из таких маркеров является галектин-3, который относится к семейству белков галектинов, способных связываться с остатками β-галактозы гликопротеинов и гликолипидов. Галектины присутствуют в тканях организмов живых существ – начиная от низших беспозвоночных до млекопитающих. Различные члены этого семейства играют роль в регуляции роста, клеточной адгезии и миграции, в некоторых случаях связаны с опухолевой трансформацией клетки и метастазами, участвуют в клеточной сигнализации и регулировании иммунного ответа [1].
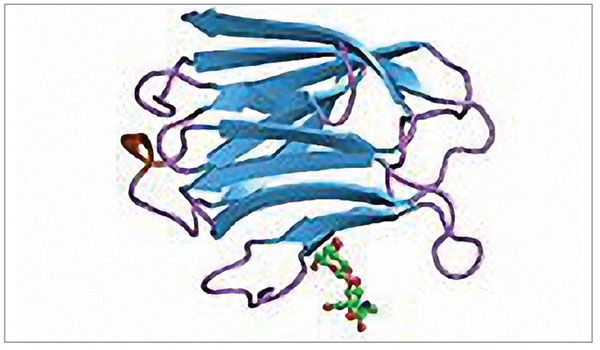
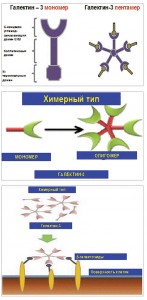
Все представители галектинов состоят из полипептидного участка, содержащего последовательность из 70-130 аминокислот, связанных с одним или несколькими углеводными остатками посредством специфического домена CRD (carbohydrate-recognition domain). Уже идентифицированы 15 членов этого семейства. Изоформы 1, 2, 5, 7, 10, 11, 13-15 содержат только один домен CRD, другие представители этого семейства имеют два гомологичных домена CRD в составе одной полипептидной цепи (изоформы 4, 6, 8, 9 и 12; рис. 1).
Открытие нового биомаркера галектина-3, известного также как Mac-2, CBP-35, L29, LBP, считается современным достижением молекулярной биохимии (рис. 2).
Это белок с молекулярной массой 30 кДа, имеющий структуру в виде тандемных повторов коротких аминокислотных последовательностей, его N-концевой домен связан с С-концевым углеводраспознающим доменом. При этом С-концевой домен отвечает за лектиновую активность, а присутствие N-концевого домена необходимо для полной биологической активности галектина-3 [4] (рис. 3).
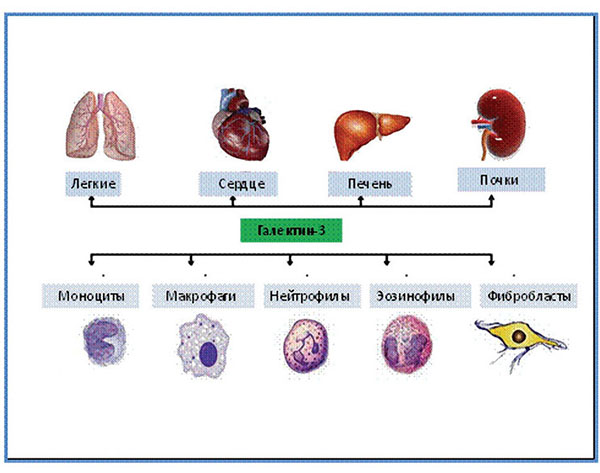
Галектин-3 находится в клетках разных тканей. Наибольшее его количество содержится в тканях легких, селезенки, желудка, толстой кишки, надпочечников, матки, яичников. Гораздо более низкий уровень галектина-3 содержится в тканях почек, сердца, головного мозга, поджелудочной железы и печени. При патологических процессах уровень экспрессии галектина-3 может существенно изменяться. Галектин-3 экспрессируется на поверхности мембран различных клеток, включая макрофаги, эозинофилы, нейтрофилы, моноциты и фибробласты [5] (рис. 4).
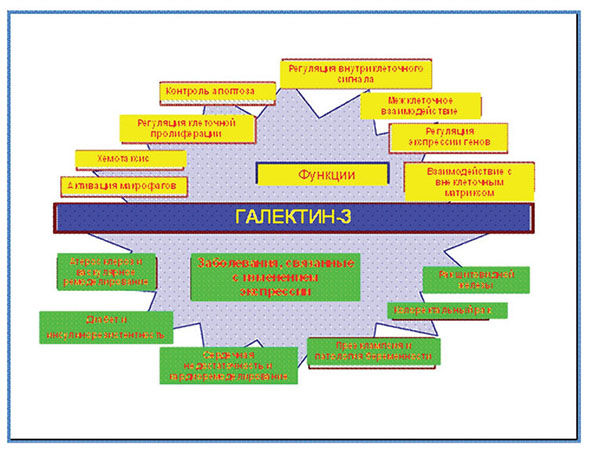
Галектин-3 задействован во многих биологических процессах, таких как фиброз миокарда, эндогенное воспаление, рост и пролиферация клеток, апоптоз; выступает как индуктор миграции макрофагов и др. [2, 3] (рис. 5).
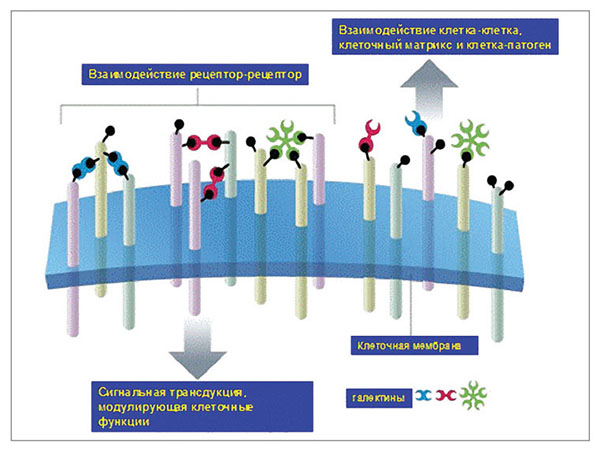
Благодаря особенностям пространственной конфигурации и химической структуре галектин-3 обладает способностью к распознаванию молекул углеводов и коллагенподобных доменов, что позволяет взаимодействовать с широким спектром внеклеточных сахаров, белков, а также негликозилированных молекул и внеклеточных рецепторов. Галектин-3 локализуется в цитоплазме, саркоплазматическом ретикулуме, ядре и митохондриях. Цитозольный пул галектина-3 при активации смещается к плазматической мембране и интегрируется для выделения из мембраны (рис. 6).
В настоящее время обобщены последние достижения в области исследований галектина-3 с акцентом на роль в развитии СН, прогрессировании фиброза предсердий, ремоделировании сердца. Установлено, что экспрессия галектина-3 минимальна или практически отсутствует у здоровых лиц и у пациентов во время ремиссии либо в компенсаторной стадии. В то же время экспрессия указанного биомаркера максимальна на пике фиброза и воспаления.
Большинство биомаркеров, таких как тропонин и натрийуретические пептиды, продуцируются и поступают в сосудистое русло в результате патологических процессов. Таким образом, они представляют собой результат, а не причину повреждения и могут рассматриваться как показатели патологического процесса.
При проведении клинических исследований было установлено, что экспрессия галектина-3 возрастает у пациентов с функцией выброса левого желудочка независимо от этиологии СН, что послужило поводом рассматривать плазменное содержание галектина-3 как маркер последней [8].
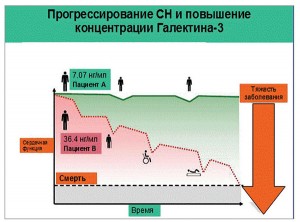
В плазме здорового индивида уровень галектина-3 составляет в среднем 7,07 нг/мл (4,67-10,30 нг/мл). Галектин-3 соотносится с тяжестью СН: чем выше функциональный класс, тем выше уровень галектина-3 и тем более высокими являются показатели смертности (рис. 7).
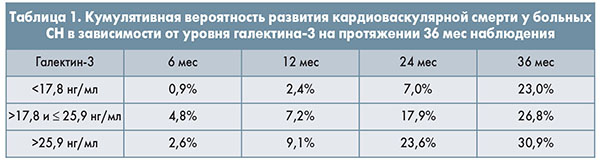
В зависимости от концентрации галектина-3 выделяют 3 категории риска: ≤17,8 нг/мл (низкий риск), 17,9-25,9 нг/мл (средний риск) и >25,9 нг/мл (высокий риск).
Показана вероятность развития кардиоваскулярной смерти у больных СН на протяжении 3 лет (табл. 1).
В последние годы опубликовано значительное количество клинических исследований, посвященных оценке информативности галектина-3 как биомаркера СН. Выводы этих исследований можно суммировать следующим образом:
• доказана диагностическая ценность плазменной/сывороточной концентрации галектина-3;
• возможно использование в практической кардиологии галектина-3 для стратификации риска с целью назначения адекватной терапии;
• оценка уровня галектина-3 может использоваться для мониторинга назначенной терапии;
• галектин-3 может быть прогностическим маркером долгосрочной заболеваемости и смертности.
С 2013 г. галектин-3 включен в действующее клиническое соглашение по профилактике и лечению СН Американской ассоциации сердца как дополнительный маркер стратификации высокого риска возникновения неблагоприятных клинических исходов (смерть и повторная госпитализация) [6].
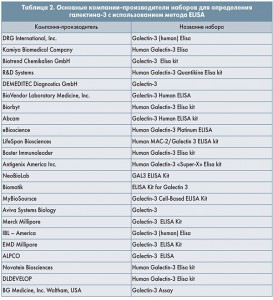
Определение концентрации галектина-3 можно успешно использовать в повседневной клинической практике, т. к. более чем 20 компаний-производителей выпускают соответствующие наборы для исследования данного аналита. Формат наборов стандартный – 96-луночные плашки, покрытые моноклональными антителами к человеческому галектину-3, метод – ELISA (Enzyme-Linked Immunosorbent Assay; табл. 2).
Литература
1. Cooper D.N. Galectinomics: finding themes in complexity / D.N. Cooper // Biochim Biophys Acta. – 2002. – Vol. 1572. – P. 209-231.
2. De Filippi C.R. Galectin-3 in heart failure-linking fibrosis, remodeling and progression / C.R. de Fi-lippi, G.M. Felker // US Cardiology 2010, 7 (1): 67-70.
3. Galectin-3 regulates myofibroblast activation and hepatic fibrosis / N.C. Henderson, A.C. Mackinnon, S.L. Ganworth // Proc. Nat. Acad. Sci. 2006.
Vol. 103. – P. 5060-5065.
4. Boer R.A. Galectin-3: a novel mediator heart failure development and progression / R.A. Boer, A.A. Voors, P. Muntendam // Eur J Heart Fail 2009. – Vol. 33 (1). – P. 16.
5. Expression and immunohistochemical localization of galectin-3 in various mouse tissues / H. Kim, J. Lee, J.W. Hyun et al. // Cell / Biol. Int. – 2007. – 31. – P. 655-662.
6. 2013 ACCEF/AHA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines / C.W. Yancy, M. Jessup, B. Bozkurt et al. // Circulation 2013, Jun 5.
7. La Baer J. So, you want to look for biomarkers // J. Proteome Res. 2005; 4: 1053-1059.
8. Lin Y.H., Lin L.Y., Wu Y.W. et al. The relationship between serum galectin-3 and serum markers of cardiac extracellular matrix turnover in heart failure patients // Clin. Chim. Acta. 2009; 409: 96-99.