13 лютого, 2015
Досвід застосування збагаченої тромбоцитами плазми в лікуванні остеоартрозу колінних суглобів
Л.В. Хіміон, д.м.н., завідувач кафедри сімейної медицини Національної медичної академії післядипломної освіти ім. П.Л. Шупика, О.А. Бур'янов, д.м.н., професор, завідувач кафедри травматології та ортопедії Національного медичного університету ім. О.О. Богомольця, С.В. Данилюк, к.м.н., О.Б. Ященко, к.м.н., Л.О. Смоліна, Г.О. Гаврилюк, Національна медична академія післядипломної освіти ім. П.Л. Шупика, м. Київ
Згідно з даними світової медичної статистики одним із найбільш поширених та соціально значущих ревматичних захворювань є остеоартроз (ОА). Кількість випадків захворювання та вартість лікування щорічно зростають у глобальному масштабі, спонукаючи і науковців, і практиків до пошуків нових методів лікування. Так, очікується, що до 2030 року потреба населення США у проведенні ендопротезування колінних суглобів з приводу ОА зросте на 640%, а витрати на фармакологічне, реабілітаційне та хірургічне лікування ОА лише цієї локалізації – на мільярди доларів.
З огляду на глобальне постаріння населення так званих цивілізованих країн світу, а також відому тенденцію до «омолодження» ОА кількість пацієнтів, які потребуватимуть як терапевтичного, так і хірургічного лікування ОА, неухильно зростатиме. Водночас, незважаючи на проведення масштабних експериментальних і клінічних досліджень, на сучасному етапі практикуючий лікар не має засобів консервативного лікування ОА, які здатні достовірно позитивно впливати на біохімічні та імунозапальні чинники, що лежать в основі патогенезу і прогресування дегенерації хряща при ОА.
Згідно із сучасними уявленнями прогресуючий перебіг ОА пов'язаний із розвитком у хрящовій тканині стійкого дисбалансу між прозапальними (фактор некрозу пухлин (ФНП), інтерлейкіни (ІЛ) 1α, 1β) і протизапальними цитокінами (ІЛ-10, ІЛ-4, ІЛ-1Rα) у бік переважання прозапальних факторів, що призводить до активації протеолітичних ферментів і прогресуючої деструкції суглобового хряща. Крім того, відносно ОА колінних суглобів доведено залучення до патологічного процесу субхондральної кістки, синовії, зв'язок, капсули суглоба і, можливо, сенсорних нервових закінчень. На жаль, на сучасному етапі не існує фармакологічних засобів, які реалізують достовірно підтверджений позитивний вплив на зазначений комплекс імунологічних, біохімічних та біомеханічних чинників, задіяних у розвитку і прогресуванні дегенерації суглобового хряща. Тому на сьогодні надзвичайно актуальними завданнями є пошук та оцінка ефективності нових методів лікування й попередження прогресування ОА, особливо таких, які мають комплексний вплив на суглобові тканини, відрізняються економічністю та простотою використання, оскільки лікування неускладненого ОА має відбуватися в умовах первинної ланки системи охорони здоров'я.
У контексті вищенаведених міркувань нашу увагу привернув порівняно новий метод лікування ОА, що пов'язаний із внутрішньосуглобовим введенням аутологічної збагаченої тромбоцитами плазми (АЗТП).
Згідно з опублікованими даними вперше АЗТП було використано в 1987 р. під час операції на серці М. Феррарі як аутологічний компонент для швидшого загоєння післяопераційних ран. У середині 1990-х років спостерігалося значне поширення застосування методу в терапії спортивних травм і для уповільнення прогресування кістково-хрящових дефектів. Ефективність введення АЗТП у таких випадках довели лікарі спортивної медицини, які використовували АЗТП в лікуванні та відновленні олімпійських спортсменів. Отримані ними дані були опубліковані в журналі Американської медичної асоціації; водночас доступні і позитивні результати застосування АЗТП спеціалістами з Європи.
АЗТП – це біологічний продукт, отриманий із крові людини, із значним вмістом тромбоцитів у невеликій кількості плазми. Якщо трактувати дослівно, то терміном «збагачена тромбоцитами плазма» позначають плазму, у якій концентрація тромбоцитів перевищує фізіологічну норму. У нормі кількість тромбоцитів у крові дорослої людини коливається від 150 до 350-400 тис./мкл і в середньому становить 200 тис./мкл. Тромбоцити – це дрібні без'ядерні клітини крові, які відіграють основну роль у процесах гемостазу, а також містять різні білки, цитокіни та інші біоактивні чинники, у тому числі так звані фактори росту, які стимулюють і регулюють основні ланки процесу регенерації при ушкодженнях різних тканин. Збагачена тромбоцитами плазма – це плазма, яка містить близько 1 млн/мкл тромбоцитів (не менше 700 тис./мкл); у такій плазмі міститься в 3-5 разів більше факторів росту, ніж у цільній крові.
Нині АЗТП досить широко використовується для прискорення репарації м'язів, сухожиль після травм та в разі їх ускладнень (хронічних виразок, тендинопатій); у стоматології та хірургії щелепно-лицьової ділянки; пластичній хірургії і корекційній косметології.
В усіх випадках теоретичним базисом для використання АЗТП є наявність у тромбоцитах у значній концентрації факторів росту та цитокінів, які регулюють процеси відновлення й репарації різних тканин організму, включаючи регуляцію міграції та проліферації клітин, ангіогенез, управління процесом запалення та синтезу колагену.
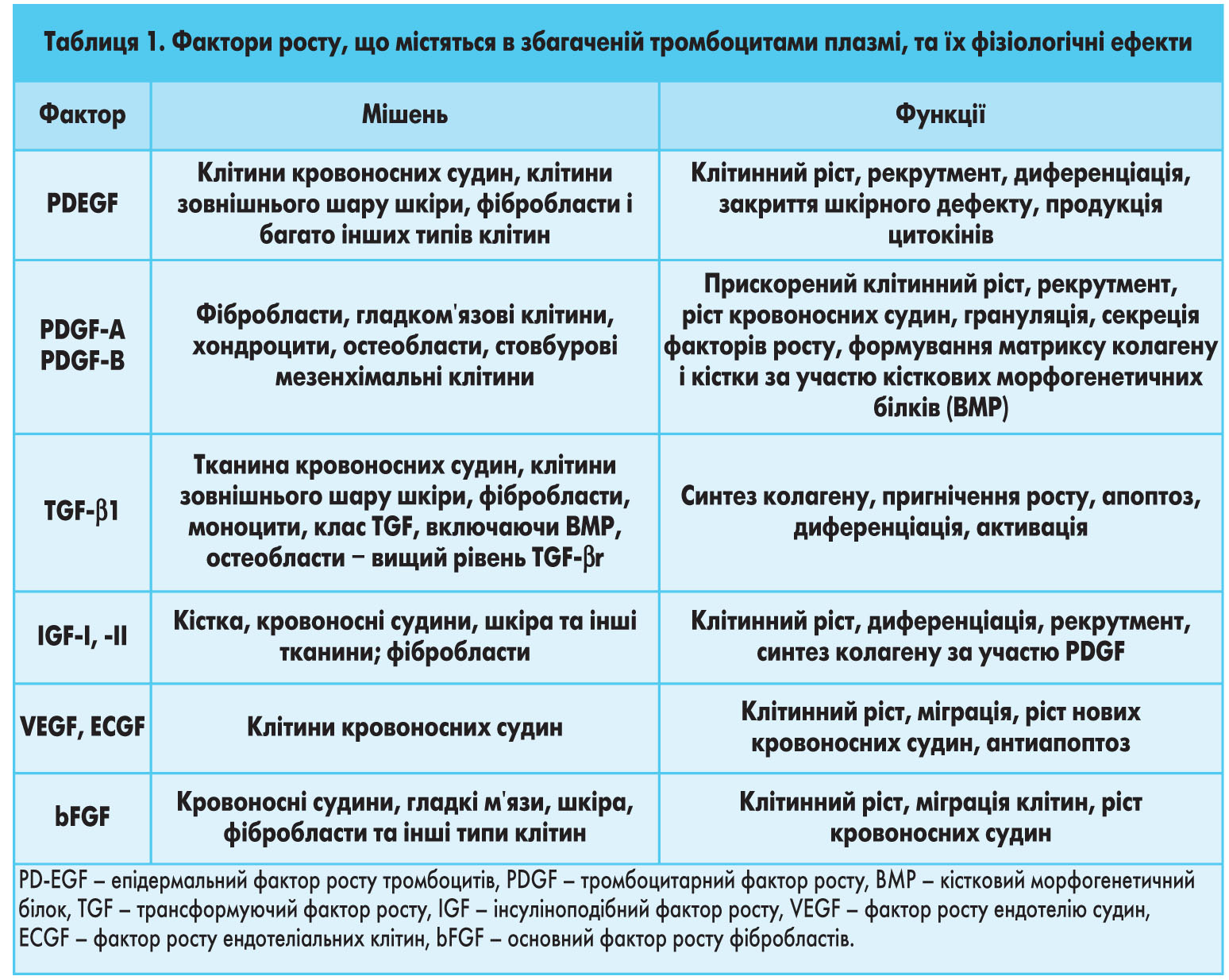
Крім того, тромбоцитарна аутоплазма модулює і регулює функцію первинних факторів росту. Згадана властивість відрізняє фактори росту тромбоцитарної аутоплазми від рекомбінантних факторів росту, кожен з яких відповідає за окремий механізм регенерації та знаходиться в системі складного й багатосходинкового регулювання каскаду ключових клітинних процесів, таких як клітинна проліферація, хемотаксис, диференціація та ангіогенез. У таблиці 1 перераховано основні фактори росту, що містяться у збагаченій тромбоцитами плазмі, і їх відомі функції. Зазначені фактори виділяються разом із цитокінами (такими як ІЛ-1 і ФНП) під час руйнування мембрани клітинних елементів з α-гранул тромбоцитів. Основні цитокіни, виявлені в тромбоцитах, включають: трансформуючий фактор росту β (TGF-β), тромбоцитарний фактор росту (PDGF), інсуліноподібний фактор росту (IGF-I, IGF-II), фактор росту фібробластів (FGF), епідермальний фактор росту (EGF), фактор росту ендотелію судин (VEGF або PDAF), фактор росту ендотеліальних клітин (PDEGF) і плацентарні ростові фактори (PLGF-1/-2); тромбоспондин, остеонектин.
АЗТП отримують за допомогою різноманітних, але однотипних і загалом нескладних методів – шляхом центрифугування венозної крові пацієнта, при якому відбувається сепарація плазми із підвищеним вмістом тромбоцитів від інших клітинних елементів крові (іноді застосовується плазма, що містить як тромбоцити, так і лейкоцити). Процес не потребує вартісного спеціального обладнання чи тривалого навчання медичного персоналу, не займає багато часу, а отже, за визнанням багатьох науковців та клініцистів, є недорогим, простим, ефективним та мінімально інвазивним методом одержання «коктейлю» із власних факторів росту та цитокінів у високій концентрації для подальшого використання з метою відновлення різноманітних тканин організму на молекулярно-клітинному рівні. Окрім ростових факторів, АЗТП містить низку біологічно активних субстанцій, які чинять протизапальну, антибактеріальну і фунгіцидну дію, що може мати позитивний ефект при лікуванні ОА.
Свідченням зростання інтересу вчених до потенціалу застосування АЗТП є збільшення з року в рік кількості наукових публікацій з цієї проблеми. При цьому важливо наголосити на наявності не лише клінічних спостережень, а й експериментальних досліджень. Так, в експерименті на клітинних лініях хондробластів і синовіоцитів людини E.A. Sundman і співавт. продемонстровано, що АЗТП порівняно з гіалуроновою кислотою не лише зменшує вміст у тканинах найбільш активного прозапального цитокіну – ФНП, а й достовірно знижує експресію гена ММР-13 у синовіоцитах (ген індукує синтез металопротеїназ), завдяки чому можна теоретично припустити інгібуючий вплив на деградацію хряща; водночас у лініях клітин після додавання АЗТП виявлено підвищення експресії генів, що індукують синтез колагену, отже, можливо, і in vivo збагачена тромбоцитами плазма має позитивний вплив як на уповільнення деструкції, так і на пришвидшення відновлення суглобових тканин, у тому числі хряща. Цікавою знахідкою цього експериментального дослідження стало виявлення стимулюючого впливу АЗТП на синтез ендогенної гіалуронової кислоти синовіоцитами, що при клінічному застосуванні може забезпечити виражений лікувальний та профілактичний ефект у пацієнтів з ОА.
В експериментальному дослідженні El-Sharkawy і співавт. (2007) продемонстровано виражений протизапальний вплив АЗТП на культуру моноцитів, що проявлявся у пригніченні синтезу прозапальних цитокінів моноцитами та збільшенні продукції протизапальних факторів у разі обробки клітин збагаченою тромбоцитами плазмою. Схожі ефекти при використанні АЗТП із культурою хондроцитів із змодельованим запаленням (за допомогою ІЛ-1) отримано й іншими дослідниками (van Buul G.M. et al., 2011): на цій експериментальній моделі ОА продемонстровано зменшення ІЛ-1-асоційованого запалення, у тому числі пригнічення активації ядерного фактора каппа В (NFkB), що лежить в основі патогенезу прогресування деградації хрящової тканини при ОА.
Важливі результати щодо сили протизапального ефекту АЗТП отримано K. Beizel і співавт. (2014), які здійснили порівняльний експеримент на культурі клітин ендотелію умбілікальної вени: культура, що спочатку стимулювалася до виникнення запального процесу, надалі обробляли одним із трьох препаратів – кеторолаком, метилпреднізолоном і АЗТП. Отримані результати дозволили дослідникам дійти висновку, що при переважанні протизапального ефекту на тлі застосування метилпреднізолону пригнічення запалення під впливом АЗТП і кеторолаку було співставним.
Окрім низки експериментальних досліджень, ефективність і безпеку застосування АЗТП, зокрема при ОА великих суглобів (найчастіше – колінних), на сьогодні продемонстровано і в клінічній практиці. Так, згідно з даними нових досліджень американських, європейських та російських науковців позитивні результати на тлі використання АЗТП у вигляді локальної терапії отримано при лікуванні хворих на ОА: виявлено зменшення прогресування запального та дегенеративного процесу в суглобах, що супроводжувалося значним покращенням якості життя пацієнтів.
У 2009 році американські дослідники (T.E. Foster et al., 2009) опублікували результати подвійного сліпого клінічного дослідження, проведеного за участю двох груп пацієнтів, наголосивши на позитивному ефекті застосування АЗТП в лікуванні ОА колінних суглобів. У цьому дослідженні одна група хворих (n=39) отримувала ін'єкції АЗТП, а друга (n=39) – інтрасуглобові ін'єкції препаратів гіалуронової кислоти. Дослідники виявили, що ін'єкції АЗТП сприяли зменшенню інтенсивності больових відчуттів на 56% і припиненню на час спостереження подальшого прогресування ОА в колінних суглобах у 73% пацієнтів. Автори дійшли висновку, що ефективність лікування ОА колінних суглобів із використанням АЗТП перевищує ефективність застосування препаратів гіалуронової кислоти на ранніх стадіях захворювання.
Одночасно голландські ортопеди з медичного центру Еразмус на чолі з Р. де Восом провели дещо інше дослідження щодо АЗТП. Було відібрано 54 пацієнти віком 20-35 років та подібними скаргами (на біль в ахілловому сухожилку після травми). Хворих розподілили на дві групи. Перша група отримувала плацебо (фізіологічний розчин), а друга група – АЗТП у вигляді 3 ін'єкцій з інтервалом 7 днів кожна. На підставі результатів оцінки стану пацієнтів обох груп через 6, 12 та 24 тижні колективом дослідників було зроблено висновок про ефективність та безпеку застосування АЗТП в комплексній консервативній терапії ушкоджень ахіллового сухожилка.
За даними російських дослідників (В.Л. Брехов, 2007), застосування АЗТП оптимізує процеси репаративного остео- і хондрогенезу, що покращує результати хірургічного лікування хворих з дефектами кісткової і хрящової (суглобової) тканин, зменшує кількість реостеосинтезів у 7 разів і призводить до скорочення термінів недієздатності на 15%.
K. Akeda і співавт. (2006) повідомили у своїх дослідженнях, що АЗТП може бути використана як джерело факторів росту для стимуляції хондроцитів у хрящових тканинно-інженерних конструкціях у зв'язку з посиленням синтезу протеогліканів та колагену.
Аналіз сучасної бази наукових досліджень щодо застосування АЗТП дозволив Американському коледжу ортопедів рекомендувати використання цього методу в лікуванні ОА колінних суглобів із рівнем доказовості В (так само, як і препаратів гіалуронової кислоти для внутрішньосуглобового введення).
На досить значній кількості хворих на ОА колінних суглобів Wang-Saegusa et al. (312 пацієнтів) і E. Kon et al. (115 пацієнтів) було продемонстровано значне покращення основних показників індексу WOMAC після введення АЗТП, яке зберігалося через 6 і 12 міс після закінчення лікування.
Важливі результати щодо ефективності АЗТП при ОА з МРТ-контролем стану суглобового хряща було отримано в дослідженні B. Halpern et al., які свідчать про відсутність прогресування деградації хряща колінних суглобів за даними МРТ протягом року після введення АЗТП.
Таким чином, на сучасному етапі вивчення ефектів АЗТП та визначення найбільш ефективних методик її застосування для лікування ОА є теоретично та клінічно обґрунтованими.
Мета дослідження – визначити ефективність та безпеку застосування АЗТП в комплексному лікуванні хворих на ОА колінних суглобів І-ІІ стадії.
Матеріали і методи
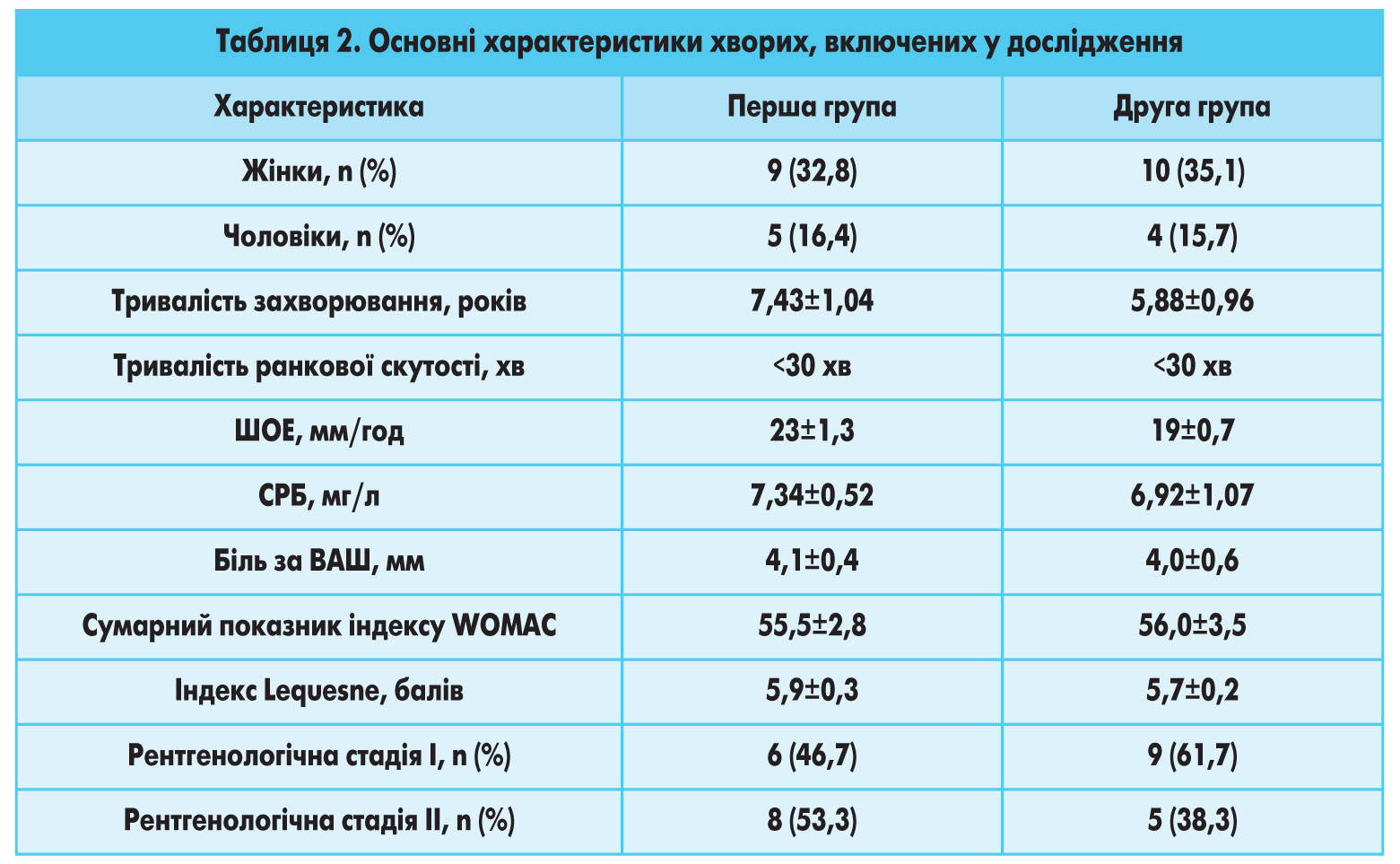
Дослідження проведено на кафедрі сімейної медицини НМАПО ім. П.Л. Шупика та кафедрі травматології та ортопедії НМУ ім. О.О. Богомольця у двох групах пацієнтів із встановленим діагнозом ОА колінних суглобів І-ІІ рентгенологічної стадії (за класифікацією J.H. Kellgren та J.S. Lawrence) у фазі загострення. У дослідження не включали хворих з тяжкими ураженнями внутрішніх органів, які могли вплинути на його результати, пацієнтів з іншими захворюваннями суглобів, травмами та оперативними втручаннями на колінних суглобах. У дослідженні взяли участь 28 хворих – 9 чоловіків (30,8%) та 19 жінок (69,2%), віком 35-55 років (середній вік 44,7±1,2 року), яких розподілили на дві групи. До першої групи увійшли 14 пацієнтів, які дали згоду на застосування в комплексі лікування ОА, окрім стандартної терапії, трьох внутрішньосуглобових ін'єкцій АЗТП; другу групу становили 14 хворих, які отримували стандартне лікування ОА колінних суглобів І-ІІ ст. згідно з чинними рекомендаціями (EULAR, наказом МОЗ України № 676): нестероїдні протизапальні препарати, лікувальна фізкультура, фізіопроцедури.
Основні демографічні і клініко-лабораторні характеристики обстежених груп хворих наведено в таблиці 2.
Хворі першої групи, окрім стандартної комплексної терапії, отримали 3 внутрішньосуглобові введення АЗТП з інтервалом 3-4 дні і загальним об'ємом 12-15 мл та середнім вмістом тромбоцитів 860×109/мкл.
АЗТП для внутрішньосуглобових ін'єкцій отримували шляхом центрифугування власної венозної крові пацієнта (9 мл) у вакуумних пробірках із спеціальним гелем протягом 5 хв із швидкістю 3 тис. обертів на хвилину. Після завершення центрифугування всі клітинні елементи крові, окрім тромбоцитів, осідають під шаром гелю. Плазма, що залишається над гелем, збагачена тромбоцитами.
Для оцінки ефективності і безпеки застосування АЗТП усім пацієнтам до початку дослідження та через 1, 3 і 6 міс від початку лікування проведено комплексне клінічне, лабораторне та інструментальне обстеження.
Згідно з рекомендаціями EULAR у якості критеріїв оцінки ефективності лікування під час проведення клінічних досліджень у хворих на ОА рекомендується використовувати індекс WOMAC і індекс Лекена, тому клінічне обстеження всіх пацієнтів передбачало:
• визначення інтенсивності болю в колінних суглобах за візуально-аналоговою шкалою (ВАШ) у мм;
• оцінку функціональних можливостей пацієнта за анкетою WOMAC (Western Ontario and McMaster University Osteoarthritis index), що містить 24 запитання в 3 розділах: оцінка болю, скутості та функціонального навантаження;
• визначення сумарного альгофункціонального індексу за опитувальником M.G. Lequesne у балах, що включає оцінку болю у спокої і під час ходьби (5 запитань), максимальної відстані під час ходьби (1 запитання) і повсякденної активності (4 запитання).
Лабораторне обстеження включених у дослідження пацієнтів включало:
• загальні аналізи крові та сечі;
• біохімічний аналіз крові (сечова кислота, креатинін, аланінамінотрансфераза – АлАТ, аспартатамінотрансфераза – АсАТ, рівень С-реактивного білка – СРБ).
Інструментальне дослідження передбачало рентгенографію колінних суглобів у двох стандартних проекціях до та через 6 міс від початку лікування.
Статистичний аналіз отриманих результатів проводили з визначенням параметричних (критерій Стьюдента) і непараметричних (кореляційний аналіз Спірмена) критеріїв, використовуючи пакет програм Statistiсa 6,0.
Результати та їх обговорення
Згідно із сучасними рекомендаціями ефективність лікування ОА визначається зменшенням тривалості ранкової скутості, показників активності запального процесу (СРБ), зниженням інтенсивності болю в суглобах за ВАШ та WOMAС і покращенням показників функціональної активності на ≥20% від початкових параметрів (Clegg O. et al., 2006; Bob H. et al., 2007; Haynes S., Gemmell H., 2007). На основі цих критеріїв нами здійснено оцінку ефективності застосування АЗТП для лікування ОА колінних суглобів І-ІІ ст. у фазі загострення.
Як свідчать дані, наведені в таблиці 2, на початку дослідження групи хворих істотно не відрізнялися за основними показниками.
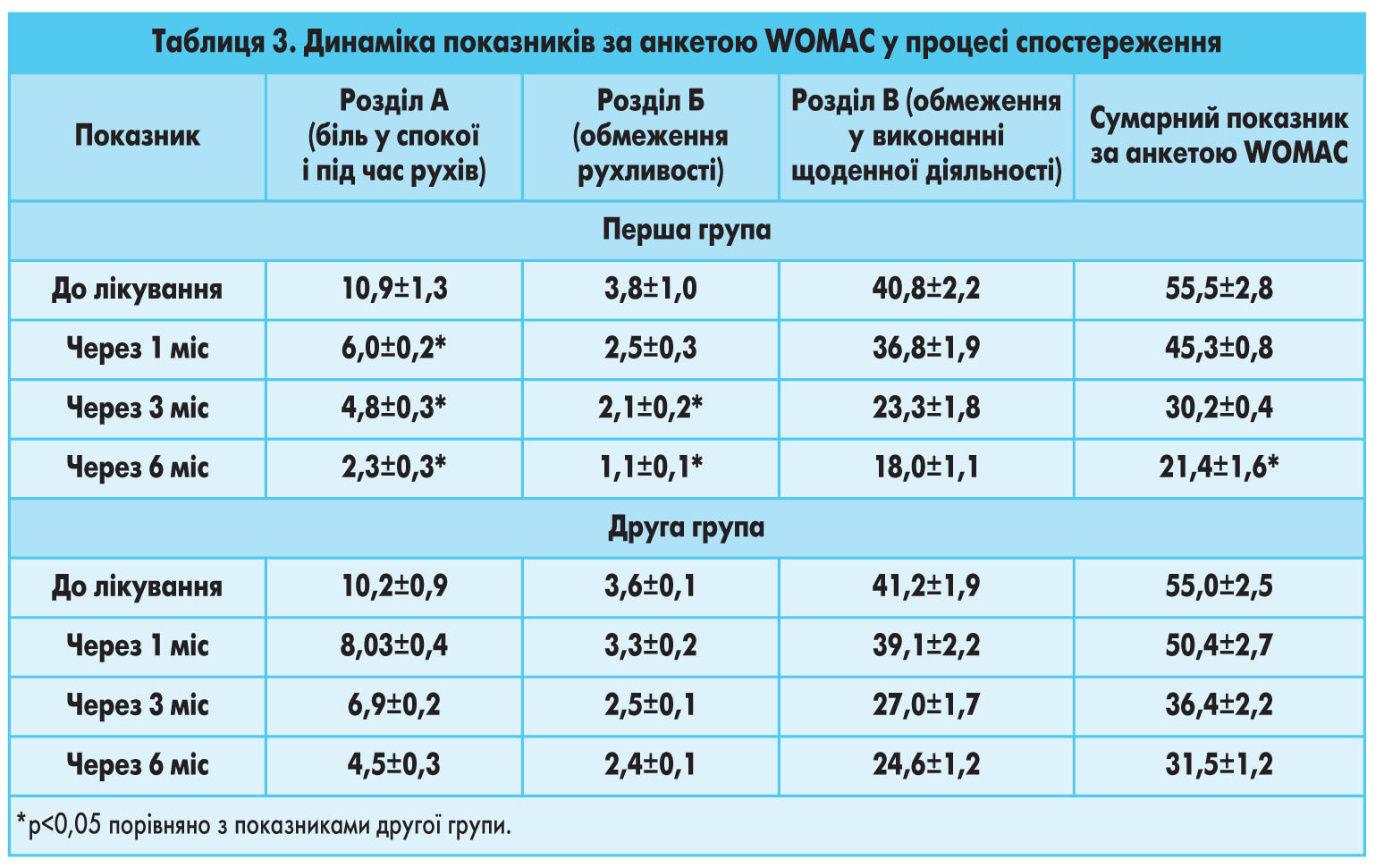
Результати клініко-лабораторного обстеження пацієнтів обох груп у динаміці спостереження після проведеного лікування представлено в таблиці 3 і на рисунку 1.
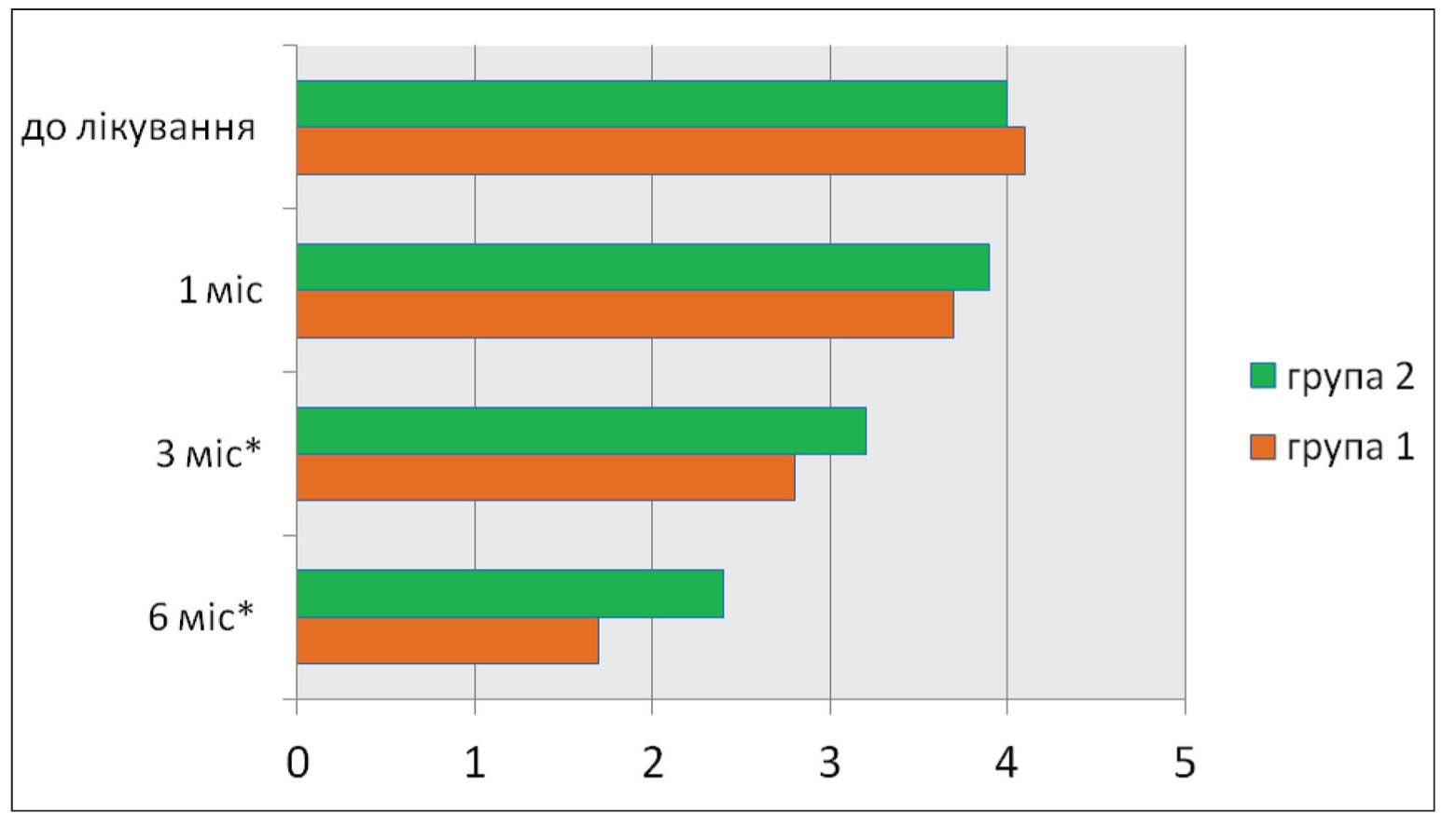 Рис. 1. Динаміка інтенсивності больового синдрому за ВАШ (см) у процесі спостереження *Різниця між групами достовірна (p<0,05).
Рис. 1. Динаміка інтенсивності больового синдрому за ВАШ (см) у процесі спостереження *Різниця між групами достовірна (p<0,05).
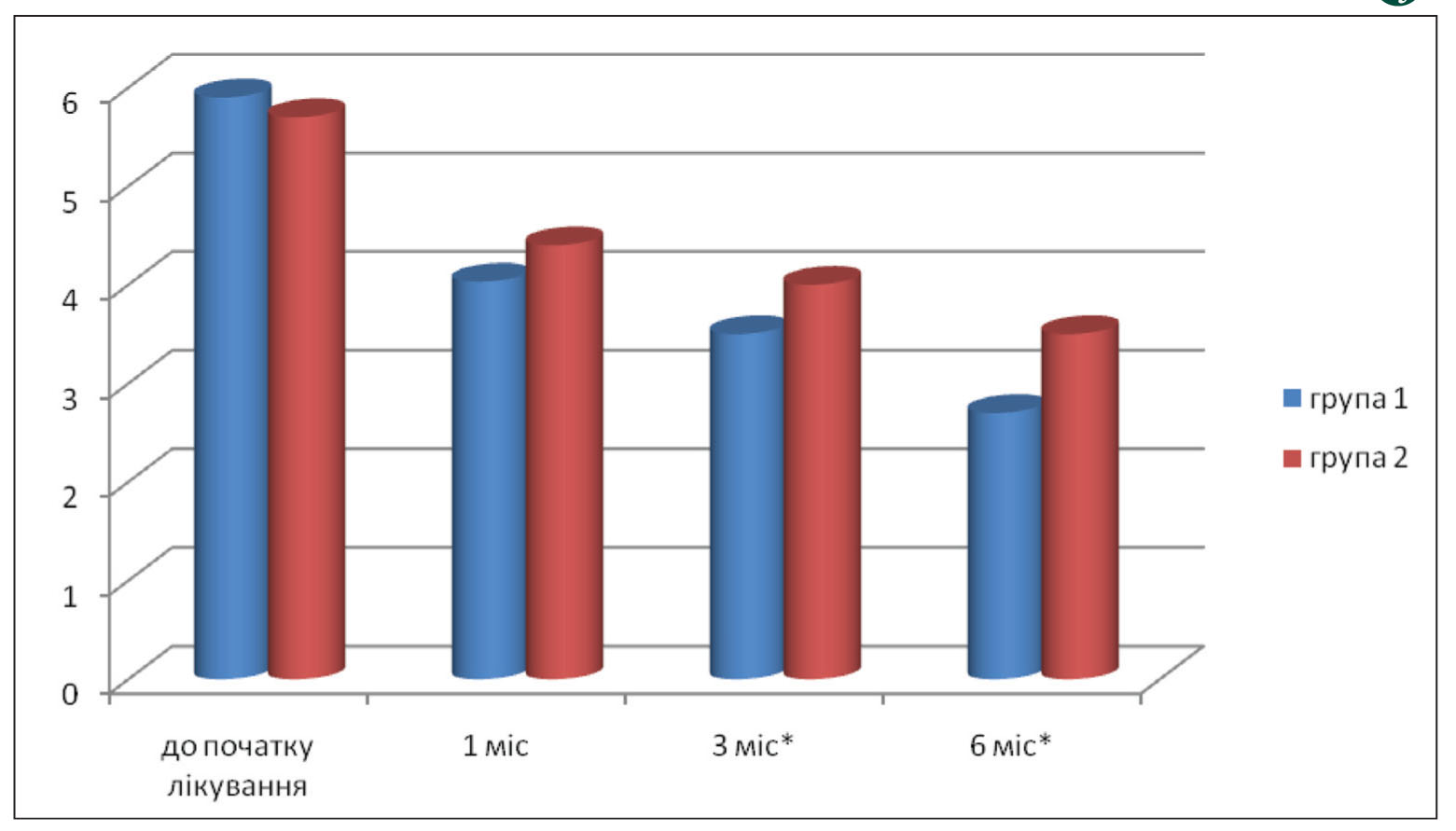 Рис. 2. Функціональний стан хворих у двох групах (за оцінкою сумарного альгофункціонального індексу M.G. Lequesne) у балах *Різниця між групами достовірна (p<0,05).
Рис. 2. Функціональний стан хворих у двох групах (за оцінкою сумарного альгофункціонального індексу M.G. Lequesne) у балах *Різниця між групами достовірна (p<0,05).Згідно з даними, наведеними в таблиці 3 і на рисунках 1 і 2, у процесі спостереження та лікування позитивна динаміка інтенсивності болю, показників шкали WOMAC та індексу Лекена спостерігалася в обох групах хворих. Однак у групі пацієнтів, які отримували лікування АЗТП, зареєстровано більш виражену позитивну динаміку больового синдрому (під час оцінювання і за анкетою WOMAC, і за ВАШ), що супроводжувалося досягненням кращих показників функціональних можливостей хворих першої групи при обстеженні через 3 і 6 міс після закінчення курсу терапії.
Функціональний стан пацієнтів першої групи покращився завдяки зменшенню скутості на 23%; больові відчуття під час рухів та після проходження дистанції зменшилися після проведеного лікування на 37,8%; біль і дискомфорт під час підйому та спуску сходами знизилися відповідно на 38,6 і 35%, а також при вставанні з положення сидячи – на 44,1%, що супроводжувалося достовірним скороченням обмежень щоденної діяльності. Важливо зазначити, що в дослідній групі пацієнтів за всіма показниками було досягнуто кращих результатів лікування, які зберігались і після 3 та 6 міс спостереження.
На початку дослідження у частини хворих в обох групах (42,9% у першій групі і 35,7% у другій групі) було виявлено підвищений рівень СРБ (на 20-25% від верхньої межі лабораторної норми). У процесі лікування у всіх пацієнтів обох груп рівень СРБ нормалізувався, однак у трьох хворих другої групи під час обстеження через 6 міс знову зареєстровано підвищення цього показника (вище верхньої межі лабораторної норми), що супроводжувалося збільшенням інтенсивності болю в суглобах і свідчило про загострення ОА. У першій групі пацієнтів зафіксовано стійку нормалізацію рівня СРБ, і клінічних ознак розвитку загострення ОА не було виявлено в жодному випадку протягом 6 міс спостереження, що може свідчити про протизапальний ефект АЗТП.
За даними рентгенологічного дослідження, суттєвої динаміки в розмірі суглобової щілини за період спостереження не зареєстровано.
Аналіз безпеки терапії АЗТП при внутрішньосуглобовому застосуванні при ОА колінних суглобів не виявив жодного випадку розвитку суттєвих небажаних явищ в обстеженій групі пацієнтів; у трьох хворих після введення АЗТП спостерігалися больові відчуття в місці ін'єкції.
Висновки
• Використання АЗТП у складі комплексної терапії ОА колінних суглобів на ранніх стадіях є патогенетично й експериментально обґрунтованим для покращення ефективності лікування, є дані про можливий позитивний вплив щодо продовження ремісії та уповільнення деградації суглобового хряща.
• Застосування трьох внутрішньосуглобових ін'єкцій АЗТП при гонартрозі І-ІІ ст. сприяє кращій динаміці больового синдрому, пришвидшує покращення показників функціональної активності пацієнтів та сприяє більш тривалому ефекту від проведеного курсу лікування порівняно із стандартною терапією ОА.
• Локальна терапія АЗТП характеризується доброю переносимістю та не супроводжується небажаними явищами, за винятком незначної болючості в місці ін'єкції у деяких пацієнтів.
• Необхідним є проведення подальших, більш тривалих досліджень з використанням рентгенологічного, ультразвукового та МРТ-моніторингу стану суглобового хряща для отримання більш точних результатів і визначення найбільш ефективної методики застосування АЗТП при ОА.
Список літератури знаходиться в редакції.