10 червня, 2016
Хронічний біль обличчя

Біль обличчя – один із найсильніших болів, що може відчувати людина і який приносить їй великі страждання. Вкотре переконуємося в цьому, поглянувши на картину норвезького художника-символіста
Едварда Мунка «Крик», на якій людина охоплює руками повне болю обличчя, марно сподіваючись допомогти собі (рис. 1).
«Очевидно, що інтенсивний і тривалий біль здатний істотно дисбалансувати звичний ритм життя людини. Нестерпний біль сповільнює розумові процеси в організмі, порушує сон, знижує апетит, підриває моральний дух людини, негативно впливає на всі життєво важливі процеси в її організмі», – писав у 1942 році американський психолог В.К. Лівінґстон.
Без сумніву, більшість лікарів у своїй медичній практиці спостерігали випадки, коли тривалий і наростаючий біль чи при невралгії трійчастого нерва, чи при лишаї, чи при онкологічних захворюваннях повністю виснажував пацієнта, і від постійних страждань він виглядав змарнілим, змученим, мав передчасно постаріле обличчя. Мої колеги-психіатри напевне згадають чимало пацієнтів, у яких невроз став причиною розвитку тривалого болю обличчя.
Діагностика та лікування лицьових болей є комплексним завданням цілої низки спеціалістів. Поширеність болю обличчя в популяції становить 17-26%, 7-11% випадків із яких є хронічними [17, 20, 23, 24, 29, 32]. Пацієнти з лицьовими болями звертаються до лікарів різних спеціальностей – стоматологів, ортодонтів, офтальмологів, оториноларингологів, неврологів, нейрохірургів, психіатрів.
Тим часом учені неодноразово робили спроби класифікувати болі обличчя. На мій погляд, однією з найбільш оптимальних є класифікація захворювань нервової системи В.Є. Гречко (1980), в основі якої лежить анатомо-функціональний принцип. Відповідно до цієї класифікації всі нейростоматологічні захворювання було поділено на 6 груп:
I. Симптомокомплекси, зумовлені ураженням системи черепно-мозкових нервів (трійчастого, лицьового, проміжного, блукаючого, під’язикового).
II. Симптомокомплекси, зумовлені ураженням вегетативного відділу нервової системи (гострі та хронічні набряки обличчя, стомалгії, ураження вегетативних гангліїв, синдроми ураження шийного відділу симпатичного стовбура).
III. Симптомокомплекси, зумовлені порушенням іннервації рухових систем щелепно-лицьової ділянки (гіперкінетичні симптомокомплекси).
IV. Симптомокомплекси, зумовлені ураженням зубощелепної системи, патологією суглобів, придаткових пазух носа та орбіти.
V. Симптомокомплекси, зумовлені захворюваннями внутрішніх органів (атеросклерозом судин головного мозку, захворюваннями серця, аорти, хребта, гіпертонічною хворобою тощо).
VI. Симптомокомплекси, зумовлені порушенням вищої нервової діяльності (неврастенії, істерії, неврози нав’язливих станів).
Більшості із цих захворювань притаманні різного ступеня вираженості больові синдроми.
В останні роки стоматологія досягла значних успіхів, пов’язаних із використанням новітніх досягнень матеріалознавства і нових технологій. Разом із тим у стоматологічні клініки дедалі частіше звертаються пацієнти з головними та лицьовими болями, клацанням у скронево-нижньощелепному суглобі (СНЩС), закладенням вух, утрудненими рухами нижньої щелепи. Таких хворих для правильного встановлення діагнозу мають оглядати не тільки стоматологи, а й невропатологи, оториноларингологи, вертеброневрологи, а іноді навіть і психіатри [1, 14]. Лікар-стоматолог, надавши пацієнтові, з його точки зору, необхідну допомогу, не завжди має можливість виконати потрібне обстеження для виявлення причини подібних скарг. Тим часом причини цих болів можуть бути пов’язані з порушенням функції СНЩС, однак найчастіше вони зумовлені розвитком міофасціального больового синдрому (МФБС), який проявляється змінами в жувальній мускулатурі та обмеженням рухів нижньої щелепи. Міофасціальні розлади лицьової мускулатури розвиваються за тими самими механізмами, що й скелетної мускулатури, і зумовлюють виникнення 10-20% больових синдромів на обличчі. Механізм розвитку м’язового болю полягає в тому, що на початковому етапі в м’язі виникає залишкова напруга, а згодом – постійний локальний гіпертонус. Такі локальні м’язові гіпертонуси спричиняють короткочасні болючі спазми м’язів (крампі). Як приклад можна навести болісний спазм м’язів щелепної ділянки під час форсованого відкривання рота. Ще частіше такі гіпертонуси призводять до постійного м’язового напруження і, відповідно, хронічного болю. При такому тривалому фіксованому локальному гіпертонусі у спазмованих м’язах виникають вторинні розлади: судинні, обмінні, запальні, що, у свою чергу, посилює біль. Локальні м’язові гіпертонуси стають джерелом локальних і відображених болів, перетворюючись на тригерні точки (ТТ). На обличчі ці ТТ найчастіше виявляються в жувальних м’язах, скроневому, латеральному та медіальному крилоподібних м’язах.
До факторів, що зумовлюють міофасціальні розлади на обличчі, відносять порушення прикусу (синдром Костена); іррадіацію болю від м’язів шиї і верхнього плечового поясу; психофізіологічні феномени – напруга м’язів, стискання зубів, скрегіт зубами вночі (бруксизм), або у разі тривоги.
Намагаючись пояснити етіологічний початок дисфункції СНЩС, учені дотримуються двох основних точок зору. Одні захищають теорію оклюзійного дисбалансу, інші – психофізіологічну теорію. За твердженням перших, оклюзійні порушення є причиною виникнення функціональних розладів у СНЩС, відтак усунення оклюзійного дисбалансу призводить до вилікування або поліпшення стану. Існування груп хворих із нормальною оклюзією, що мають функціональні розлади, свідчить, що не тільки порушення оклюзії може стати причиною захворювання. О. Шварц, який увів термін «скронево-нижньощелепний больовий синдром», зробив припущення, що психофізіологічний стан хворого має більше значення, ніж порушення оклюзії. Д. Ласкін назвав його слова першим значним зрушенням на шляху від механістичної концепції оклюзійної етіології до психофізіологічної теорії. Наприкінці 1960-х рр. учені для пояснення розвитку дисфункціонального синдрому СНЩС спиралися на психофізіологічну теорію. Першість у цьому питанні належала Центру із вивчення СНЩС і лицьового болю при університеті штату Іллінойс. Незважаючи на те що ця теорія значною мірою відрізнялася від концепції О. Шварца, обидві теорії не були взаємовиключними. За твердженням О. Шварца, спазм жувальної мускулатури є первинним чинником, відповідальним за ознаки та симптоми розвитку больового синдрому дисфункції СНЩС. М’язовий спазм може виникнути внаслідок травми, м’язового стомлення, перенапруження, надскорочення. Незалежно від того, чим спричинений спазм, пацієнт починає відчувати біль і різко обмежене відкривання рота, тобто виникає больова м’язова дисфункція. Такі порушення на цій стадії є функціональними. Однак якщо такий стан триває постійно, це може призвести до органічних змін у зубощелепній системі, м’язах і зв’язках. Односторонній спазм одного або декількох жувальних м’язів, особливо латерального крилоподібного, може викликати незначні зміни в положенні щелепи. Цей стан відносять до гострого порушення оклюзії. Якщо ненормальне положення нижньої щелепи зберігається протягом декількох днів і більше, то зубощелепна система може зазнати значних змін й акомодувати до нової позиції. У цих випадках така невідповідність непомітна в положенні центральної оклюзії. Однак якщо спазм припиняється або слабшає і м’язи повертають нижню щелепу до її початкової позиції, пацієнт відчуває оклюзійну дисгармонію. Зміни в положенні нижньої щелепи, що супроводжуються постійним міоспазмом, можуть призвести до анатомічних порушень суглобових структур і, врешті-решт, – до дегенеративних змін.
Перевагою патофізіологічної теорії дисфункціонального больового синдрому СНЩС є те, що вона пояснює розвиток початкових ознак та симптомів, а також показує, що оклюзійна дисгармонія виникає раніше, ніж з’являться ознаки захворювання. Стрес, емоційні чинники, тривога і напруга призводять до м’язової гіперактивності, м’язового спазму, порушення функції та болю.
Важливе місце серед причин виникнення хронічних болів обличчя посідає невралгія трійчастого нерва, яка проявляється раптовим нападом інтенсивного, але короткотривалого болю обличчя. З часом біль може змінюватися, ставати більш тривалим, однак менш інтенсивним, до нього додаються алодинія, зони порушення чутливості, він стає класичним прикладом невропатичного болю. Цей біль вважають одним із «найбільш сильних болів, на які страждає людство» і є класичним у галузі неврології та нейрохірургії. Лікування невралгії трійчастого нерва має історію багатьох форм деструктивних, внутрішньочерепних та екстракраніальних впливів на гілки трійчастого нерва з повним або частковим руйнуванням ядра трійчастого нерва. Серед медикаментозних методів лікування найбільш ефективним вважається карбамазепін – єдиний препарат, що за цієї патології має рівень доказовості А, хоча можна використовувати й інші антиконвульсанти (прегабалін, габапентин). Їх переважно використовують у разі виражених побічних ефектів карбамазепіну і за появи толерантності болю до нього, що протягом року використання виникає у 12-20% пацієнтів. На сьогодні очевидно, що причиною цієї патології у більшості хворих є розвиток хронічної судинної компресії трійчастого нерва. Проте після оприлюднення у 1967 р. цієї концепції нейрохірургом із Піттсбурга P. Jannetta викликало чимало суперечок. Суть її полягає у тому, що протягом життя наші артерії стають більш схильними до компресії, тому з віком поширеність цієї патології зростає. Причому часто спостерігається не тільки конфлікт «артерія-нерв», а й «вени-нерв». Мікроваскулярна декомпресія є методом вибору при лікуванні хронічного лицьового болю, який виникає унаслідок стиснення корінця трійчастого нерва.
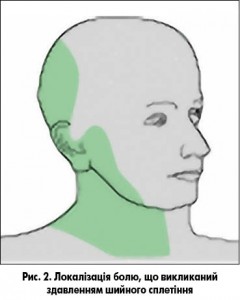
Хронічний біль може бути спровокований здавленням шийного сплетіння. Сегменти С2 і С3 мають дерматоми, які вкривають потилицю, шию, а також бокові частини щелепи (рис. 2). Виникнення хронічного болю біля мочки вуха є класичним ускладненням ушкодження великого вушного нерва під час тиреоїдектомії.
У хворих із компресією плечового сплетіння у грудній апертурі (так званий синдром грудної апертури) спостерігаються головні болі в ділянці потилиці і бічний лицьовий біль.
На підставі результатів досліджень B. Guyuron (2000) було встановлено, що у пацієнтів з мігренню спостерігалося зниження або зникнення головного або лицьового болю після введення ботулінічного токсину типу А у м’язи шиї та обличчя.
Одним із найбільш поширених і водночас тяжко діагностованих є персистуючий ідіопатичний біль обличчя (ПІБО). Відповідно до Міжнародної класифікації головного болю-2 (МКГБ-2) ПІБО належить до розділу «Центральні лицьові болі» (13.18) [3]. Раніше для позначення цього синдрому використовували термін «атиповий біль обличчя», щоб протиставити його класичній тригемінальній невралгії.
Даних щодо поширеності ПІБО на цей час не існує. Окремі спостереження [15] засвідчують, що 60-70% пацієнтів із цією формою прозопалгії становлять жінки середнього віку. В спеціалізованих центрах болю хворі з ПІБО трапляються дещо частіше, ніж пацієнти з тригемінальною невралгією. Більшість хворих спершу потрапляють на прийом до стоматолога чи ортодонта. В ході великого епідеміологічного дослідження, у якому взяло участь 34 242 пацієнти, які спостерігалися у стоматологів у 19 університетських центрах Німеччини [35], було виявлено, що хронічний лицьовий біль виникав у 5,2% хворих.
Серед пацієнтів із хронічним болем ПІБО було зафіксовано у 5,8% випадків, відтак ПІБО входив у трійку найбільш частих причин розвитку хронічної прозопалгії. До факторів ризику виникнення ПІБО належать наявність поширеного больового синдрому в анамнезі, генетична предиспозиція, жіноча стать, пасивна копінг-стратегія [36].
На сьогодні дано визначення та окреслено клінічні критерії для орофаціальної невралгії; термін «ідіопатична» означає, що лицьовий біль складно класифікувати. ПІБО є, по суті, діагнозом виключення. Разом із тим діагностика цього стану надзвичайно важлива, оскільки дає змогу пацієнтові уникнути нераціональної фармакотерапії і непотрібних оперативних втручань. Так, було доведено, що серед пацієнтів з лицьовим болем у 83% випадків відбувається гіпердіагностика тригемінальної невралгії і у 100% випадків – недодіагностика ПІБО. Неправильна діагностика призводить до необґрунтованих оперативних втручань, часто повторних: у 24% пацієнтів, перш ніж поставити правильний діагноз, видаляють один чи більше зубів [13]. ПІБО визначається як триваючий лицьовий біль, який не має ознак краніальної невралгії і не пов’язаний з іншими причинами. Як правило, біль односторонній, пацієнти описують його як тупий, глибокий або пекучий. У ході неврологічного дослідження зазвичай не виявляють об’єктивних розладів, таких як порушення чутливості в ділянці болю або слабкість м’язів обличчя. Більше того, виявлення патології в неврологічному статусі виключають встановлення діагнозу ПІБО. Розвиткові болю може передувати хірургічна операція, виконана в ділянці, на якій згодом локалізувався біль, або травма зубів чи ясен, хоча подальше персистування болю не може бути пояснено локальним ушкодженням.
Серед загальних критеріїв ПІБО можна назвати такі:
- Біль у лицьовій ділянці, що виникає щодня або майже щодня і зберігається увесь день.
- Біль виникає в обмеженій ділянці на одному боці обличчя; за характером глибокий і погано локалізується
- Біль не супроводжується порушенням чутливості або іншими неврологічними ознаками.
- Додаткові методи обстеження, такі як рентгенографія обличчя та щелеп, не виявляють патології, яка пояснила б причину болю.
Клінічна картина і диференційна діагностика
Основна скарга пацієнтів – тривалий біль, який може варіювати за інтенсивністю, однак, як правило, не виникає у вигляді нападів. Незважаючи на те що біль виникає унілатерально, у багатьох пацієнтів напади болю можуть змінюватися – виникати у різних ділянках обличчя, а у 40% хворих можуть бути білатеральними [25, 27]. Важливим діагностичним критерієм є невідповідність болю зонам іннервації гілок трійчастого нерва. Найчастіше біль локалізується в ділянці верхньої щелепи і може поширюватися на періорбітальну ділянку, ніс, щоку, скроню і нижню щелепу. Біль може мігрувати з однієї частини обличчя в іншу і супроводжуватися відчуттям «руху слизової оболонки» в синусах. Цікаво, що міграція болю, як правило, відбувається по дерматомах [32]. У багатьох пацієнтів біль може поширюватися на голову, шию і навіть руки. В деяких випадках біль локалізується в одному зубі, це явище має назву атипова одонталгія. Незважаючи на те що біль зберігається протягом усього дня, вночі, як правило, він відсутній; разом із тим 50-70% пацієнтів скаржаться на порушення сну [36]. Іноді пацієнти характеризують біль як нестерпний, хоча у більшості інтенсивність болю середня – близько 7 балів ВАШ (візуальна аналогова шкала) [5]. На відміну від невралгій для пацієнтів із ПІБО не характерні напади болю, простріли, у них відсутні куркові зони. У багатьох випадках хворі зауважують посилення болю, яке нагадує напад, що, проте, не виключає розвиток ПІБО. Загострення болю може бути спровоковано холодом, психологічним стресом, а також хірургічними та стоматологічними маніпуляціями [36]. Перебіг захворювання, як правило, тривалий, упродовж багатьох років із можливими ремісіями [25, 27]. Діагностичні труднощі можуть викликати пацієнти, у яких ПІБО в дебюті нагадує розвиток тригемінальної невралгії і лише згодом набуває характерного клінічного патерну [32].
Однак якщо тригемінальна невралгія характеризується короткочасними нападами пронизуючого або стріляючого болю, то при ПІБО напади триваліші, ніж кілька секунд, – продовжуються хвилини або навіть години і не провокуються характерними для тригемінальної невралгії тригерами.Під час перевірки неврологічного статусу у 60-75% пацієнтів із ПІБО можуть виявлятися дизестезії, парестезії, суб’єктивне відчуття оніміння, однак об’єктивне порушення чутливості або інші неврологічні симптоми не виявляються [16, 27]. Деякі пацієнти можуть повідомляти про появу суб’єктивного відчуття набряку обличчя, однак під час об’єктивного огляду набряк не виявляють.Як уже згадувалося, у багатьох випадках у пацієнтів в анамнезі є травма обличчя або перенесена операція на щелепі, носі або синусах. Якщо больовий синдром персистував до операції, то після втручання біль може посилитися [25]. Даних про частоту виникнення персистуючого болю після хірургічного втручання на цей час не існує. У пацієнтів із ПІБО можуть фіксуватися хронічні больові синдроми іншої локалізації – хронічний біль у спині, шиї, міофасціальний біль, мігрень, синдром передменструального напруження; синдром подразненого кишечника, дисменорея [14]. 50% пацієнтів із ПІБО повідомляють про хронічну втому [36].
Поширеність емоційно-афективних та інших психіатричних розладів є більшою серед пацієнтів із ПІБО, ніж в загальній популяції. Так, афективні розлади спостерігаються у 16% пацієнтів, соматоформні – у 15%, психоз – у 6%, решта захворювань – у 16% хворих [28].
Крім того, описано випадки виникнення соматосенсорних галюцинацій під час депресії – як можливої, проте рідкісної причини лицьового болю [33]. Діагностика ПІБО ґрунтується на даних анамнезу і нормальному неврологічному статусі. При зборі анамнезу необхідно з’ясувати у пацієнта характер перебігу і тривалість захворювання, характер і частоту виникнення болю, використовувані методи лікування, особливо хірургічні, та їх ефективність. За допомогою опитувальника Мак- Гілла (McGill Pain Questionnaire, MPQ) можна додатково здійснити оцінку болю у таких пацієнтів. Також необхідно бути готовим для виявлення супутніх емоційно-афективних та інших психічних розладів. Для диференційної діагностики з невропатією трійчастого нерва можна використовувати мигальний рефлекс, при цьому необхідно зазначити, що у 35% пацієнтів із ПІБО може спостерігатися дефіцит габітуації [16]. Кількісне сенсорне тестування у пацієнтів із ПІБО дає суперечливі результати: за даними одних дослідників, виявляється порушення чутливості [22], за даними інших авторів [16], у 45% хворих фіксується температурна гіпестезія, а у 10% – теплова алодинія. H. Forssell [16] під час свого дослідження здійснив порівняння клініко-електрофізіологічних патернів ПІБЛ і тригемінальної невралгії. Були виявлені достовірні відмінності: при ПІБО частіше залучалася інфраорбітальна зона і переважав ниючий біль, а при тригемінальній невралгії рідше спостерігався фоновий біль і були характерні тригери. Для тригемінальної невралгії також були характерні суб’єктивні та об’єктивні зміни чутливості на обличчі. У разі підозри на симптоматичний лицьовий біль необхідно проводити низку інших досліджень. Диференційний діагноз ПІБО проводиться із низкою захворювань: біль, пов’язаний із патологією кісток черепа; цервікогенний головний біль; глаукома, порушення рефракції, страбізм; хвороби вуха; синусит; патологія щелеп, зубів і навколишніх тканин; патологія скронево-нижньощелепного суглоба; патологія краніальних нервів, така як тригемінальна компресія, діабетична невропатія окорухових нервів, оперізуючий лишай, постгерпетична невралгія, синдром Толоса-Ханта, шийно-язиковий синдром; тригемінальна невралгія; глософарингеальна невралгія; невралгії кінцевих гілок краніальних нервів; головний біль, пов’язаний із зовнішнім здавленням; холодовий головний біль; центральний постінсультний біль [9]. У рідкісних випадках лицьовий біль може бути відображеним болем при раку легень [9]. J.C. Nоbreg та співавт. [26] під час своїх досліджень порівнювали клінічну картину виникнення ПІБО і симптоматичного лицьового болю, що включає дисфункцію скронево-нижньощелепного суглоба, синдром Валенберга-Захарченка, інтракраніальну пухлину тощо. Так, було встановлено, що алодинія траплялася частіше при симптоматичному болі, а для ПІБО більш характерним було провокування болю емоційними стресами та наявність травми обличчя в анамнезі захворювання.
Патогенез
Патогенез виникнення ПІБО досі не з’ясований. Ймовірно, ПІБО являє собою синдром, що охоплює різні етіологічні фактори. Тривалий час вважали, що в основі розвитку ПІБО лежать психогенні причини [15].
Крім того, обговорювався варіант дефіциту центральних серотонінергічних та опіоїдних систем, схожий з такими при розвитку депресії, проте в подальшому було доведено, що трициклічні антидепресанти ефективні лише у частини таких пацієнтів. В анамнезі у багатьох хворих зазначається про повторні хірургічні маніпуляції в лицьовій зоні. Повторні оперативні втручання можуть призводити до ушкодження термінальних гілок трійчастого нерва, і багато хто з авторів розглядають ПІБО як варіант фантомного болю. З іншого боку, якесь структурне ушкодження трійчастого нерва суперечить діагнозу ПІБО. Таким чином, у цьому випадку слід ставити діагноз «тригемінальна нейропатія». Певну інформацію про патогенез ПІБО було отримано після виконання нейровізуалізаційних досліджень. Так, S.W. Derbyshire та співавт. (1998) пацієнтам із зазначеною патологією провели позитронно-емісійну томографію (ПЕТ). Використовувалася теплова стимуляція на дорсальній поверхні кисті. У пацієнтів із ПІБО було отримано достовірне прискорення кровотоку в передній цингулярній звивині й уповільнення кровотоку в префронтальній корі порівняно з контрольною групою [10]. Проте цей патерн не є специфічним, інтерпретується як гіперемоційна реакція у відповідь на отриману сенсорну інформацію, що свідчить про недостатність інгібіторних систем. В іншому дослідженні, також із використанням ПЕТ [18], було виявлено підвищення щільності дофамінових D2-рецепторів у шкаралупі. Під час свого дослідження T. Schmidt-Wilcke та співавт. (2005) проводив морфометрію, яка показала зниження щільності сірої речовини в іпсилатеральній передній цингулярній звивині і скронево-інсулярній зоні, що в цілому характерно для хронічних больових синдромів [31].Обговорювалася роль вазоневрального конфлікту в розвитку ПІБО. У дослідженні A. Kuncz та співавт. (2006) встановлено, що якщо вазоневральний конфлікт виявляється у 66,5% пацієнтів із типовою тригемінальною невралгією, то в групі пацієнтів із ПІБО вазоневральний конфлікт спостерігається лише в 3,4% випадків [21]. Серед пацієнтів із ПІБО хірургічна декомпресія проводилася лише в одного хворого і виявилася неефективною. Важлива роль у розвитку ПІБО належить м’язовому компоненту краніомандібулярної системи, який може служити джерелом периферичної сенситизації. У дослідженні H. Didier та співавт. (2015) [11], у якому взяв участь 21 пацієнт із ПІБО, проводилися електроміографічні дослідження жувальних і передніх скроневих м’язів під час руху та у спокої, а також кінезіографія для виявлення позиції спокою нижньої щелепи після проведення крізьшкірної електричної стимуляції нерва. Пацієнти використовували шину для корекції наявної асиметрії. Було встановлено, що показники електроміографії (ЕМГ) достовірно перевищували норму у всіх групах м’язів і нормалізувалися після електричної стимуляції. Дослідження показало, що всі пацієнти потребували ортопедичної корекції, причому у 90,5% випадків була необхідна корекція шиною у фронтальній площині. Порівняння показників під час максимального стиснення природного прикусу із шиною виявило зниження асиметрії м’язової напруги (-30,21% для передньо-скроневого м’яза і -55,81% для жувального м’яза) і дифузне збільшення м’язової сили (лівий передній скроневий м’яз +25,37%; лівий жувальний м’яз +59,40%; правий жувальний м’яз +40,80%; правий скроневий м’яз +30,27%). Крім того, було виявлено дифузне зниження інтенсивності болю від 9,5 до 3,1 бала за ВАШ.Таким чином, ПІБО на сьогодні розглядають як поліетіологічний синдром, що включає міогенне або ятрогенне джерело периферичної сенситизації в лицьовій ділянці, недостатність центральних протибольових систем, а також наявність коморбідних емоційно-афективних порушень.
Лікування
ПІБО є одним із найбільш резистентних до терапії хронічних больових синдромів. Під час ведення таких пацієнтів надзвичайно важливо вжити заходів для уникнення подальшої травматизації обличчя. Пацієнтів слід поінформувати про хронічний, однак доброякісний перебіг їхнього захворювання. Необхідно уникати виконання необґрунтованих хірургічних і стоматологічних процедур, навіть у разі, якщо пацієнт наполягає на них. На відміну від тригемінальної невралгії мікроваскулярна декомпресія (операція Джаннета) не дає ефекту при ПІБО. В одному з досліджень було показано ефективність проведення пульсової радіочастотної терапії крилопіднебінного ганглію [6]. Із 30 пацієнтів, що спостерігалися після лікування протягом 4-5 місяців, тільки у 21% було виявлено повний регрес болю, а у 65% випадків зафіксовано помірний або незначний ефект. На відміну від тригемінальних вегетативних цефалгій проведення глибокої стимуляції заднього гіпоталамуса не є ефективним при ПІБО [7]. Фармакотерапія ПІБО на сьогодні здебільшого є емпіричною, оскільки контрольованих досліджень ефективності лікарських препаратів не проводилося [1, 2, 13, 30]. Антидепресанти фенелзин і дотіепін, що показали помірний ефект у лікуванні розвитку ПІБО, тепер недоступні. Клінічний досвід показує, що трициклічні антидепресанти дають найкращий ефект. Терапію слід починати з мінімальної дози з прийому на ніч, поступово збільшуючи дозу, переходити до лікарських форм із повільним вивільненням препарату. Також можна використовувати антиконвульсанти з протибольовою дією, такі як карбамазепін, окскарбазепін, габапентин, прегабалін. Найчастіше пацієнти потребують призначення комбінації трициклічного антидепресанту й антиконвульсанту. Якщо препарат, який хворий отримує в адекватній дозі протягом двох місяців, не дає ефекту, його необхідно змінити. В одному відкритому дослідженні була показана ефективність місцевих аплікацій капсаїцину [34], в іншому – виявлений певний ефект крізьшкірної електричної стимуляції [12]. В окремих випадках під час лікування пацієнтів можна вдаватися до застосування гіпнозу [4]. Поведінкова терапія надзвичайно ефективна для пацієнтів із ПІБО, оскільки дає змогу знизити рівень тривоги і виробити реалістичну самооцінку для кращої копінг-стратегії у подоланні болю.
Література
- Sternbach R.A. Acute versus chronic pain. In: In: Wall PD, Melzack R, editor. Textbook of Pain. New York, NY: Churchill Livingstone; 1984. P. 173-177.
- Wall P.D. Introduction. In: In: Wall P.D., Melzack R., editor. Textbook of Pain. New York, NY: Churchill Livingstone; 1984. P. 1-16.
- Livingston W.K. Pain Mechanisms. New York, NY: MacMillan; 1942.
- Bonica J.J. The Management of Pain. Philadelphia, PA: Lea and Febinger; 1953. P. 154-156.
- Waldman S. Atlas of Common Pain Syndromes. Philadelphia, PA: WB Saunders; 2002.
- Jannetta P.J. Arterial compression of the trigeminal nerve at the pons in patients with trigeminal neuralgia. J Neurosurg. 1967; 26: 159-162. [PubMed]
- Shelton M.L. Working in a Very Small Space: The Making of a Neurosurgeon. New York, NY: WW Norton; 1989.
- Jannetta P.J. Neurovascular compression in cranial nerve and systemic disease. Ann Surg. 1980; 192: 518-525. [PMC free article] [PubMed]
- Sindou M., Leston J., Decullier E. et al. Microvascular decompression for primary trigeminal neuralgia: long-term effectiveness and prognostic factors in a series of 362 consecutive patients with clear cut neurovascular conflicts who underwent pure decompression. J Neurosurg. 2007; 107: 1144-1153. [PubMed]
- Baker F.G., Jannetta P.J., Bissonette D.J. et al. The long-term outcome of microvascular decompression for trigeminal neuralgia. N Engl J Med. 1996; 334: 1077-1083. [PubMed]
- Mackinnon S.E., Dellon A.L. Surgery of the Peripheral Nerve. New York, NY: Thieme Medical Publishers; 1989.
- Dellon A.L., Aszmann O.C., Muse V. Collateral sprouting documentation using the PSSD. Ann Plast Surg. 1996; 37: 520-525. [PubMed]
- Dellon A.L. Resection: nerve repair’s most neglected technique. Plast Surg Techn. 1995; 1: 191-199.
- Zachary L.S., Dellon A.L., Seiler W.A. IV Relationship of intraneural damage in the rat sciatic nerve to the mechanism of injury. J Reconstr Microsurg. 1989; 5: 137-140. [PubMed]
- Weber R.A., Briedenbach W.C., Brown R.E. et al. A randomized prospective of polyglycolic acid conduits for digital nerve reconstruction in humans. Plast Reconstr Surg. 2000; 106: 1036-1045. [PubMed]
- Crawley W.A., Dellon A.L. Inferior alveolar nerve reconstruction with a polyglycolic acid, bioabsorbable nerve conduit: a case report. Plast Reconstr Surg. 1992; 90: 300-302. [PubMed]
- Ducic I., Maloney C.T., Dellon A.L. Reconstruction of the spinal accessory nerve: autograft or neurotube? Two case reports. J Reconstr Microsurg. 2005; 21: 29-33. [PubMed]
- Navissano M., Malan F., Carnino R. et al. Neurotube for facial nerve repair. Microsurgery. 2005; 25: 268-271. [PubMed]
- Ramirez O.M., Pozner J.N. Endoscopically assisted supraorbital nerve neurolysis and correction of eyebrow asymmetry. Plast Reconstr Surg. 1997; 100: 755-758. [PubMed]
- Mackinnon S.E., Dellon A.L., Hudson A.R. et al. Alteration of neuroma formation by manipulation of neural microenvironment. Plast Reconstr Surg. 1985; 76: 345-352. [PubMed]
- Dellon A.L., Aszmann O.C. Treatment of dorsal foot neuromas by translocation of nerves into anterolateral compartment. Foot Ankle. 1998; 19: 300-303. [PubMed]
- Dellon A.L., Mackinnon S. Treatment of the painful neuroma by neuroma resection and muscle implantation. Plast Reconstr Surg. 1986; 77: 427-436. [PubMed]
- Evans G.R.D., Dellon A.L. Implantation of the palmar cutaneous branch of the median nerve into the pronator quadratus for treatment of painful neuroma. J Hand Surg [Am] 1994; 19: 203-206. [PubMed]
- Mackinnon S.E., Dellon A.L. Results of treatment of recurrent dorsoradial wrist neuromas. Ann Plast Surg. 1987; 19: 54-61. [PubMed]
- Dellon A.L., Maloney C.T., Jr Salvage of sensation in a hallux-to-thumb transfer by nerve tube reconstruction. J Hand Surg [Am] 2006; 31: 1495-1498. [PubMed]
- Evans G.R.D., Crawley W., Dellon A.L. Inferior alveolar nerve grafting: an approach without intermaxillary fixation. Ann Plast Surg. 1994; 33: 221-224. [PubMed]
- Fogaсa W.C., Fereirra M.C., Dellon A.L. Neurosensory testing in evaluation of infraorbital nerve injuries associated with zygoma fracture. Plast Reconstr Surg. 2004; 113: 834-838. [PubMed]
- Price D.D., McGrath P.A., Rafii A., Buckingham B. The validation of visual analogue scales as ratio scale measures for chronic and experimental pain. Pain. 1983; 17: 45-56. [PubMed]
- Revill S.I., Robinson J.O., Rosen M., Hogg M.I. The reliability of a linear analogue for evaluating pain. Anaesthesia. 1976; 31: 1191-1198. [PubMed]
- Dellon A.L., Keller K.M. Computer-assisted quantitative sensory testing in carpal and cubital tunnel syndromes. Ann Plast Surg. 1997; 38: 493-502. [PubMed]
- Rosenberg D., Conolley J., Dellon A.L. Thenar eminence quantitative sensory testing in diagnosis of proximal median nerve compression. J Hand Ther. 2001; 14: 258-265. [PubMed]
- Tassler P.L., Dellon A.L. Pressure perception in the normal lower extremity and in tarsal tunnel syndrome. Muscle Nerve. 1996; 19: 285-289. [PubMed]
- Okwueze M.I., Spear M.E., Zwyghuizen A.M. et al. Effect of augmentation mammaplasty on breast sensation. Plast Reconstr Surg. 2006; 117: 73-83. [PubMed]
- Mofid M.M., Klatsky S.A., Singh N.K. et al. Nipple-areola complex sensitivity after primary breast augmentation: a comparison of periareolar and inframammary incision approaches. Plast Reconstr Surg. 2006; 117: 1694-1698. [PubMed]
- Dellon A.L., Andonian E., De Jesus R.A. Measuring sensibility of the trigeminal nerve. Plast Reconstr Surg. 2007; 120: 1546-1550. [PubMed]
- Costas P.D., Heatley G., Seckel B.R. Normal sensation of the human face and neck. Plast Reconstr Surg. 1994; 93: 1141-1145. [PubMed]
- Kesarwani A., Antonyshyn O., Mackinnon S.E. et al. Facial sensibility testing in the normal and posttraumatic population. Ann Plast Surg. 1989; 22: 416-425. [PubMed]
- Lawrence J.E., Poole M.D. Mid-facial sensation following craniofacial surgery. Br J Plast Surg. 1992; 45: 519-522. [PubMed]