8 червня, 2016
Метаболический синдром в неврологической практике: возможности патогенетической терапии полинейропатии
Метаболический синдром является актуальной междисциплинарной проблемой, требующей внимания не только эндокринологов и кардиологов, но и неврологов. В большинстве случаев неврологические последствия метаболических нарушений ассоциируются с сенсорной полинейропатией, которая, в свою очередь, связана с болевым синдромом, существенно ухудшает качество жизни пациентов и требует адекватной медикаментозной коррекции.
В рамках традиционной научно-практической конференции для украинских неврологов – Школы клинических нейронаук «Карпатские чтения» – вопросам патогенеза и патогенетической терапии полинейропатии посвятила выступление заведующая кафедрой неврологии № 1 Харьковского национального медицинского университета, доктор медицинских наук, профессор Ирина Анатольевна Григорова.
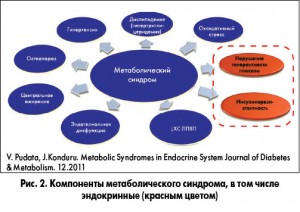
Метаболический синдром (МС) представляет собой комплекс взаимосвязанных факторов риска развития сердечно-сосудистых заболеваний (ССЗ) и сахарного диабета (СД). Эти факторы включают дисгликемию, повышенное артериальное давление (АД), повышенный уровень триглицеридов, низкий уровень холестерина липопротеинов высокой плотности (ЛПВП) и ожирение (особенно центральное) (рис. 1). Известно, что МС является не только фактором риска развития церебро- и кардиоваскулярных заболеваний, но и патологическим фоном для формирования дистальной сенсорной нейропатии (L. Zbou et al., 2011).
Избыточная масса тела, гипертриглицерид емия и снижение уровня холестерина липопротеинов высокой плотности значительно увеличивают риск развития нейропатии даже у пациентов без СД.
Приблизительно у 25-62% больных с идиопатической периферической нейропатией обнаруживают инсулинорезистентность и/или МС. В то же время среди пациентов с предиабетом отмечаются симптомы периферической нейропатии в 11-25% случаев, а жалобы на нейропатическую боль – в 3-26% случаев (D. Ziegler et al., 2014).
Распространенность МС или его составляющих симптомов выше у пациентов с нейропатией, что позволяет выделить МС как независимый фактор развития данной патологии.
Инсулинорезистентность приводит к повреждению периферических нервных волокон, что клинически проявляется нейропатией.
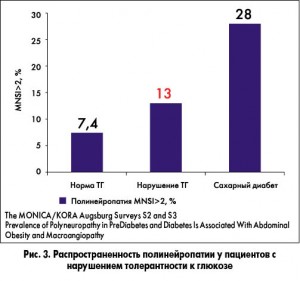
В ряде исследований показано, что частота возникновения нейропатии стремительно возрастает при нарушении толерантности глюкозы (НТГ) (The MONICA/KORA Augsburg Surveys S2 and S3 Prevalence of Polyneuropathy in PreDiabetes and Diabetes Is Associated With Abdominal Obesity and Macroangiopathy) (рис. 3).
Учитывая взаимосвязь, особое внимание следует уделять неврологическим пациентам с различными нейропатиями и МС.
Развитие полинейропатии связано с поражением периферических нервов и нервных корешков. Обычно она начинается с дистальных отделов периферической нервной системы. К основным видам повреждения периферических нервов относят:
- демиелинизацию (возникает замедление или полное блокирование проведения нервного импульса и, как следствие, гип- или анестезия);
- аксонотмезис (повреждение нерва, сопровождающееся дегенерацией аксонов дистальнее места травмы и их атрофией, клинически проявляющееся потерей чувствительности);
- невротмезис (характеризуется полным анатомическим разрывом периферического нерва с невозможностью регенерации).
В то же время существует несколько видов восстановительных процессов нервных волокон, а именно: ремиелинизация, аксональная регенерация (проксимальная, дистальная) и коллатеральная реиннервация (в случае частичного повреждения нерва). Они отличаются между собой по длительности: так, к примеру, ремиелинизация занимает от 2 до 12 нед, а коллатеральная иннервация – 4-6 нед. Для начала аксональной регенерации, скорость которой составляет 1 мм/сут, обязательным условием является сохранность базальной мембраны.
Наиболее часто в клинической практике используют следующую классификацию полинейропатий: 1) по клинической картине полинейропатия бывает симметричная и асимметричная; 2) по течению – острая и хроническая; 3) по патогенетическому механизму – аксональная, демиелинизирующая и нейронопатия.
Как правило, полинейропатия сопровождается болевым синдромом. Нейропатическая боль развивается в результате дисфункции ноцицептивной и антиноцицептивной систем, локализуется в области иннервации пораженных нервов, не соответствует по времени или интенсивности степени повреждения и существенно снижает качество жизни больных. По клиническим проявлениям нейропатическая боль может быть спонтанной (дизестезическая симпатически поддерживаемая – жгучая, симпатически независимая – стреляющая, дергающая, а также воспалительная – глубокая ноющая, ломящая) или стимулзависимой (механическая и температурная гипералгезия).
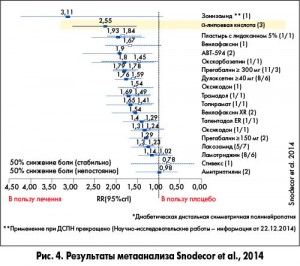
Патогенетически оправданной стратегией лечения полинейропатий является применение препаратов α-липоевой кислоты (АЛК), которые представлены I и II поколением. Эффективность АЛК в снижении невропатической боли было подтверждено в недавно проведенном метаанализе Snodecor и соавт. (2014) (рис.4), в котором подтверждена высокая эффективность АЛК в снижении нейропатической боли в сравнении с традиционными препаратами, используемыми для лечении этого болевого синдрома.
Оригинальным представителем препаратов АЛК является Тиоктацид®. Впервые он был синтезирован в 1959 г. Изначально в состав препарата входили этилендиаминовая соль АЛК и пропиленгликоль (1 поколение), но в связи с проблемами непереносимости при внутривенном введении этилендиаминовую соль заменили на трометамоловую. В 1994 г. из состава препарата был исключен пропиленгликоль, а также начат выпуск инъекционной формы Тиоктацид 600Т (2 поколение).
Большинство клинических исследований по эффективности АЛК проводились именно с оригинальным препаратом Тиоктацид®. Первой была серия исследований ALADIN (Alpha Lipoic Acid in Diabetic Neuropathy), которые подтвердили эффективность и безопасность лечения дистальной полинейропатии (ДПН) Тиоктацидом 600Т, а также достоверное уменьшение выраженности клинической симптоматики ДПН по шкалам NSS (Neuropathy Symptoms Score – шкала нейропатических симптомов) и TSS (Total Symptoms Score – шкала общих симптомов).
В исследовании SYDNEY I установлено, что клинический эффект Тиоктацида 600Т наблюдался уже после 3 дней терапии.
Положительное влияние АЛК в дозе 600 мг/сут на степень выраженности неврологического дефицита наблюдалось в исследовании NATHAN (Neurological Assessment of Thioctic Acid in Diabetic Neuropathy) при оценке по шкале NIS (Neuropathy Impairment Score – шкала нарушений, связанных с нейропатией).
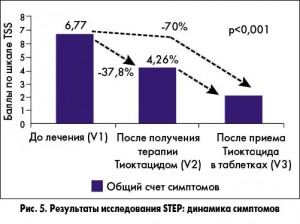
В Украине также было проведено широкомасштабное исследование STEP (Symptomatic Treatment of diabEtic Polyneuropathy), посвященное оценке эффективности Тиоктацида в лечении ДПН. В нем приняли участие 1368 пациентов с СД 1 или 2 типа и различной длительностью нейропатии (в 60% случаев – до 5 лет). В результате после проведенного курса терапии интенсивность основных симптомов ДПН (боли, жжения, онемения и парестезий) уменьшилась более чем в 2 раза (рис. 5).
Показательными являются результаты метаанализа, которые подтвердили лучшую эффективность АЛК в устранении болевых симптомов ДПН по сравнению с нестероидными противовоспалительными средствами, местными анестетиками и антиконвульсантами (S.J. Snedecor et al., 2014) (рис. 4), традиционными препаратами, используемыми для лечения этого болевого синдрома. В связи с этими данными у неврологических пациентов с нейропатической болью и сопутствующим МС существует необходимость использования АЛК совместно со страдиционными препаратами для лечения болевого синдрома.
Следует отметить и то, что Тиоктацид® способен нормализировать показатели оксидативного стресса и повышать чувствительность тканей к инсулину. Так, после курса лечения данным препаратом уровень 8-изопростагландина (маркера интенсивности окислительного стресса) снизился на 25%, а чувствительность к инсулину повысилась на 18% (Y. Zhang et al., 2011). После приема АЛК в дозе 600 мг/сут на протяжении 2 нед у пациентов с ожирением и сниженной толерантностью к глюкозе повышается чувствительность к инсулину и улучшается липидный профиль крови за счет уменьшения оксидативного стресса, хронического воспаления и повышения уровня адипонектина.
Тиоктацид® можно вводить парентерально без разведения, что особенно важно для пациентов с артериальной гипертензией, сердечной недостаточностью, хронической почечной недостаточностью. При отсутствии показаний к ограничению вводимого объема жидкости Тиоктацид® разводят в 250 мл изотонического раствора натрия хлорида.
Применение таблетированной формы АЛК – Тиоктацид® 600 HR – позволяет уменьшить число пациентов, не отвечающих на лечение из-за проблем с абсорбцией обычной формы препарата. Стабильная абсорбция Тиоктацида HR создает достаточный уровень АЛК в плазме крови, обеспечивающий высокую клиническую эффективность.
Рекомендуется следующий режим дозирования: 1 ампула препарата Тиоктацид® 600Т или 3 таблетки Тиоктацида 600 HR в сутки на протяжении 15 дней, затем назначают поддерживающую терапию Тиоктацидом 600 HR по 1 таблетке в сутки.
В ведении больных с неврологическими осложнениями МС важная роль отводится патогенетически обоснованной терапии препаратами АЛК, что позволяет уменьшить симптомы неврологического дефицита, купировать болевой синдром и тем самым повысить качество жизни пациентов с этим хроническим и труднокурабельным состоянием.
Подготовила Людмила Онищук