8 липня, 2015
Эозинофильная пневмония у детей: клиническое наблюдение
Мальчик К., 6 лет, поступил в пульмонологическое отделение Областной детской клинической больницы с жалобами на повышение температуры тела до 37-38,2°С, кашель, одышку.
Из анамнеза заболевания известно, что ребенок болен 4 дня, когда впервые появился кашель: вначале – редкий, сухой, затем в течение суток кашель приобрел навязчивый характер, отмечался постоянно, в том числе и в ночное время суток. Мать связывает начало заболевания с контактом ребенка с больным ОРЗ (в семье болен отец). На 2-е сутки температура повысилась до 38°С, кашель стал более продуктивным, интенсивность его уменьшилась, однако появилось затрудненное дыхание и заложенность носа. По рекомендации участкового педиатра ребенок получал амоксициллин, амброксол, виброцил в форме назального спрея). На фоне проводимого лечения состояние ребенка не улучшилось; по направлению педиатра ребенок доставлен в стационар с диагнозом «Острый обструктивный бронхит. Пневмония?».
Из анамнеза жизни известно, что ребенок от второй нормально протекавшей беременности, вторых срочных родов. Период новорожденности прошел без осложнений. До 4 мес находился на грудном вскармливании. При введении заменителей грудного молока (адаптированные молочные смеси) отмечались реакции в виде атопического дерматита, респираторные инфекции сопровождались явлениями бронхиальной обструкции (2-3 раза в год). Травм, операций не было. Среди перенесенных инфекционных заболеваний – ветряная оспа в возрасте 4 лет. Вакцинация – соответственно календарю прививок.
При поступлении в стационар состояние ребенка средней тяжести, одышка экспираторного характера с участием вспомогательной мускулатуры в акте дыхания, кашель влажный, дистанционные хрипы; SpO2 – 93%. Ребенок беспокойный, капризный, аппетит снижен.
Физическое и нервно-психическое развитие соответствует возрастным параметрам. Кожа бледная, сухая, отмечается умеренно выраженный цианоз носогубного треугольника, высыпаний нет. Периферические лимфоузлы (затылочные, шейные, подчелюстные, подмышечные, паховые) мелкие, подвижные, безболезненные. Со стороны костной системы – признаки диспластического статуса: уплощение грудной клетки, асимметрия расположения лопаток, сандалевидная щель, плоскостопие. Дыхательная система: носовое дыхание несколько затруднено из-за выделений слизистого характера; слизистая задней стенки глотки, миндалин – рыхлая, незначительно гиперемирована, миндалины гипертрофированы, налетов нет. Грудная клетка цилиндрической формы, имеет место уплощение в сагиттальном направлении, межреберные промежутки сглажены, отмечается фиксация плечевого пояса, инспираторное втягивание надгрудинной ямки. Над легкими симметрично с обеих сторон грудной клетки определяется коробочный оттенок перкуторного звука. Частота дыхания – 32 в минуту. Аускультативно дыхание жесткое, выдох удлинен, рассеянные сухие и звучные влажные мелкопузырчатые хрипы над обоими легочными полями, больше справа. Частота сердечных сокращений – 110 в минуту, тоны сердца звучные, ритмичные, учащены; короткий систолический шум на верхушке и в V точке, в другие области сердца не проводится. Живот мягкий, при пальпации безболезненный, печень не выступает из подреберья; селезенка не пальпируется. Стул 1 раз за сутки, оформлен. Мочеиспускание безболезненное, диурез достаточный. Со стороны нервной и эндокринной систем патологических отклонений не выявлено. Диагноз при поступлении: «Острый обструктивный бронхит. Пневмония?».
Для купирования обструктивного синдрома проведено ингаляционное введение
β2-агонистов (Вентолин) через небулайзер. Явления бронхиальной обструкции уменьшились, однако аускультативные данные сохранялись; при этом асимметрия хрипов в легких стала более явной: справа на уровне проекции 3-го сегмента отмечалось обилие звучных мелкокалиберных влажных хрипов; слева – рассеянные сухие и влажные разнокалиберные хрипы.
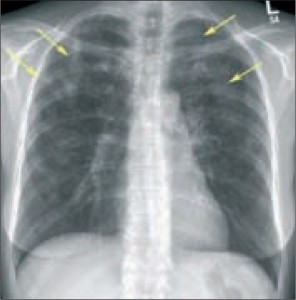
Таким образом, на основании данных анамнеза (кашель, лихорадка в течение 3 дней, отсутствие положительной динамики на фоне проводимого лечения, контакт с больным ОРЗ), данных объективного обследования (интоксикационный синдром, асимметрия физикальных данных в легких), рентгенографии органов грудной полости – ОГП (повышение прозрачности легочных полей симметрично с обеих сторон; справа, в проекции верхней доли на уровне 3-го сегмента отмечается воспалительная инфильтрация очагово-сливного характера средней интенсивности, с нечеткими контурами; корни структурны, тень сердца не изменена, синусы свободны) поставлен предварительный диагноз: «Первичная внегоспитальная правосторонняя очаговая пневмония. Бронхообструктивный синдром».
Данные дополнительных методов обследования. Клинический анализ крови (при поступлении): гемоглобин – 112 г/л, СОЭ – 15 мм/ч, лейкоциты – 11,3×109/л, эозинофилы – 12%, палочкоядерные – 5%, сегментоядерные – 47%, лимфоциты – 30%, моноциты – 6%.
Клинический анализ мочи, копрологическое исследование – без патологических изменений.
Наличие эозинофилии крови, сведения дополнительного анамнеза (в доме есть собака) послужили поводом для проведения исследования крови на наличие антител к гельминтам (результат положительный – повышение уровня антител к токсокарам).
Ребенок получал лечение: стол № 5, гипоаллергенная диета, цефуроксим в/в струйно 100 мг/кг/сут (через периферический катетер), затем перорально 10 мг/кг/сут; Вермокс 3 мг/кг, амброксол 15 мг × 3 раза в день, левоцетиризин (Алерон) 5 мг × 1 раз в день, сальбутамол (Вентолин) через небулайзер в возрастных дозировках. В течение трех дней состояние ребенка улучшилось: температура нормализовалась, явления бронхиальной обструкции значительно уменьшились, нормализовался сон, улучшился аппетит. Физикальные данные: уменьшение гиперпневматизации легких (уменьшение интенсивности коробочного звука), исчезновение сухих свистящих хрипов с обеих сторон, мелкопузырчатых хрипов слева. Справа локализация мелкопузырчатых хрипов сохранялась, количество их уменьшилось.
На 4-й день пребывания в стационаре состояние ребенка ухудшилось: отмечалось повышение температуры до 38,3°С, появились выделения из носа, кашель усилился, усилились явления бронхиальной обструкции. Данное состояние расценено как реинфицирование. Учитывая ухудшение физикальных данных, проведена повторная рентгенография ОГП, исследование крови в динамике, клиническое исследование мокроты.
На рентгенограмме ОГП: в проекции левой верхней доли на уровне 3-го сегмента отмечается средней интенсивности инфильтрация очагового характера, округлой формы, с четкими контурами. Корни структурны, тень сердца не изменена, синусы свободны. Заключение: эозинофильный инфильтрат?
Результаты анализа крови – увеличение степени эозинофилии до 29%. В цитологическом исследовании мокроты – эозинофилия до 34 экз. в поле зрения, кристаллы Шарко-Лейдена. Уровень общего IgE – в пределах возрастной нормы.
Таким образом, клиническое течение заболевания, данные рентгенографии органов грудной клетки (наличие летучих инфильтратов в легочной ткани), эозинофилы в мокроте, эозинофилия крови и ее нарастание параллельно с изменениями физикальных данных и рентгенологических изменений в легких позволили сделать заключение о наличии у ребенка эозинофильной пневмонии.
К лечению добавлено введение дексаметазона внутривенно в дозе 1 мг/кг/сут. Вопрос относительно продолжения и длительности антибиотикотерапии являлся предметом дискуссии и клинического разбора, в результате которого было решено продолжить введение антибиотика (цефуроксим – перорально) до 7 дней, в терапии продолжить прием противогельминтного препарата (Вормил); учитывая длительность антибактериальной терапии, с целью предупреждения развития дисбиоза кишечника назначен пробиотик.
На фоне короткого курса применения дексаметазона (в течение 3 дней) состояние ребенка улучшилось, отмечалась быстрая положительная динамика заболевания – купирование бронхообструктивного синдрома, нормализация аускультативных данных.
Для справки
Легочные эозинофилии (синоним: РІЕ-синдром – pulmonary infiltration with eosinophilia) – группа заболеваний и синдромов, характеризующихся преходящими легочными инфильтратами и эозинофилией крови, превышающей 1,5х109/л, эозинофилией мокроты, лаважной и плевральной жидкостей.
При проведении контрольной рентгенографии ОГП через 2 нед пребывания в стационаре инфильтративных изменений легочной ткани не отмечалось. Эозинофилия крови составляла 15%.
Ребенок выписан домой под наблюдение участкового педиатра, даны рекомендации по дальнейшему наблюдению.
Таким образом, приведенный клинический случай показывает, что при рентгенологически подтвержденной пневмонии, сопровождающейся явлениями бронхообструкции, эозинофилией крови (независимо от ее степени) на фоне отягощенного аллергологического анамнеза необходимо проведение дифференциальной диагностики с эозинофильной пневмонией (синдромом Леффлера).
Приводимый клинический случай вряд ли можно отнести к разряду «трудных» диагнозов, однако диагностический поиск осложняется схожестью симптомов эозинофильной пневмонии, острого обструктивного бронхита и пневмонии, обусловленной инфекционными агентами, а также довольно частым наличием эозинофилии крови у детей младшего возраста. Затрудняет диагностику также и небольшая частота встречаемости эозинофильной пневмонии в детской популяции, обусловленная, по-видимому, трудностью верификации заболевания.
Основные физиологические особенности эозинофилов:
– нормальное количество эозинофилов в периферической крови – 1-6%;
– абсолютное количество эозинофилов – 0,08-0,37×109/л;
– количество эозинофилов обратно пропорционально возрасту человека (наибольшее количество эозинофилов – у новорожденных);
– эозинофилы располагаются преимущественно в тканях (100-500 тканевых эозинофилов на 1 эозинофил крови).
Эозинофилы в организме человека выполняют функции главной защиты против личиночных стадий паразитарных инфекций (свойства цитотоксичности), а также модулятора реакций гиперчувствительности (ингибитора и регулятора реакции гиперчувствительности немедленного типа).
В зависимости от количества эозинофилов в периферической крови различают следующие степени эозинофилии:
– незначительная (до 15-20% клеток);
– умеренная (20-50% клеток);
– выраженная (более 50% клеток).
Основными механизмами развития эозинофилии крови являются:
– механизм АТ-зависимого хемотаксиса при паразитарных инфекциях (при участии IgE, IgG);
– истинный механизм гиперэозинофилии крови, опосредованный IgE (при аллергии);
– ответ на хемотаксический фактор, выделяемый опухолевыми клетками;
– собственно опухолевая эозинофилия (субстратом опухоли являются клетки эозинофильного ростка).
До настоящего времени классификация заболеваний органов дыхания, сопровождающихся гиперэозинофильным синдромом у детей, в Украине отсутствует. Согласно классификации A. Fischman (1980) у взрослых легочные эозинофилии включают 5 нозологических форм:
1) эозинофильная пневмония паразитарного генеза;
2) химически индуцированная (лекарственная) легочная эозинофилия;
3) эозинофильная пневмония с бронхообструктивным синдромом;
4) эозинофильная пневмония с системными проявлениями (миелопролиферативный гиперэозинофильный синдром);
5) эозинофильная пневмония неясной этиологии.
Проявления легочной эозинофилии достаточно разнообразны: от наличия летучих эозинофильных легочных инфильтратов, эозинофильной пневмонии, эозинофильных гранулем, плевральных эозинофилий до васкулитов различной этиологии (лекарственных, паразитарных).
С учетом этиологического фактора выделяют первичные легочные эозинофилии (этиологический фактор остается невыясненным) и вторичные: лекарственные повреждения легких (45%), паразитарные инвазии легких (25%), грибковая сенсибилизация легких (25%), новообразования (до 1%).
Больные предъявляют жалобы, типичные для острых заболеваний органов дыхания: повышение температуры тела до субфебрильных и фебрильных цифр, кашель, одышка.
Гиперэозинофильный синдром можно наблюдать при следующих заболеваниях органов дыхания:
• простая эозинофильная пневмония (синдром Леффлера);
• острая оэозинофильная пневмония;
• хроническая эозинофильная пневмония;
• синдром Чарга-Стросс;
• идиопатический эозинофильный синдром;
• аллергический ринит;
• бронхиальная астма;
• аллергический бронхопульмональный аспергиллез;
• бронхоцентрический гранулематоз (гистиоцитоз Х, саркоидоз);
• инфекционные заболевания, вызванные паразитами;
• аллергические реакции, вызванные приемом медикаментов;
• экзогенный аллергический альвеолит.
Алгоритм врачебной тактики при гиперэозинофилии крови и предположении о наличии эозинофильного поражения органов дыхания:
1. Тщательное изучение анамнеза с установлением наличия домашних животных, отягощенного аллергологического анамнеза (бронхиальная астма, аллергический ринит, атопический дерматит), аллергических реакций на лекарственные препараты (на этапах лечения всех заболеваний).
2. Физикальное обследование (вовлечение других органов и систем).
3. Исследование крови, бронхоальвеолярного лаважа, мокроты, многократные исследования на глистную инвазию, антитела к грибам.
4. Определение уровня IgE.
5. Гистологическое исследование материала с целью выявления специфических морфологических изменений органов и тканей.
Решающими в диагностике заболевания являются исследование крови и рентгенография органов грудной полости. Интересен тот факт, что эозинофилия наиболее выражена не во время максимального развития легочного инфильтрата, а спустя несколько дней.
У детей наиболее часто встречается простая эозинофильная пневмония, или синдром Леффлера, для которого характерно наличие «летучих» инфильтратов (рис. 1), выявляемых, как правило, только при рентгенографии органов грудной полости и нередко самостоятельно разрешающихся. Доказано, что в основе развития синдрома Леффлера лежат следующие факторы: атопическая сенсибилизация к аллергенам цветочной пыльцы, грибковым антигенам (особенно рода аспергилл); гельминтная инвазия (аскаридоз, стронгилоидоз, шистосомоз, анкилостомоз, парагонимоз, токсокароз); лекарственная пищевая аллергия. Эозинофилию предопределяет не только наличие гельминтов с тканевой локализацией паразитов и личинок, но и миграция глистов, которые не адаптированы к организму человека (Toxocara canis, Toxocara catis).
Патогенез окончательно не выяснен. Известно, что инфильтрация тканей эозинофилами происходит вследствие их привлечения из кровотока различными хемотаксическими факторами: эозинофильным хемотаксическим фактором анафилаксии, который выделяется тучными клетками (лаброцитами) при их активации как иммунными (IgE-обусловленными), так и неиммунными механизмами; гистамином; компонентами системы комплемента, особенно С5а; некоторыми лимфокинами.
Для синдрома Леффлера характерны жалобы на сухой кашель, реже – влажный с отделением вязкой мокроты, одышка, болезненность в области трахеи. На рентгенограмме ОГП определяются инфильтраты округлой формы диаметром от нескольких миллиметров до нескольких сантиметров, иногда с двусторонней локализацией. Легочные инфильтраты могут сохраняться до нескольких недель, мигрировать по легочным полям и самостоятельно разрешаться, не оставляя рубцовых изменений в легких. В анализе крови определяется повышение количества эозинофилов более чем на 10%, характерно повышение уровня IgE.
Прогноз заболевания благоприятный. Как правило, дегельминтизация и устранение воздействия аллергена приводят к выздоровлению, и назначение глюкокортикостероидов (ГКС) не требуется. В некоторых случаях отмечается спонтанное разрешение инфильтратов.
Острая эозинофильная пневмония (острый эозинофильный пневмонит) характеризуется тяжелым течением с развитием симптомов острой легочной недостаточности, бактериальной деструкции легких, острого респираторного дистресc-синдрома, наличием более 40% эозинофилов в лаважной и плевральной жидкости. Бактериологическое исследование при острой эозинофильной пневмонии дает отрицательный результат, подтверждающий неинфекционную природу патологического процесса. Связь заболевания с приемом лекарственных препаратов отсутствует, при лечении ГКС прогноз благоприятный. Клинически для острой эозинофильной пневмонии характерно острое начало на протяжении 1-5 дней, симптомы острой дыхательной недостаточности, требующей респираторной поддержки. Больные предъявляют жалобы на боль в груди, миалгию, гипертермию. При объективном обследовании над легкими аускультативно выслушивается ослабленное везикулярное дыхание и распространенные мелкопузырчатые («целлофановые») хрипы. При проведении рентгенографии ОГП фиксируют интенсивные инфильтраты смешанной природы, распространяющиеся как на альвеолярное, так и на интерстициальное пространство (чаще в верхних легочных полях). При исследовании периферической крови выявляют нормальное количество или незначительную (до 15%) эозинофилию. При этом в лаважной и плевральной жидкости регистрируют 40% и более эозинофилов. С помощью компьютерной томографии легких выявляют диффузные консолидирующие инфильтраты, которые распространяются на альвеолярную ткань и интерлобарные перегородки, быстрое и частое (в 50% случаев) повреждение плевры. Морфологические особенности острой эозинофильной пневмонии: острое и диффузное геморрагическое поражение альвеол с выраженной инфильтрацией эозинофилами, которые депонируются в альвеолах и интерстициальной ткани, гиалиновые мембраны, гиперплазия пневмоцитов второго типа, наличие кластеров эозинофилов (5-10 клеток в поле зрения).
Особенностью данной патологии является быстрая регрессия процесса на фоне лечения ГКС. В большинстве случаев назначается преднизолон в дозе 1-3-5 мг/кг/сут с постепенной отменой препарата. Ингаляционные стероиды (флутиказон, будесонид) эффективны после отмены перорального применения кортикостероидов, а также на фоне рецидива заболевания.
Хроническая эозинофильная пневмония (хронический эозинофильный пневмонит) в настоящее время рассматривается как вариант простой легочной эозинофилии, которая отличается от синдрома Леффлера существованием и рецидивированием эозинофильных инфильтратов в легких более 4 нед. Для нее характерны длительная фебрильная лихорадка, интоксикация, снижение массы тела, высокая эозинофилия крови в сочетании с инфильтратами в легких и плевральным выпотом.
Суть диагностики хронического эозинофильного пневмонита состоит в исключении атопической сенсибилизации, микотической и паразитарной инфекции. Применяют дегельминтизацию, антимикотическую терапию, назначают ГКС в дозе 20-30 мг/сут (в пересчете по преднизолону) в течение 4-6 нед. Прогноз в большинстве случаев благоприятный.
Идиопатический гиперэозинофильный синдром (синдром Леффлера II, фибропластический пристеночный эндокардит) характеризуется длительным повышением уровня эозинофилов в периферической крови и инфильтрацией этими клетками многих органов и систем с развитием полиорганного поражения.
При установлении диагноза необходима ориентация на следующие признаки:
– эозинофилия крови более 1,5×109/л в течение более 6 мес;
– отсутствие паразитарной инфекции и аллергических заболеваний;
– доминирование симптомов полиорганного патологического процесса.
Начало заболевания острое или подострое. Первые проявления: анорексия, снижение массы тела, слабость, тошнота, абдоминальная боль, диарея, непродуктивный кашель, зуд кожи, лихорадка, потливость в ночное время, венозное тромбообразование. Позднее среди клинических проявлений выделяется полиорганный синдром, а именно: со стороны органов дыхания – интерстициальные инфильтраты в легких, плевральный выпот; при обследовании сердечно-сосудистой системы – застойная сердечная недостаточность, шумы сердца, нарушения ритма и проводимости (следствие эндомиокардиального фиброза); со стороны желудочно-кишечного тракта – гепато- и/или спленомегалия; отмечается дисфункция центральной нервной системы в виде расстройств поведения, делирия, деменции, комы, энцефалопатии, полинейропатии, инсульта. Со стороны системы крови отмечается анемия, реже – тромбоцитопения, лейкоцитоз с выраженной эозинофилией (выше 1,5×109/л). В миелограмме – гиперплазия эозинофильного ростка.
Клинически при обследовании органов дыхания отмечается непродуктивный кашель, одышка, рентгенологически выявляются инфильтраты, возникающие вследствие миграции эозинофилов в паренхиму легкого; на поздних стадиях – фиброз легких, инфаркт-пневмонии.
Лечебная тактика при идиопатическом гиперэозинофильном синдроме состоит в назначении ГКС на этапе полиорганного поражения (до 60-90 мг/сут), цитостатиков и препаратов интерферона (при полиорганном поражении и низкой терапевтической эффективности ГКС). При отсутствии полиорганного поражения специфическая терапия не показана, рекомендуется наблюдение больного.
Прогноз неблагоприятный: несмотря на терапию ГКС или цитостатическими препаратами, около 75% пациентов погибают после 3 лет болезни.
Трудности представляет дифференциальная диагностика с бронхиальной астмой (БА), особенно при повторных рецидивах заболевания. БА характеризуется приступообразным развитием обструкции, не связанной с вирусной инфекцией, имеется контакт с аллергеном. У больных прослеживается отягощенный аллергологический анамнез, признаки пищевой аллергии, атопического дерматита, аллергического ринита как в комплексе, так и самостоятельно. Эпизоды сухого кашля чаще всего возникают в ночное время и сочетаются с приступами удушья. При лабораторном исследовании отмечается увеличение уровня IgE, повышение эозинофилов в крови, снижение уровня Т-супрессоров, сывороточного и секреторного IgА. Особые трудности в постановке диагноза БА возникают в раннем детском возрасте. Диагностические критерии БА у детей раннего возраста представлены в таблице 1.

Аллергический бронхопульмональный аспергиллез – иммунокомплексное заболевание дыхательных путей, которое развивается вследствие колонизации на поверхности слизистой оболочки трахеи и бронхов плесневого гриба рода Aspergillus (A. fumigatus, A. flavus, A. niger, A. nidulans).
Фоном аспергиллеза являются состояния, приводящие к снижению общей сопротивляемости организма: неполноценное питание, фоновые заболевания (сахарный диабет, саркоидоз, туберкулез, заболевания крови, онкологические процессы, инфаркт легкого, деструктивные процессы в легких), переутомление, длительное лечение антибактериальными, гормональными и цитостатическими препаратами, радиотерапия.
Особенностью этого заболевания являются частые обострения, эпизоды длительной обструкции дыхательных путей, признаки рецидивирующей инфекции дыхательных путей, образование слизистых пробок, развитие бронхоэктазов.
Клиническими признаками бронхиальной обструкции при аллергическом бронхопульмональном аспергиллезе являются обострение обструкции, сопровождаемое повышением температуры тела, наличие мокроты, которая приобретает коричневый цвет (возможна примесь крови), гиперэозинофилия как крови, так и мокроты, обнаружение колоний гриба в мокроте, выявление специфических антител к роду Aspergillus и высокое содержание IgE.
Гистологическая картина при аллергическом бронхопульмональном аспергиллезе характеризуется особым вариантом поражения легких, который описан именно при этом заболевании и получил название «бронхоцентрическая гранулема» (бронхиолит с формированием слизистых пробок, которые обтурируют просвет дыхательных путей, эозинофильная пневмония и бронхоцентрическая гранулема). Гранулема образуется в ответ на антителообразование и является причиной развития необратимой обструкции дыхательных путей мелкого калибра, плохо устраняемой традиционными бронхолитиками.
Основу терапии аспергиллеза составляют противогрибковые антибиотики, имеющие наивысшую активность к грибам рода Aspergillus (амфотерицин В, амфоглюкамин, кетоконазол, флуцитозин). Препараты вводят ингаляционно, аэрозольно, трансбронхиально и трансторакально, через микродренаж в зашитой ране. Осуществляют десенсибилизацию аспергиллезными экстрактами. По показаниям (при наличии гранулем) – выполняют оперативное лечение.
Паразитарные инфекции. Различают три механизма развития эозинофильной пневмонии при паразитозах – инвазия паразитов в легкие, их временное обитание в легких в рамках жизненного цикла или попадание в легочную ткань через кровоток. Эозинофилы мигрируют в легочную ткань для борьбы с паразитами, что приводит к развитию эозинофильной пневмонии. К паразитам, внедряющимся в легкие, относятся легочный сосальщик (возбудитель легочного парагонимоза), ленточные черви эхинококк (Echinococcus) и свиной цепень (Taenia solium). К паразитам, временно заселяющимся в легкие в ходе жизненного цикла, относятся человеческие аскариды (Ascaris lumbricoides), кишечные угрицы (Strongyloides stercoralis), анкилостомы (Ancylostoma duodenale) и некаторы (Necator americanus). Эозинофильная пневмония, вызванная паразитами этой группы, часто носит название синдрома Леффлера. Паразиты из третьей группы попадают в легочную ткань посредством заноса массивных скоплений яиц через кровоток. К таким паразитам относятся трихинеллы (Trichinella spiralis), кишечные угрицы (Strongyloides stercoralis), человеческие аскариды (Ascaris lumbricoides), анкилостомы и шистосомы.
Лекарственная легочная эозинофилия характеризуется следующими особенностями:
– высокая эозинофилия крови, сочетающаяся с повреждением тканей;
– применение антибактериальных препаратов, таких препаратов, как сульфаниламиды, ацетилсалициловая кислота, соли золота, хемотрипсин, эуфиллин, витамины группы В, папаверин, преднизолон, нитрофураны, фенитоин, триптофан, ампициллин, ацетаминофен, пентамидин, ранитидин, соли металлов, серосодержащие соли, которые способны нарушать реактивность эозинофилов.
В последние годы описана гиперэозинофилия на ГКС, латексная гиперэозинофилия, гиперэозинофилия на кромогликат натрия. Кроме этого, описаны следующие изменения паренхимы легких, возникающие под воздействием различных лекарственных препаратов:
– некардиогенный отек легких (вызванный салицилатами, пенициллином, диуретиками, ингибиторами моноаминооксидазы, галоперидолом, опиатами, барбитуратами, цитостатиками, лидокаином, гипотиазидом, амфотерицином В, колхицином);
– фиброзирующий альвеолит (обусловленный цитостатиками, нитрофуранами, ганглиоблокаторами, адиурекрином);
– гиперчувствительный пневмонит (спровоцированный антибактериальными препаратами, сульфаниламидами, нитрофуранами, цитостатиками, дифенином, солями золота, D-пеницилламином, амиодароном);
– фосфолипидоз легких (обусловленный амиодароном);
– облитерирующий бронхиолит (вызванный D-пеницилламином, сульфосалазином);
– синдром Гудпасчера (D-пеницилламин);
– нарушения легочного кровообращения (вследствие приема пероральных контрацептивов, прогестинов, ГКС, диуретиков, контрастных веществ, а также внезапной отмены антикоагулянтов).
Для всех форм лекарственной легочной эозинофилии характерна связь с применением тех или иных лекарственных препаратов, отмена которых сопровождается улучшением состояния больного, нормализацией лабораторных показателей.
Экзогенный аллергический альвеолит (ЭАА) – общее название группы аллергических пневмопатий, которые возникают вследствие аллергической реакции легочной ткани на интенсивные и длительные ингаляции определенного рода антигенов. ЭАА представляет собой диффузный гранулематозный воспалительный процесс альвеол и интерстициальной ткани легких, развивающийся под влиянием интенсивной и продолжительной ингаляции преимущественно органических водонерастворимых антигенов. Заболевание впервые было описано в 1932 г. J. Campbell, обнаружившим у пятерых фермеров развитие острых респираторных симптомов после работы с влажным заплесневелым сеном. Эта форма заболевания получила название «легкое фермера». В настоящее время заболевание может регистрироваться у детей. Этиологическим фактором ЭАА в детском возрасте чаще является TORCH-инфекция. Большинство экспертов приходит к мнению, что примерно 5-15% лиц, подвергшихся воздействию высокой концентрации этиологического агента, заболевают гиперчувствительным пневмонитом. Тем не менее большинство людей, подвергшихся воздействию антигенного материала, не заболевает ЭАА, что позволяет предположить участие в развитии заболевания (кроме экзогенных) эндогенных факторов, которые изучены пока недостаточно.
Для развития ЭАА необходимо глубокое – до альвеол – проникновение антигена, поэтому величина его не должна превышать 5 мкм, они должны быть устойчивы к действию лизосомальных ферментов, а контакт с ними должен быть длительным.
Группы антигенов (АГ), вызывающие ЭАА:
• микроорганизмы (бактерии, грибы, простейшие) и продукты их жизнедеятельности – белки, глико- и липопротеиды, полисахариды, ферменты, эндотоксины;
• белковые субстанции животного и растительного происхождения (сывороточные белки, экскременты домашних птиц, шерсть домашних животных и пр.);
• низкомолекулярные соединения и лекарственные средства;
• АГ растительного происхождения (опилки деревьев, заплесневелая солома, экстракты кофейных зерен и пр.).
Большинство авторов придерживается точки зрения, что основную роль в патогенезе ЭАА играют иммунокомплексные аллергические реакции (3 тип по классификации Джелла-Кумбса), хотя возможны и аллергические реакции другого типа (цитотоксического или замедленного). Циркулирующие иммунные комплексы и специфические антитела активизируют систему комплемента и альвеолярные макрофаги. Последние выделяют интерлейкин-2, хемотаксические факторы, протеолитические ферменты, активные кислородные радикалы, способствуют росту фибробластов, продукции коллагена. В результате развивается альвеолобронхиолит, происходит образование гранулем, фиброзирование интерстиция легких. Тем не менее в последнее время получены данные, что при ЭАА наряду с иммунокомплексной развивается аллергическая реакция замедленного типа. Уже на ранней стадии заболевания вслед за нейтрофильной инфильтрацией альвеол и мелких дыхательных путей в очаге воспаления появляются лимфоциты. При длительном или многократном поступлении в легкие антигена или вещества, обладающего адъювантным действием, развивается аллергическая реакция замедленного типа, что приводит к образованию гранулем. Сразу после контакта с АГ (при остром ЭАА) лаважная жидкость, помимо тучных клеток и нейтрофилов, содержит большое количество лимфоцитов CD4. У выздоравливающих от ЭАА, а также у больных с подострой и хронической формами заболевания преобладают лимфоциты CD8.
В зависимости от клинического течения ЭАА имеет следующие формы: острую, подострую, хроническую. Характер течения ЭАА определяется длительностью контакта с антигеном: интермиттирующий контакт с АГ ведет к острым реакциям, длительный – к хроническому прогрессирующему процессу, когда чрезвычайно трудно заподозрить его аллергический генез.
В типичных случаях острая форма развивается через 4-12 ч после контакта с АГ и быстро проходит после его прекращения. Среди общих симптомов отмечаются недомогание, озноб, чувство стеснения в груди, потливость, головная боль, боли в конечностях, кашель, одышка. Состояние напоминает острое вирусное или бактериальное респираторное заболевание.
Развитие ЭАА возможно по пневмониеподобному варианту: на первый план выходит выраженная одышка, в легких прослушиваются крепитация, хрипы. При элиминации антигена в течение нескольких дней больные выздоравливают.
Возможен также астмоидный вариант ЭАА, при котором через 15-20 мин после контакта с соответствующим антигеном наблюдается клиническая картина, весьма сходная с таковой при приступе бронхиальной астмы: явления удушья, в легких выслушиваются свистящие хрипы, после разрешения приступа выделяется серозная мокрота.
Для любых вариантов острого течения ЭАА характерным является «симптом понедельника»: за выходные дни (если антиген связан с профессиональной деятельностью) состояние больного улучшается, практически исчезают жалобы и клинические проявления ЭАА, а в первый же день выхода на работу все возобновляется.
При подострой форме ЭАА (продолжительно действуют небольшие дозы антигена) общие симптомы заболевания менее выражены. Больные жалуются на утомляемость, похудение, одышку и кашель. Объективно определяются признаки бронхита. Каждое очередное обострение сопровождается более медленным выздоровлением больного и уже неполным восстановлением функции легких.
Хроническая форма ЭАА развивается при многолетнем длительном контакте с небольшими дозами антигена. Больные жалуются на одышку даже при небольших физических нагрузках, постоянный кашель со скудной слизистой мокротой и недомогание, снижение работоспособности, потерю аппетита, снижение массы тела, миалгию, субфебрильную температуру тела. При аускультации в легких выслушиваются мелко- и среднепузырчатые влажные хрипы, ослабленное дыхание, при перкуссии определяется коробочный оттенок звука. В дальнейшем у больных развивается легочная и легочно-сердечная недостаточность, обычно с неблагоприятным прогнозом.
Диагноз ЭАА устанавливают на основании:
1) анамнеза: указания на наличие профессионального или домашнего антигена, его определенного воздействия, установление связи между действием антигена и клинической симптоматикой;
2) объективных данных: аускультативных данных, признаков дыхательной недостаточности при хроническом течении;
3) кожного тестирования с некоторыми антигенами: прик-тест при эпидермальной аллергии; внутрикожная проба; патч-тест при аллергии к некоторым химическим веществам (моющие средства и пр.);
4) исследования функции внешнего дыхания: для всех форм экзогенного аллергического альвеолита характерны рестриктивный тип дыхательных нарушений со снижением легочных объемов, диффузионной способности и податливости легких, а также гипоксемия после физической нагрузки, а затем и в покое. Скорость развития дыхательных нарушений зависит от формы заболевания. На ранних стадиях заболевания, как правило, наблюдается нормальное напряжение О2 в артериальной крови, однако уже отмечается снижение сатурации во время физической нагрузки;
5) рентгенографии грудной клетки: при острых и подострых формах ЭАА наиболее частыми находками являются снижение прозрачности легочных полей по типу «матового стекла», распространенные узелково-сетчатые затемнения (до 3 мм во всех участках легких). Рентгенологические изменения при остром течении ЭАА обычно разрешаются в течение 4-6 нед при отсутствии повторного контакта с причинным антигеном. Для подострой и хронической форм характерны множественные мелкоочаговые тени на фоне сетчатой перестройки легочного рисунка. Возможно формирование «сотового легкого». При компьютерной томографии можно выявить диффузное повышение плотности ткани легких, утолщение стенки сегментарных бронхов, множественные мелкоочаговые тени на фоне сетчатой перестройки легочного рисунка;
6) лабораторного исследования: при остром ЭАА в крови выявляется умеренный лейкоцитоз, в среднем до 12-15×109/л. Часто отмечается сдвиг лейкоцитарной формулы влево. Эозинофилия выявляется редко и, как правило, является незначительной. У большинства пациентов отмечаются нормальные значения СОЭ, однако в 31% случаев этот показатель достигает 20-40 мм/ч, в 8% – превышает 40 мм/ч. Часто выявляют повышенные уровни общих IgG и IgM, иногда также увеличено содержание общего IgA. У некоторых больных обнаруживают умеренное повышение активности ревматоидного фактора. Особое значение при ЭАА имеет обнаружение специфических преципитирующих антител к «виновному» антигену (методами двойной диффузии по Оухтерлони, встречного иммуноэлектрофореза и иммуноферментными методами);
7) исследования лаважной жидкости. Можно выявить увеличенное в 5 раз содержание Т-лимфоцитов (преимущественно CD8 Т-лимфоцитов). Соотношение CD4 Т-лимфоцитов к CD8 Т-лимфоцитам превышает 1:2;
8) биопсии легкого (вначале трансбронхиальная, а при неинформативности – открытая). При ЭАА биопсия легкого позволяет выявить три основных признака: лимфоцитарный бронхиолит, интерстициальную инфильтрацию из плазматических клеток и лимфоцитов (в поздней стадии – интерстициальный фиброз) и единичные, беспорядочно расположенные гранулемы без некроза. Эти изменения наиболее четко выражены при подостром и хроническом течении ЭАА. Если биопсия проведена при острой форме заболевания, типична интерстициальная и альвеолярная инфильтрация из плазматических клеток, лимфоцитов, а также эозинофилов и нейтрофилов, иногда в сочетании с гранулемами.
В качестве диагностических критериев, которые можно использовать практически на любом уровне, можно предложить анамнестические признаки:
• длительное воздействие частиц органической пыли относительно небольшого размера;
• наличие эпизодов одышки, сопровождающейся сухим кашлем, лихорадкой и недомоганием, развивающейся через несколько часов после ингаляции соответствующего антигена, и исчезновение респираторных симптомов заболевания после прекращения контакта;
• двусторонняя крепитация над легкими;
• поздняя (типа феномена Артюса) или аллергическая реакция замедленного типа при внутрикожном введении соответствующего антигена;
• выявление рестриктивных нарушений легочной вентиляции;
• рентгенологическая картина легочной диссеминации смешанного или узелкового характера с переходом в «сотовое легкое»;
• выявление в сыворотке крови специфических антител.
Лечение заключается в прекращении контакта с антигеном.
При остром течении ЭАА медикаментозное лечение можно не проводить. Единственным эффективным средством лечения подострой и хронической форм ЭАА являются системные ГКС – преднизолон в дозе 1 мг/кг в течение 1-2 мес с последующим постепенным снижением дозы до поддерживающей (5-10 мг/сут). Преднизолон отменяют по достижении клинического улучшения или при отсутствии клинического и функционального ответа на него. Если в период снижения дозы преднизолона происходит ухудшение состояния больного, то следует вернуться на предшествующую ступень терапии.
Прогноз при ЭАА зависит от своевременности выявления заболевания. При остром и подостром течении ЭАА изменения в легких обратимы, и спустя несколько дней, недель или месяцев после прекращения контакта с антигеном симптомы заболевания полностью исчезают. При хронической форме ЭАА прогноз сомнителен. Заболевание может прогрессировать даже после прекращения контакта с антигеном и трудно поддаваться лечению.
Список литературы находится в редакции.