27 листопада, 2016
Метформин: новые аспекты клинического применения
Хвалебные эпитеты не составляют похвалы.
Похвала требует фактов, и притом умело поданных.
Жан де Лабрюйер
В эпоху высоких технологий и инновационных лекарственных средств практически невозможно себе представить лечение сахарного диабета (СД) 2 типа без метформина. Хорошо изученный на практике и показывающий оптимальные результаты, этот препарат пользуется спросом не только у врачей, но и у пациентов.
На страницах медицинских журналов и просторах всемирной информационной сети метформин называют «наиболее эффективным антидиабетическим средством», а также «единственным препаратом для одновременной профилактики осложнений СД и сердечно-сосудистых заболеваний», «лекарством от рака и старости», «уникальным снадобьем для быстрого похудения», «волшебным лекарством со скрытыми возможностями». Перечисленные похвальные отзывы отнюдь не лесть, все эти высказывания подтверждены реальными фактами и данными доказательной медицины.
Только факты
Метформин – это единственный представитель группы бигуанидов, полученный из растения галеги лекарственной, снижающий уровень глюкозы в крови без риска развития гипогликемии, являющийся препаратом первой линии терапии СД 2 типа и входящий в перечень жизненно важных лекарств Всемирной организации здравоохранения. В настоящее время терапевтический потенциал этого препарата стремительно расширяется: опубликовано большое количество данных, подтверждающих роль метформина в лечении рака и кардиоваскулярных заболеваний, замедлении старения и модуляции кишечной микробиоты.
Изменение состава микробиоты на фоне терапии метформином объясняют активацией слизистой АМФ-активируемой протеинкиназы (AMP activated protein kinase, AMPK), способной поддерживать целостность кишечного барьера. На сегодняшний день считается, что сочетанная активация печеночной и слизистой АМРК способствует уменьшению содержания липолисахаридов в печени и системном кровотоке.
Гипогликемическое действие данного бигуанида связывают со способностью метформина ингибировать глюконеогенез посредством:
• активации печеночной AMPK с помощью печеночной киназы В1 (liver kinase B1 LKB1);
• ингибирования глюкагониндуцированной продукции циклического аденозинмонофосфата (АМФ) в результате блокады аденилатциклазы;
• ингибирования НАДН-коэнзима Q оксидоредуктазы (I комплекса) в митохондриальной цепи переноса электронов для уменьшения уровня аденозинтрифосфата (АТФ) и увеличения соотношения АМФ/АТФ, необходимого для последующей активации АМPK;
• ингибирования митохондриальной глицерин‑3-фосфат дегидрогеназы (mG3PDH) и изменения транспорта НАДН из цитоплазмы в митохондрии (Marin-Penalver J. et al., 2016).
Ряд эффектов метформина, в том числе ингибирование клеточного роста, объясняют активацией LKB1, являющейся супрессором опухолевого роста и активатором АМPK.
Особенности клинического применения
Метформин, применяемый в качестве противодиабетического средства, снижает уровень гликемии натощак приблизительно на 20%, а концентрацию HbA1c – на 1,5%. При необходимости он может назначаться в комбинации с производными сульфонилмочевины, глинидами, ингибиторами α-глюкозидазы, инсулином, тиазолидиндионами, ингибиторами дипептидилпептидазы 4 типа, агонистами рецепторов глюкагонподобного пептида. Метформин противопоказан больным с предрасположенностью к развитию лактатацидоза (пациентам, злоупотребляющим алкоголем, имеющим нарушение функции почек, сопутствующую патологию печени или отягощенный анамнез в отношении развития лактатацидоза, а также лицам, страдающим острой сердечной недостаточностью).
Прием этого бигуанида может сопровождаться появлением побочных действий со стороны желудочно-кишечного тракта (анорексия, тошнота, абдоминальный дискомфорт и диарея); как правило, они носят транзиторный характер и легко переносятся пациентами. В редких случаях терапия метформином может спровоцировать развитие В12-дефицитной анемии и лактатацидоза (Marin-Penalver J. et al., 2016).
Результаты обсервационных исследований утверждают, что метформин обладает целым рядом плейотропных эффектов: уменьшает распространенность неопластических заболеваний любой локализации, снижает уровень летальности у онкологических больных, увеличивает фертильность у пациенток с синдромом поликистозных яичников, замедляет процесс старения, способствует нормализации массы тела.
Кроме того, с помощью метформина можно снизить риск развития сердечно-сосудистых событий (инфаркта, инсульта) у лиц обоего пола, а также нормализовать течение гипертонической болезни. Возможность достижения таких удивительных результатов связывают с уникальной способностью этого бигуанида смягчать явления атерогенной дислипидемии: снижать концентрацию свободных жирных кислот, триглицеридов (ТГ), холестерина (ХС) липопротеинов низкой плотности (ЛПНП) и увеличивать уровень ХС липопротеинов высокой плотности (ЛПВП).
Раскрывая скрытые возможности
Известно, что дислипидемия в сочетании с инсулинорезистентностью является значимым фактором риска развития кардиоваскулярных событий. Метформин обладает дополнительным защитным эффектом в отношении развития сердечно-сосудистых осложнений. Это утверждение не является голословным: гиполипидемическое действие данного бигуанида подтверждено результатами многочисленных клинических исследований. Одним из таких исследований является работа под руководством R. Goldberg (2013), отличительной чертой которой стал тщательный анализ липидного спектра, проведенный на уровне субфракций липопротеинов.
Материалы и методы
В исследовании, выполненном американскими учеными, приняли участие пациенты, у которых в рамках Программы профилактики диабета (Diabetes Prevention Program) было выявлено нарушение толерантности к глюкозе. Исследователи использовали следующие критерии включения: возраст ≥25 лет, индекс массы тела (ИМТ) ≥24 кг/м2, уровень гликемии натощак в пределах 95-125 мг/дл, уровень гликемии спустя 2 ч после проведения теста толерантности к глюкозе – 140-199 мг/дл. Из исследования исключались больные, принимавшие медикаменты, провоцирующие нарушение толерантности к глюкозе, а также пациенты, которые на протяжении последних 6 мес перенесли какое-либо кардиоваскулярное событие. Еще одним критерием исключения являлось наличие любого сопутствующего заболевания, способного значительно ограничить возможность пациента принимать активное участие в исследовании.
Всех участников рандомизировали в три группы: в первой группе пациентов назначали метформин (850 мг/сут), во второй – плацебо, а в третьей рекомендовали придерживаться положений интенсивной программы по модификации образа жизни (ИМОЖ) на протяжении 1 года. ИМОЖ была направлена на быстрое снижение массы (минимум на 7% от исходных значений) и удержание достигнутого результата посредством соблюдения гипокалорийной диеты с низким содержанием жира и увеличения физической активности минимум до 150 мин/нед. В данном исследовании диагноз СД устанавливали в соответствии с диагностическими критериями American Diabetes Association: на основании ежегодного проведения теста толерантности к глюкозе или определения уровня гликемии натощак один раз в полгода.
R. Goldberg и соавт. рандомизировали 3234 пациентов, для дальнейшего анализа использовались результаты обследования больных, прошедших врачебный осмотр в контрольных точках (n=2023); ученые получили 1645 образцов парных сывороток (группа плацебо: n=553; группа метформина: n=558; группа ИМОЖ: n=534). Перед началом рандомизации все участники дали письменное информированное согласие на участие в исследовании.
Оценку демографических и клинических данных проводили с помощью стандартизованного опросника. Уровень артериального давления, а также все необходимые антропометрические показатели определялись при помощи стандартных методик. Дизайн исследования предусматривал сбор и анализ информации о привычном рационе (при включении пациента в исследование) и соблюдении диетических рекомендаций (спустя 12 мес терапии) с использованием Модифицированного опросника частоты потребления различных пищевых продуктов. Ученые также измеряли уровень физической нагрузки при помощи суммарного метаболического эквивалента, а также определяли уровень гликемии натощак, концентрацию инсулина, адипонектина и ХС в сыворотке крови, показатели липидограммы и средневзвешенные размеры ЛПОНП, ЛПНП, ЛПВП, рассчитывали индекс инсулинорезистентности (Homeostasis Model Assessment of Insulin Resistance, НОМА-IR).
Для обнаружения и характеристики субфракций липопротеинов у пациентов с нарушенной толерантностью к глюкозе использовали сразу две методики: ядерно-магнитный резонанс (ЯМР) и ультрацентрифугирование в градиенте плотности.
Результаты
Клинические и метаболические параметры
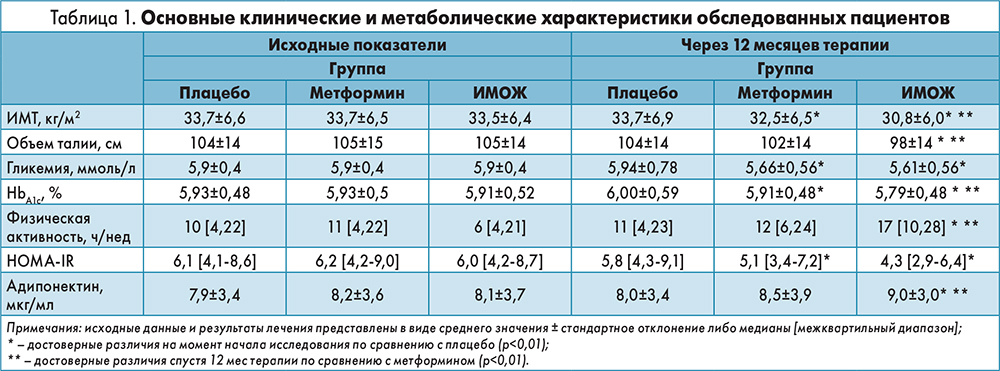
Основные клинические и метаболические характеристики, как на момент включения в исследование, так и спустя 12 мес от его начала, представлены в таблице 1.
Характеризуя исходные клинико-демографические показатели, исследователи подчеркнули сопоставимость сформированных групп. Спустя 12 мес терапии ученые зафиксировали статистически достоверные изменения некоторых антропометрических показателей, а также уровня гликемии, концентрации адипонектина и свободных жирных кислот, индекса HOMA-IR и степени физической активности. Исследователи выявили интересный факт: концентрация ТГ снизилась только в группе ИМОЖ, тогда как содержание ХС ЛПВП в сыворотке крови возросло как у пациентов, вошедших в состав группы ИМОЖ, так и у больных из группы метформина. Ни в одной из трех групп не было зарегистрировано значимых изменений концентрации ХС ЛПНП.
Субфракции липопротеинов (результаты ЯМР)
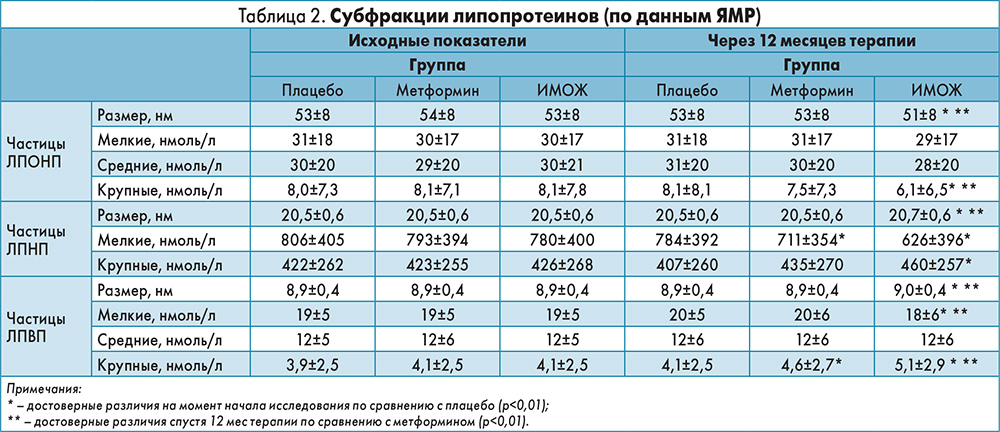
В таблице 2 приведены нескорректированные средние значения липопротеинов в динамике лечения.
Сопоставляя исходные характеристики размеров и концентраций мелких, средних и крупных частиц ЛПОНП, ЛПНП и ЛПВП, ученые не выявили достоверных межгрупповых различий. Однако спустя 12 мес лечения таковые появились: концентрация крупных частиц ЛПОНП и размеры ЛПОНП у больных, вошедших в состав группы ИМОЖ, были значительно меньше, чем у пациентов в группах плацебо и метформина (р<0,01).
Размеры ЛПНП и концентрация крупных частиц ЛПНП в группах ИМОЖ и метформина превосходили аналогичные показатели в группе плацебо; содержание мелких частиц ЛПНП у пациентов, принимавших метформин или поддерживавших ИМОЖ, значительно уступало таковому у больных, получавших плацебо (во всех случаях р<0,01). Интересно, что значения перечисленных показателей в группе ИМОЖ достоверно (во всех случаях р<0,01) превышали соответствующие параметры в группе метформина. Подобная зависимость зафиксирована в отношении субфракций ЛПВП: концентрация крупных частиц ЛПВП, а также размеры ЛПВП у больных из группы ИМОЖ превосходили аналогичные показатели у пациентов из группы плацебо и метформина (во всех случаях р<0,01).
Исследователи зафиксировали значимое уменьшение содержания крупных частиц ЛПОНП, а также размеров ЛПОНП в группе ИМОЖ по сравнению с группой метформина и плацебо. Несмотря на отсутствие достоверных изменений концентрации ХС ЛПНП, в группе ИМОЖ общее количество частиц ЛПНП несколько снизилось, вероятно, вследствие падения концентрации мелких ЛПНП; зарегистрирована также тенденция к увеличению содержания крупных частиц ЛПНП (во всех случаях р<0,01).
Подобные изменения, хотя и менее значимые, были отмечены в группе метформина по сравнению с плацебо (во всех случаях р<0,01).
Проводимая терапия способствовала достоверному увеличению размера ЛПНП у больных, соблюдавших принципы ИМОЖ, по сравнению с аналогичным показателем у пациентов, получавших метформин или плацебо (р<0,01). В группах ИМОЖ и метформина зафиксировано достоверное увеличение размера ЛПВП, концентрации крупных частиц ЛПВП по сравнению с плацебо; в то же время содержание мелких ЛПВП в группе ИМОЖ уменьшилось (р<0,01), а в группе метформина возросло.
Обсуждение
Отличительной чертой данного исследования является одновременное использование двух современных методик: ультрацентрифугирования в градиенте плотности для определения изменения плотности липопротеинов и ядерного магнитного резонанса, предназначенного для фракционирования липопротеинов по размеру и содержанию их частиц в сыворотке крови. Анализ перечисленных параметров проводился у пациентов с нарушенной толерантностью к глюкозе в динамике лечения метформином или соблюдения норм ИМОЖ. Вышеперечисленные методики имеют свои преимущества и недостатки. Ультрацентрифугирование в градиенте плотности является более дорогостоящим и трудоемким методом по сравнению с ЯМР, поэтому оно реже используется в клинической практике. При помощи ЯМР можно провести детальный анализ субфракций ЛПВП в зависимости от их размера и концентрации частиц, что невозможно при использовании процедуры ультрацентрифугирования в градиенте плотности.
Одновременное применение этих двух уникальных методик позволило авторам исследования подтвердить данные предыдущих работ и получить новую информацию об изменении размеров и плотности субфракций ЛПОНП и ЛПНП на фоне терапии метформином и ИМОЖ.
Применив указанные методики фракционирования липопротеинов, ученые доказали, что изменение уровня ТГ и ХС ЛПВП (но не ХС ЛПНП) сопровождается благоприятными и достаточно распространенными изменениями концентраций, размеров и плотности частиц ЛПОНП, ЛПНП, ЛПВП. ИМОЖ оказывала значимое влияние на липопротеины всех классов. Во-первых, соблюдение норм ИМОЖ было ассоциировано с уменьшением концентрации крупных и средних частиц ЛПОНП, способствовало снижению размеров ЛПОНП и, следовательно, сокращению плавучих и плотных частиц ЛПОНП. Во-вторых, ИМОЖ содействовала уменьшению содержания мелких частиц ЛПНП и ультрацентрифугированной плотности ЛПНП, а также умеренному увеличению концентрации крупных частиц ЛПНП по данным ЯМР, обусловив тем самым увеличение размеров ЛПНП и уменьшение общего количества ЛПНП. В-третьих, зафиксированный рост (24%) концентрации крупных частиц ЛПВП индуцировал увеличение размеров ЛПВП. Вероятно, выявленные изменения способствуют уменьшению атерогенности липидного профиля. Несмотря на то что патогенетические механизмы возникновения этих эффектов еще окончательно не изучены, R. Goldberg и соавт. полагают, что гиперпродукция крупных плавучих частиц ЛПОНП является первым шагом в развитии синдрома инсулинорезистентности, трансформации ЛПНП и ЛПВП в небольшие плотные проатерогенные частицы.
Снижение массы тела полностью меняет выявленные патологические нарушения. Уменьшение плотности небольших ЛПНП, вероятно, является следствием падения активности обмена ТГ и эфиров ХС, способствует образованию крупных плавучих ЛПНП, являющихся менее атерогенными. Эти изменения сопровождаются снижением общей концентрации ЛПНП, что содействует более быстрому клиренсу крупных частиц ЛПНП.
Данный факт имеет большое клиническое значение, т. к. исследователи зафиксировали сильную корреляционную взаимосвязь между уровнем ЛПНП и распространенностью кардиоваскулярных заболеваний, общая концентрация которых, в отличие от ХС ЛПНП, не претерпевала значимых изменений в обследованной группе. Увеличение соотношения между крупными и мелкими частицами ЛПВП, вероятно, обусловлено уменьшением их ремоделирования, а также ассоциировано со снижением сердечно-сосудистого риска. В целом ученые считают ИМОЖ-индуцированное уменьшение ЛПОНП, снижение концентрации мелких плотных ЛПНП и рост соотношения крупные/мелкие частицы ЛПВП благоприятным признаком.
Метформин не оказывает значимого влияния на уровень ЛПОНП, но ассоциирован с изменениями субфракций ЛПНП, подобными тем, которые наблюдаются при ИМОЖ, хотя и в более малых размерах. До настоящего времени не было сообщений, описывающих увеличение концентраций крупных и мелких частиц ЛПВП на фоне терапии метформином. В отличие от ИМОЖ эти отклонения ЛПНП и ЛПВП не сопровождаются изменением концентрации ТГ или ЛПОНП, предполагая другой, независимый механизм трансформации ТГ/ЛПОНП.
Клиническая значимость повышения концентрации мелких частиц ЛПВП остается пока не ясной. Гемфиброзил является известным фармакологическим препаратом, применение которого сопровождается увеличением концентрации мелких частиц ЛПВП; по данным одного интервенционного исследования, гемфиброзилиндуцированный рост содержания мелких частиц ЛПВП ассоциирован с уменьшением количества кардиоваскулярных событий. Хотя авторы исследования не смогли объяснить зарегистрированные метформининдуцированные изменения ЛПВП, R. Goldberg и соавт. считают, что метформин и ИМОЖ модифицируют уровень ЛПВП посредством различных патогенетических механизмов.
Каковы возможные детерминанты этих изменений липопротеинов? Снижение концентрации насыщенных жирных кислот и увеличение физической активности, являющиеся ключевыми элементами ИМОЖ, могут видоизменить субфракционный состав липопротеинов.
Однако эти факторы оказали незначительное влияние на зафиксированные изменения. Наиболее значимыми оказались изменения ИМТ и окружности талии. Несмотря на то что каждый из этих параметров имел сопоставимую сильную корреляционную взаимосвязь (r=0,90) с субфракциями липопротеинов, исследователи сочли влияние ИМТ более значимым, т. к. наиболее сильная корреляционная связь зафиксирована между этим показателем и изменением липопротеинов, в отличие от объема талии. Ученые также зарегистрировали положительную корреляционную взаимосвязь между ИМТ и крупными частицами ЛПОНП, размером ЛПОНП, мелкими частицами ЛПВП, а также отметили обратную корреляционную зависимость между ИМТ и крупными частицами ЛПВП. Поскольку изменения липопротеинов в группе ИМОЖ были ассоциированы со значениями ИМТ, исследователи предположили, что снижение массы тела, достигнутое за счет изменения образа жизни, приводит к возникновению большинства из вышеописанных эффектов. Механизмы, связывающие изменение ИМТ и модификацию липопротеинов, достаточно сложны, т. к. коррекция массы тела приводит к различным альтерациям, влияющим на метаболизм липопротеинов, среди которых наиболее важным является увеличение чувствительности к инсулину. В связи с выявленным фактом исследователи заинтересовались ролью адипонектина (адипокина, модулирующего чувствительность липопротеинов к инсулину) в развитии дислипидемии. Проанализировав полученные результаты, ученые выявили прямую корреляционную зависимость между уровнем адипонектина и концентрацией ХС ЛПВП и обратную взаимосвязь между этим адипокином и ТГ.
Таким образом, авторы этого широкомасштабного продолжительного исследования впервые доказали, что ИМОЖ и терапия метформином не только замедляют развитие СД, но и способствуют появлению благоприятных изменений субфракций липопротеинов, нивелируя явления дислипидемии. Достоверные изменения были зарегистрированы по истечении 12-месячной терапии, но R. Goldberg и соавт. утверждают, что положительная динамика начинает отмечаться вскоре после начала терапии. Ученые объясняют нормализацию липидного спектра при ИМОЖ снижением массы тела и ассоциированными с ним метаболическими изменениями, уменьшением инсулинорезистентности и увеличением концентрации адипонектина. В отличие от ИМОЖ действие метформина обусловлено не только уменьшением массы, но и связано с другими специфическими, пока не известными механизмами.
В настоящее время метформин одобрен только для лечения СД 2 типа, однако результаты многочисленных исследований указывают на огромный терапевтический потенциал этого препарата. Продолжая изучать эффекты метформина, ученые предоставляют клиницистам возможность осознанно и безопасно использовать данное лекарственное средство в клинической практике, в том числе для нивелирования явлений дислипидемии у больных СД 2 типа.
Список литературы находится в редакции.
Подготовила Лада Матвеева
Медична газета «Здоров’я України 21 сторіччя» № 20 (393), жовтень 2016 р.