31 серпня, 2015
Ураження опорно-рухового апарату у хворих на цукровий діабет
 Ендокринна система досить складно впливає на структуру та функції кістково-м’язових тканин, оскільки як недостатня, так і надмірна продукція різних гормонів призводить до розвитку патологічних змін у кістках, суглобах і м’язах.
Ендокринна система досить складно впливає на структуру та функції кістково-м’язових тканин, оскільки як недостатня, так і надмірна продукція різних гормонів призводить до розвитку патологічних змін у кістках, суглобах і м’язах.
Часто у клінічній картині ендокринного захворювання симптоми ураження опорно-рухового апарату виступають на передній план. У цій ситуації важливо вчасно розпізнати вторинний характер остеопатії або артропатії, адже адекватна корекція ендокринної патології, як правило, призводить до зворотного розвитку цих змін. Найчастіше ураження кістково-суглобової системи спостерігають у хворих на ЦД, гіпо- і гіпертиреоз, гіперпаратиреоз, акромегалію, синдром Кушинга.
Порушення обміну речовин при ЦД призводить до зміни функціональної активності всіх органів і систем. Унаслідок цього суб’єктивна (скарги хворих) й об’єктивна симптоматика ЦД часто зумовлена залученням до патологічного процесу внутрішніх органів і систем.
Останнім часом до групи хронічних ускладнень ЦД все частіше відносять патологічні зміни кісткової тканини. Переконливі дані свідчать про те, що при ЦД існує тенденція до зниження кісткової маси і зміни мікроархітектоніки кісткової тканини. Процес, який супроводжується зниженням кісткової щільності, призводить до підвищення ризику розвитку переломів. При цьому неадекватну «пікову» кісткову масу можна розглядати як важливу детермінанту остеопорозу. Наявні дані вказують на те, що у хворих на ЦД 1 типу з дитячого віку «пікова» кісткова маса значно менша, ніж у здорових осіб, отже, вони мають низьку «стартову точку», від якої починається зумовлена віковими змінами втрата кісткової речовини.
Ураховуючи те, що єдиним енергетичним субстратом для хондроцитів за виключно анаеробного характеру їх метаболізму є глюкоза, порушення синтетичних процесів у хрящовій, кістковій і сполучній тканинах при ЦД здається цілком вірогідним.
Гіперглікемія через активацію поліолового шляху метаболізму глюкози і неферментативного глікозилювання білків може визначати ураження м’язів і периартикулярних тканин. Гіперглікемія є основним чинником, який бере участь у розвитку пізніх ускладнень ЦД, тому зрозуміло, яке значення має правильне і якісне лікування ЦД, а саме забезпечення стійкої компенсації порушеного вуглеводного обміну, тобто досягнення нормоглікемії й аглюкозурії впродовж тривалого часу. Якщо під час лікування не вдається досягти цільових значень глікемії й відсутності аглюкозурії, то це призводить до хронічних ускладнень ЦД: діабетичної нейропатії, ретинопатії, нефропатії, остеоартропатії, остеопенії й остеопорозу.
ЦД і хронічні захворювання суглобів часто є проявом поліморбідності в похилому віці, яка стає однією з найбільш актуальних для сучасної медицини.
Діабетична артропатія знижує працездатність хворих, значно погіршує можливості виконання високодиференційованої роботи, часто стає причиною інвалідизації, особливо у пацієнтів працездатного віку. Зміни в кістково-суглобовій системі відносять до досить частих ускладнень ЦД, особливо 1 типу, при якому артропатію виявляють у 58% таких хворих. A. Rosenbloom виявив ураження суглобів у 24% пацієнтів із ЦД 2 типу.
За клінічними проявами діабетичні артропатії нагадують ревматологічні синдроми. Проте характерною особливістю ураження суглобів при ЦД є те, що до патологічного процесу насамперед залучається периартикулярна сполучна тканина і лише в окремих випадках розвиваються вторинні кісткові зміни. У літературі відсутні конкретні рекомендації з лікування діабетичної артропатії, не розроблено ефективних профілактичних заходів.
Причиною розвитку так званих пізніх ускладнень ЦД, до яких належать ускладнення з боку кістково-суглобової системи, є гіперглікемія. Феномен глюкозотоксичності реалізується шляхом як прямої (неферментативне глікозилювання білків, активація поліолового шляху обміну глюкози, «окислювальний стрес»), так і опосередкованої (порушення експресії генів) пошкоджувальної дії на різні структури клітин, тканин і органів. Глікозилювання білків є одним з головних механізмів формування судинних і суглобових змін при ЦД. Взаємодія продуктів кінцевого глікозилювання з рецепторами гладких м’язів судинної стінки призводить до проліферації останніх. У результаті цих самих механізмів за участі фібробластів відбувається накопичення мезангіальних клітин і збільшення матриксу. Деякі автори вважають, що зміни в судинах шкіри і навколосуглобових тканинах сприяють ішемії й фіброзу сполучної тканини. На думку інших, ураження колагенових структур виникають самостійно, разом з мікроангіопатією і ці ускладнення є взаємно обтяжливими. У разі гіперглікемії метаболізм глюкози зрушується у бік утворення сорбітолу, який накопичується в ендотеліальних клітинах, нейронах, і як наслідок – відбувається розвиток діабетичної нейропатії. Виявлено суглобові контрактури у половини з обстежених пацієнтів із ЦД 1 типу і продемонстровано зв’язок цих змін із запізнюванням провідності серединного нерва й атрофією власне м’язів кисті.
На думку багатьох дослідників, на зміни сполучної тканини при ЦД значною мірою впливає окислювальний стрес з утворенням цілого спектра вільних радикалів. Е. Yamato et al. досліджували зв’язок ЦД 1 типу і ревматоїдного артриту. Наявність органоспецифічних антитіл і антигенів головного комплексу гістосумісності HLA DR3 і HLA DR4 дала можливість припустити існування загальної iмунопатогенетичної основи цих захворювань. Окремі автори відзначають, що в разі дефіциту інсуліну порушується протеїнглікановий склад кістки і хряща.
Клініка ускладнень з боку кістково-суглобової системи при ЦД різноманітна і нагадує ревматичні ураження. При цьому можна виділити такі порушення з боку кістково-м’язової системи:
• Ускладнення, характерні для ЦД:
– синдром діабетичної кисті з обмеженням рухливості суглобів (діабетична артропатія кисті);
– невропатична артропатія (суглоб Шарко);
– діабетичний остеоліз;
– діабетична аміотрофія.
• Захворювання, ризик розвитку яких на тлі перебігу ЦД зростає:
– періартрит плеча («заморожене плече»);
– рефлекторна симпатична дистрофія (синдром «плече-кисть»);
– тендосиновіт згиначів;
– контрактура Дюпюїтрена;
– зап’ястний тунельний синдром;
– дифузний ідіопатичний гіперостоз скелета;
– септичний артрит/остеомієліт;
– остеопороз.
Діабетична остеоартропатія (ДОАП) у хворих на ЦД може виникнути вже через 5-8 років після початку захворювання, якщо до цього не проводили систематичного лікування ЦД, і частіше зустрічається за лабільного перебігу ЦД. Є вказівки на кореляцію частоти ДОАП і наявність мікро- і макроангіопатій, нейропатій.
У розвитку ДОАП першочергове значення відводять інсуліновій недостатності. Важливу роль відіграють порушення вуглеводного, білкового, мінерального обміну, гормональні розлади, ангіо- і нейропатія. Остання викликає посилення кісткового кровотоку, що є основною ланкою патогенезу ДОАП. Це поступово призводить до резорбції кісткової тканини внаслідок дисбалансу остеобластної й остеокластної активності.
Використання ультразвукової остеометрії дало змогу виявити початкові ознаки ДОАП у 66% хворих на ЦД. Частіше при цьому уражаються суглоби нижніх кінцівок, зазвичай гомілковоступневі (10% хворих), передплесно-плеснові (60%), плесно-фалангові (30%); рідше – колінні, тазостегнові. Процес, як правило, односторонній, у 20% випадків може бути двостороннім.
У розвитку ДОАП розрізняють такі чотири стадії:
– наявність набряку стопи, гіпертермії та гіперемії;
– виникнення деформації стопи; рентгенологічно визначаються кісткові зміни у вигляді остеопорозу, кісткової деструкції та фрагментації;
– виражена деформація стопи, наявність спонтанних переломів і вивихів;
– утворення виразкових дефектів; у разі інфікування можливий швидкий розвиток гангрени.
Клінічна картина складається з больового синдрому в ділянці уражених суглобів, їх деформації, іноді з набряком. Часто больовий синдром виражений слабко або відсутній, незважаючи на значні рентгенологічні зміни. Це пов’язано із супутньою нейропатією і розладами чутливості. Виявляються різні рентгенологічні зміни: від помірного епіфізарного остеопорозу, субхондрального склерозу із крайовими остеофітами до патологічної перебудови кісткової тканини, що нагадує перелом, розвиток остеолізу, секвестрації. Гістологічно виявляються ділянки резорбції кістки, розростання сполучної тканини, асептичні некрози. Частіше ці зміни локалізуються у плеснових кістках. Через порушення глибокої чутливості легко виникають розтягування зв’язок, нестійкість зведення стопи, що одночасно з лізисом фаланг призводить до деформації стопи та її вкорочення.
Синдром діабетичної кисті (діабетична хейрартропатія) характеризується поступовим розвитком згинальних контрактур з ураженням малих суглобів кистей. Патологічний процес починається з дистальних і проксимальних міжфалангових суглобів, поступово поширюючись у проксимальному напрямку. Такий стан спостерігається як при 1, так і при 2 типі ЦД; ризик його розвитку залежить від тривалості захворювання, концентрації глюкози в сироватці крові та ступеня ураження малих судин нирок і сітківки. Діабетична хейрартропатія виникає у 30-50% хворих із тривалим перебігом ЦД.
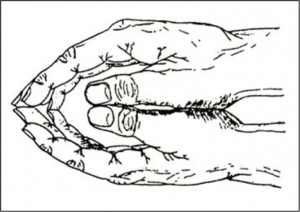
Під час огляду лікар виявляє симптом «людини, яка молиться» і неможливість пацієнта повністю випрямити пальці рук (рис. 1). Контрактури пальців зумовлені надмірним утворенням молекул колагену і зв’язків між ними, а також підвищеною гідратацією дерми, що, у свою чергу, призводить до індурації й потовщення шкіри навколо суглобів. Ці порушення можна прийняти за прояви системної склеродермії. Однак на відміну від системної склеродермії, при якій потовщення шкіри зумовлено гіперпродукцією колагену, діабетичний склероз пальців виникає через судинно-трофічні зміни дистальних відділів кінцівок у разі діабетичної ангіопатії, зменшення видалення колагену та можливої гіпергідратації тканин. При цій формі індурація шкіри та вісцеральні прояви відсутні. У хворих молодого, зрілого і середнього віку важливим є розпізнавання неболючих контрактур проксимальних або дистальних міжфалангових суглобів, оскільки паралельно з ними розвиваються мікросудинні ускладнення ЦД (ретинопатія, нефропатія).
Результати серологічних досліджень і рентгенографії кистей без особливостей. Проводять фізіотерапевтичне лікування і корекцію ЦД. Як правило, процес поволі прогресує, проте виражене обмеження рухливості суглобів спостерігають рідко.
Діабетична склередема – один з варіантів склередеми Бушке, яка відрізняється від класичної більшою поширеністю кам’янисто-щільного набряку шиї, плечей, тулуба, обличчя; відсутністю атрофії, загострення обличчя та «кисетного рота» (оскільки уражаються переважно глибокі шари дерми), синдрому Рейно, склеродактилії, телеангіектазій і порушень пігментації. Дисфагія і серцеві прояви переважно віддзеркалюють діабетичну нейро- й ангіопатію. Зустрічається нечасто, але відрізняється торпідним перебігом і резистентністю до лікування.
Синдром обмеженої рухливості суглобів (ОРС) визначають як зменшення можливості рухів у малих і, рідше, великих суглобах. Уперше синдром тугорухливості кисті описано у чотирьох хворих із тривалим перебігом інсулінзалежного ЦД. 1971 р. G. Lung et al. уперше застосували термін «діабетична рука» (main diabetique), при цьому у виникненні ревматичних розладів верхньої кінцівки вони підкреслювали значення супутньої діабетичної нейропатії. Ознаки синдрому ОРС згодом підсумували і назвали діабетичною хондропатією. Клінічно синдром тугорухливості проявляється безболісним обмеженням рухливості суглобів, частіше – проксимальних міжфалангових, п’ясно-фалангових. Можливе ураження променезап’ясткових, ліктьових, плечових, гомілковостопних суглобів. Серед багатьох класифікацій ОРС найбільш простою і зрозумілою є класифікація, запропонована Н. Starkman 1982 р.:
0 – відсутні зміни шкіри, об’єм рухів у суглобах збережений;
1 – ущільнена, потовщена шкіра кистей;
2 – двостороння згинальна контрактура V пальців кистей;
3 – двостороння контрактура V і будь-яких інших пальців кистей;
4 – контрактура інших суглобів.
Безболісне обмеження розгинання п’ясно-фалангових і проксимальних міжфалангових суглобів часто поєднується зі змінами шкіри кистей. Шкіра стає блискучою, воскоподібною. Іноді переважають зміни з боку шкіри. У цих випадках говорять про псевдосклеродермічні ураження при ЦД. Патогенез синдрому тугорухливості дискутується до цього часу. Висловлюється припущення про вплив судинної ішемії на структуру і синтез колагену. Безперечною є участь нейропатій у патогенезі цього синдрому. Враховуючи поширену імунокомплексну концепцію патогенезу діабетичних мікроангіопатій, не можна виключити вплив імунних розладів на розвиток артропатій при ЦД.
Поява синдрому ОРС у хворих на ЦД залежить від тривалості та ступеня компенсації захворювання (маніфестує зазвичай через 4-6 років за рівня глікозильованого гемоглобіну 8,1-12,2% і корелює з такими ускладненнями ЦД, як ретинопатія і нефропатія). За деякими даними, ризик розвитку проліферуючої ретинопатії у 2,8 раза, а нефропатії у 3,6 раза вищий у хворих на ЦД із синдромом ОРС, ніж без нього.
Артропатію Шарко спостерігають менш ніж в 1% хворих на ЦД, він розвивається з однаковою частотою у чоловіків і жінок. Більшість хворих (понад 66%) мають вік понад 40 років і тривалий перебіг (понад 10 років) декомпенсованого ЦД, ускладненого діабетичною периферичною нейропатією. З’являється безболісна набряклість і деформація, як правило, суглобів стопи (найчастіше передплесно-плеснових) і гомілковоступневого суглоба, до процесу також можуть залучатися колінний, кульшовий суглоби і суглоби хребта.
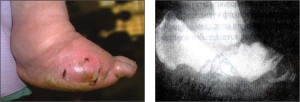
На початковій стадії можливим є виражений больовий синдром, який примушує проводити диференціальну діагностику з гострим подагричним артритом або гострим тромбофлебітом вен нижніх кінцівок. Для діагностики синдрому проводять рентгенологічне дослідження стоп, хоча на початковій стадії зміни на рентгенограмах можуть бути відсутніми. У цих ситуаціях використовують метод ультразвукового сканування кістки або магнітно-резонансної томографії. У міру розвитку процесу на рентгенограмах виявляють осередковий остеопороз, множинні або одиничні переломи кісток стопи, чергування ділянок остеолізу і гіперостозу, фрагментацію кісток з репаративними процесами, типову дезорганізацію суглобів стопи. Стопа набуває вигляду мішка, наповненого кістками (за описом англійських авторів). Кісткові зміни прогресують протягом декількох місяців після появи перших симптомів. Клінічно визначається сплощення стопи, спостерігаються патологічні рухи в суглобах. Біль на пізніх стадіях відсутній у зв’язку з вираженою нейропатією. Із прогресуванням ураження у хворого деформується стопа за типом крісла-гойдалки внаслідок деструкції середньої частини передплесна (рис. 2). Виявляється виразка шкіри над кістковими виступами із приєднанням інфекції, причому це відбувається непомітно для хворого, оскільки через наявність нейропатії чутливість порушується.
На рентгенограмах часто визначаються виражені зміни, які можна описати за допомогою п’яти слів, які починаються на D:
Destruction – деструкція (руйнування) кісткової тканини;
Density – підвищена щільність (склероз);
Debris – секвестрація;
Disorganization – патологічна перебудова структури кістки;
Dislocation – зміщення.
Підвищення щільності (склероз) кісткової тканини і гострі краї кісткових секвестрів допомагають відрізнити артропатію Шарко від інфекційного ураження.
Лікування полягає у зменшенні вагового навантаження на пошкоджений суглоб, застосуванні м’яких пов’язок, носінні зручного взуття, а також активній санації та профілактиці розвитку трофічних виразок. Проте артропатія Шарко, як правило, прогресує. Хірургічні методи лікування (артродез, артропластика) неефективні, і лише в украй важких випадках удаються до ампутації стопи. Сьогодні найчастіше причиною розвитку артропатії Шарко є ЦД, який витіснив нейросифіліс на другу позицію.
Специфічним ускладненням ЦД є діабетичний остеоліз – процес, який характеризується розвитком остеопорозу і різного ступеня резорбції дистальних відділів плеснових кісток і проксимальних фаланг. Тяжкість больового синдрому різна. На рентгенограмах визначаються кісткові деструкції із секвестрами, субхондральний склероз, остеофіти, внутрішньосуглобові переломи; характерним є симптом «облизаного льодяника». Патогенез цього патологічного процесу не вивчений, він може розвиватися на будь-якій стадії перебігу ЦД. Під час обстеження насамперед необхідно виключити інфекційне ураження.
Лікування консервативне: обмеження вагових навантажень на пошкоджений суглоб. Перебіг процесу може зупинитися на будь-якому етапі, трапляються випадки повного одужання.
Діабетична аміотрофія характеризується розвитком вираженого больового синдрому і парестезій у м’язах тазового поясу. У 50% випадків ураження двобічне. Може розвиватися втрата апетиту, схуднення і хитка хода через атрофію і слабкість м’язів. Діабетична аміотрофія характерна для пацієнтів віком 50-60 років з компенсованим перебігом інсуліннезалежного ЦД середнього ступеня тяжкості. Вона з’являється через декілька років від початку захворювання, хоча цей синдром може бути першою ознакою ЦД. Зазвичай у пацієнтів при цьому немає діабетичної ретинопатії або нефропатії, проте можуть бути прояви дистальної симетричної сенсорної нейропатії. Результати лабораторних досліджень, як правило, без особливостей, окрім підвищення концентрації білка в цереброспинальній рідині. Результати електроміографії й дослідження швидкості проведення імпульсу по нервових волокнах свідчать про зміни, характерні для нейропатії, а біопсія м’язів виявляє атрофію м’язових волокон за відсутності запального інфільтрату. Етіологія цього синдрому не вивчена, можливо, аміотрофія – наслідок гострого мононевриту стегнового нерва.
Лікування включає усунення больового синдрому і застосування різних фізіотерапевтичних методів. Більше 50% хворих видужують через 3-18 міс, у деяких випадках спостерігають прогрес процесу або рецидиви.
Діабетичний периартрит плеча («заморожене» плече, адгезивний капсуліт) розвивається у 10-33% хворих на ЦД і зустрічається у них у 5 разів частіше порівняно зі здоровими людьми. Найбільш поширений периартрит серед жінок із тривалим перебігом інсуліннезалежного ЦД. З’являється дифузна болісність і різке обмеження рухливості у плечовому суглобі. Більш ніж у 50% хворих ураження двобічне, при цьому дисфункція плеча недомінуючої руки виражена сильніше. Результати лабораторних досліджень і рентгенографії без особливостей.
Лікування полягає в застосуванні нестероїдних протизапальних препаратів (НПЗП), рідко – у внутрішньосуглобовому введенні стероїдів, також використовують фізіотерапію і лікувальну гімнастику з метою збільшення об’єму рухів у суглобі. Через незрозумілі причини цей синдром іноді спонтанно проходить через декілька тижнів або місяців.
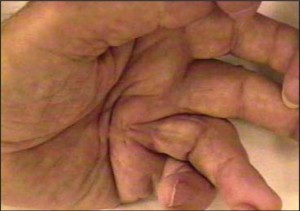
Тендосиновіт згиначів (контрактура Дюпюїтрена) спостерігають у 5-33% хворих на ЦД (у жінок із тривалим перебігом частіше, ніж у чоловіків). Пацієнти скаржаться на біль і скутість у долонній поверхні кисті. Симптоми більш виражені уранці. Може розвиватися синдром пальця, що «замикається», через утворення запального вузлика в ділянці проксимальної кільцеподібної зв’язки в основі пальця. Найчастіше уражається великий палець домінуючої руки (75%), проте процес може охопити декілька пальців на обох кистях. Досить часто (у 33-60% випадків) контрактура Дюпюїтрена формується внаслідок інсулінзалежного ЦД. Розвивається вузликове потовщення долонного апоневрозу з утворенням згинальних контрактур, як правило, IV і V пальців (рис. 3).
Зазвичай контрактура Дюпюїтрена виникає у людей із тривалим перебігом ЦД, хоча не виявлено зв’язку із ступенем компенсації ЦД. Передбачається, що в патогенезі цього синдрому відіграє роль надмірна продукція колагену здатними до скорочення міофібробластами, що пов’язано з ішемією, зумовленою ураженням судин мікроциркуляторного русла. Результати лабораторних досліджень і рентгенографії без особливостей.
Лікування полягає в застосуванні НПЗП, фізіотерапевтичних методів, вітаміну Е, місцевих ін’єкцій стероїдних гормонів. У разі необхідності виконують хірургічне втручання.
Зап’ястний тунельний синдром розвивається у 15% людей, хворих на ЦД. При цій патології втрачається чутливість у ділянці іннервації серединним нервом. Крім того, можуть з’являтися нічні парестезії, біль у кистях або біль, що іррадіює в передпліччя або плече (феномен Валлекса). Можуть спостерігатися позитивні симптоми Тінеля (Tinel) і Фалена (Phalen). Атрофія тенара – пізній симптом захворювання, який свідчить про денервацію м’язів. Причиною нейропатії може бути як здавлення нерва, так і ураження vasa nervorum, що призводить до ішемії нервового волокна.
Лікування включає забезпечення спокою пошкодженої кисті за допомогою шин і лонгет, застосування НПЗП, діуретиків, ін’єкцій стероїдів у зап’ястний канал; проводиться хірургічна декомпресія нерва.
Дифузний ідіопатичний гіперостоз скелета, відомий також під назвою хвороби Форестьє (Forestier), спостерігають більш ніж у 20% хворих на ЦД 2 типу. Як правило, це люди віком понад 50 років з надмірною масою тіла. З’являються скутість у ділянці шиї та спини, обмеження рухливості хребта. Больовий синдром не виражений. Діагностично цінними є дані рентгенографічного дослідження. На рентгенограмах визначається осифікація передньої поздовжньої зв’язки впродовж чотирьох і більше хребців, що призводить до різкого зменшення рухливості хребта у цій зоні. Периферичні симптоми і внутрішні органи інтактні, ознак запального процесу немає. Міжхребцеві простори, суглобові відростки і крижово-клубові з’єднання не змінені, що дає змогу провести диференціальну діагностику з остеоартрозом й анкілозивним спондилітом.
Призначають терапію НПЗП, застосовують фізіотерапевтичні методи лікування і лікувальну гімнастику.
Синдром діабетичної стопи (СДС) – симптомокомплекс патологічних змін шкіри, м’яких тканин, кісток, суглобів стопи у хворих на ЦД, зумовлених ураженнями артеріального та мікроциркуляторного русла, нейропатією, які призводять до формування гострих і хронічних виразок, кістково-суглобових уражень і гнійно-некротичних процесів.
Основним механізмом розвитку діабетичної стопи є сенсорна, моторна і вегетативна нейропатія, ці порушення сприяють розвитку ульцерації стопи. Виразковий дефект найчастіше утворюється під впливом зовнішніх факторів – надмірного тиску на певні ділянки стопи. СДС спостерігають у 10-25%, а за деякими даними, у тій або іншій формі у 30-80% хворих на ЦД. Це основна причина ампутації нижніх кінцівок, яку спостерігають у 17-45 разів частіше, ніж у людей без ЦД. Згідно з даними Інституту ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України, діабетичну гангрену серед дорослого населення України 2007 р. було виявлено у 7364 осіб, а кількість ампутацій, пов’язаних із ЦД, того самого року становила 3389 з післяопераційною летальністю 6,5%.
Найчастіше СДС розвивається на тлі тривалого (більше 15 років) ЦД переважно у людей похилого віку. Кількість ампутацій у хворих на ЦД досягає 70% від загальної кількості нетравматичних ампутацій нижніх кінцівок, а смертність протягом першого року після ампутації на 30% вища, ніж в осіб без ЦД. Існує пряма залежність частоти СДС від тривалості й тяжкості основного захворювання.
Виділяють три основні форми СДС:
– нейропатична форма «стопи діабетика», до якої відносять варіант без остеоартропатії та з ДОАП (суглоб Шарко, що представляє деструктивний процес в одному або декількох суглобах стопи і гомілки);
– нейроішемічна форма СДС;
– ішемічна форма СДС.
Нейропатична остеоартропатія є результатом значних дистрофічних змін у кістково-суглобовому апараті стопи (остеопороз, остеоліз, гіперостоз). Нейропатія маскує спонтанні переломи кісток, які в деяких випадках виявляються безболісними. Деструктивні зміни кістково-зв’язкового апарату стопи можуть прогресувати впродовж багатьох місяців і призвести до вираженої кісткової деформації – формування суглоба Шарко.
Діагноз діабетичної стопи встановлюють за наявності факторів ризику в анамнезі, скарг пацієнта, виразки, хронічних ускладнень ЦД. Серед лабораторних досліджень обов’язковими є загальний і біохімічний аналіз крові, коагулограма, бактеріологічний посів із рани. До основних інструментальних досліджень належать допплерометрія і рентгенографія. За допомогою допплерометрії встановлюють наявність і ступінь гемодинамічних порушень (показник плечо-щиколоткового індексу менше одного свідчить про оклюзію або стеноз артерії), рентгенографії – деструкцію кісток стопи. Додаткові методи дослідження включають ангіографію, допплерографію (оцінка ступеня та локалізації чи оклюзії артерій нижніх кінцівок), черезшкірну оксиметрію (оцінка життєдіяльності тканин).
Важливу інформацію для оцінки стану іннервації надають неврологічні тести. Досліджують вібраційну, больову, тактильну і температурну чутливість.
Успішне лікування діабетичної стопи можливе за дотримання таких умов:
– відновлення адекватного артеріального кровообігу;
– успішне лікування інфекцій;
– розвантаження ураженої кінцівки.
Основою лікування та профілактики розвитку діабетичної стопи є компенсація ЦД, корекція артеріальної гіпертензії та дисліпідемії, а також регулярне користування ортопедичним взуттям, догляд за стопами, видалення кератозів, навчання хворих.
Остеопороз у хворих на ЦД. Метаболічні зміни, які виникають при ЦД, призводять до порушення процесів ремоделювання кісткової тканини. В умовах інсулінової недостатності порушується остеобластна функція: знижується вироблення колагену і лужної фосфатази остеобластами. Рекомендується стимулюючий вплив інсуліну на синтез кісткового матриксу й остеобластний остеопоез. Відомо, що остеобласти мають рецептори інсуліну і прямо залежать від його регуляторного впливу. При ЦД часто виявляється зменшення кількості остеобластів і їх активності.
Наявність остеопенії при ЦД 1 типу відмічено в багатьох дослідженнях. Більшість авторів вважають, що остеопенія й остеопороз при ЦД носять дифузний характер і зустрічаються не менше ніж у половини пацієнтів. Термін «остеопенія» використовують для визначення зниження щільності рентгенологічної тіні (при стандартній рентгенографії кісток) або зниження маси кістки за допомогою методів кількісної кісткової денситометрії; остеопороз – системне захворювання скелета, яке характеризується зниженням маси кістки в одиниці об’єму і порушенням мікроархітектоніки кісткової тканини, що призводить до збільшення крихкості кісток і високого ризику їх переломів.
Патофізіологічні аспекти розвитку остеопорозу у хворих на ЦД до кінця не вивчені. Однак у дещо спрощеному вигляді порушення метаболізму кісткової тканини можна представити п’ятьма основними формами:
– недостатність утворення кісткової тканини;
– підвищене її руйнування;
– поєднання зменшеного утворення зі збільшеним руйнуванням;
– одночасне, але неоднаково підвищене утворення і руйнування кісткової тканини;
– поєднання особливо зменшеного утворення зі зменшеною резорбцією.
Основні ланки патогенезу остеопорозу при ЦД такі:
• абсолютний дефіцит інсуліну → зниження продукції остеобластами колагену і лужної фосфатази, необхідних для утворення кісткового матриксу і його мінералізації; зменшення стимуляції остеокластів, опосередкованої інсуліноподібними факторами росту (секретуються в печінці);
• прямий вплив високої концентрації глюкози внаслідок кінцевих продуктів глікозилювання → посилення резорбції кістки остеокластами;
• знижена секреція інсуліну → дефіцит активних метаболітів вітаміну D → зниження всмоктування кальцію в кишечнику, збільшення секреції й активності паратгормона → негативний баланс неорганічних елементів у організмі й посилення резорбції кісткової тканини.
У третини хворих на ЦД 1 типу виявляють остеопенію, а остеопороз – у 18-20% випадків. Зниження мінеральної щільності кісток було виявлено у 20% дітей за тривалості ЦД понад 5 років. Системне ураження кісткової тканини призводить до підвищеного ризику переломів у цих хворих. Чинниками ризику розвитку остеопенічного синдрому є маніфестація ЦД до 20 років, тривалість захворювання понад 10 років, тривала декомпенсація вуглеводного обміну.
Основними завданнями лікування остеопорозу є сповільнення або припинення втрати маси кістки; попередження виникнення нових переломів кісток; нормалізація процесів кісткового ремоделювання; зменшення або зникнення больового синдрому; покращення стану хворого і розширення його рухової активності; відновлення працездатності й покращення якості життя пацієнта.
Важливими факторами лікування остеопорозу у цієї категорії пацієнтів, окрім ретельної компенсації ЦД, що може попередити розвиток остеопенії й остеопорозу, треба вважати підтримання активного способу життя, виключення куріння, помірне споживання кави, обмежене вживання солі, оптимальний уміст у їжі кальцію і фосфору, достатнє надходження в організм вітаміну D, своєчасну діагностику і корекцію синдрому мальабсорбції. Серед антиостеопоротичних препаратів найбільше значення мають бісфосфонати, кальцитонін, комбінація кальцію з вітаміном D, гормональна терапія (ралоксифен, тамоксифен, тиболон), активні метаболіти вітаміну D (альфакальцидол).
Таким чином, у хворих на ЦД можливим є розвиток різних уражень опорно-рухового апарату. При цьому найбільш важкі порушення розвиваються при інсулінзалежному ЦД.
Лікування хворих на ЦД з патологією опорно-рухового апарату мають проводити спільно ендокринолог і ревматолог. Варто підкреслити, що добра і тривала компенсація ЦД – головна умова успішної терапії таких хворих.
У комплексній терапії залежно від характеру ураження опорно-рухового апарату використовують НПЗП, засоби, які поліпшують реологічні властивості крові, ангіопротектори, дезагреганти, анаболічні препарати, антирезорбенти кісткової тканини, антиоксиданти тощо.
За наявності показань, крім лікарських засобів, застосовують фізіотерапію, лікувальну фізкультуру, курортне лікування, масаж, у разі необхідності – хірургічне втручання.
Список літератури знаходиться в редакції.