19 грудня, 2016
Проблема антибиотикорезистентности в современной медицине: есть ли решение?

По материалам Национального конгресса анестезиологов Украины, 21-24 сентября, г. Днепр
Неуклонный рост антибиотикорезистентности (АБР) – одна из острейших глобальных медицинских и социальных проблем. Следствием АБР является увеличение заболеваемости, сроков стационарного лечения и уровня смертности. Сегодня человечество вплотную подошло к тому рубежу, за которым устойчивость к антибиотикам станет серьезной угрозой для общественного здравоохранения.
 Разработка новых антибиотиков (АБ) – сложный, длительный и крайне дорогостоящий процесс. АБ теряют свою эффективность так быстро, что компаниям становится невыгодно их создавать: затраты на разработку новых препаратов попросту не успевают окупиться. Экономические факторы являются основной причиной снижения интереса к созданию новых АБ. Многие фармацевтические компании в большей степени заинтересованы в разработке лекарств длительного применения, а не препаратов, используемых короткими курсами. В период с 1930-х по 1970-е годы активно появлялись новые классы АБ, в 2000 г. в клиническую практику вошли цикличные липопептиды, оксазолидиноны. С тех пор новых АБ не появлялось. По словам директора ГУ «Национальный институт сердечно-сосудистой хирургии им. Н. М. Амосова НАМН Украины» (г. Киев), члена-корреспондента НАМН Украины, доктора медицинских наук, профессора Василия Васильевича Лазоришинца, объем финансирования, необходимый для всестороннего изучения и поиска решения проблемы АБР, варьирует в пределах стоимости проекта Большого адронного коллайдера и Международной космической станции.
Разработка новых антибиотиков (АБ) – сложный, длительный и крайне дорогостоящий процесс. АБ теряют свою эффективность так быстро, что компаниям становится невыгодно их создавать: затраты на разработку новых препаратов попросту не успевают окупиться. Экономические факторы являются основной причиной снижения интереса к созданию новых АБ. Многие фармацевтические компании в большей степени заинтересованы в разработке лекарств длительного применения, а не препаратов, используемых короткими курсами. В период с 1930-х по 1970-е годы активно появлялись новые классы АБ, в 2000 г. в клиническую практику вошли цикличные липопептиды, оксазолидиноны. С тех пор новых АБ не появлялось. По словам директора ГУ «Национальный институт сердечно-сосудистой хирургии им. Н. М. Амосова НАМН Украины» (г. Киев), члена-корреспондента НАМН Украины, доктора медицинских наук, профессора Василия Васильевича Лазоришинца, объем финансирования, необходимый для всестороннего изучения и поиска решения проблемы АБР, варьирует в пределах стоимости проекта Большого адронного коллайдера и Международной космической станции.
Повсеместное применение АБ в животноводстве также является ключевым фактором развития резистентности, поскольку устойчивые бактерии могут передаваться человеку с продуктами питания животного происхождения. Сельскохозяйственные животные могут служить резервуаром антибиотикорезистентных бактерий Salmonella, Campylobacter, Escherichia coli, Clostridium difficile, метициллин-/оксациллинрезистентного Staphylococcus aureus (MRSA), ванкомицинрезистентного Enterococcus faecium (VRE). MRSA зоонозного происхождения отличается от госпитальных и амбулаторных штаммов MRSA, однако способность бактерий к горизонтальному переносу генов резистентности значительно повышает распространенность устойчивых к различным АБ штаммов. Горизонтальный перенос генов наблюдается и среди других возбудителей.
По оценкам ВОЗ, половина всех производимых в мире АБ используется не для лечения людей. Неудивительно, что количество штаммов возбудителей, резистентных даже к АБ резерва, неуклонно возрастает. Так, распространенность штаммов S. aureus, резистентных к метициллину/оксациллину, к 2012 г. в США составляла 25-75%, штаммов Acinetobacter baumannii, устойчивых к карбапенемам, – до 80% в отдельных штатах. В Европе ситуация немногим лучше: распространенность возбудителей, резистентных к карбапенемам (продуцентов карбапенемаз), в 2013 г. достигала 25%, а в Италии и Греции превышала 52%.
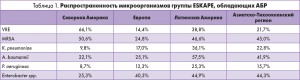
«Проблемные» микроорганизмы, которые имеют уже сформированные механизмы резистентности к АБ широкого спектра действия (табл. 1), объединяют в группу ESKAPE:
• Enterococcus faecium;
• Staphylococcus aureus;
• Klebsiella pneumoniae;
• Acinetobacter baumannii;
• Pseudomonas aeruginosa;
• Enterobacter spp.
В ГУ «Национальный институт сердечно-сосудистой хирургии им. Н.М. Амосова» за период с 1982 по 2016 год проведена большая работа по выявлению микроорганизмов, устойчивых к АБ, у 2992 больных, среди которых имели место 2603 случая инфекционного эндокардита, 132 эпизода сепсиса, 257 – бактериемии. При этом в 1497 (50%) случаях возбудителя удалось идентифицировать.
При бактериологическом исследовании были определены грамположительные возбудители у 1001 (66,9%) пациента, грамотрицательные – у 359 (24,0%). Среди грамположительных возбудителей выявлены S. epidеrmidis (у 71,8% больных), Enterococcus spp. (17,2%), S. aureus (7%) и Streptococcus spp. (4%). Среди грамположительных инфекционных агентов были обнаружены P. aeruginosa (20,6% случаев), A. baumannii (22,3%), Enterobacter spp. (18,7%), E. coli (11,7%), Klebsiella spp. (10,3%), Moraxella (6,1%).
Грибковая микрофлора, выявленная у 137 (9,1%) пациентов, представлена видами Candida, Aspergillus, Histoplasma. Развитию инвазивных микозов предшествовали такие факторы риска, как длительная комбинированная антибиотикотерапия, лечение кортикостероидами и/или цитостатиками, сахарный диабет, сопутствующие онкологические заболевания. Чаще всего грибы обнаруживали в ассоциации с патогенными бактериями.
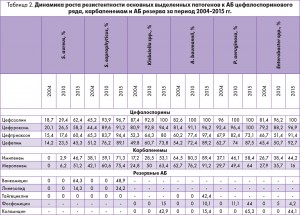
За период с 2004 по 2015 год частота выявляемости Enterococcus spp. в разное время варьировала в пределах от 5,5 до 22,4%. В 2015 г. доля резистентных к ванкомицину и линезолиду штаммов Enterococcus spp. составила 48,0 и 34,2% соответственно, частота выявляемости S. aureus – 1,5-10%. Резистентность этого патогена к ванкомицину и линезолиду в 2015 г. достигла 64,3 и 14% соответственно. Отмечено достоверное увеличение частоты встречаемости Klebsiella spp: с 0% случаев в 2004 г. до 36,7% – в 2015 г. При этом уровни резистентности Klebsiella spp. к АБ также высоки: 42,9% штаммов устойчивы к фосфомицину, 10,0% – к коломицину.
A. baumannii выявляли в 5,9-44,2% случаев, к коломицину оказались резистентными 15,4%, а к фосфомицину – 10,1% штаммов данного патогена. Частота выявляемости P. aeruginosa составила в среднем 11,8-36,6%. В 2015 г. 65,3% штаммов синегнойной палочки оказались невосприимчивыми к действию коломицина, 44,0% – фосфомицина. Enterobacter spp. был обнаружен в 5,9-61,9% случаев, резистентность штаммов этого возбудителя к коломицину и фосфомицину составила 44,1 и 4,2% соответственно.
Что касается грибковой флоры, то ее выявляли у 2,3-20,4% пациентов. В последние годы отмечен рост случаев тяжелых инфекций с органными поражениями, вызванных грибково-микробными ассоциациями. Таким образом, на территории Украины отмечается неуклонный рост числа резистентных к АБ штаммов возбудителей группы ESKAPE (табл. 2).
В настоящее время во всем мире идет поиск альтернативных подходов к терапии инфекционных заболеваний. Так, разрабатываются антитела, которые могли бы связывать и инактивировать возбудителей. Такой препарат для борьбы с C. difficile проходит исследования ІІІ фазы и, вероятно, появится уже в 2017 г.
Применение бактериофагов и их компонентов – еще одно перспективное направление в борьбе с инфекциями. Бактериофаги природных штаммов и искусственно синтезированные генетически модифицированные фаги с новыми свойствами инфицируют и обезвреживают бактериальные клетки. Фаголизины – это ферменты, которые используются бактериофагами для разрушения клеточной стенки бактерий. Ожидается, что препараты на основе бактериофагов и фаголизинов дадут возможность побеждать устойчивые к АБ микроорганизмы, однако появятся эти препараты не ранее 2022-2023 гг. Параллельно с этим идет разработка препаратов на основе антибактериальных пептидов и вакцин для профилактики инфекций, вызванных C. difficile, S. aureus, P. aeruginosa. Вместе с тем вызывает обеспокоенность тот факт, что средства, которые находятся в стадии разработки и тестирования, малоактивны в отношении других ESKAPE-возбудителей – E. faecium, K. pneumoniae, A. baumannii, Enterobacter spp. Вероятность того, что действенная альтернатива АБ для этих патогенов будет разработана в ближайшие 10 лет, очень низка.
В случае выделения резистентной флоры в клинике ГУ «Национальный институт сердечно-сосудистой хирургии им. Н. М. Амосова» для повышения эффективности терапии интраоперационно используется общая управляемая гипертермическая перфузия у больных инфекционным эндокардитом, а также применяются пассивная иммунизация в сочетании с комбинированной антибиотикотерапией, препараты с так называемым антикворумным действием.

По мнению президента Ассоциации анестезиологов Украины, доцента кафедры анестезиологии и интенсивной терапии Национального медицинского университета им. А. А. Богомольца (г. Киев), кандидата медицинских наук Сергея Александровича Дуброва, высокая частота полирезистентных штаммов означает, что лечение вызванных этими возбудителями тяжелых инфекций в большинстве случаев возможно только резервными АБ, в частности карбапенемами. Следует помнить, что по сравнению с имипенемом меропенем более эффективен в отношении грамотрицательных патогенов, но менее результативен в случае грамположительных микроорганизмов. Дорипенем обладает равным терапевтическим действием в отношении грамположительных и грамотрицательных возбудителей инфекций. Известно также, что при комнатной температуре (25 °С) и при 37 °С стабильность раствора дорипенема выше, чем имипенема и меропенема. Высокая стабильность дорипенема позволяет применять его в схемах с непрерывными инфузиями и длительно поддерживать необходимую концентрацию АБ в плазме крови. Одним из альтернативных направлений лечения при наличии поли- и панрезистентной флоры является терапия комбинацией АБ. Следует помнить о явлении синергизма АБ и использовать его в случае тяжелых инфекций. Рациональными считают сочетанное применение карбапенема с аминогликозидом или фторхинолоном.
Бактериологическое исследование с построением антибиотикограммы представляется ключевым при ведении пациента с инфекционным заболеванием. Индивидуальный подбор АБ, к которому чувствителен инфекционный агент, является не только залогом успешной терапии, но и фактором, предупреждающим формирование АБР.
Подготовила Мария Маковецкая
Настоящая информация предоставлена компанией MSD в качестве профессиональной поддержки специалистам здравоохранения. Информация, относящаяся к любому продукту (-ам), может не совпадать с инструкцией по применению препарата. Пожалуйста, ознакомьтесь с полным текстом инструкции для получения точной информации или данных по продуктам, рассматриваемым в настоящей публикации, до назначения.
AINF‑1201819-0000