12 квітня, 2016
Антибактериальный кризис: как сохранить щит от бактерий для будущих поколений?

25-26 ноября 2015 г. по инициативе ГО «Всеукраинская ассоциация инфекционного контроля и антимикробной резистентности» при поддержке Европейского регионального бюро Всемирной организации здравоохранения (ВОЗ), Министерства здравоохранения (МЗ) Украины и Национальной медицинской академии последипломного образования (НМАПО) им. П.Л. Шупика в г. Киеве состоялся всеукраинский научно-практический семинар с международным участием «Стратегия сдерживания появления и распространения антибиотикорезистентности и рационального использования антимикробных препаратов». Благодаря инновационному формату телемоста возможность виртуально посетить мероприятие получили более 1 тыс. врачей из различных городов Украины – Львова, Одессы, Харькова, Днепропетровска, а также зарубежные эксперты из Грузии (г. Тбилиси), Индии (г. Нью-Дели), Республики Беларусь (г. Минск).
Почетными гостями конференции стали директор департамента по антимикробной
резистентности Европейского бюро ВОЗ Данило Ло Фо Вонг (Danilo Lo Fo Wong), эксперты ВОЗ Гийом Деде (Guillaume Dedet) и Бела Кочиш (Bela Kocsis).
В течение двух дней происходили оживленные дискуссии, касавшиеся проблемы повышения устойчивости основных патогенных бактерий к антибактериальным препаратам (АБП) – тенденции, характерной для большинства стран мира и рассматривающейся их системами здравоохранения как угроза национальной безопасности. Но все же ключевой темой стала перспектива участия Украины в международном проекте CAESAR, разработанном Европейским региональным офисом ВОЗ и посвященном мониторингу антибактериальной резистентности (АБР) в странах Восточной Европы (он уже охватывает Беларусь, Польшу, Сербию, Словакию, Чехию, Болгарию и другие страны бывшего социалистического лагеря).
Обязательное требование для вовлечения государства в проект CAESAR – соответствие его нормативно-правовой базы европейским критериям, что, учитывая размытость мнений относительно дальнейшей судьбы санитарно-эпидемиологической службы и департаментов общественного здоровья, в украинских реалиях пока представляется довольно затруднительным.
АБР в Украине: основные тенденции
Вниманию присутствующих была представлена книга «Антимикробная резистентность и инфекции, ассоциированные с медицинской помощью в Украине», автором которой является национальный координатор МЗ Украины по инфекционному контролю и антимикробной резистентности в Европейском бюро ВОЗ, заведующий кафедрой микробиологии и эпидемиологии НМАПО им. П. Л. Шупика (г. Киев), доктор медицинских наук, профессор Айдын Гурбанович Салманов. В послужном списке ученого – более чем 30-летний опыт практической деятельности в указанной сфере, разработка и адаптация множества нормативно-правовых актов, написание книг по проблеме резистентности к антибиотикам.

Докладчик подчеркнул, что нельзя отождествлять понятие «инфекционный контроль» (корректнее – контроль над инфекциями), намного более емкое и учитывающее риски, связанные с пациентом, с термином «санитарно-эпидемиологический режим», и перечислил ключевые выводы эпидемиологического мультицентрового исследования (2000-2014 гг.), отражающие нынешнюю ситуацию относительно устойчивости к антибиотикам в нашей стране.
– В последние годы в Украине отмечается увеличение уровней антибактериальной резистентности основных возбудителей, в т. ч. патогенов, провоцирующих возникновение гнойно-воспалительных заболеваний (за период с 2010 по 2014 г. частота указанных состояний возросла в 1,8 раза), связанных с оказанием медицинской помощи. Во многом это обусловлено нерациональным использованием АБП.
В стране уделяется достаточное внимание изучению большого количества объектов внешней среды хирургических стационаров, что сопряжено со значительными материальными затратами и невозможностью эпидемиологической интерпретации полученных результатов, однако государственные программы, четко обозначающие подходы и критерии проведения мониторинга АБР возбудителей инфекций, связанных с оказанием медицинской помощи, отсутствуют.
Кроме того, на государственном уровне не налажена эффективная система учета нозокомиальных инфекций. К примеру, нами обнаружены существенные расхождения между данными официальной статистической отчетности и эпидемиологической диагностики относительно количества пациентов с послеоперационными инфекционными процессами – цифры отличаются в 19,6 (!) раза.
Кроме того, на государственном уровне не налажена эффективная система учета нозокомиальных инфекций. К примеру, нами обнаружены существенные расхождения между данными официальной статистической отчетности и эпидемиологической диагностики относительно количества пациентов с послеоперационными инфекционными процессами – цифры отличаются в 19,6 (!) раза.
В Украине основная роль в возникновении послеоперационных гнойно-воспалительных процессов в настоящее время отводится Staphylococcus aureus, Enterococcus faecalis, Escherichia coli, Enterobacter spp., Pseudomonas aeruginosa. На государственном уровне подтверждена эпидемиологическая актуальность их антибиотикорезистентных штаммов. Отмечается значительная вариабельность показателей, отражающих частоту выделения тех или иных патогенов и уровни их устойчивости к антибиотикам, в зависимости от территориального расположения лечебных учреждений.
Поражает значительная распространенность нечувствительных к антибиотикам штаммов возбудителей послеоперационных гнойно-воспалительных инфекций: 70,7% из них обладали устойчивостью как минимум к 1 АБП, а 35% были мультирезистентными.
Результаты проведенных нами мультицентровых исследований показывают, что микробиологический мониторинг устойчивости возбудителей инфекций к антибиотикам следует осуществлять в каждом стационаре, а уже на основании полученных локальных данных – выбирать АБП и разрабатывать лекарственные формуляры, определяющие подходы к назначению средств этого класса в конкретном медицинском учреждении.
Ключевым шагом представляется присоединение Украины к сети CAESAR, что позволит сопоставлять данные микробиологического мониторинга касательно АБР, ориентируясь на единые стандарты и методологии, которые успешно применяются в 53 странах Европейского региона ВОЗ.
Мониторингу АБР в Украине быть?
На вопросах мониторинга АБР в Украине остановилась главный внештатный специалист МЗ Украины по специальности «Бактериология», заведующая бактериологической лабораторией ГУ «Украинский центр по контролю и мониторингу заболеваний МЗ Украины» (г. Киев) Татьяна Георгиевна Глушкевич.
– Согласно ВОЗ (2014 г.)«АБР – серьезная опасность, которая представляет собой не только прогноз на будущее, но уже сейчас проявляется в каждом регионе мира и может отразиться на каждом пациенте независимо от возраста и места проживания». АБР ассоциируется с негативными медицинскими последствиями (увеличением сроков госпитализации, повышением летальности и др.) и экономическими затратами, в значительной мере она обусловлена социальными причинами (показатели устойчивости возбудителей к АБП выше в развивающихся странах). АБР – постоянно действующий фактор национальной, транснациональной и глобальной биологической угрозы.
В Украине определение чувствительности к АБП регламентирует ряд нормативно-правовых актов, для микробиологов основным является приказ МЗ Украины от 05.04.2007 г. № 167 «Про затвердження методичних вказівок «Визначення чутливості мікроорганізмів до антибактеріальних препаратів». Результаты мониторинга АБР, осуществлявшегося ГУ «Украинский центр по контролю и мониторингу заболеваний МЗ Украины», указывают на формирование в нашей стране неблагоприятной ситуации, связанной с распространением устойчивых к АБП штаммов.
В 2014 г. лабораториями медицинских учреждений выполнено 1,3 млн исследований материала из ран, крови, мочи и внешней среды хирургических, неонатологических, акушерских, урологических стационаров и отделений реанимации/интенсивной терапии. Из 107 тыс. выделенных культур 9,5% штаммов патогенов идентифицированы как полирезистентные (частота выявления в отделениях реанимации/интенсивной терапии (ОРИТ) – 17,1%, хирургических стационарах – 11,3%, неонатологических, акушерских, урологических отделениях – 9,8; 7,1 и 2,1% соответственно).
Не вызывает сомнений тот факт, что для сдерживания такой тенденции и улучшения ситуации необходимо наличие разветвленной сети микробиологических лабораторий, гарантирующих достоверность результатов, и тесное их сотрудничество с персоналом больниц. Какова же ситуация с наличием такой сети в Украине в настоящее время? К сожалению, количество бактериологических лабораторий неуклонно сокращается (особенно остро – на уровне районного звена), а их укомплектованность специалистами недостаточна; практически во всех лабораториях отсутствуют боксы безопасности, морозильные камеры для хранения референс-штаммов; аппаратами для определения плотности бактериальной суспензии обеспечена лишь треть учреждений, что усложняет стандартизацию результатов. Отмечается существенный дефицит оргтехники, средств связи, компьютеров (ими оснащены лишь 39% лабораторий), что фактически делает невозможными оперативный сбор, обработку и передачу информации. Компьютерная программа WHONET, рекомендованная ВОЗ для анализа АБР, внедрена только в 113 лабораториях страны. Но даже в случае адекватного технического оснащения работу многих анализаторов лимитирует дефицит финансовых ресурсов на расходные материалы.
Вместе с тем доказано (Barenfanger et al., 1999), что сокращение среднего времени микробиологического исследования с 44,4 до 39,2 ч обеспечивает снижение уровня летальности с 9,6 до 7,9% и средней стоимости лечения приблизительно с 6700 до 4900 долларов; экономию ресурсов на уровне госпиталя в течение года оценивали в 4 млн долларов.
С учетом вышесказанного принципиально важными представляются разработка национального плана действий по учету внутригоспитальных инфекций и случаев АБР, оптимизация существующих документов с учетом рекомендаций EUCAST и ежегодным пересмотром в дальнейшем. Необходимо внести на рассмотрение МЗ Украины следующие предложения: дополнить соответствующими пунктами статистическую отчетность; возложить функции референс-лаборатории на бактериологическую лабораторию ГУ «Украинский центр по контролю и мониторингу заболеваний МЗ Украины»; создать систему опорных баз в региональных медицинских учреждениях. Крайне необходимы развитие и совершенствование сети микробиологических лабораторий (в т. ч. трансформация бактериологических отделов в отдельные структуры) и обеспечение достойных условий для их работы.
Ожидается, что огромные перспективы в мониторинге ситуации и борьбе с АБР откроются после присоединения Украины к сети CAESAR.
АБР: кто виноват и что делать?
Предикторы эффективности антибиотикотерапии (АБТ) перечислил заведующий кафедрой терапии Харьковской медицинской академии последипломного образования, доктор медицинских наук, профессор Игорь Геннадьевич Березняков.
– На эффективность АБТ влияют факторы, связанные с:
• микроорганизмами (природная/приобретенная резистентность, инокулюм-эффект, существование в виде свободно плавающих клеток и в составе биопленок);
• АБП (фармакокинетические/фармакодинамические характеристики, путь введения, доза);
• пациентами (состояние иммунной системы макроорганизма, локализация инфекции и ее тяжесть, наличие сопутствующих заболеваний, приверженность к лечению);
• врачами (адекватность диагностики и выбора стартовой терапии, соблюдение оптимальной продолжительности АБТ, учет возможных лекарственных взаимодействий).
Устойчивость микроорганизмов к АБП возникает в результате приобретения новой генетической информации путем горизонтального обмена либо изменения собственной (мутации). Выделяют множественную АБР (нечувствительность хотя бы к 1 средству из ≥3 классов АБП), обширную (отсутствие чувствительности как минимум к 1 средству из всех, за исключением 1-2, классов АБП) и панрезистентность (устойчивость ко всем существующим АБП).
Приобретенная АБР может быть обусловлена такими механизмами:
• деструкция или инактивация АБП;
• изменение мишени действия АБП;
• активное удаление АБП из клетки посредством мембранных насосов (эффлюкс);
• уменьшение проницаемости клеточной стенки или блокада механизмов транспорта АБП внутрь бактериальной клетки;
• приобретение нового метаболического пути взамен подавляемого АБП.
Один из наиболее распространенных механизмов, опосредующих приобретенную резистентность, – деструкция/инактивация АБП посредством продукции β-лактамаз. Наиболее проблемными в отношении синтеза этих ферментов являются грамотрицательные бактерии. Одним из подходов к преодолению АБР, вызванной продукцией β-лактамаз, является использование АБП, содержащих ингибиторы β-лактамаз (клавуланат, сульбактам, тазобактам). Следует отметить, что сульбактам отличается большей устойчивостью к изменению рН раствора (активнее проникает в воспаленные ткани), сохраняет стабильность в водных растворах (что обеспечивает длительное хранение), чуть менее активен, чем клавуланат, в отношении плазмидных β-лактамаз, но способен нейтрализовать хромосомные β-лактамазы, предопределяющие устойчивость к цефалоспоринам III поколения, демонстрирует активность в отношении Acinetobacter baumannii в условиях in vitro.
Одной из наиболее сложных проблем в современной клинической практике является лечение инфекций, вызванных продуцентами β-лактамаз расширенного спектра (БЛРС), которые сложно определить рутинными методами. БЛРС гидролизируют цефалоспорины I-IV поколений, но чувствительны к влиянию ингибиторов. Чаще других они вырабатываются такими представителями семейства Enterobacteriaceae, как Klebsiella spp., E. coli, Proteus spp.
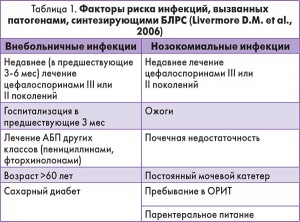
Факторы риска инфекций, ассоциированных с продуцентами БЛРС, перечислены в таблице 1.
При высоком исходном риске выделения полирезистентных штаммов продуцентов БЛРС и наличии соответствующих показаний у пациентов с негоспитальной и ранней вентилятор-ассоциированной пневмонией может назначаться комбинация цефтриаксона и сульбактама.
Что касается возможных путей решения проблемы преодоления устойчивости патогенов, существующих в виде биопленок, то наиболее перспективными представляются использование ингибиторов системы взаимообмена и координации между бактериями quorum sensing и препаратов, подавляющих адгезию возбудителей (в частности, кларитромицин влияет на подвижность P. aeruginosa), а также механическое/физическое воздействие.
Максимальный уровень эрадикации патогенов на фоне терапии β-лактамами достигается при устойчивых концентрациях АБП, в 4-5 раз превышающих минимальные подавляющие.
В масштабном (13 рандомизированных клинических испытаний, включавших 782 участника, и 13 когортных исследований с общим количеством пациентов 2117) метаанализе, выполненном C. Chant и соавт. (2013), сопоставили 2 стратегии дозирования АБТ: продленные/постоянные инфузии времязависимых АБП и традиционное введение. Тактика продленных/постоянных инфузий пиперациллина (с тазобактамом или без него) и карбапенемов, но не цефалоспоринов, ассоциировалась со снижением уровня смертности.
Предшествующее назначение АБП ассоциируется с повышением риска развития инфекций, вызванных метициллинрезистентными штаммами S. aureus (MRSA), – такой вывод сделали E. Tacconelli и соавт. (2008), проанализировав итоги 76 исследований с участием более 24 тыс. пациентов.
Адекватность стартовой АБТ больных с тяжелыми инфекциями во многом предопределяет исход лечения.
Основной принцип разумного использования АБТ в лечении тяжелых инфекций можно сформулировать как «лечи сразу правильно». Рекомендуются: раннее применение АБП широкого спектра; выбор оптимальных доз и пути введения; адекватная длительность АБТ; коррекция/прекращение лечения в зависимости от результатов микробиологического исследования. При выборе АБП необходимо ориентироваться, в том числе, на данные о локальной АБР.
Профиль возбудителей в отделениях интенсивной терапии в Украине
Ситуацию с заболеваемостью гнойно-воспалительными процессами в отделениях интенсивной терапии (ОИТ) в отечественных лечебных учреждениях обрисовал заведующий кафедрой анестезиологии и интенсивной терапии Национального медицинского университета им. А. А. Богомольца (г. Киев), доктор медицинских наук, профессор Феликс Семенович Глумчер.
– К патогенам, быстро приобретающим устойчивость к АБП, относят так называемую группу ESKAPE:
• Enterococcus faecium;
• Staphylococcus aureus (метициллинрезистентные штаммы);
• Klebsiella pneumoniae;
• Acinetobacter baumannii;
• Pseudomonas aeruginosa;
• Enterobacter spp.
Целью нашей работы было проанализировать распространенность патогенов группы ESKAPE и метициллинчувствительных штаммов S. aureus (MSSA) в ОИТ нашей страны при наиболее распространенной инфекционной патологии (пневмония, инфекционный эндокардит, перитонит, инфекции мочевыводящих путей, инфекции мягких тканей и раны). Выполнен ретроспективный анализ бактериологических исследований, проведенных в 2014 г. в 14 ОИТ.
Результаты анализа позволили сделать ряд выводов:
1. В целом значительно чаще (67%) выделялась грамнегативная микрофлора. Наиболее распространенные возбудители – S. aureus (почти 25%) и P. aeruginosa (около 20%).
2. Зафиксирована высокая резистентность E. faecium к линезолиду и тайгециклину.
3. Зарегистрирована меньшая чувствительность MSSA к ванкомицину и линезолиду в сравнении с таковой MRSA, что можно объяснить лишь плохим качеством бактериологических исследований. При этом показатели их устойчивости к тайгециклину сохранялись на низком уровне.
4. Большинство АБП не смогли повлиять на E. coli – в плане АБР она оказалась более проблемным возбудителем, чем K. pneumoniae.
5. Максимально высокую частоту АБР (в т. ч. к карбапенемам и пиперациллину/тазобактаму) продемонстрировали A. baumannii и P. aeruginosa.
В структуре возбудителей пневмоний лидировали P. aeruginosa (33%) и A. baumannii (15%), что вызывает значительную обеспокоенность, а причиной перитонита чаще всего становился E. faecium (25%). Среди патогенов, провоцирующих инфекции мочевыделительных путей, первенство ожидаемо удерживала E. coli (26%), высокую актуальность также продемонстрировали E. faecium и K. pneumoniae (22 и 19% соответственно). Что касается раневой инфекции, довольно часто (43%) обнаруживалась грампозитивная микрофлора, что создает в лечении дополнительные трудности, ассоциированные с MRSA.
Профиль АБР множественнорезистентных грамнегативных бактерий
В клинических условиях вследствие широкого использования АБП происходит селекция резистентных штаммов, которые легко могут приобретать новые механизмы устойчивости и распространяться как среди госпитализированных больных, так и за пределы стационара. В последние годы в структуре возбудителей нозокомиальных инфекций возросла доля грамнегативных микроорганизмов.
О том, как обстоят дела с устойчивостью к мощным этиотропным средствам у этих возбудителей в Украине и мире, сообщила руководитель лаборатории медицинской микробиологии с музеем патогенных для человека микроорганизмов ГУ «Институт эпидемиологии и инфекционных болезней им. Л. В. Громашевского НАМН Украины» (г. Киев), кандидат медицинских наук Елена Викторовна Покас.
– Как свидетельствуют данные Центра по контролю и профилактике заболеваний (CDC), в 2013 г. в европейских странах грамнегативные микроорганизмы являлись причиной инфекций хирургических ран в 39% случаев, вентилятор-ассоциированных пневмоний – в 55,5% случаев, инфекций кровотока – в 37,3% случаев, инфекций мочевыводящего тракта – в 59,1% случаев. Доминируют среди них представители семейства Enterobacteriaceae (E. coli, Klebsiella spp., Enterobacter spp.) и неферментирующие бактерии (P. aeruginosa, A. baumannii), для которых характерно быстрое приобретение резистентности к клинически активным группам АБП.
За период 2013-2015 гг. нами было изучено 256 полирезистентных штаммов условно-патогенных микроорганизмов, выделенных у пациентов, получающих лечение по поводу гнойно-воспалительных процессов в условиях стационара, из различных регионов Украины. Среди них превалировали представители семейства Enterobacteriaceae – 41% (из них 41% – E. coli, 32% – K. pneumoniaе, 24% – Enterobacter cloacae, 2% – Serratia marcescens, 1% – Morganella morganii) и неферментирующие грамнегативные бактерии – 39% (P. aeruginosa и A. baumannii с частотой 19,5% соответственно).
По данным CDC (2013 г.), 19% энтеробактерий, являющихся возбудителями нозокомиальных инфекций, вырабатывали БЛРС. БЛРС – ферменты, гидролизирующие β-лактамы пенициллинового и цефалоспоринового ряда (включая цефалоспорины III-IV поколений и монобактамы). Штаммы, продуцирующие БЛРС, часто демонстрируют устойчивость к фторхинолонам и аминогликозидам, поэтому оптимальным выбором в случае выделения таких патогенов представляются карбапенемы. Способность вырабатывать БЛРС обнаруживают преимущественно представители семейства Enterobacteriaceae, однако этим свойством обладают и некоторые неферментирующие грамнегативные патогены.
Изучение чувствительности к АБП полирезистентных штаммов E. coli, K. pneumoniaе, E. cloacae дало следующие результаты: чувствительность к цефалоспоринам III поколения была низкой (на уровне 0-8,8%), низкой и/или средней – к ципрофлоксацину, хлорамфениколу, аминогликозидам (амикацину, нетилмицину). Наилучшие результаты (>90%) обеспечили имипенем и меропенем. Особо тревожный факт – появление штаммов K. pneumoniaе, резистентных к этим карбапенемам.
Способность продуцировать БЛРС была присуща 65% штаммов E. coli, 54% штаммов K. pneumoniaе, 36% штаммов E. cloacae. Уровень их чувствительности к карбапенемам был наиболее высоким, но ниже, чем таковой полирезистентных штаммов. Неэффективными оказались цефалоспорины, ципрофлоксацин, хлорамфеникол, гентамицин, тобрамицин, в связи с чем их использование в качестве эмпирической терапии нозокомиальных инфекций, вызванных микроорганизмами семейства Enterobacteriaceae, нецелесообразно. Чрезвычайно важно обеспечить внедрение в практику информативных методов для рутинного скрининга клинических изолятов энтеробактерий, способных вырабатывать БЛРС.
В настоящее время внимание экспертов приковано к учащению инфекций, вызванных неферментирующими грамнегативными бактериями P. aeruginosa и A. baumannii, уровень угрозы которых классифицируют как «серьезный», в том числе по причине наличия устойчивости к АБП группы резерва и способности синтезировать металло-β-лактамазы, гидролизирующие все β-лактамы (за исключением азтреонама) и нечувствительные к клавуланату.
Существуют данные, что A. baumannii является промежуточным звеном в обмене генами резистентности к карбапенемам между неферментирующими грамнегативными бактериями и Enterobacteriaceae. Патогены P. aeruginosa и A. baumannii продемонстрировали низкую чувствительность к цефалоспоринам, на уровне 28-38% – к карбапенемам, максимальную (28 и 68% соответственно) – к нетилмицину.
Сравнение показателей чувствительности P. aeruginosa и A. baumannii в динамике (2010-2012 vs 2013-2015 гг.) свидетельствует о возрастании их устойчивости ко всем группам АБП, включая карбапенемы. Металло-β-лактамазы синтезируют 54% штаммов P. aeruginosa и 56% штаммов A. baumannii. Доказано, что это свойство существенно снижает их ответ на терапию карбапенемами (например, устойчивость к меропенему P. aeruginosa увеличилась в 2,5 раза, A. baumannii – более чем в 9 раз). Все продуценты металло-β-лактамаз не реагировали на действие ципрофлоксацина, цефалоспоринов III поколения. Максимальный эффект на них оказывал нетилмицин.
Альтернативных вариантов АБТ инфекций, спровоцированных штаммами, резистентными к карбапенемам, очень мало: колимистин и полимиксин В (но их использование лимитируется нефротоксичностью и аллергогенностью), повышение дозы карбапенемов или комбинация их с другими АБП.
По моему мнению, в ближайшей перспективе следует сосредоточить усилия на стандартизации и внедрении в практику методов скрининга, направленных на выявление продуцентов БЛРС и металло-β-лактамаз.
Риски и способы коррекции изменения микропейзажа в медицинском учреждении
Изменения микропейзажа в медицинском учреждении после лечения гнойно-воспалительных процессов у пациентов, пострадавших во время АТО, проанализировал врач-анестезиолог высшей категории, заместитель главного врача по медицинской части КБ «Феофания» ГУД (г. Киев), доцент кафедры анестезиологии НМАПО им. П. Л. Шупика (г. Киев), кандидиат медицинских наук, Андрей Николаевич Строкань.
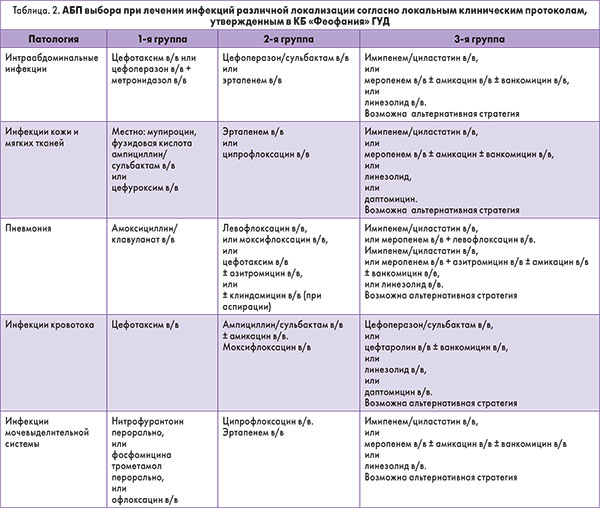
– Организацию контроля и профилактические мероприятия в отношении послеоперационных гнойно-воспалительных процессов регламентируют приказы МЗ Украины № 236 и № 181. В соответствии с современными требованиями в КБ «Феофания» ГУД регулярно проводится мониторинг качественного и количественного состава патогенных микроорганизмов, ежеквартально презентуются доклады бактериологов. На основании данных о локальной резистентности и стратификации факторов риска в нашем учреждении разработаны лекарственные формуляры, регламентирующие назначение АБП (табл. 2).
В 1-ю группу относят пациентов без хронической сопутствующей патологии, обусловливающей необходимость в приеме АБП; не имевших контакта с лечебными учреждениями в предшествующие 6 мес; больных с инфекциями, вызванными так называемыми уличными штаммами возбудителей.
2-ю группу составляют пациенты с хронической сопутствующей патологией, требующей назначения АБП; принимавшие антибактериальные средства в предшествующие 3 мес; госпитализировавшиеся/получавшие терапию в амбулаторных условиях в предшествующие 6 мес.
3-я группа – больные с нозокомиальной инфекцией, послеоперационными гнойно-воспалительными осложнениями или процессами, спровоцированными поли- или панрезистентными штаммами.
Всего через 6 мес после массовой госпитализации пациентов, пострадавших во время АТО (n=91), микробный пейзаж в ряде отделений нашего лечебного учреждения существенно изменился: появились возбудители, не выделявшиеся ранее, а численность ряда типичных патогенов колоссально повысилась/снизилась.
Например, количество неферментирующих грамнегативных бактерий возросло с 14 до 20%, из них доля A. baumannii, присутствие которого ранее было нехарактерно, составила 64% (следует отметить, что указанный возбудитель проявлял чувствительность только к цефоперазону/сульбактаму, и то, к сожалению, не во всех случаях). Более того, увеличилась частота положительных смывов в местах пребывания пациентов, с оборудования, со спецодежды, с рук.
Известно, что в случае попадания в стационар «чужеродной» микрофлоры возможны 2 исхода: она «поселяется» здесь навсегда и провоцирует тяжелые последствия либо ликвидируется благодаря усилиям персонала и адекватному санитарно-эпидемиологическому режиму.
Оперативно были приняты экстренные меры по нормализации микробного пейзажа. Они предусматривали:
• изолированное размещение пациентов;
• строгий контроль соответствия внешнего вида персонала современным требованиям (запрещено пользование мобильными телефонами и другими электронными гаджетами, ношение наручных часов, браслетов и других ювелирных украшений в палатах интенсивной терапии, что регламентировалось приказом главного врача; обязательно наличие медицинской шапочки, халата с короткими рукавами, перчаток, фартуков);
• проверку чистоты рук посредством нанесения флуоресцентной краски (она смывается только спиртсодержащими растворами, поэтому следы краски на руках указывали на недостаточно тщательную их обработку);
• соблюдение современных хирургических стратегий и канонов, таких как:
- выполнение перевязок исключительно в операционной, то есть в условиях асептики и антисептики;
- максимальное иссечение некротизированных тканей;
- выбор терапии на основании данных микробиологического исследования;
- метод ультразвуковой кавитации и массивное промывание ран (до 12 л на перевязку);
- VAC-терапия (аппараты состоят из гидрофильной полиуретановой губки, прозрачного адгезивного покрытия, источника вакуума с емкостью для аспирации жидкости; такие повязки уменьшают локальный отек, микробную обсемененность раны, ускоряют заживление дефекта и служат отличным методом профилактики нозокомиальных инфекций; кроме того, повязки накладывают на длительный период (3-7 дней), что позволяет экономить силы персонала и обеспечить мобильность пациента).
Соблюдение перечисленных требований способствовало восстановлению привычного для нашего лечебного учреждения микробного пейзажа и ликвидации «чужеродной» флоры всего через 2 мес (хотя и не во всех подразделениях хирургического профиля).
Организаторам здравоохранения следует учитывать, что массовая госпитализация тяжелых пациентов из других стационаров может быть сопряжена со значительным изменением качественного и количественного спектра микрофлоры, характерной для данного лечебного учреждения, и является весомой причиной для максимально оперативного пересмотра разработанных ранее внутрибольничных формуляров по назначению АБП, внедрения строгих санитарно-эпидемиологических мероприятий и использования барьерных методов (VAC-терапии и др.).
АБТ в лечении острого панкреатита
Руководитель отдела лапароскопической хирургии и холелитиаза ГУ «Национальный институт хирургии и трансплантологии им. А. А. Шалимова» НАМН Украины (г. Киев), доктор медицинских наук, профессор Михаил Ефимович Ничитайло рассказал о подходах к проведению АБТ на различных этапах лечения острого панкреатита.
– Специфическими показаниями для назначения АБТ при остром панкреатите являются:
• прогрессирующая органная недостаточность;
• развитие синдрома системного воспалительного ответа;
• прогрессирующее клиническое ухудшение с/без признаков бактериальной инфекции;
• внепанкреатические инфекционные процессы (острый деструктивный холецистит, холедохолитиаз);
• некротический панкреатит с поражением более 50% органа;
• период после оперативных вмешательств по поводу некротического панкреатита.
АБТ острого некротического панкреатита проводится поэтапно: эскалация (максимально раннее начало лечения АБП широкого спектра действия); коррекция назначений с учетом полученных этиологических данных (спустя 24-36 ч).
Описанная стратегия соответствует новой концепции эмпирической АБТ – так называемой тактике интервенции, получившей в настоящее время широкое распространение (Masterton R. G., 2008; Rodloff A. C. et al., 2006). Она предусматривает использование в качестве стартового АБП средства с максимально интенсивным действием (образно говоря, ранний и мощный удар) с последующей коррекцией терапии, учитывающей результаты определения чувствительности возбудителя к антибиотикам (Hoffren G. et al., 2002; Chastre J. et al., 2003). Основная цель тактики интервенции – оптимизировать клинический исход посредством предупреждения возникновения устойчивости возбудителей к АБП.
В качестве стартового препарата для терапии острого некротического панкреатита с успехом используется эртапенем. Его концентрация в ткани поджелудочной железы превышает минимальную подавляющую концентрацию для основных возбудителей более чем в 3 раза. Эртапенем указан как препарат выбора для стартовой АБТ внебольничных осложненных интраабдоминальных инфекций средней степени тяжести в рекомендациях IDSA/SIS.
Данные зарубежных ученых (Cancino et al., 2002; Whitelow et al., 2004) и собственный опыт свидетельствуют о достаточно приемлемой эффективности только консервативной терапии: в выполненном нами в 2013 г. наблюдении у 45 из 71 пациентов с инфицированным панкреонекрозом (ИП) удалось избежать оперативных вмешательств и достичь удовлетворительных результатов лечения с помощью консервативного подхода (применялись эртапенем, имипенем, меропенем, линезолид). Превентивная АБТ обеспечила полное купирование процесса у 32% пациентов.
При неэффективности консервативного лечения показаны оперативные вмешательства, лаваж брюшной полости, пункция и дренирование очагов под контролем ультразвукового исследования, открытая некрозэктомия. В комплексной терапии может использоваться декаметоксин.
В нашей клинике проведено лечение 260 пациентов с ИП. Изолированный консервативный подход обеспечил излечение 27 пациентов. Консервативная терапия в сочетании с миниинвазивными вмешательствами (преимущественно чрескожным пункционным дренированием, лапароскопическими некрозэктомиями) применялась у 76 больных. Открытая некрозэктомия выполнена в 131 случае, миниинвазивные вмешательства потребовались в 29 случаях. Общая летальность составила 10,2%.
К счастью, в отнюдь не внушающей оптимизма картине борьбы с АБР в Украине все же достигнут определенный прогресс: на базе НМАПО им. П. Л. Шупика создан первый в Восточной Европе «Украинский научно-образовательный центр инфекционного контроля и антимикробной резистентности», в котором врачей всех специальностей обучают нюансам осуществления инфекционного контроля (а не фрагментарным основам дезинфекции и стерилизации). Разработаны программы для клиницистов и среднего медицинского персонала, изданы соответствующие учебники, получившие одобрение европейских экспертов, проводятся лекции, семинары, практические занятия. Выпускниками курсов уже стали 14 врачей. С целью расширения аудитории слушателей планируется внедрение дистанционной формы обучения.
В 2015 г. была создана первая профильная профессиональная организация – ГО «Всеукраинская ассоциация инфекционного контроля и антимикробной резистентности», в составе которой 11 академиков НАМН Украины и 76 профессоров.
21-22 апреля в НМАПО им. П. Л. Шупика состоится конференция «Актуальные вопросы относительно внедрения стандартов Европейского союза в систему здравоохранения: антибиотикотерапия и профилактика, внутрибольничные инфекции, безопасность пациента, инфекционный контроль» с международным участием. О готовности поделиться с украинскими врачами имеющимся практическим опытом уже заявили профессионалы из Грузии, Беларуси, Азербайджана, Великобритании, Швеции, Нидерландов, Польши, Германии, Словении, Турции, США. В свою очередь, отечественные эксперты надеются, что эта встреча станет катализатором в ликвидации имеющихся бюрократических преград относительно присоединения Украины к сети CAESAR и позволит перейти от слов к делу в соблюдении европейского вектора в борьбе с АБР.
Подготовила Ольга Радучич
|
Медична газета «Здоров’я України 21 сторіччя» №5 (378), березень 2016 р
|