1 квітня, 2015
Роль Toll-подобных рецепторов в патогенезе патологии почек
Патология почек очень часто наблюдается в детском возрасте. К таковым следует отнести бактериальные инфекции, постинфекционный гломерулонефрит, тубулоинтерстициальный нефрит, IgA-нефропатию, волчаночный гломерулонефрит и др. В то же время патогенез этих заболеваний, несмотря на успехи медицинской науки, до конца не изучен.
Известно, что иммунологическая защита против различных патогенов осуществляется в результате скоординированной работы врожденной (неспецифической) и адаптивной (специфической) систем иммунитета, взаимодействие которых обеспечивает эффективное протекание иммунного ответа. Активация врожденного иммунитета является первым и обязательным этапом развития адаптивного иммунитета. Эффекторные механизмы врожденного иммунитета изучены достаточно хорошо, тогда как первые этапы взаимодействия с патогенами и активация воспаления стали понятными лишь в последние годы в результате открытия молекулярных структур распознавания различных типов микроорганизмов.
Открытие Toll-подобных рецепторов стало одной из ярких страниц в современной иммунологии и вызвало огромный интерес к их изучению, что связано с важнейшей ролью этих рецепторов в формировании врожденного и приобретенного иммунитета.
В 1985 г. Nusslein-Volhard и соавт., анализируя нарушения процессов эмбриогенеза у Drosophila melanogaster, наблюдали личинку с недоразвитой вентральной частью туловища. Ген, вызвавший мутацию дорсовентральной полярности, получил название Toll (от нем. «безумный», «удивительный», «поразительный»). Спустя десятилетие было установлено, что дрозофилы, имеющие мутацию toll-гена, были высоко восприимчивы к грибковым инфекциям, на основании чего сделан вывод, что Toll-рецептор принимает участие в запуске иммунного ответа у взрослых дрозофил. При последующих исследованиях был обнаружен первый гомолог toll-рецептора дрозофилы у млекопитающих, который получил название Toll-подобный рецептор (Toll-like receptors – TLR). Первым был открыт TLR4, затем последовало открытие и других TLR у млекопитающих и у человека. После этого важного открытия у млекопитающих было идентифицировано еще 13 TLR. TLR 1-9 экспрессируются и у мышей, и у человека. TLR10 экспрессируется только у человека, а TLR11 – только у мышей.
Поэтому обобщение результатов исследований о структуре и основных функциях TLR, их экспрессии в почках, а также роли некоторых из этих TLR в активации ответа врожденного иммунитета в связи с патологией почек, в частности с бактериальной инфекцией, обусловленной уропатогенными штаммами Escherichia coli (UPEC), является актуальной проблемой.
Структура TLR
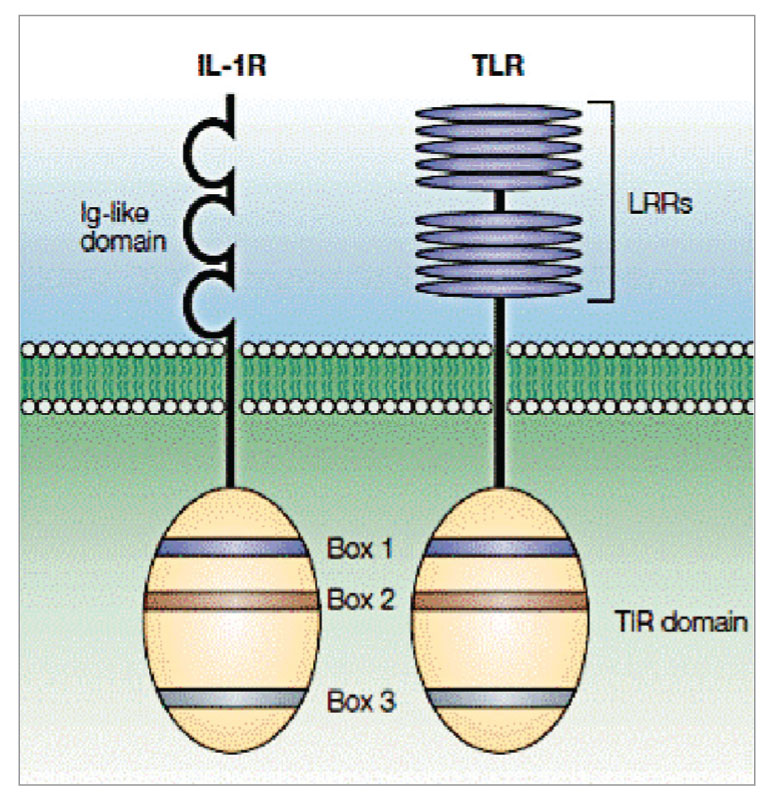
TLR представляют собой интегрированные трансмембранные гликопротеины 1 типа. Они, как и рецепторы к интерлейкину-1 (IL-1RS), имеют поверхностный (ранее именуемый внеклеточный) домен, ответственный за связывание лиганда. Он представлен N-концевой областью аминокислотной последовательности из 19-25 повторяющихся участков, обогащенных лейцином (LRR) (рис. 1). Далее следует переходный участок, отвечающий за прикрепление рецептора к клеточной мембране, обогащенный цистеином. Внутренняя дистальная (цитоплазматическая) часть рецептора представлена Toll/IL1-receptor (TIR) – доменом, получившим свое название из-за одинакового строения этого участка у TLR и у рецепторов цитокинов семейства IL-1. При этом домен TIR рекрутирует адапторные сигнальные молекулы.
Домен TIR характеризуется наличием трех высоко гомологичных регионов (известных как боксы 1, 2 и 3). Однако, несмотря на схожесть в цитоплазматических доменах этих молекул, их внеклеточные области существенно отличаются: TLR имеет тандемные повторы, богатые лейцином (известные как LRR), тогда как IL-1RS имеет три иммуноглобулинподобные домены (рис. 1).
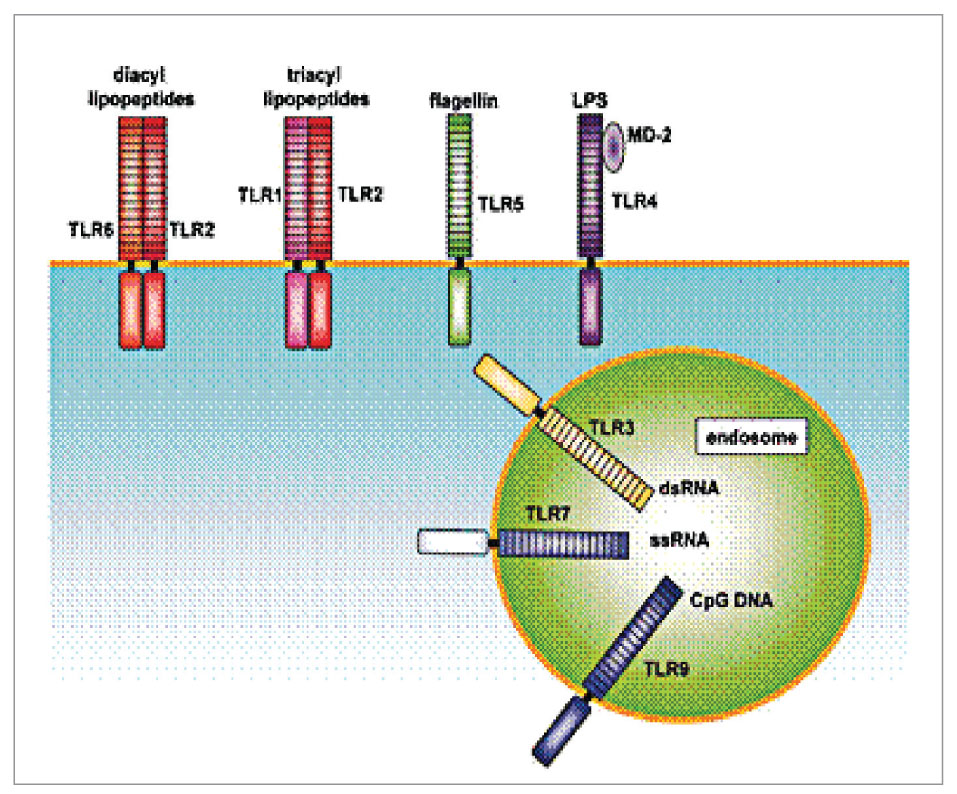
В зависимости от локализации TLR в клетке выделяют рецепторы, расположенные на цитоплазматической мембране (TLR1, TLR2, TLR4, TLR5, TLR6 и TLR10) и на мембранах внутриклеточных органелл (TLR3, TLR7, TLR8 и TLR9) – лизосом, эндосом, аппарата Гольджи (рис. 2).
Лигандами рецепторов, локализованных на цитоплазматической мембране, являются поверхностные структуры микроорганизмов – липопротеин, липополисахариды, флагеллин, зимозан. Рецепторы, локализованные на мембранах внутриклеточных органелл, распознают молекулы ядерных структур микроорганизмов, но могут быть активированы и поврежденными молекулярными структурами собственного организма.
В состоянии покоя неактивированные TLR находятся на мембране клеток в мономерном состоянии, а при активации TLR образуют димеры. Например, гетеродимер TLR1 и TLR2 улавливает трехациальные липопептиды бактерий. TLR2 может также образовывать гетеродимер с TLR6, и этот димер также распознает липопептиды бактерий.
Пути активации TLR
Врожденный иммунитет распознает уловленные микробные или вирусные компоненты, которые известны как патогенассоциированные молекулярные паттерны (ПАМП), для чего используется ограниченное количество паттернраспознающих рецепторов (ПРР), представляющих собой первую линию обороны против патогенов. В последние годы было доказано, что именно TLR играют важную роль в распознавании ПАМП и активации врожденного иммунитета. Многочисленные новые сведения о функции TLR были получены в ходе исследований различных линий мышей с дефицитом TLR, выведенных с помощью направленного воздействия на гены.
На рисунке 3 схематически представлены различные адапторные белки и сигнальные процессы, зависящие от TIR, которые ведут к активации нуклеарного фактора транскрипции (NF-kB) и/или интерферон (IFN)-регулирующего фактора (IRF). В запуск сигналов через TLR вовлечены пять адапторных белков.
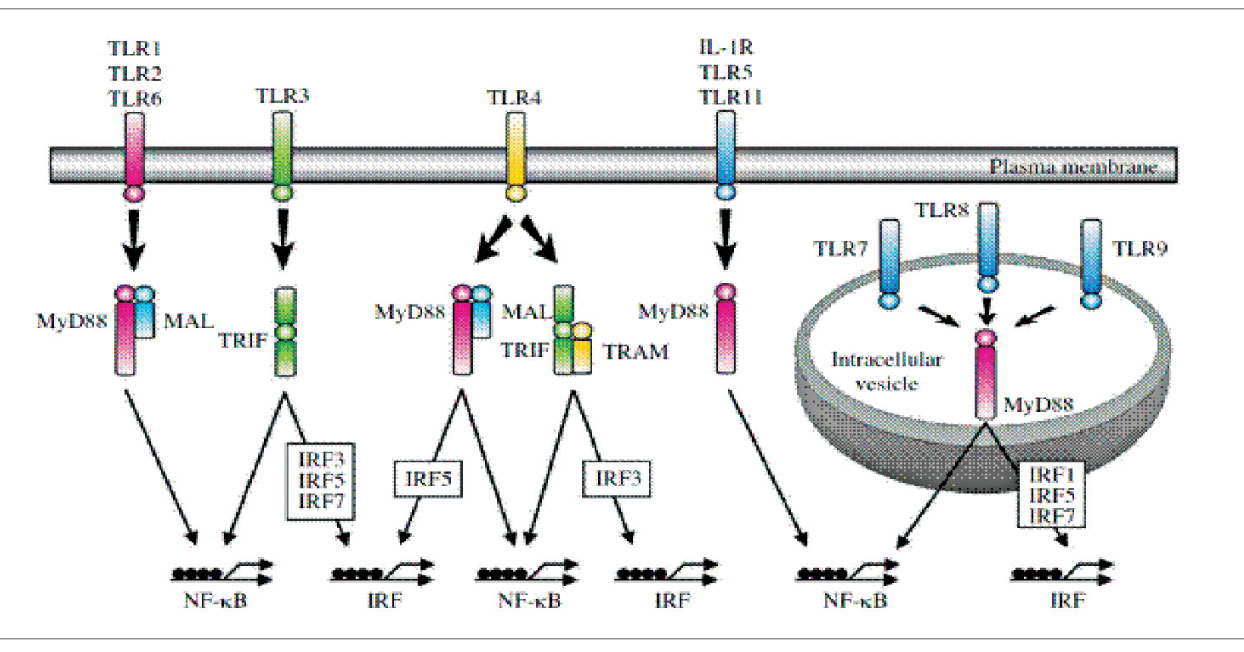 Рис. 3. Схематическое изображение адапторных молекул, ассоциированных с TIR-доменом TLR IL-1R – рецептор интерлейкина 1; MyD88 – адапторный белок первичного ответа миелоидной дифференциации 88; MAL-0 MyD88-адаптор подобный; TRIF – MyD88 и Toll-IL-1-рецептор (TIR)-доменсодержащий адапториндуцирующий IFN-b (TRIF); TRAM – адапторная молекула, связанная с TRIF.
Рис. 3. Схематическое изображение адапторных молекул, ассоциированных с TIR-доменом TLR IL-1R – рецептор интерлейкина 1; MyD88 – адапторный белок первичного ответа миелоидной дифференциации 88; MAL-0 MyD88-адаптор подобный; TRIF – MyD88 и Toll-IL-1-рецептор (TIR)-доменсодержащий адапториндуцирующий IFN-b (TRIF); TRAM – адапторная молекула, связанная с TRIF.Распознавание бактериальных и небактериальных лигандов ПАМП специфическими TLR приводит к активации факторов транскрипции, таких как нуклеарный фактор kB (NF-kB), и членов семейства IRF. Связывание лигандов вызывает гомодимеризацию или гетеродимеризацию TLR, а также рекуратинг адапторных молекул.
В настоящее время различают два основных пути активации TLR: МуD88-зависимый путь и МуD88-независимый путь.
МуD88-зависимый путь. TLR используют сигнальные пути, на старте которых адапторные молекулы формируют молекулярный комплекс с TIR-доменом TLR, тем самым инициируя запуск сигнального каскада. Все известные TLR, кроме TLR3, взаимодействуют с адапторным белком первичного ответа миелоидной дифференциации 88 (myeloid differentiation protein 88; MyD88), который несет С-концевой TIR-содержащий участок, связывающий гомофильный TIR-домен TLR. TLR2 и TLR4 проявляют коадаптор MyD88-адапторподобный (MAL), который также известен как TIRAP и необходим для активации NF-kB.
Рекрутинг MyD88 облегчает ассоциацию TIR с семейством серин/треонин киназами, ассоциированными с рецептором IL-1 (IL-1 receptor associated kinase – IRAK). Затем фосфорилированные IRAK диссоциируют и взаимодействуют с фактором 6, ассоциированным с рецептором TNF (TNF receptor associated factor 6 – TRAF6), что приводит к активации киназы 1 с помощью трансформирующего фактора роста β (TAK-1).
Далее IRAK-1 и TRAF6 диссоциируются из комплекса TIR/MyD88/IRAK-4 и взаимодействуют с мембранассоциированной киназой ТАК-1 и вспомогательными белками ТАВ1 и ТАВ2. В результате фосфорилированные ТАК1 и ТАВ2 индуцируют диссоциацию IRAK-1 из комплекса с последующей активацией IKK и митогенактивируемых протеинкиназ (МАРК). В результате последующего убиквитинирования TRAF6 происходит активация ядерного фактора транскрипции NF-kВ. В регуляции транскрипционной активности через NF-kВ участвует ингибиторный сигнальный белковый комплекс IkB (IKK), формируемый двумя каталитическими субъединицами – киназами IKKα и IКKβ – и одной регуляторной IKKγ. IKK-комплекс индуцирует активацию NF-kВ через фосфорилирование ингибитора IkВ по остатку серина с последующим расщеплением его в протеасомах. Благодаря этому обеспечивается димеризация и перемещение (транслокация) NF-kВ в ядро. Этот путь является классическим сигнальным путем, зависящим от MyD88.
В итоге, связываясь с промоторными участками генов, ядерный фактор NF-kВ активирует синтез провоспалительных цитокинов, молекул адгезии, костимулирующих молекул с последующей активацией структур адаптивного иммунитета.
Белок CD14, связанный с гликозилфосфатидилиноситолом, также необходим для активации под воздействием TLR2-TLR6 сигнальных путей, зависящих от MyD88, и сигнального пути, активируемого LPS и проводимого TRIF.
МуD88-независимый путь. Известен также механизм MyD88-независимой передачи активационных сигналов от TLR. Его принципиальным отличием является то, что TIR-домен взаимодействует с адапторной молекулой TRIF (TIR domain containing adaptor inducing IFN-β) с последующей активацией внутриклеточного фактора IRF3 (interferon regulatory factor 3), индуцирующего экспрессию генов IFN-α и IFN-β, являющихся важнейшими молекулами для дифференцировки Т-лимфоцитов.
При определенных условиях TLR3 и TLR4 могут активировать сигнальный путь NF-kB, не зависящий от MyD88 (рис. 3), что приводит к индукции генов, индуцируемых IFN, и способствует созреванию клеток.
При запуске сигнального пути через TLR3, осуществляемом вирусной двухцепочечной РНК, TRIF связывается с рецептором и индуцирует экспрессию IFN типа 1 через TRIF-IKKe. Кроме того, активация TLR агонистом обеспечивает фосфорилирование тирозина с вовлечением фосфатидилинозитол-3-киназы с активацией Akt и фосфорилированием IRF-3. TLR3 также стимулирует экспрессию провоспалительных цитокинов, вовлекая сигнальные молекулы в активацию NF-βВ после взаимодействия TRIF с рецептором.
Механизмы индукции IFN типа 1 при ответе, реализуемом через разные типы TLR, различаются на уровне адапторных молекул. Конвергенция сигнальных путей осуществляется на этапе активации киназы TLR или общего активатора сигнальных путей NF-kВ, митогенактивируемой протеинкиназы р38 и JNK-киназы.
TLR4 индуцирует два различных сигнальных пути, один из них контролирует адапторные белки TIRAP и MyD88, вовлекаемые в выработку провоспалительных цитокинов, другой – адапторы TRAM и TRIF, через которые запускается продукция IFN. TLR4 – единственный из экспрессируемых на клеточной поверхности членов семейства TLR способен индуцировать IFN типа 1.
При активации с участием адаптора TRAM TLR4 связывает дополнительный адаптор TRIF. TLR4 использует адапторы TRIF и TRAM для инициации поздней фазы активации NF-kВ, а также для индукции экспрессии генов IFN-β и других IFN-индуцибельных генов через фактор транскрипции IRF-3. TRAM, подобно TIRAP, выступает в роли связующего звена для соединения TRIF с TLR4. TLR4 последовательно активирует MyD88/ TI-RAP- и TRAM-зависимый сигнальные каскады. Изначально адапторы MyD88 и TILAP воспринимают сигнал от TLR4, экспрессированного на клеточной поверхности, а затем претерпевший эндоцитоз TLR4 взаимодействует с TRAM в ранних эндосомах.
Основные функции TLR
TLR2 распознает широкий круг микробных продуктов, таких как липопротеины из грамотрицательных бактерий, микоплазмы и спирохеты, пептидогликаны и липотейхоевая кислота из грамположительных бактерий, гликоинозитолфосфолипиды из Trypanosoma сruzi, зимозан из грибков или порины (табл.).
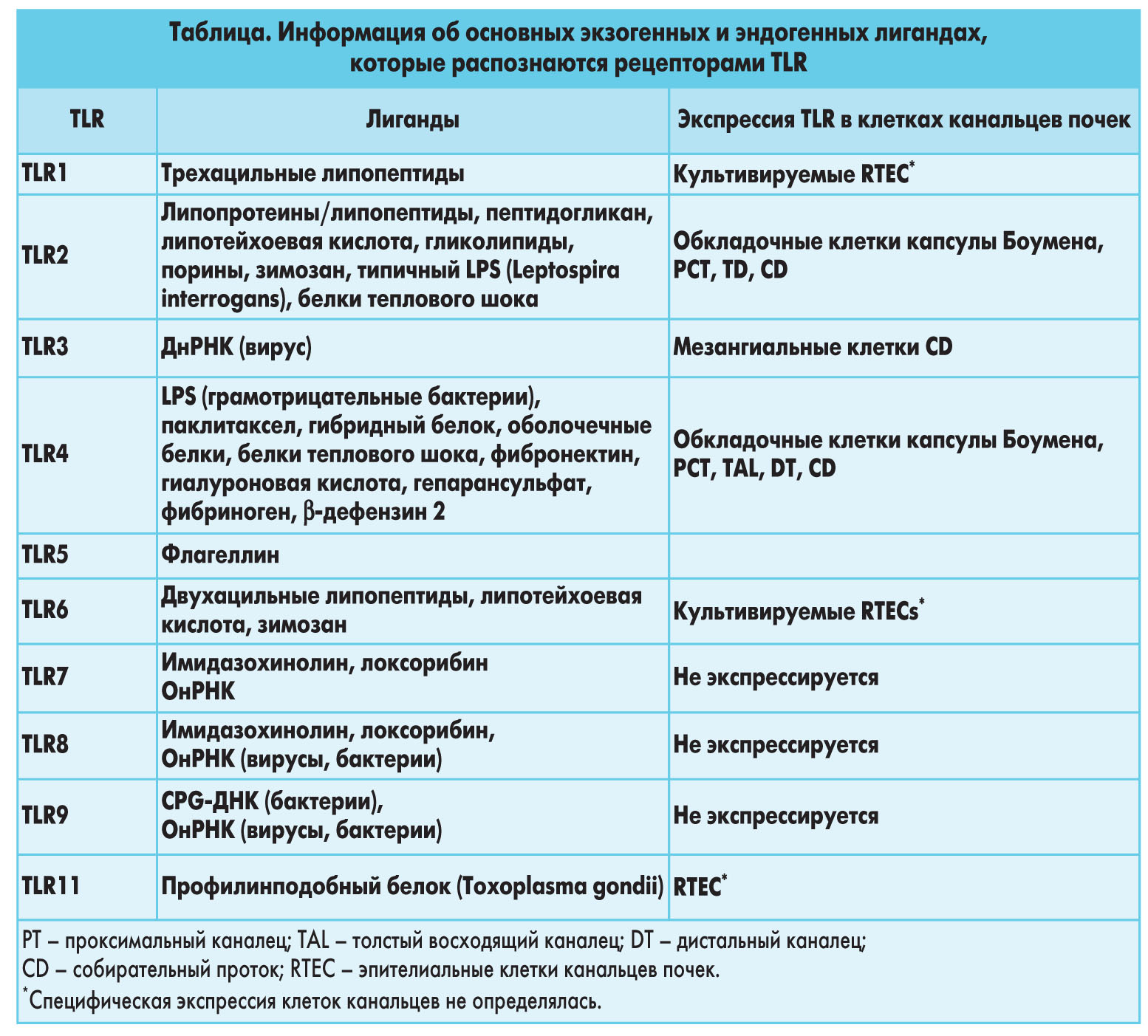 Кроме того, TLR2 распознает нетипичные LPS из Leptospira interrogans и Porphyromonas gingvalis, но не улавливает те, что вырабатывают E. coli или Salmonella spp., являющиеся лигандами для TLR4. В почках TLR2, экспрессированный в проксимальных клетках канальцев почек, распознает наружные белки мембраны Leptospira, что приводит к активации NF-kB, и MAPK. Но известно, что существует также и дифференцированное распознавание очищенного липида А Leptospira TLR.
Кроме того, TLR2 распознает нетипичные LPS из Leptospira interrogans и Porphyromonas gingvalis, но не улавливает те, что вырабатывают E. coli или Salmonella spp., являющиеся лигандами для TLR4. В почках TLR2, экспрессированный в проксимальных клетках канальцев почек, распознает наружные белки мембраны Leptospira, что приводит к активации NF-kB, и MAPK. Но известно, что существует также и дифференцированное распознавание очищенного липида А Leptospira TLR.
Доказано, что TLR2/TLR1 являются преобладающим рецептором в клетках человеческого организма, а TLR2 и TLR4 способствуют клеточной активации в макрофагах мышей. TLR2 также распознает различные эндогенные лиганды, в том числе Hsp70, который повышающе регулируется после ишемического/реперфузионного (I/R) повреждения и, возможно, играет определенную роль при активации TLR2 в ишемических тканях.
TLR2 взаимодействует с высокогомологичными рецепторами TLR1 и TLR6, чтобы различать разные микробные компоненты. Например, TLR1 и TLR2 сигнализируют растворимым факторам, которые выпускает Neisseria meningitides. TLR1 также имеет большое значение для распознавания трехацильных липопептидов. Любопытно, что TLR2, который повышающе регулируется при почечном I/R повреждении, играет ключевую роль в индуцировании воспалительного ответа и повреждения клеток.
У мышей с нехваткой TLR2 отмечается существенно более слабый воспалительный ответ, меньшая инфильтрация лейкоцитами, а следовательно, более слабое повреждение клеток канальцев почек, чем у их сородичей дикого типа при I/R повреждении. Более того, установлено, что in vivo инъекция TLR2-анти-мРНК также эффективно защищает от нарушения функции почек в результате I/R. Shigeoka и соавт. показали, что индуцирование воспалительного ответа, который проводится с помощью TLR2, происходит по сигнальным путям TRIF, которые могут зависеть от MyD88. Но точный механизм активации TLR2 при I/R повреждении остается невыясненным.
TLR3 распознает однонитевую РНК (онРНК) и двухнитевую РНК (днРНК), которые вырабатывают многие вирусы при репликации. Экспрессия человеческого TLR3 в клетках, не реагирующих на днРНК, позволяет последней активировать NF-kB [22]. TLR3 отличается от других TLR тем, что не имеет пролинового остатка, который сохраняется в прочих TLR. Этот остаток соответствует пролиновому остатку, который мутирует в гене tlr4 у мышей с нехваткой LPS (которые обозначаются также как мыши Lpsd) C3H/HeJ. Эти мыши не реагируют на LPS и не могут выводить грамотрицательные бактерии, образующие колонии в нижних мочевых путях и почках.
Установлено, что у человека TLR3 преимущественно экспрессируется в зрелых дендритных клетках. Также доказано, что мРНК TLR3 экспрессируется в почках человека. Более того, выяснено, что TLR3 также экспрессируется в мезангиальных клетках почек, наряду с антигенпредставляющими (APC) клетками инфильтрата, на экспериментальной мышиной модели системной красной волчанки (SLE). Высказывается предположение, что TLR3 участвует потому, что, как известно, днРНК активирует цитокины дендритных клеток – интерфероны 1 типа, которые ассоциируются с SLE. Установлено, что вирусная днРНК усиливает вызванный волчанкой нефрит у мышей MRLlpr/lpr, у которых спонтанно развивается иммунокомплексный гломерулонефрит.
TLR4 – это основной рецептор LPS из грамотрицательных бактерий. С начала 1980-х гг. известно, что некоторые мыши, например C3H/HeJ, очень чувствительны к инфекции мочевых путей и не могут выводить бактерии из организма. Через 10 лет в ходе 2 исследований были идентифицированы точечная мутация в гене tlr4 у мышей C3H/HeJ с нехваткой LPS и нулевая мутация в гене tlr4 у гиперчувствительных к LPS мышей C57BL10/ScCr. У мышей с нехваткой TLR4, выведенных с помощью адресного разрушения гена tlr4, проявляется такой же гиперчувствительный к LPS фенотип, что подтверждает, что TLR4 – это рецептор LPS. Мутации TLR4, связанные с пониженной реакцией на LPS, также были идентифицированы у человека.
Для распознавания LPS рецептором TLR4 необходимо наличие еще двух молекул – CD14 и MD-2. Считается, что CD14 взаимодействует с TLR4 в сигнализировании LPS, а MD-2 ассоциируется с внеклеточным доменом TLR4 и усиливает вызванную LPS клеточную активацию. Белок RIP105, который экспрессируется преимущественно на поверхности В-клеток, также участвует в распознавании LPS. Все вместе результаты этих исследований говорят о том, что TLR4 образует большой комплекс с несколькими ассоциированными белками для эффективной активации клеток, вызываемой LPS.
TLR4 распознает и другие лиганды, показанные на рисунке 3. Один из них таксол – продукт тиса тихоокеанского (Taxus brevifolia), который обладает мощным противораковым действием, – также вызывает мощный воспалительный процесс, проводимый TLR4-MD-2. Кроме того, показано, что белки теплового шока Hsp60 и Hsp70 активируют сигнальные пути NF-kB и MAP-киназы, проводимые TLR4. TLR4 распознает и Hsp70, чья чрезмерная экспрессия происходит в ишемических клетках канальцев почек. Однако роль Hsp в активации TLR остается спорной из-за возможного загрязнения чистого Hsp под воздействием LPS. Недавнее исследование, в ходе которого было установлено, что TLR4, как и TLR2, играет активную роль в инициировании воспалительного ответа, а также апоптоза клеток канальцев почек, показало также, что Hsp70 не активируется в почках мышей после I/R-повреждения.
Такие компоненты внеклеточного матрикса, как фибронектин, гиалуроновая кислота или гепарансульфат, выпускаются при повреждении клетки и также активируют TLR4 и TLR2. Внеклеточный домен А фибронектина, растворимый гепарансульфат, олигосахариды гиалуроновой кислоты и β-дефензин 2, как доказано, тоже активируют TLR4. Следует отметить, что эти эндогенные лиганды TLR4 активируют иммунные клетки только в высоких концентрациях, в отличие от активации клеток, вызванной низкими концентрациями LPS. Более того, нельзя исключить вероятность того, что эти лиганды, возможно, были загрязнены LPS.
TLR5 распознает мономерный флагеллин, первичный белковый компонент жгутика, т.е. очень сложной структуры, которая выдается из наружной мембраны грамотрицательных бактерий. Бактерии используют жгутики для перемещения в жидкой среде. Кроме того, жгутики важны для прикрепления бактерий к клеткам хозяина, и было установлено, что эти жгутики способствуют вирулентности патогенных бактерий.
Флагеллин вызывает белковый иммунный ответ в клетках как млекопитающих, так и растений. Но некоторые бактерии, например Helicobacter pylori и Bartonella bacilliformis, имеют модифицированный флагеллин, который не вызывает провоспалительной реакции.
TLR5 активно экспрессируется в эпителиальных клетках интерстиция. Задействование рецептора TLR5 бактериальным флагеллином вызывает активацию клеток, что ведет к выработке IL-8 и воспалительного белка макрофагов 3а. Флагеллин, как было показано, является основным детерминантом проводимой Salmonella активации провоспалительных сигналов NF-kB.
TLR5, расположенный в базолатеральной мембране эпителиальных клеток интерстиция, также может различать симбиотические и патогенные бактериальные штаммы с флагеллином. Патогенные бактерии со жгутиками, располагающиеся базолатерально, вызывают воспалительный ответ посредством сигналов, проводимых рецептором TLR5. In vivo воздействие флагеллина на пораженную декстраном сульфата, а не на незадействованную толстую кишку усиливает воспаление толстой кишки, а значит, флагеллин играет важную роль в развитии и прогрессировании колита. Однако полярность экспрессии TLR5 остается спорной, поскольку имеются сообщения об апикальной экспрессии TLR5 в культивируемых клетках HT29, подобных кишечным, и в кишечнике мыши. Полиморфизм стоп-кодона в лигандсвязующем домене TLR5, действующий как отрицательная доминанта, ассоциируется с повышенной чувствительностью к бактериям Legionella pneumophila со жгутиками, которые вызывают пневмонию у человека.
Высказывается предположение, что TLR5 играет важную роль в проведении ответа врожденного иммунитета в эпителиальных клетках легких. TLR5 распознает инфекцию Pseudomonas aeruginosa в эпителиальных клетках дыхательных путей. В недавнем исследовании было выявлено, что TLR5 вызывает воспалительный ответ врожденного иммунитета в мочевом пузыре и почках, инфицированных E. coli, что косвенно указывает на то, что TLR5 экспрессируется в эпителиальных клетках почек. Но экспрессия мРНК TLR5 обнаружена в первичных культурах – клетках почечных корковых канальцев у мышей, и нельзя исключить вероятность того, что экспрессия TLR5 ограничивается только некоторыми специализированными клетками канальцев почек.
TLR7, TLR8 и TLR9. TLR7 и TLR8 высоко гомологичны с TLR9. Они экспрессируются в эндоплазматическом ретикулуме и во внутриклеточных эндосомных органеллах. TLR7, TLR8 и TLR9 распознают нуклеиновые кислоты. TLR7 и TLR8 могут распознавать вирусную онРНК вирусов и бактерий и синтетические имидазохинолины, которые, как известно, обладают мощными противовирусными и противораковыми свойствами. Синтетический нуклеозидный аналог R488 также является лигандом TLR7 и TLR8. TLR7 и TLR8 не обнаружены в эпителиальных клетках почек. TLR9 распознает неметилированные 2-деоксирибо-(цитидин-фосфат-гуанин) (CpG) мотивы, которые обнаруживаются в ДНК вирусов и бактерий, но не в ДНК эукариотов. CpG ДНК стимулирует пролиферацию В-клеток и секрецию провоспалительных цитокинов, которые необходимы для ликвидации атакующих патогенов. Например, CpG ДНК защищает мышей от инфекций, вызываемых внутриклеточными патогенами, такими как Leishmania major и Listeria monocytogenes. TLR9 экспрессируется в В-клетках, древовидных клетках и моноцитах/макрофагах и локализуется в эндоплазматическом ретикулуме покоящихся клеток. Он активируется после перемещения из эндоплазматического ретикулума в эндоцитозную CpG ДНК в лизосомах. TLR9 также экспрессируется в эпителиальных клетках, в том числе клетках желудка и кишечника. В клетках кишечника ДНК из патогенных штаммов Salmonella и E. coli стимулирует экспрессию мРНК TLR9. Lee и соавт. доказали, что при добавлении к апикальной или базолатеральной стороне клеток, выращенных на фильтрах, TLR9 активирует поляризованные эпителиальные клетки кишечника по-разному. Эти же авторы показали, что апикальная экспрессия TLR9 сигнализирует деградацию IkBα и сопутствующую активацию NF-kB, в то время как апикальная экспрессия TLR9 ограничивает воспалительные ответы TLR9 после последующей стимуляции TLR9 под воздействием механизма, при котором убиквитинированный IkBα аккумулируется в цитоплазме и тем самым препятствует активации NF-kB. Что касается почек, то в культивируемых клетках почечных канальцев мРНК TLR9 не выявлена. Но это не может полностью исключить вероятность того, что TLR9 ограничивается некоторыми специализированными эпителиальными клетками канальцев. Считается также, что TLR9 участвует в патогенезе SLE, активируя В-клетки и стимулируя выработку цитокинов. Участие TLR7 и роль TLR9 в прогрессировании SLE рассматривалась в недавних работах.
TLR11 экспрессируется у мышей, но не у человека. TLR11 распознает профилинподобный белок Toxoplasma gondii. Профилин относится к группе малых актинсвязывающих белков, которые играют определенную роль в полимеризации актина, следовательно, TLR11 у мышей, возможно, участвует в переносе паразитов. TLR11 вызывает передачу сигнала, который ведет к активации NF-kB и AP-1 в клетках HEK 293, экспрессирующих CD14-TLR11. Однако его точную функцию еще только предстоит выяснить. Любопытно, что TLR11, как установлено, участвует также в распознавании уропатогенных E. coli у мышей. TLR11 экспрессируется преимущественно в эпителиальных клетках мочевого пузыря и почек. Но до настоящего времени не проводились исследования колонизации с применением специфических маркеров клеток почечных канальцев.
Локализация TLR в эпителиальных клетках канальцев почек
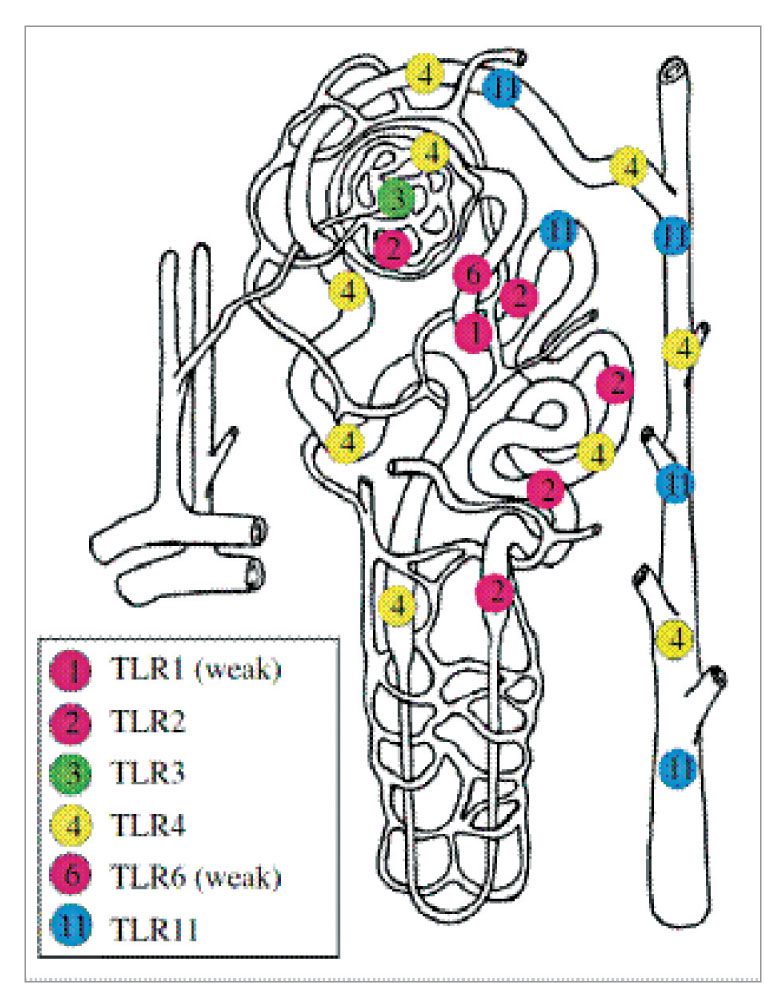
Эпителиальные клетки канальцев почек у мышей экспрессируют мРНК TLR1, TLR2, TLR3, TLR4 и TLR6. Экспрессия мРНК полными TLR зафиксирована в почках человека, но экспрессия TLR в эпителиальных клетках канальцев почек не различалась с экспрессией в циркулирующих иммунных клетках. На рисунке 4 обобщается информация о внутрипочечном распространении TLR, экспрессированных в клетках канальцев почек.
Хотя установлено, что эпителиальные клетки почечных канальцев экспрессируют TLR1, его точное расположение в клетках канальцев неизвестно.
TLR3 экспрессируется в миелоидных дендритных клетках. Кроме того, обнаружена его экспрессия в почках мышей и человека. Экспрессия TLR3 в мезангиальных клетках почек и иммунных клетках, которые проникли в почки, также была выявлена на экспериментальной модели SLE у мышей. Анализ экспрессии мРНК TLR3 в образцах почечной биопсии человека показал, что этот рецептор экспрессируется в почечном мезангии и клетках собирательного протока.
TLR2 и TLR4 активно экспрессируются в клетках костного мозга, а также в различных неэпителиальных клетках, в том числе эндотелиальных клетках, клетках гладкой мышцы и эпителиальных клетках кишечника. Экспрессия мРНК TLR2 была преимущественно обнаружена в ходе in situ гибридизации в проксимальных и дистальных канальцах. С помощью иммунофлюоресцентных анализов почек крыс и мышей был обнаружен белок TLR2 в проксимальных канальцах, клетках толстого восходящего канальца и дистальных канальцах. Экспрессия TLR2 имеется также в гломерулярных клетках, возможно, в мезангиальных клетках и в капсуле Боумена. Интересно, что TLR2 локализуется в базолатеральных мембранах незатронутых клеток почечных канальцев, но остается преимущественно в цитоплазме клеток ишемических канальцев.
Точное распространение TLR4 в эпителиальных клетках все еще остается спорным. Показано, что TLR4 экспрессируется на уровне как мРНК, так и белков в клетках почечных канальцев у мышей, крыс и человека. In situ гибридизация выявила наличие мРНК TLR4 в проксимальных канальцах, толстом восходящем канальце и дистальных канальцах, а также в капсуле Боумена. TLR4 активно экспрессируется на поверхности макрофагов, также сообщается, что этот рецептор локализуется внутри целого ряда эпителиальных и неэпителиальных клеток. Культивируемые клетки кишечной слизи экспрессируют TLR4 исключительно в комплексе Гольджи. Локализация TLR4 в почечных канальцах по-прежнему остается предметом споров. TLR4 был идентифицирован в щеточной каемке клеток проксимальных канальцев у крыс. Используя иммунную сыворотку против мышиного TLR4, Chassin и соавт. показали, что TLR4 локализуется преимущественно в цитоплазме незатронутых клеток почечных канальцев и преимущественно экспрессируется в клетках толстого восходящего канальца и собирательного протока. Более того, иммуногистохимический анализ почек мышей дикого типа через 2 дня после инфицирования UPEC показал, что TLR4 локализуется вместе с поглощенными UPEC преимущественно в цитоплазме клеток собирательного протока. В ходе недавнего исследования также было установлено, что TLR4 локализуется в комплексе Гольджи, а также локализуется с маркером CTR433 комплекса Гольджи и с p58K. Поэтому необходимы дальнейшие исследования, которые должны прояснить аспекты локализации этих TLR в стимулируемых и нестимулируемых клетках почечного эпителия.
Экспрессия мРНК TLR5 в эпителиальных клетках канальцев у мышей не обнаружена. Поскольку было установлено, что мыши с нехваткой TLR5 также более подвержены ретроградной инфекции UPEC, то экспрессию TLR5 в клетках почечных канальцев нельзя исключить.
In situ гибридизация показала, что TLR11 экспрессируется в клетках канальцев почек. Однако какие-либо иммуногистохимические анализы для изучения внутрипочечного распространения белка TLR11 не проводились.
TLR и патология почек
Инфекции мочевой системы (ИМС), в том числе бессимптомная бактериурия, цистит и пиелонефрит, относятся к самым распространенным инфекционным заболеваниям и являются важной причиной заболеваемости и смертности у человека. Более того, острый или хронический пиелонефрит может привести к тяжелому повреждению почек, которое переходит в терминальную стадию почечной недостаточности.
Кроме того, ИМС являются самой распространенной формой бактериальной инфекции у пациентов после пересадки почек. Известно, что послетрансплантационные ИМС возникают из-за воздействия патогенов в результате хирургических процедур (т.е. использования уретральных и уретеральных стент-катетеров) и длительного лечения иммунодепрессантами. Недавно было показано, что острый пиелонефрит, возможно, является независимым фактором риска, который ассоциируется с длительным снижением функции пересаженной почки, а значит, внутрипочечная инфекция, которая способствует сморщиванию почек, может иметь разрушительный эффект для поддержания длительного функционирования пересаженного органа. Основными микроорганизмами, вызывающими ИМС, являются UPEC.
Фимбриальные адгезины типа 1 и Р, которые экспрессируются на поверхности UPEC, играют важную роль в прикреплении бактерий с эпителиальными клетками слизистой оболочки, что является первым шагом патогенности E. coli. Связывание фимбриальных адгезинов типа 1 и Р с рецепторами эпителиальных клеток определяет специфичность ткани и позволяет UPEC подниматься в нижние мочевые пути и почки. Распознавание микроорганизмов UPEC клетками слизистой оболочки, выстилающими мочевые пути, запускает мощный воспалительный ответ в процессе привлечения TLR4.
В процессе исследований с использованием экспериментальных моделей восходящих ИМС в эпителиальных клетках мочевого пузыря и канальцев почек мышей и человека были получены четкие свидетельства того, что почечный воспалительный ответ на бактерии E. coli с фимбриями типа 1 или Р действительно зависит от TLR4. Недавнее исследование также показало, что E. coli с фимбриями типа 1 или Р могут задействовать различные адапторные молекулы, чтобы повлиять на активацию нейтрофилов и клиренс бактерий, но в обоих случаях для эффективного бактериального клиренса требуется MyD88.
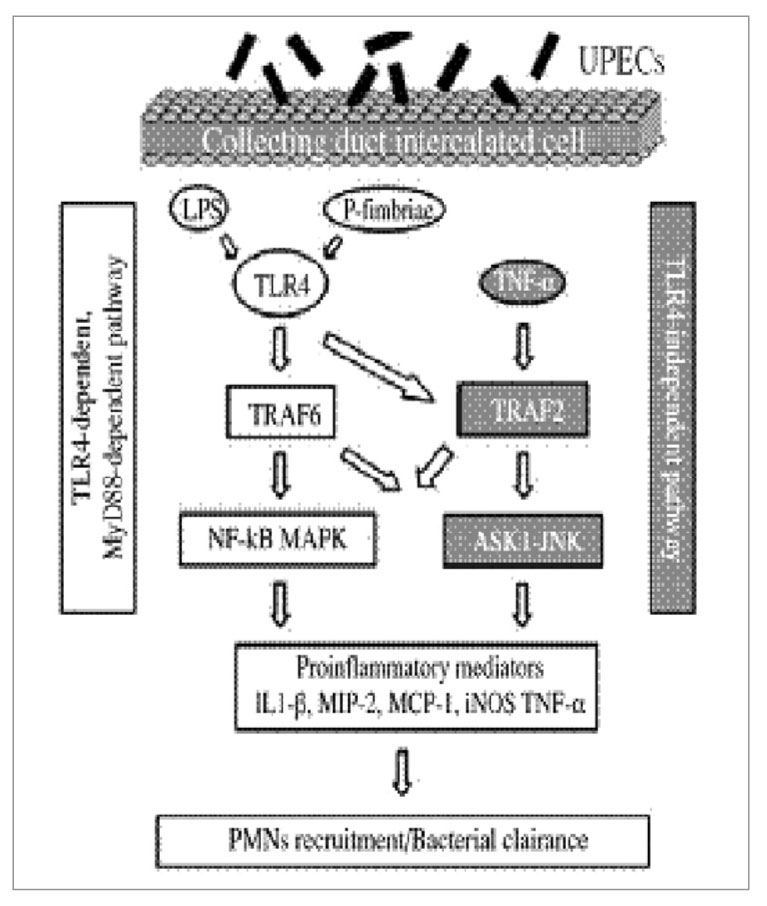
Сигнальные пути, активируемые UPEC в клетках собирательного протока, исследовались в первичных культурах клеток среднего слоя собирательного протока, которые были взяты из почек LPS-восприимчивых мышей C3H/HeOuJ, экспрессирующих функциональный TLR4, из почек LPS-дефективных мышей C3H/HeJ и у мышей с нехваткой MyD88 или TRIF. Анализ сигнальных путей показал, что UPEC стимулируют экспрессию провоспалительных медиаторов в среднем слое собирательного протока с помощью TLR4-проводящих, MyD88-зависимых, TRIF-независимых сигнальных путей, активируемых NF-kB и MAPK, а также посредством TLR4-независимого MyD88-независимого сигнального пути. Этот последний сигнальный путь TLR4 возникает в результате активации фактора 2, ассоциированного с рецептором TNF (TRAF2) и сигнального пути киназы 1, регулирующей сигнал апоптоза (ASK1)-JNK. На рисунке 5 обобщена информация о различных сигнальных путях, активируемых под воздействием UPEC в клетках среднего слоя собирательного протока в почках.
Значение различных типов TLR показано в развитии многих других заболеваний почек. В частности, установлена патогенетическая роль TLR4 при остром повреждении почек, обусловленном ЛПС, а также в развитии системного воспаления при гломерулонефрите. Кроме того, в экспериментальных и клинических исследованиях было показано, что в развитии быстро прогрессирующего гломерулонефрита (с «полулуниями») важное значение имеют TLR2 и TLR3, тогда как при иммунокомплексном гломерулонефрите установлена роль TLR3, TLR7 и TLR9.
Заключение
Таким образом, некоторые из идентифицированных TLR экспрессируются в почках, а также в эпителиальных клетках клубочков и канальцев почек. Вместе с иммунными клетками в системе общего кровообращения эпителиальные клетки канальцев играют ключевую роль в распознавании ПАМП и активации сигнальных путей, что приводит к выработке цитокинов/хемокинов для привлечения полиморфоядерных клеток к очагу воспаления и эффективного клиренса бактерий. Необходимы дополнительные исследования, чтобы можно было определить механизмы участия TLR в развитии различных заболеваний почек.
Список литературы находится в редакции.