10 січня, 2017
Хроническая боль: быстрое обезболивание или безопасность?
...Будучи не в состоянии изменить ситуацию,
…мы призваны измениться сами.
Виктор Э. Франкл, Человек в поисках смысла, 1946
Согласно анализу данных популяционных исследований боль является самой частой причиной обращений к врачу, при этом типичный пациент с хронической болью имеет длительный анамнез, прошел немало курсов малоэффективной терапии и получил консультации у нескольких специалистов (невропатолог, травматолог, хирург, терапевт, ревматолог). В 2010 г. было проведено одно из самых масштабных исследований боли, в рамках которого обследовали 46 394 пациента из 16 европейских стран и США.
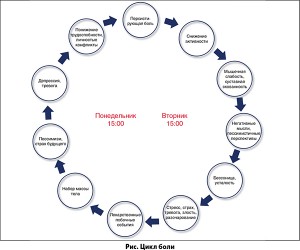
Полученные результаты продемонстрировали, что каждый пятый пациент страдает хронической болью более 20 лет, а 40% неудовлетворены предоставленным лечением. В патофизиологическом аспекте боль – это неприятное ощущение и эмоциональное переживание, обусловленные действительным или возможным повреждающим воздействием на ткани, однако это лишь верхушка айсберга. Боль – это бессонница, финансовые затраты и побочные эффекты лекарственных средств (ЛС), чувство удрученности, стресс, а также межличностные конфликты (рис.).
Именно болью чаще всего манифестирует патология костно-мышечной системы, одной из важнейших составляющих которой считается остеоартроз (ОА). ОА – хроническое прогрессирующее дегенеративное заболевание, характеризующееся дегенерацией суставного хряща, структурными изменениями субхондральной кости, явным или скрыто протекающим синовитом. ОА является самым распространенным заболеванием суставов (10% в популяции во всем мире), хотя в Украине этот показатель намного меньше – 2,5%, что, по-видимому, связано с недостаточным выявлением этого грозного заболевания. Достаточно отметить, что ОА – наиболее частая причина эндопротезирования коленных и тазобедренных суставов. Около трети лиц в возрасте от 25 до 74 лет имеют рентгенологические признаки ОА по меньшей мере одной локализации. В основе патогенеза заболевания лежат изменения в хрящевой ткани, связанные с дегенерацией и гибелью хондроцитов, деполимеризацией основного вещества, снижением количества гликозаминогликанов. Эти изменения приводят к уменьшению прочности хряща, его разрушению с возможным формированием мелких эрозий, образованием и разрастанием остеофитов. Все вышеуказанные процессы могут активизироваться под воздействием немодифицируемых факторов риска развития ОА:
• возраст старше 45 лет;
• отягощенная наследственность по ОА;
• врожденные особенности;
• женский пол;
• постменопаузальный период;
• предшествовавшая травма области сустава и/или хирургические вмешательства на суставах;
• выраженная сопутствующая патология.
Учитывая, что при ОА чаще всего поражаются нагрузочные суставы (тазобедренные, коленные), кисти, позвоночник, клиническая картина данного заболевания может быть очень разнообразной. Однако существуют симптомы, позволяющие верифицировать диагноз на максимально ранних этапах заболевания:
• «механический» характер боли;
• утренняя скованность не более 30 мин;
• ограничение объема движений;
• снижение функциональных возможностей сустава;
• болезненные точки и плотные утолщения по краю суставной щели, крепитация, умеренные признаки воспаления, ограниченные болезненные движения, ощущения напряженности в суставе, а также его нестабильность.
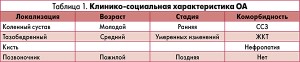
Сложность обоснования рациональной медикаментозной и/или немедикаментозной терапии ОА связана в первую очередь с разнообразием клинических симптомов, различиями в возрасте пациентов и в стадийности поражения, а также с наличием коморбидной патологии (табл. 1). Так, при простом анализе вышеуказанных характеристик легко посчитать, что в повседневной клинической практике мы можем столкнуться с более чем 100 вариантами ОА.
С учетом полиморфизма симптоматики и высокой коморбидности оптимальная терапия ОА представляет собой серьезную проблему, несмотря на то что перечень применяемых препаратов в последнее время значительно пополнился. Основные цели терапии ОА – уменьшение выраженности или полное устранение боли, улучшение функциональной активности, а также замедление прогрессирования заболевания и, конечно, улучшение качества жизни больных.
В основу терапевтических методик при ОА заложены как фармакологические, так и нефармакологические методы, рассчитанные на длительный срок лечения. Выполнение рекомендуемых мероприятий возможно при условии грамотного обучения больных, наличия совместного решения врача и пациента, а также эффективной коррекции модифицируемых факторов риска.
К последним относятся: избыточная масса тела (индекс массы тела – более 25 кг/м2); низкая физическая активность; неадекватные нагрузки на суставы, способствующие травмам (частый подъем по лестнице, ношение тяжелых грузов во время работы, профессиональное занятие спортом, продолжительное нахождение на корточках, на коленях или прохождение дистанции более 3 км ежедневно).
В связи с тем, что большинство ЛС, применяемых при ОА, оказывают лишь симптоматическое
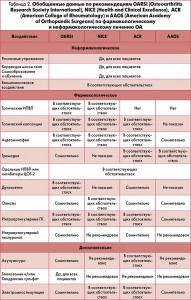
действие, целесообразно инициировать лечение боли, руководствуясь, во‑первых, оценкой потребностей пациента и, во‑вторых, оценивая научные данные, касающиеся компонентов терапии. Именно в таком случае больной получает индивидуализированное лечение, направленное на купирование боли. Роль и значение нестероидных противовоспалительных средств (НПВС) в схеме лечения хронической боли при ОА трудно переоценить – необходимость использования НПВС отражена во всех современных рекомендациях (табл. 2).
Однако популяционные исследования продемонстрировали значительную частоту различных нежелательных явлений на фоне применения НПВС, особенно у пациентов старших возрастных групп с коморбидными состояниями. Это послужило обоснованием для разработки рекомендаций по применению селективных и неселективных НПВС в минимальных дозировках на протяжении минимально возможного времени.
Группа ЛС, называемых препаратами замедленного действия (SYSADOA – symptomatic slow-acting drugs for osteoarthritis) и обладающих симптоматическим и структурно-модифицирующим действиями, считается самой безопасной для длительной терапии ОА, однако именно SYSADOA вызывают наиболее жаркие дебаты относительно эффективности и целесообразности применения для лечения боли при ОА. Попробуем разобраться в данных, представленных в литературе на сегодняшний день.
При оценке эффективности SYSADOA в лечении ОА наиболее важными представляются данные, накопленные для глюкозамина и хондроитина сульфата (ХС). Результаты исследований были представлены в многочисленных обзорах и метаанализах, которые продемонстрировали структурно-модифицирующие и аналгетические эффекты глюкозамина и ХС. Показано, что длительный прием глюкозамина и ХС приводит к замедлению дегенерации суставного хряща, улучшению функционального индекса Лекена и клинических показателей болевого синдрома по визуальной аналоговой шкале – ВАШ (B.F. Leeb и др., T.E. McAlindon и др., F. Richi и др., T.E. Towheed и др.). Полученные данные свидетельствуют о целесообразности рутинного использования глюкозамина и ХС для купирования болевого синдрома при ОА. При этом как глюкозамин, так и ХС демонстрировали благоприятный профиль безопасности.
Тем не менее вопрос выбора инициальной терапии остается не до конца решенным. Не существует убедительного обоснования, что является более эффективным в устранении боли при ОА: глюкозамин, ХС в качестве монотерапии или их комбинация.
Для изучения биохимического взаимодействия ХС и глюкозамина был проведен целый ряд клинических и биохимических исследований in vitro и in vivo, согласно которым эти препараты обеспечивают синергичный эффект в отношении стимуляции матриксного синтеза и ингибирования катаболических процессов в суставном хряще.
Так, в ходе экспериментальных исследований установлено, что комбинированная терапия ХС и глюкозамином способствует повышению продукции гликозаминогликанов на 96,6% (против 32% на фоне монотерапии). Кроме того, при применении данной комбинации наблюдается замедление деструкции хряща (L. Lippiello и др., 2000) и подавление синтеза медиаторов дегенерации суставного хряща. Было показано ингибирование желатинолитической активности ММР‑9, а также уменьшение концентрационных значений протеина ММ‑13 и снижение уровня кератан-сульфата в тканях под воздействием ХС и глюкозамина.
В исследовании C.N. Leffler и др. (1999) по изучению комбинации ХС и глюкозамина у пациентов с гонартрозом и болью в нижней части спины обобщены результаты, свидетельствующие о возможном значительном уменьшении выраженности боли в коленных суставах. Подобные результаты были получены и A.K. Das (1998) при использовании комбинированной терапии у больных с гонартрозом. В частности, подтверждено достоверное значимое уменьшение выраженности боли у пациентов по сравнению с лицами контрольной группы через 6 мес от инициации лечения.
Новой вехой, обозначившей значительное продвижение в направлении сочетанного применения ХС и глюкозамина, считается исследование GAIT (Glucosamine/chondroitin Arthritis Intervention Trial) (D.O. Clegg и др., 2006). Исследование проводилось в 16 центрах США под эгидой Национального института здоровья, спонсировалось Национальным центром комплементарной и альтернативной медицины и Национальным институтом артрита, скелетно-мышечных и кожных заболеваний. В исследование было включено 1583 пациента с симптоматическим ОА коленных суставов. Больных рандомизировали на пять групп в зависимости от получаемой терапии: глюкозамин, ХС, комбинация ХС и глюкозамина, целекоксиб, плацебо. Помимо этого, все пациенты могли использовать ацетаминофен до 4000 мг в сутки в качестве аналгезирующего средства. Период наблюдения составил 24 недели. Согласно полученным данным в группе пациентов с умеренным или выраженным болевым синдромом прием глюкозамина в комбинации с ХС на протяжении 24 недель приводил к достоверному снижению выраженности боли. Важно, что побочные эффекты терапии глюкозамином, ХС и их комбинацией регистрировались редко и были незначительны.
Данные исследования GAIT продемонстрировали, что комбинация ХС и глюкозамина эффективно купирует умеренный и выраженный болевые синдромы у пациентов с ОА коленных суставов.
Актуальными остаются вопросы изучения совместного применения SYSADOA с НПВС, особенно у пациентов с коморбидностью. Ценную информацию предоставляют, на наш взгляд, данные исследования Л.И. Алексеевой и др. (2003), в котором изучались эффекты комбинированного применения ХС, глюкозамина и ибупрофена у пациентов с гонартрозом. На протяжении 3 мес наблюдения выявлено достоверное снижение выраженности болевого синдрома, улучшение функциональных показателей и увеличение двигательной активности. Указанные эффекты сохранялись в течение всего срока наблюдения. В результате синергический эффект хондропротекторов и НПВС способствовал достижению основных целей лечения, а также снижению потребности или полному отказу от приема ибупрофена в дальнейшем.
В текущем году J.P. Raynauld и др. опубликовали результаты первого когортного исследования в условиях повседневной практики с продолжительностью наблюдения 6 лет, в котором подтвердились терапевтические эффекты комбинации глюкозамина и ХС в отношении структурных изменений при ОА коленного сустава, определяемых методом автоматизированного анализа МРТ-снимков.
В исследовании анализировались результаты лечения пациентов из когорты длительного наблюдения Osteoarthritis Initiative, у которых были доступными данные МРТ исходно и через 6 лет, а также данные о приеме глюкозамина и ХС за все время наблюдения. Таких пациентов было 1593. Из них выделили группу 429 пациентов, у которых исходно наблюдалась экструзия медиального мениска коленного сустава (как наиболее подверженных прогрессирующей дегенерации суставного хряща). В этой группе изучалось влияние терапии комбинацией глюкозамина и ХС на объем хряща в зависимости от длительности приема препаратов. Статистический анализ показал, что лечение достоверно замедляло потерю хрящевой ткани коленного сустава, преимущественно за счет латерального компартмента. Многовариантный анализ с поправкой на различия демографических и клинических характеристик пациентов подтвердил, что защитный эффект комбинации хондропротекторов за 6 лет наблюдения был наиболее выраженным у тех пациентов, которые принимали препараты 2 года и дольше.
Эти результаты в очередной раз подтверждают долгосрочный структурно-модифицирующий эффект комбинации глюкозамина и ХС у пациентов с ОА коленного сустава.
Полученные данные соотносятся с концепцией длительного применения SYSADOA при ОА коленных суставов на умеренных стадиях заболевания, и в первую очередь речь идет о ХС и глюкозамине. Однако эти данные должны быть оценены в контексте ограничений обсервационных исследований, таких как выборка пациентов, отсутствие информации о дозировках глюкозамина и ХС, недостаточная оценка симптоматики.
Таким образом, мы можем констатировать, что выбор тактики лечения боли и разработка плана терапии ОА должны основываться на клиническом опыте и согласовываться с пациентом. Учитывая клинически подтвержденную эффективность и высокий профиль безопасности SYSADOA (глюкозамина и ХС), исходя из данных рандомизированных клинических исследований, указывающих на наличие у этих препаратов структурно- и симптом-модифицирующего эффектов, их длительный прием является важной составляющей лечения ОА; в определенных ситуациях глюкозамин и ХС могут быть назначены в первой линии терапии ОА.
Список литературы находится в редакции.