4 липня, 2016
Ревматическая полимиалгия: внедрение новых диагностических критериев (2012) и рекомендаций EULAR/ACR (2015) по менеджменту и лечению

Ревматическая полимиалгия (РПМ; греч. poly – много + myalgia – мышечная боль) – воспалительное ревматическое заболевание, которое характеризуется острым развитием и сопровождается выраженными симметричными болями в области плечевого, тазового пояса и шеи, ограничением движений, значительным повышением показателей острой фазы воспаления и анемией хронического заболевания [4]. Ревматическая полимиалгия является общим воспалительным ревматическим заболеванием, поражающим пожилых людей, и существуют значительные трудности в ее диагностике. Дать короткое, но исчерпывающее определение этому состоянию трудно, поскольку его уникальность, позволяющая отличить РПМ от других заболеваний, является исключительно клинической. Недаром R. Spiera и R. Westhovens – авторы одной из последних обзорных статей, посвященных диагностике РПМ, – сравнили это заболевание с порнографией. Они начинают свою статью этим ярким сравнением: «В 1964 году судья Верховного суда США Поттер Стюарт, хорошо известный своими ораторскими способностями, когда пытался дать определение порнографии, сказал: «Я бы никогда не смог определить ее как следует, но я всегда узнаю ее, когда вижу». Ревматическая полимиалгия очень похожа на порнографию. Это синдром боли, воспаления, ограничения подвижности у людей старшего возраста, которому тяжело дать словесное определение, но с которым мы часто встречаемся в реальной клинической практике и который почти не пропускают опытные клиницисты».
Статья ученых так и называется: «Ревматическая полимиалгия: выход за рамки клинической интуиции?» [11].
Сложность и неоднозначность при постановке диагноза РПМ подтверждают и исторические данные в отношении открытия и описания этой болезни. Первое описание пяти случаев РПМ было выполнено шотландским врачом W. Bruce в 1888 г.; он назвал эту болезнь «сенильной ревматической подагрой». Врач сообщил о 5 пожилых пациентах, страдавших выраженными генерализованными миалгиями, и указал, что клиническая картина в данных случаях отличалась от клинической картины подагры, ревматизма и ревматоидного артрита, т.е. всех известных на то время заболеваний суставов [1]. Следующее описание РПМ появилось значительно позже. E. Meulengracht, работающий в г. Копенгагене, в 1945 году сообщил о двух больных, сформулировав их диагноз как «плечелопаточный периартроз с общими симптомами». В том же году J. Holst и E. Johansen из Дании описали уже 5 случаев «особенного типа ревматического заболевания», подчеркнув их сходство с наблюдениями E. Meulengracht, экстра- и периартикулярный характер болей, наличие лихорадки и значительное повышение скорости оседания эритроцитов (СОЭ). Ученые назвали это заболевание «Периэкстраартикулярный ревматизм» и считали его новой нозологией. В 1951 году на Европейском конгрессе ревматологов V.A. Porsman сообщил о 29 пожилых пациентах с «особым типом артрита», характеризовавшимся болями в проксимальных отделах конечностей и отсутствием припухлости и рентгенологических изменений суставов. В еще одном описании клинических случаев данное заболевание называлось «миалгический синдром с системными реакциями». Автором же наиболее распространенного в настоящее время термина «ревматическая полимиалгия» является врач из Манчестера H. Barber (1957). Несмотря на продолжающуюся критику данного термина, именно он прочно вошел в международный медицинский лексикон. Необходимо отметить, что во Франции более распространенным и употребляемым термином является «ризомелический псевдополиартрит», который подчеркивает поражение зон крупных суставов (плечевые и тазобедренные суставы) и отсутствие типичного артрита. Таким образом, с момента первого описания болезни прошло более 100 лет, однако до сих пор диагноз заболевания преимущественно устанавливается на основании яркой клинической картины.
Клиническая картина РПМ состоит из комбинации признаков поражения опорно-двигательного аппарата и изменений лабораторных показателей воспаления, которые наблюдаются у всех пациентов, а также общих (конституциональных) нарушений, возникающих часто, но не постоянно [6]. Клинические особенности РПМ отображены в следующих положениях.
• Начало заболевания – резкое, неожиданное, «коварное»; пик развития симптомов достигается достаточно быстро – через 2-3 недели.
• Основными клиническими симптомами являются боль и скованность в плечевом и тазовом поясе, шее, которые в большинстве случаев носят симметричный характер.
• Симптомы в большей степени выражены в утреннее время.
• Характерен феномен «геля» – ощущение скованности после долгого периода отдыха или отсутствия активности.
• Общеконституционные симптомы – слабость, вялость, общее недомогание, депрессия, потеря веса, субфебрильная температура тела.
• Характерны артралгии и артриты суставов кистей, теносиновиты кисти.
• Несмотря на наличие миалгий, отсутствует мышечная слабость, боль не уменьшает силу в конечностях, не отмечаются мышечные атрофии/гипотрофии.
• Определяется болезненность мышц при пальпации от слабой до умеренной.
• Уменьшение диапазона движений в суставах, возможно, из-за боли.
• Могут присоединяться симптомы гигантоклеточного артериита (болезни Хортона). Единого мнения по вопросу взаимосвязи РПМ и болезни Хортона нет. Она может быть начальным симптомом, возникать одновременно и появляться позже. Приблизительно у 15% пациентов с РПМ развивается гигантоклеточный артериит, и 40-50% больных с гигантоклеточным артериитом имеют РПМ [3].
• Лабораторные характеристики и особенности РПМ сгруппированы ниже.
• Существенное повышение СОЭ >50 мм/ч и уровня С-реактивного белка (СРБ). СРБ при этом – более чувствительный показатель, чем СОЭ.
• Анемия – нормохромная, нормоцитарная (анемия хронического заболевания).
• Миозит-специфические ферменты: нормальные значения креатинфосфокиназы, миоглобина, альдолазы.
• Ревматоидный фактор негативный (следует помнить о возможности позитивного ревматоидного фактора у 5% лиц без признаков ревматического заболевания), антитела к циклическому цитруллинированному пептиду – негативные.
• Антинуклеарные антитела – негативные.
• Наблюдается значительное повышение уровня интерлейкина-6, что коррелирует с выраженностью воспаления.
• Может отмечаться незначительное повышение уровня печеночных ферментов (АлАТ, АсАТ, ГГТП).
С помощью инструментальных методов исследования установлено, что клиническая симптоматика РПМ обусловлена главным образом воспалительными изменениями суставов и околосуставных тканей. Магнитно-резонансная томография, ультразвуковое исследование (УЗИ) и позитронно-эмиссионная томография позволяют выявить у больных РПМ признаки бурсита в области плечевых и тазобедренных суставов, а также шейного отдела позвоночника [7, 8]. Наиболее характерными являются поддельтовидный бурсит, теносиновит бицепса, трохантерный (вертлужный) бурсит, выпот в плечевом и/или тазобедренном суставах. Описан также синовит плечевых и тазобедренных суставов. При гистологическом исследовании синовиальной оболочки у больных РПМ наблюдается слабо выраженная воспалительная инфильтрация с преобладанием макрофагов и CD4 Т-клеток [10].
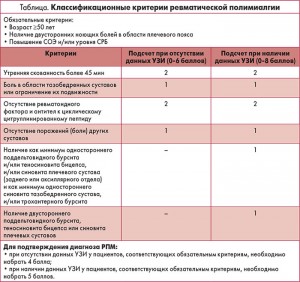
На сегодняшний день не существует единственного клинического, лабораторного или инструментального признака, наличие которого позволяло бы подтвердить диагноз РПМ. Диагностика проводится на основании совокупности проявлений болезни. Наиболее типичные из них используются в качестве диагностических критериев, предложенных Европейской группой по изучению РПМ [8]. Они включают обязательные необходимые критерии, к которым относят возраст ≥50 лет, двустороннюю боль в плечах (появившуюся менее 12 нед назад), повышение СОЭ/уровня CРБ. Критерии следует применять лишь в тех случаях, когда диагноз другого заболевания не представляется более обоснованным [4]. Для верификации диагноза и решения вопроса о назначении глюкокортикоидов (ГК) у таких пациентов могут быть использованы два набора критериев. При отсутствии данных УЗИ диагноз может быть подтвержден на основании 4 признаков: утренней скованности более 45 мин, боли или ограничения подвижности в тазобедренном суставе, отсутствия ревматоидного фактора и АЦЦП, отсутствия поражения других суставов. Максимально возможная сумма баллов по данным 4 критериям составляет 6. Для подтверждения диагноза РПМ достаточно 4 баллов.
Второй набор классификационных критериев используется при наличии результатов УЗИ и, помимо указанных основных 4 параметров, включает 2 дополнительных. Каждый дополнительный критерий представляет собой набор сонографических признаков. Первый из них предусматривает наличие как минимум поддельтовидного бурсита и/или теносиновита бицепса и/или синовита плечевого сустава (заднего или аксиллярного отдела), а также синовита тазобедренного сустава и/или трохантерного бурсита. Второй определяется как наличие двустороннего поддельтовидного бурсита, теносиновита бицепса или синовита плечевых суставов. Каждый из дополнительных критериев оценивается в 1 балл. Поэтому при использовании второго набора классификационных критериев максимально возможная сумма баллов составляет 8, и в этом случае для подтверждения диагноза РПМ необходимо набрать 5 баллов (табл.).
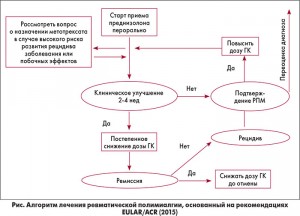
На сегодняшний день существует множество расхождений в подходах к лечению РПМ, которые включают вопросы дозирования ГК и целесообразности использования базисных болезнь-модифицирующих антиревматических препаратов [5]. К сожалению, у большинства пациентов (29-45%), страдающих РПМ, не удается достичь адекватного ответа на терапию ГК в течение первых 3-4 недель. При этом приблизительно у 50% больных наблюдаются различные побочные эффекты на фоне лечения этой группой препаратов. Целью Американской коллегии ревматологов (ACR) и Европейской антиревматической лиги (EULAR) являлось обеспечение клиницистов кратким, четко изложенным современным руководством, которое поможет стандартизировать подходы к лечению и улучшить прогнозы для пациентов с данным заболеванием [9]. Как обычно, при создании подобных рекомендаций эксперты ACR и EULAR руководствовались доказательной методологией с использованием классов рекомендаций и уровней доказательств [2]. Алгоритм лечения РПМ, основанный на рекомендациях (EULAR/ACR 2015), представлен на рисунке.
Экспертами тщательно проработана и обобщена вся база иcследований по РПМ, а после детальной оценки и обсуждения изложена в окончательном варианте данных рекомендаций [9].
1. На старте терапии больных РПМ настоятельно рекомендуется использовать ГК вместо нестероидных противовоспалительных препаратов (НПВП), за исключением возможного кратковременного применения НПВП и/или анальгетиков в случаях, когда болевой синдром ассоциирован с другой патологией (к примеру, сопутствующим остеоартритом).
2. Настоятельно рекомендуется использовать минимально эффективную индивидуальную длительность ГК-терапии у больных РПМ.
3. Условно рекомендуется применять минимально эффективную дозу ГК в диапазоне 12,5-25 мг преднизолона (или эквивалента) как стартового лечения РПМ. Вопрос о назначении более высокой стартовой дозы ГК в границах этого диапазона может рассматриваться у пациентов с высоким риском развития рецидива и низким риском возникновения побочных эффектов; в то же время у пациентов с сопутствующими заболеваниями (например, сахарным диабетом, остеопорозом, глаукомой и др.) и другими факторами риска для ГК-ассоциированных побочных эффектов может быть предпочтительным назначение более низких доз ГК. Условно отрицается использование начальных доз ≤7,5 мг/сут и высказаны настоятельные возражения против применения начальных доз >30 мг/сут.
4. Настоятельно рекомендуется индивидуализация графиков постепенной отмены ГК, основанных на регулярном мониторинге состояния пациента, активности заболевания, лабораторных маркеров и негативных событий. Предложены следующие принципы снижения доз:
a) стартовое снижение: рекомендуется медленно уменьшать дозу ГК до 10 мг/сут в пересчете на преднизолон на протяжении 4-8 нед;
b) терапия рецидивов: рекомендуется увеличить дозу перорального преднизолона до уровня, предшествовавшего рецидиву, и в последующем уменьшать ее постепенно (в течение 4-8 нед) до дозы, во время приема которой случился рецидив;
c) снижение дозы в период ремиссии: после достижения ремиссии необходимо уменьшать дозу перорального преднизолона на 1 мг каждые 4 нед (либо на 1,25 мг, используя, к примеру, схему 10/7,5 мг через день и т.д.) на протяжении того времени, пока сохраняется ремиссия.
5. Условно рекомендуется рассмотреть возможность внутримышечного введения метилпреднизолона как альтернативы применению пероральных ГК. Выбор между пероральным и внутримышечным введением остается на усмотрение врача. Рекомендации не могут четко указать фенотип пациента, который бы нуждался во внутримышечном введении ГК. Предложен следующий график отмены внутримышечного метилпреднизолона:
• метилпреднизолон (депо-форма) внутримышечно 120 мг каждые 3 нед до 9-й недели;
• на 12-й неделе – 100 мг, с последующими 3-месячными интервалами;
• далее доза снижается на 20 мг каждые 12 нед до 48-й недели;
• после этого доза снижается на 20 мг каждые 16 нед до полного прекращения.
6. Условно рекомендуется использовать одноразовый, а не раздельный прием ежедневных доз ГК для лечения РПМ. Разделять дозу препарата на несколько приемов следует в случае выраженного интенсивного болевого синдрома в ночное время суток.
7. Условно рекомендуется учесть возможность раннего назначения метотрексата в дополнение к ГК, в частности у пациентов с высоким риском развития рецидива и/или длительной терапии, а также в случаях имеющихся факторов риска, сопутствующих заболеваний и/или приема сопутствующих препаратов, когда высока вероятность возникновения осложнений ГК-терапии или побочных эффектов ГК. В клинических испытаниях метотрексат применялся перорально в дозах 7,5-10 мг/нед.
8. Настоятельно не рекомендуется использовать ингибиторы фактора некроза опухолей для лечения РПМ в связи с отсутствием доказательной базы. В настоящее время продолжается только одно рандомизированное клиническое исследование с тоцилизумабом (clinicaltrials.gov NCT01396317), а также в другом исследовании сравниваются секукинумаб, канакинумаб и ГК (clinicaltrials.gov NCT01364389).
9. Условно рекомендуется рассмотреть вопрос о создании индивидуальной программы упражнений для пациентов с РПМ, направленных на поддержку мышечной массы и функции, а также снижение риска падений.
10. Применение растительных препаратов в терапии РПМ не рекомендуется. Особенно категорически авторы документа выступают против использования китайских травяных препаратов Yanghe и капсул Biqi у пациентов с РПМ. Данное заявление связано в первую очередь с тем, что вышеуказанные средства не одобрены Управлением по контролю качества пищевых продуктов и лекарственных препаратов США (FDA), а также Европейским агентством лекарственных средств (EMA).
Настоящие рекомендации [9] Американской коллегии ревматологов и Европейской антиревматической лиги предназначены прежде всего для врачей-клиницистов, и предполагается, что они окажут им определенную помощь в ведении пациентов с РПМ.
Литература
1. Бунчук Н.В. Ревматические заболевания пожилых. – М.: МЕДпресс-информ, 2010. – 272 с.
2. Ватутин Н.Т., Смирнова А.С., Тарадин Г.Г., Эль-Хатиб М.А. Обзор рекомендаций по лечению ревматической полимиалгии (EULAR/ACR 2015). Архивъ внутренней медицины. 2016; 1: 3-5.
3. Глазунов А.В., Жиляев Е.В., Толдиева Ф.А. Ревматическая полимиалгия и височный артериит. Клиническая геронтология. 2006; 6: 34-46.
4. Олюнин Ю.А. Ревматическая полимиалгия. Consilium medicum. 2013; 15(9): 53-57.
5. Сатыбалдыев А.М. Лечение ревматической полимиалгии. Современная ревматология. 2013; 1: 66-72.
6. Щедрина И.С., Троицкая М.П., Овчаренко С.И. Ревматическая полимиалгия: сложности диагностики. Лечащий врач. 2011; 4: 33-36.
7. Blockmans D., de Ceuninck L., Vanderschueren S. et al. Repetitive 18-fluorodeoxyglucose positron emission tomography in isolated polymyalgia rheumatica: a prospective study in 35 patients. Rheumatology (Oxford) 2007; 46 (4): 672–677.
8. Dasgupta B., Cimmino M., Maradit-Kremers H. et al. 2012 provisional classification criteria for polymyalgia rheumatica: a European League Against Rheumatism/American College of Rheumatology collaborative initiative. Ann Rheum Dis. 2012; 71(4): 484-492.
9. Dejaco C., Singh Y., Perel P. et al. 2015 Recommendations for the management of polymyalgia rheumatica: a European League Against Rheumatism. American College of Rheumatology collaborative initiative Ann Rheum Dis. 2015; 74: 1799–1807.
10. Meliconi R., Pulsatelli L., Uguccioni M. et al. Leukocyte infiltration in synovial tissue from the shoulder of patients with polymyalgia rheumatica. Quantitative analysis and influence of corticosteroid treatment. Arthritis Rheum. 1996; 39 (7): 1199-1207.
11. Spiera R., Westhovens R. Provisional diagnostic criteria for polymyalgia rheumatica: moving beyond clinical intuition? Ann Rheum. Dis. 2012; 71 (4): 475-476.



