17 травня, 2016
Системний червоний вовчак: клінічно значущі аспекти

Ураження органів дихання
Частою і прогностично несприятливою ознакою СЧВ є ураження органів дихання, а саме паренхіми легень, плеври, дихальних м’язів, легеневих судин і гортані. Плеврит – найпоширеніший плевропульмональний прояв СЧВ. Біль у плевральній порожнині виникає у 45-60% випадків, а ознаки ексудативного плевриту – у половини пацієнтів з СЧВ. Випіт зазвичай двосторонній (але може бути й одностороннім), помірний або незначний, з лабораторними характеристиками ексудату (високий рівень глюкози та низький рівень лактатдегідрогенази – ЛДГ). У плевральній рідині можуть виявлятися антинуклеарний фактор (АНФ), антитіла (АТ) до нативної ДНК (нДНК), і LE-клітини. Люпус-пневмоніт може бути як гострим, так і хронічним. Гострий пневмоніт зазвичай виникає на тлі високої загальної активності СЧВ і проявляється лихоманкою, задишкою, кашлем, плевральним болем, іноді кровохарканням. Розвиток пневмоніту часто асоціюється з наявністю АТ до Ro/SS-A через можливу перехресну реакцію між АТ до Ro/SS-A і поверхневими молекулами альвеолоцитів. Рентгенографія грудної клітки і комп’ютерна томографія (КТ) демонструють односторонні або двосторонні альвеолярні інфільтрати – симптом «матового скла». Частіше виникає хронічний пневмоніт з малосимптомним перебігом – помірна задишка, непродуктивний кашель, посилення легеневого малюнка та дископодібні ателектази в нижніх відділах легень на рентгенограмі.
Геморагічний альвеоліт є відносно рідкісним проявом, який спостерігається лише у 1,5% пацієнтів з СЧВ з гострим перебігом та на тлі високої загальної активності захворювання, проте може бути його єдиною ознакою. Аналогічно гострому пневмоніту геморагічний альвеоліт характеризується раптовою появою задишки, лихоманки та кашлю, а у половини пацієнтів можливе кровохаркання. Характерними ознаками геморагічного альвеоліту є різке зниження рівня гемоглобіну й артеріальна гіпоксемія, які в половині випадків потребують проведення штучної вентиляції легень (A. Lauretis et al., 2011). При рентгенологічному дослідженні виявляють дифузну інфільтрацію легень. Розвиток геморагічного альвеоліту асоціюється з високою летальністю (50-92%) протягом перших днів або 2-3 тиж і потребує призначення пульс-терапії глюкокортикоїдами (ГК).
Легенева гіпертензія розвивається у 0,5-14% пацієнтів з СЧВ і пов’язана як із захворюванням (васкуліт, ендотеліальна дисфункція, синдром Рейно), так і з його ускладненнями (тромбоемболія легеневої артерії, лівошлуночкова серцева недостатність, легеневий фіброз). Ранні симптоми легеневої гіпертензії не є специфічними, і до них належать задишка при фізичному навантаженні, підвищена втомлюваність, слабкість і непродуктивний кашель, які часто розвиваються непомітно. У міру прогресивного підвищення рівня систолічного тиску в легеневій артерії виникають ознаки правошлуночкової недостатності. Допплер-ехокардіографія (ЕхоКГ) є найважливішим неінвазивним скринінговим методом для діагностики легеневої гіпертензії.
У пацієнтів із люпус-пневмонітом та легеневим васкулітом можливим є виникнення ускладнень: ателектазу, бульозної емфіземи, спонтанного пневмотораксу, пневмофіброзу та приєднання вторинної інфекції. Також слід пам’ятати про можливі фіброзні зміни в легенях на тлі прийому метотрексату та циклофосфаміду.
Ураження серцево-судинної системи
Кардіоваскулярні прояви у пацієнтів з СЧВ можна класифікувати таким чином: ураження клапанного апарату серця, перикарда, міокарда та коронарних судин. За даними ЕхоКГ, перикардит виникає у 40% пацієнтів з СЧВ, може бути ексудативним або фібринозним і частіше з асимптомним перебігом. У чверті хворих розвивається клінічна симптоматика гострого перикардиту (біль у грудній клітці при певних положеннях тіла, задишка, інколи супроводжується появою лихоманки і тахікардії, аускультативно – шум тертя перикарда чи приглушення серцевих тонів), рідко виникає констриктивний перикардит (за нашими даними – у 2 із 380 пацієнтів), тампонада серця. Перикардит, як правило, асоціюється з клінічною активністю захворювання, часто поєднується із плевритом і добре піддається лікуванню ГК. Наявність випоту в перикарді потребує виключення вторинного приєднання інфекції (туберкульоз, стафілокок) і ниркової недостатності. Клінічно міокардит виникає у 3-15% пацієнтів, проте, за даними аутопсії, його частота є значно вищою (A. Doria et al., 2005). Розвиток міокардиту асоціюється з наявністю АТ до Ro/SS-A. Дані ЕхоКГ демонструють сегментарні порушення руху стінок серця і зниження фракції викиду лівого шлуночка, але ці зміни є неспецифічними. Тому впродовж останніх років для діагностики міокардиту використовують МРТ, яка дає змогу навіть на доклінічних стадіях виявити порушення релаксації міокарда (J.A. Singh et al., 2005).
Ендокардит Лібмана-Сакса – специфічний прояв СЧВ з ураженням мітрального, аортального та, рідше, трикуспідального клапанів і розвитком їх потовщення, вегетацій та дисфункції (частіше у вигляді помірної регургітації). Виникнення ендокардиту асоціюється з наявністю антифосфоліпідних (АФЛ) АТ. Гемодинамічно значущі вади серця у пацієнтів з СЧВ розвиваються рідко. Необхідно проводити диференційну діагностику ендокардиту Лібмана-Сакса з інфекційним ендокардитом, а також вродженими й набутими (ревматичними) вадами серця.
У незначної кількості пацієнтів з високою активністю захворювання виникає коронарит, проте частіше ураження коронарних судин зумовлене раннім розвитком атеросклерозу.
Ураження шлунково-кишкового тракту та печінки
Клінічні прояви ураження шлунково-кишкового тракту – ШКТ (анорексія, нудота, блювання, абдомінальний біль) не входять до діагностичних критеріїв СЧВ, проте виявляються у 50% пацієнтів і можуть бути зумовлені власне вовчаковими змінами, побічною дією медикаментів (НПЗП, ГК, азатіоприну, метотрексату, циклофосфаміду, сульфасалазину) або супутніми гастроентерологічними захворюваннями. До типових проявів СЧВ належать вовчаковий перитоніт, ентерит/коліт, холецистит, панкреатит, гепатит, ентеропатія із втратою білка, псевдообструкція кишечнику, васкуліт мезентеріальних судин тощо. Асцит не є характерною ознакою СЧВ, і при його виявленні необхідно виключити наявність нефротичного синдрому, застійної серцевої недостатності, ентеропатії із втратою білка та перитоніту. Васкуліт мезентеріальних судин та їх тромбоз – одні з найтяжчих і прогностично несприятливих проявів СЧВ. Поширеність цієї патології коливається в межах 0,2-9,7% серед усіх пацієнтів з СЧВ і в межах 29-65% – серед пацієнтів з гострим болем у животі (J.H. Ju et al., 2009). До факторів ризику розвитку мезентеріального васкуліту відносять периферичний васкуліт і нейролюпус. Клінічні прояви можуть бути гострими (за типом гострого живота) або хронічними (абдомінальна стенокардія) з поступовим розвитком виразок слизової оболонки, шлунково-кишкових кровотеч і перфорації кишечнику. Гострий тромбоз та інфаркт кишечнику, як правило, асоціюються з наявністю АФЛ АТ (X.P. Tian, X. Zhang, 2010).
Панкреатит є рідкісним, але небезпечним для життя ускладненням СЧВ, який виникає у 0,7-4% пацієнтів (A. Makol, M. Petri, 2010). Варто зазначити, що у 30,5% пацієнтів виявляється безсимптомне підвищення рівня амілази в сироватці крові. Частота розвитку гепатомегалії у пацієнтів з СЧВ становить 12-25%. Часто під час проведення ультразвукового дослідження (УЗД) виявляється стеатоз, що може бути як проявом активності захворювання, так і наслідком терапії ГК. Підвищення рівня печінкових ферментів (аланінамінотрансферази – АЛТ, аспартатамінотрансферази – АСТ, лактатдегідрогенази, лужної фосфатази – ЛФ) реєструється при люпус-гепатиті або під час лікування НПЗП. Вовчаковий гепатит розвивається рідко, і головною його відмінністю від аутоімунного гепатиту є серологічні дані: відсутність антимітохондріальних АТ, АТ до непосмугованих м’язів і наявність антирибосомальних АТ (АНФ виявляється при обох патологіях). Не варто забувати про можливість реактивації вірусних гепатитів В і С на тлі імуносупресивної терапії СЧВ.
Гематологічні порушення та ураження ретикулоендотеліальної системи
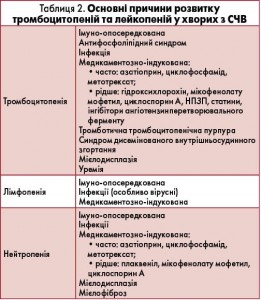
Цитопенія (анемія, лейкопенія, лімфопенія, тромбоцитопенія) – типова ознака СЧВ і може бути його першим проявом. Анемія спостерігається у половини пацієнтів з СЧВ. Найпоширенішими патогенетичними варіантами її розвитку є анемія хронічного захворювання, залізодефіцитна анемія, аутоімунна гемолітична анемія, анемія при хронічній нирковій недостатності і циклофосфамід-індукована мієлотоксичність (S. Giannouli et al., 2006) (табл. 1).
Активність захворювання відображає Кумбс-позитивна гемолітична анемія з ретикулоцитозом, яка зазвичай поєднується з іншими цитопеніями. Аутоімунна гемолітична анемія виявляється у 10% пацієнтів. Слід зазначити, що у хворих з СЧВ проба Кумбса може бути позитивною без явних ознак гемолізу.
Лейкопенія є типовою для СЧВ, може бути його раннім симптомом і, як правило, асоціюється з активністю захворювання. Вона може бути єдиним проявом хвороби протягом тривалого часу, персистуючи за типом «айсберга». За даними епідеміологічних досліджень, лімфопенія виникає у 20-81% пацієнтів, нейтропенія – приблизно у 47%, тромбоцитопенія – у 7-30% хворих з СЧВ (А. Hepburn et al., 2010). Тромбоцитопенія при СЧВ часто асоціюється з гемолітичною анемією, іншими цитопеніями й антифосфоліпідним синдромом. Посилене руйнування тромбоцитів, пов’язане з наявністю антитромбоцитарних АТ, є основною ланкою патогенезу тромбоцитопенії у пацієнтів з СЧВ (табл. 2).
Збільшення лімфатичних вузлів спостерігається приблизно у 40% пацієнтів, як правило, на початку захворювання або під час загострень. Лімфатичні вузли зазвичай м’які, безболісні, не спаяні з оточуючими тканинами і пропальповуються в шийних, аксілярних і пахових ділянках. Пацієнти з лімфаденопатією найчастіше мають конституційні симптоми. Спленомегалія виявляється у 10-45% хворих, особливо в період активного захворювання, і не обов’язково пов’язана з розвитком цитопеній.
Ураження нирок
Люпус-нефрит – характерна риса СЧВ, яка виникає у 60% пацієнтів і за відсутності адекватної терапії може призводити до смерті. Клінічний перебіг уражень нирок у хворих з СЧВ характеризується розмаїттям проявів – від безсимптомної протеїнурії/мікрогематурії до швидко прогресуючої ниркової недостатності. Люпус-нефрит у дебюті СЧВ виникає у 25% пацієнтів і є прогностично несприятливим фактором. У більшості випадків ураження нирок розвивається протягом перших 3 років після встановлення діагнозу СЧВ. Проте у 5% хворих, особливо у чоловіків, старших 40 років, ознаки люпус-нефриту можуть розвиватися за декілька років до виникнення інших клінічних проявів СЧВ (C. Molino et al., 2009). Більш тяжкий перебіг вовчакового нефриту спостерігається зазвичай у пацієнтів молодого віку. Перебіг люпус-нефриту може ускладнюватися виникненням пієлонефриту, циклофосфамід-індукованого геморагічного циститу, НПЗП-індукованої нефропатії. Розвиток амілоїдозу при СЧВ вважається казуїстикою.
Люпус-нефрит може мати безсимптомний перебіг. Інколи пацієнти скаржаться на появу олігурії, набряків, головного болю, рідше – макроскопічної гематурії. Основними фізикальними проявами уражень нирок є виникнення набряків і підвищення артеріального тиску. Зміни в аналізах сечі (лейкоцитурія, макро-/мікрогематурія, циліндрурія, протеїнурія різного ступеня) та ознаки ниркової недостатності (підвищення рівня сироваткового креатиніну і зниження кліренсу креатиніну) – характерні лабораторні прояви вовчакового нефриту. Наявність будь-якої з ознак ураження нирок, зокрема протеїнурії ≥0,5 г/добу з гематурією та/або циліндрурією є показанням до проведення біопсії нирок. Встановлено взаємозв’язок між особливостями морфологічної картини нефриту і його клінічними проявами, характером перебігу та прогнозом (G. Мoroni et al., 2013) (табл. 3).
Незважаючи на лікування цитостатиками та ГК, у 11-33% пацієнтів з дифузним проліферативним люпус-нефритом упродовж 5 років розвивається термінальна стадія хронічної хвороби нирок (ХХН) (C.C. Mok et al., 2013). Прогностично несприятливі фактори ризику розвитку термінальної стадії ХХН у пацієнтів з люпус-нефритом можна розподілити на ниркові та позаниркові (C. Molino et al., 2009) (табл. 4).
За даними дослідження G. Moroni і співавт. (2013), предикторами розвитку термінальної стадії ХХН протягом 20 років є чоловіча стать, високий рівень креатиніну, низький гематокрит, високий індекс хронічних змін за даними біопсії, відсутність пульс-терапії метилпреднізолоном, неможливість досягнути повної ремісії та наявність рецидивів люпус-нефриту. Упродовж останніх років значну роль у прогресуванні ниркової недостатності відводять неімунологічним факторам, таким як артеріальна гіпертензія (АГ), гіперхолестеринемія, цукровий діабет, ожиріння, куріння тощо.
Нейропсихіатричні прояви СЧВ
До нейропсихіатричних проявів СЧВ належать неврологічні синдроми ураження центральної, периферичної і вегетативної нервової системи та психічні синдроми, за умови виключення інших причин (інфекції, прийом медикаментів, метаболічні порушення). За даними метааналізу А. Unterman і співавт. (2011), поширеність нейропсихіатричних проявів у пацієнтів з СЧВ становить 56,3%, а найчастішими проявами є головний біль (28%), розлади настрою (20%), когнітивні дисфункції (20%), судоми (10%) та церебральний васкуліт (8%). Ураження нервової системи залишається однією з основних причин інвалідності та смертності серед хворих з СЧВ. Американською колегією ревматологів розроблено номенклатуру та визначення основних 19 нейропсихіатричних синдромів СЧВ (табл. 5).
У 50-60% випадків нейропсихіатричні прояви виникають протягом першого або другого року після діагностики СЧВ; приблизно 28-40% – до або під час встановлення діагнозу СЧВ. За даними італійського багатоцентрового когортного дослідження, у третини пацієнтів нейропсихіатричні прояви передували іншим симптомам СЧВ (M. Govoni et al., 2012). До факторів ризику виникнення уражень нервової системи у хворих з СЧВ належать високий індекс активності (SLEDAI) та ушкодження (SDI), постійно високий титр АФЛ АТ і наявність в анамнезі неврологічних проявів (G. Bertsias et al., 2010). Для раннього виявлення нейропсихіатричних проявів СЧВ у клінічній практиці розроблено просте анкетування (M. Mosca et al., 2011), яке містить 27 питань, що охоплюють ураження нервової системи та психічні прояви (загальна сума балів >17 свідчить про наявність нейропсихіатричних проявів СЧВ у цього пацієнта з чутливістю 92,9% і специфічністю 25,4%).
Особливості перебігу СЧВ у чоловіків
СЧВ виникає у чоловіків значно рідше і у старшому віці. Перебіг хвороби у чоловіків є тяжчим, а смертність – вищою. За даними когортного дослідження Університету Джона Хопкінса (США), у чоловіків з СЧВ частіше, ніж у жінок, спостерігається люпус-нефрит, АГ, тромбози, гематологічні та серологічні прояви (АФЛ АТ, АТ до Sm, нДНК, низький рівень комплементу), проте рідше – дерматит за типом «метелика», фотосенсибілізація, виразки в ротовій порожнині, алопеція, синдром Рейно, артралгії (Т.С. Tan et al., 2012). У дебюті захворювання у чоловіків порівняно з жінками рідше виникає артрит і частіше – серозити і дискоїдний вовчак. Особливостями суглобового синдрому є часте ураження суглобів нижніх кінцівок, а в 1/3 випадків – виявлення асиметричного сакроілеїту.
Особливості перебігу СЧВ із пізнім дебютом
Пізнім дебютом СЧВ вважається поява перших симптомів захворювання після досягнення 50-річного віку. Для цієї категорії пацієнтів характерним є повільно прогресуючий перебіг із низькою активністю захворювання. У хворих з СЧВ із пізнім дебютом рідше виникає артрит, дерматит за типом «метелика», фотосенсибілізація і нефрит. Проте частота міозиту значно перевищує таку у пацієнтів молодшого віку. Варто зазначити, що в осіб, старших 50 років, спостерігається «зумовлена віком серореактивність», тому потрібно з обережністю інтерпретувати імунологічні показники, особливо їх помірні титри. За даними метааналізу J. Boddaert і співавт. (2004), частота серозитів та ураження легень значно вища у популяції хворих з пізнім дебютом, проте рідше виникають артрит, дерматит за типом «метелика», фотосенсибілізація, алопеція, синдром Рейно, лімфаденопатія, нефрит та ураження нервової системи.
Вагітність у хворих на СЧВ
Вплив вагітності на розвиток загострень СЧВ залишається найбільш дискутабельним питанням. Активність СЧВ може підвищуватися під час вагітності та в післяпологовому періоді. Частота загострень у пацієнток з СЧВ під час вагітності коливається в широких межах (13,5-65% випадків). Для визначення впливу вагітності на частоту загострень СЧВ було проведено сім проспективних порівняльних досліджень (M.D. Lockshin et al., 1984; G. Mintz et al., 1986; M. Petri et al., 1991; K.L Wong et al., 1991; M.B. Urowitz et al., 1993; G. Ruiz-Irastorza et al., 1996; A. Tandon et al., 2004). Результати чотирьох з цих досліджень не продемонстрували збільшення частоти загострень, тоді як дані трьох інших таку закономірність підтвердили. Ця неоднозначність відображає неоднорідність досліджуваних когорт і відсутність єдиних критеріїв визначення загострення СЧВ. Крім того, деякі симптоми та лабораторні дані у жінок з фізіологічним перебігом вагітності можуть імітувати ознаки СЧВ, що ускладнює діагностику загострення СЧВ під час вагітності (G. Stojan, A. Baer, 2012) (табл. 6).
Проспективні дослідження останніх років з використанням валідних методів визначення активності захворювання продемонстрували зростання у 2-3 рази активності СЧВ під час вагітності. При активації СЧВ під час вагітності або в післяпологовому періоді найчастіше виникають шкірні, суглобові, гематологічні та ниркові прояви. Активність захворювання у момент зачаття є сильним предиктором наступних загострень та збереження високої активності впродовж усієї вагітності (D.D. Gladman et al., 2010), а наявність люпус-нефриту у 2-3 рази підвищує ризик розвитку загострення, включаючи прогресування уражень нирок (M.A. Saavedra et al., 2012).
Вагітність у пацієнток з СЧВ асоціюється з вищим ризиком виникнення ускладнень порівняно з вагітністю у здорових жінок. Національне американське дослідження за участю 13 555 вагітних з СЧВ продемонструвало збільшення материнської смертності у 20 разів, підвищення ризику материнської захворюваності, у тому числі кесаревого розтину (відношення шансів 1,7) і передчасних пологів (ВШ 2,4). Ризики розвитку інших серйозних ускладнень, таких як прееклампсія, АГ, кровотечі та тяжкі інфекції, також підвищились у 2-8 разів (M.E. Clowse et al., 2008). Ці ризики зростають з віком матері. За даними метааналізу 29 обсерваційних досліджень 2751 вагітності, у пацієнток з СЧВ частота передчасних пологів становила 39,4%, мимовільного аборту – 16%, затримки внутрішньоутробного росту – 12,7%, мертвонародження – 3,6% і неонатальної смертності – 2,5% (A. Smyth et al., 2010). До основних причин невиношування вагітності належать висока активність СЧВ протягом 6 міс до зачаття, висока активність СЧВ під час вагітності, дебют СЧВ під час вагітності, вторинний антифосфоліпідний синдром, наявність гіпокомплементемії, АТ до нДНК, тромбоцитопенії, АГ, захворювань нирок в анамнезі і протеїнурії в першому триместрі вагітності (G. Stojan, A. Baer, 2012). Прееклампсія виникає у 16-30% пацієнток з СЧВ порівняно з 5-7% у здорових жінок. До предикторів розвитку прееклампсії належать наявність в анамнезі люпус-нефриту, наявність антифосфоліпідних АТ, АГ, тромбоцитопенії і зниження рівня комплементу в другій половині вагітності.
Неонатальний вовчак – це клінічні прояви пасивної аутоімунної реакції у плода. З 16-го тижня гестації материнські АТ анти-Ro/SS-A або анти-La/SS-B мають здатність проникати через плаценту і призводити до розвитку повних і неповних блокад серця, транзиторних фоточутливих висипань, печінкових, гематологічних і неврологічних проявів у новонароджених. Неонатальні висипання спостерігаються у 10-25% новонароджених з неонатальним вовчаком, гематологічні зміни (тромбоцитопенія, нейтропенія) та асимптомне підвищення рівня печінкових ферментів – у 10-15% випадків, і зазвичай регресують до 6-8 міс в міру руйнувань материнських АТ (E. Silverman, E. Jaeggi, 2010). Неонатальний вовчак може розвинутися за відсутності симптомів у матерів, у яких перші клінічні прояви СЧВ виникають через декілька років після пологів. Вроджена атріовентрикулярна блокада – найпоширеніший кардіологічний прояв неонатального вовчака, який спостерігається у 2% дітей, народжених від матерів, позитивних за АТ до Ro/SS-A або La/SS-B. У жінок із гіпотиреозом ризик виникнення вроджених блокад серця плода підвищений порівняно з жінками з нормальною функцією щитоподібної залози (A. Lateef, M. Petri, 2012). Вроджена повна атріовентрикулярна блокада асоціюється з високим рівнем смертності (неонатальна виживаність становить близько 80%) та потребує імплантації кардіостимулятора (D. Hutter et al., 2010). Діагностується вроджена блокада серця на основі виявлення брадикардії у плода. Призначення фторвмісних ГК є ефективним для реверсії неповних блокад, але не впливає на повну атріовентрикулярну блокаду.
Діагностика
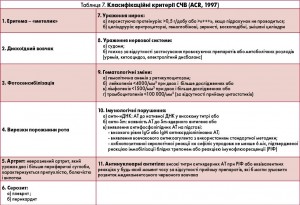
Діагностика СЧВ базується на сукупності клінічних та лабораторних даних, включаючи імунологічні показники (АНФ, АТ до нДНК, АТ до Sm-антигена та інші). В Україні для встановлення діагнозу СЧВ використовуються класифікаційні критерії СЧВ, запропоновані Американською колегією ревматологів у 1997 р. (табл. 7).
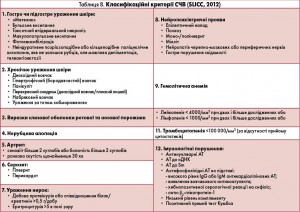
Для встановлення діагнозу СЧВ необхідна наявність 4 з 11 критеріїв. Недоліком зазначених критеріїв є те, що всі 4 критерії можуть бути клінічними, а імунологічні дані – відсутні, або навпаки. У 2012 р. групою експертів з Північної Америки, Європи та Південної Кореї – Systemic Lupus International Collaborating Clinics (SLICC) – запропоновано нові критерії для встановлення діагнозу СЧВ (табл. 8).
Для встановлення діагнозу СЧВ згідно з критеріями SLICC (2012) необхідними є наявність щонайменше 4 критеріїв (один клінічний та один імунологічний) чи наявність підтвердженого біопсією нефриту в поєднанні з позитивністю за антинуклеарними АТ або АТ до нДНК. Клінічні критерії SLICC (2012) значно розширені: деталізовано дерматологічні прояви й ураження нервової системи (моно-/поліневрит, мієліт, нейропатія черепно-мозкових або периферичних нервів, гостре порушення свідомості), додано алопецію. До лабораторних критеріїв включено низький рівень комплементу та позитивний прямий тест Кумбса. Під час порівняння валідності критеріїв ACR та SLICC виявлено, що критерії SLICC (2012) мають вищу чутливість (97 і 83% відповідно), але нижчу специфічність (84 проти 96% відповідно) (M. Petri et al., 2012).
Згідно з рекомендаціями EULAR 2010 р. (M. Mosca et al., 2010) стандартне обстеження пацієнта з СЧВ має передбачати:
- оцінку активності захворювання з використанням будь-яких валідизованих індексів (SLEDAI, SLEDAI-2K, SLAM-R, ECLAM, LAI, BILAG) під час кожного візиту до лікаря;
- оцінку тяжкості пошкодження органів (SLICС/ACR Damage Index) щорічно;
- оцінку якості життя пацієнта під час кожного візиту до лікаря (візуальна аналогова шкала);
- оцінку наявності супутніх захворювань;
- виявлення побічних дій лікарських засобів.
Протягом останніх років для оцінки активності захворювання наполегливо рекомендується використовувати індекси SLEDAI, BILAG та їх модифікації як найбільш чутливі методи виявлення загострень (SELENA FLARE INDEX) та ремісії, а також відповіді на лікування. Однак ці індекси є досить об’ємними, і їх визначення потребує чимало часу, тому в реальній практиці вони застосовуються переважно в рамках контрольованих клінічних досліджень, а в практичній діяльності лікарі уникають їх використання. Наприклад, шкала SELENA-SLEDAI містить 24 параметри (16 клінічних та 8 лабораторних показників), кожному з яких необхідно присвоїти певну кількість балів (від 1 до 8) залежно від їх клінічної значущості. Індекс активності СЧВ BILAG містить перелік 97 ознак СЧВ, розподілених на 9 систем, і спеціальний термінологічний словник. Тому на сьогодні здійснюються спроби розробити спрощені, більш лаконічні індекси для моніторингу перебігу СЧВ.
Важливим аспектом під час оцінювання стану пацієнта, прогнозу та вибору тактики лікування є визначення наявності незворотних ушкоджень органів протягом усього періоду перебігу захворювання. З цією метою використовують індекс ушкодження при СЧВ SLICC/ACR DAMAGE INDEX, який містить ознаки пошкодження 12 систем, наявних у хворого упродовж не менше 6 міс, і відображається в балах. Цього індексу також стосуються вищезазначені критичні зауваження.
Лабораторні дані. Підвищення ШОЕ – часта ознака СЧВ, проте вона не відображає активність захворювання і може свідчити про приєднання вторинної інфекції. Особливо часто дисоціація між активністю СЧВ і ШОЕ зустрічається при люпус-ураженні центральної нервової системи та нирок. У пацієнтів з СЧВ діагностичне значення рівня СРБ залишається суперечливим питанням. Раніше постулювалося, що рівень СРБ є або нормальним, або незначно підвищеним у хворих з активним СЧВ, а при його рівні >50 мг/л необхідно насамперед виключити наявність супутнього інфекційного процесу. Проте в дослідженнях, проведених упродовж останніх років, у яких використовували високочутливі методики оцінки концентрації СРБ (визначають рівень СРБ до 0,3 мг/л), отримано неоднозначні результати. Так, у дослідженні Z. Rezaieyazdi і співавт. (2011) кореляція між СРБ та активністю захворювання за SLEDAI, сироватковими рівнями АТ до нДНК, лейкопенією, тромбоцитопенією, анемією і протеїнурією була відсутньою, хоча рівень СРБ у всіх пацієнтів був вищим порівняно зі здоровими особами. Водночас, за даними С. Mok і співавт. (2013), існує сильна кореляція між СРБ і гематологічними змінами, ураженням опорно-рухового апарату, серозних оболонок та індексом SLEDAI, однак залежності між рівнем СРБ й ураженням нирок, шкіри та нервової системи не було виявлено.
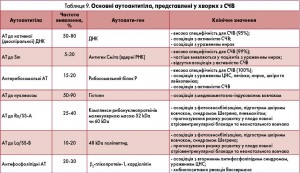
Імунологічні зміни. АНА або АНФ – це гетерогенна група АТ, які реагують з різноманітними компонентами ядра. АНФ виявляють у 95% пацієнтів з СЧВ, проте його специфічність є досить низькою, оскільки позитивний АНФ спостерігається у хворих із системною склеродермією, поліміозитом, дерматоміозитом, РА, аутоімунним тиреоїдитом, аутоімунним гепатитом, інфекціями, злоякісними новоутвореннями та під час прийому деяких медикаментів. У частини здорових осіб також виявляється АНФ (10-35% осіб віком >65 років позитивні за АНФ), проте низькі титри (1:40). Золотим стандартом для виявлення АНФ є метод непрямої імунофлюоресценції, за результатами якого встановлюється не лише титр АТ, а і його патерн світіння (характерним для СЧВ є крайовий тип світіння). Також для визначення АНФ використовують метод імуноферментного аналізу (для первинного скринінгу системних захворювань сполучної тканини), імуноблотингу, імунодифузії та інші. Описано випадки СЧВ, негативного за АНФ, проте, як правило, вони асоційовані з аутоантитілами до цитоплазматичних аутоантигенів, таких як Ro/SS-A, та антирибосомального білка Р.
Спектр основних аутоантитіл, які виявляються у пацієнтів з СЧВ, та їх діагностичне значення наведено в таблиці 9.
Зниження загальної активності комплементу СH50 і С3, С4 корелює з активністю СЧВ і тому входить до індексу SLEDAI. Визначення рівня С1q використовують у клінічній практиці рідше, але він має важливе значення для моніторингу перебігу люпус-нефриту (J. Leffler et al., 2014).
Прогноз
За даними метааналізу A. Mak і співавт. (2012), за 50-річний період (1950-2000 рр.) загальний прогноз пацієнтів з СЧВ значно покращився: 5-річна виживаність зросла із 75 до 95%, а 10-річна – з 63 до 91%. Проте зростання виживаності досягло плато, і за останні 2 десятиліття істотних змін у показниках виживаності хворих не реєстрували. Пацієнти з СЧВ і надалі мають високий ризик смерті (утричі вищий, ніж у загальній популяції). Ураження нирок і нервової системи належать до факторів, які негативно впливають на виживаність хворих із СЧВ. Причини смерті пацієнтів з СЧВ розподіляються на ті, які пов’язані з активністю захворювання, ті, які є результатом лікування, та коморбідні стани. Висока активність СЧВ, інфекції, серцево-судинні події та злоякісні новоутворення – найпоширеніші причини смерті серед хворих з СЧВ (М. Abu-Shakra, V. Novack, 2012). Для СЧВ характерним є бімодальний розподіл смертності: рання (протягом перших 5 років), спричинена активністю СЧВ та інфекційними ускладненнями, та пізня (через 5-10 років від дебюту захворювання), зумовлена переважно серцево-судинними подіями. До факторів, які визначають несприятливий життєвий прогноз при СЧВ, належать негроїдна раса, низький соціально-економічний рівень життя, ураження нирок, антифосфоліпідний синдром, тромбоцитопенія, високі індекси SLEDAI, SLICC тощо. Основою покращення прогнозу при СЧВ є рання діагностика, інтенсифікація базисної терапії та мінімізація доз ГК, активне призначення ГХ, контроль побічних ефектів ГК та імуносупресорів, використання імунобіологічних препаратів, оцінка серцево-судинного ризику та лікування серцево-судинних захворювань. Один із важливих резервів покращення прогнозу при СЧВ в Україні – підвищення частоти застосування гідроксихлорохіну (ГХ). Згідно з результатами проведеного епідеміологічного дослідження (Lupus Science & Medicine, 2015) в Україні у 2010 році ГХ отримували лише 38% пацієнтів з СЧВ (для порівняння: у Росії – 40,8%, у Казахстані – 18,3%), що щонайменше удвічі менше порівняно з європейськими показниками.