19 січня, 2017
Паллиативная химиотерапия рака шейки матки: надежда или путь в никуда?

Не искавшему путь вряд ли путь и укажут.
Постучись – и откроются двери к судьбе!
Омар Хайям
Несмотря на возросшие возможности современной онкологии, более половины больных злокачественными опухолями обречены погибнуть от прогрессирования заболевания. В Украине ежегодно в получении паллиативной помощи нуждаются до 500 тыс. людей, эта проблема крайне актуальна и требует поиска путей решения. Паллиативная помощь – это дело для тех, кто постиг смысл человеческой жизни и полностью состоялся как личность.
Рак шейки матки (РШМ) относится к наиболее распространенным формам злокачественных новообразований женских половых органов. В настоящее время РШМ является одной из нерешенных проблем современной онкологии. Ежегодно в мире регистрируется около 500 тыс. случаев РШМ, что составляет 5% всех онкологических заболеваний. Наивысшая заболеваемость РШМ отмечена в развивающихся странах. В последние годы четко прослеживается увеличение заболеваемости РШМ у молодых женщин до 40 лет. На момент первичной диагностики у 40-46% больных РШМ обнаруживается в III-IV стадии заболевания с прогнозируемой 5-летней выживаемостью 11-13%. Средняя продолжительность жизни в данном случае составляет до 7 мес.
Анализ результатов многоцентровых рандомизированных клинических исследований показал, что 30-45% больных РШМ умирают в течение 5 лет в связи с прогрессированием основного заболевания. Причиной смерти в таком случае является развитие местного рецидива или отдаленных метастазов. По данным литературы, у 35% больных РШМ III‑IV стадии в течение 2 лет после хирургического и лучевого лечения возникают рецидивы заболевания. Прогноз у таких больных неблагоприятный: до 1 года после развития рецидива доживают только 10-15% больных, а при назначении только симптоматического лечения продолжительность жизни измеряется месяцами.
На сегодняшний день в мире нет единого мнения о ведении пациенток с распространенным РШМ. Существующие стандарты предлагают использование паллиативной химиотерапии до развития непереносимой токсичности или назначение только симптоматической терапии. Будет ли целесообразно назначать дорогостоящие цитостатики II-III линии пациентке с распространенным РШМ? Или же лучше обеспечить удовлетворительное качество жизни путем проведения адекватной симптоматической терапии? Вопросы подобного рода всегда возникают у врача-онколога, онкогинеколога, химиотерапевта, сталкивающегося в своей повседневной практике с необходимостью отработки дальнейшей тактики ведения пациентки с распространенным РШМ. В связи с чем целью проведенной нами совместной работы была оценка целесообразности, пользы и значения паллиативной химиотерапии распространенного РШМ в сравнении с только симптоматической терапией.
По определению ВОЗ (2002), паллиативная помощь – это подход, позволяющий улучшить качество жизни пациентов, столкнувшихся с проблемой смертельного заболевания, путем предотвращения и облегчения страданий благодаря проведению адекватных лечебных вмешательств. Американское общество клинической онкологии (ASCO) определяет паллиативную помощь, как «интеграцию в онкологическую помощь процедуры, которая способствует устранению многочисленных проблем, причиняющих страдания пациентам и их семьям, и улучшению качества их жизни». В отличие от хосписной симптоматической помощи, которая назначается только больным с прогнозируемой выживаемостью <6 мес, паллиативная помощь, в том числе контроль за проявлением симптомов заболевания, может и должна быть предложена с момента установления диагноза и до самой смерти. Национальная онкологическая сеть США (NCCN) руководствуется принципом «паллиативная помощь назначается одновременно с противоопухолевым лечением, терапией, продлевающей жизнь».
В недавно опубликованных рекомендациях Общества онкогинекологов указано, что «для женщин с распространенным или рецидивирующим раком органов малого таза предоставление базового уровня паллиативной помощи нельзя откладывать».
В 2012 г. ASCO выпустило новую клиническую рекомендацию под названием «Интеграция паллиативной помощи в стандарты оказания онкологической помощи», посвященную изучению комбинирования стандарта онкологической помощи и паллиативной медицинской помощи «на ранних стадиях болезни для любого пациента с метастатическим раком».
Паллиативная помощь призвана повысить качество жизни пациента, невзирая на предполагаемую небольшую продолжительность жизни. Главный принцип – от какого бы заболевания пациент ни страдал, каким бы тяжелым это заболевание ни было, какие бы средства ни были использованы для его лечения, всегда можно найти способ повысить качество жизни больного в оставшиеся дни. Если нет возможности остановить прогрессирование основного заболевания, нельзя говорить пациенту, что «больше ничего нельзя сделать». Это никогда не бывает абсолютной истиной и может выглядеть как отказ от оказания помощи. В такой ситуации больному можно предоставлять психологическую поддержку и контролировать патологические симптомы. Но сегодня речь пойдет не об этом.
Главной задачей паллиативной помощи является улучшение качества жизни пациента, что может положительно влиять на течение болезни. При своевременном начале проведения мероприятий и в совокупности с другими методами лечения и поддержки паллиативная помощь может продлить жизнь больного.
Основным видом лечения больных рецидивирующим и метастатическим РШМ является системная химиотерапия, которая носит в основном паллиативный характер. Причем эффективность химиотерапевтического лечения не превышает 10-35%.
Трудности лекарственного лечения рецидивирующего/метастатического РШМ связаны как со значительной резистентностью (в том числе генетической) опухолевых клеток к современным цитостатикам, так и с отсутствием высокоэффективных режимов полихимиотерапии. Одни из причин развития резистентности – повышенная активность Р-гликопротеинового насоса, который выкидывает цитостатик из опухолевых клеток в связи с экспрессией гена множественной устойчивости к лекарственным препаратам, а также детоксикация лекарственных препаратов через экспрессию гена глутатион‑5-трансферазы. Кроме того, при местных рецидивах РШМ после проведенной лучевой терапии возникают выраженные фиброзные изменения тканей с облитерацией сосудов малого таза, нарушающие транспорт цитостатиков к опухоли, что снижает эффективность лечения.
Одновременно предшествующее облучение малого таза приводит к уменьшению резервов костномозгового кроветворения, повышая вероятность токсичности химиотерапии, и в ряде случаев вызывает необходимость редукции доз цитостатиков.
История лекарственного лечения распространенного РШМ интересна современному врачу-онкологу, химиотерапевту с точки зрения ретроспективного анализа эффективности цитостатиков и пути слепого выбора лучшей схемы лечения. Постулаты по лечению РШМ не изменились и все еще остаются актуальными подходами к терапии этой непростой болезни.
Еще в 1968 г. Trelford суммировал данные клиник США о применении различных химиотерапевтических средств у больных с рецидивами и метастазами РШМ. Была отмечена низкая эффективность таких алкилирующих средств, как тиофосфамид и этимидин, а также алкалоидов – винбластина и винкристина. Их дальнейшее применение у больных РШМ было признано малообоснованным. И наоборот, назначение антиметаболитов – фторурацила и метотрексата – у части больных приводило к объективному улучшению. Более эффективными казались алкилирующие препараты – циклофосфамид и проспидия хлорид.
Применение противоопухолевых антибиотиков началось с конца 1970-х, в частности, определенные надежды возлагались на блеомицин, адриамицин, митомицин. Существенным прорывом в лечении больных онкогинекологической группы (США) стал опыт применения Di Saia, Croasman (1984) цисплатина.
Новым развивающимся направлением конца 1980-х стало усовершенствование методов регионарной химиотерапии – внутриартериальной (А. Крищюпас, 1981) и эндолимфатической (Е.Г. Ильинская, 1986), предприняты первые попытки иммунотерапии.
В 1990-х при распространенном РШМ стало возможным использование комбинаций цисплатина с иринотеканом, винорельбином, гемцитабином, топотеканом, паклитакселом, обеспечивающих в среднем 11% полных и 27% частичных регрессий с медианой времени до прогрессирования 12 мес, медианой общей выживаемости – 9 мес.
 В последующих клинических исследованиях была показана сопоставимая эффективность комбинации иринотекан+цисплатин — иринотекан+карбоплатин. Так, наилучшие результаты применения схемы иринотекан+цисплатин были получены в исследовании T. Sugiyama et al., где общая эффективность составила 59%, полная регрессия опухоли была достигнута у 2 больных (7%), частичная регрессия – у 15 больных (52%), что статистически достоверно выше, чем при использовании только цисплатина (общая эффективность равна 15-23%; р<0,01).
В последующих клинических исследованиях была показана сопоставимая эффективность комбинации иринотекан+цисплатин — иринотекан+карбоплатин. Так, наилучшие результаты применения схемы иринотекан+цисплатин были получены в исследовании T. Sugiyama et al., где общая эффективность составила 59%, полная регрессия опухоли была достигнута у 2 больных (7%), частичная регрессия – у 15 больных (52%), что статистически достоверно выше, чем при использовании только цисплатина (общая эффективность равна 15-23%; р<0,01).
В результате другого клинического исследования впервые показана низкая эффективность второй линии химиотерапии распространенного РШМ с использованием комбинации гемцитабин+капецитабин. В связи с этим дальнейшее применение указанной схемы лечения признано нецелесообразным (Одинцова А.С., 2011).
Неоспорим тот факт, что хирургическое лечение при РШМ является основным прогностическим фактором, определяющим дальнейшее течение заболевания. Однако основной составляющей борьбы с тяжелым недугом является системная цитостатическая терапия.
Поэтому перед химиотерапевтами стоит стратегически важная задача распланировать лечение максимально длительно на весь период болезни пациентки, в течение которого она будет способна получать химиотерапию.
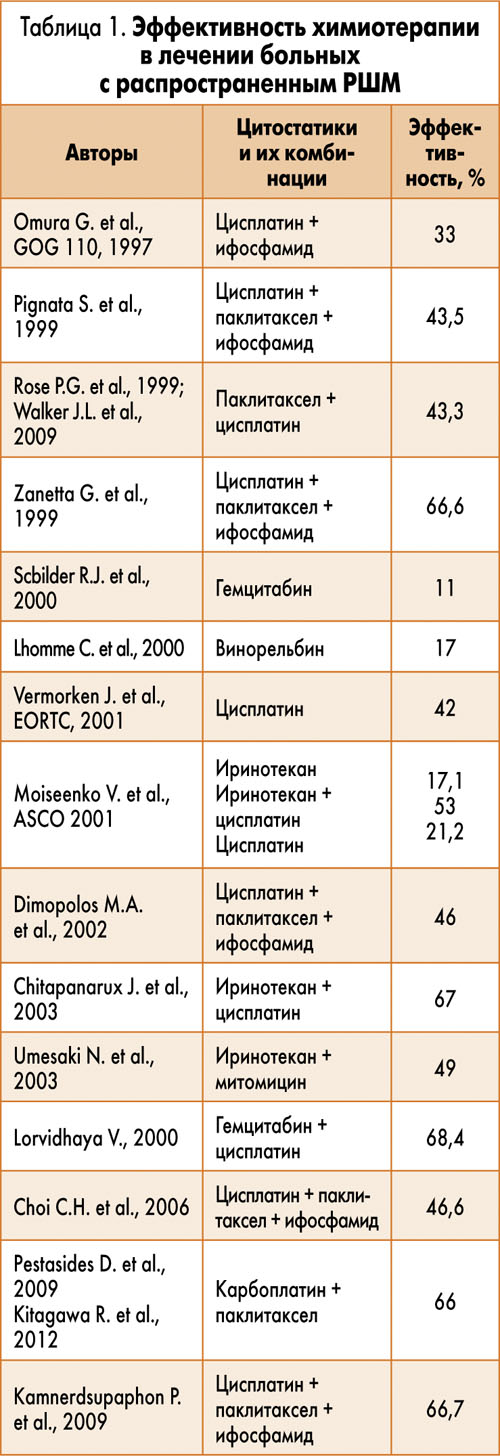
За последние несколько десятилетий с появлением новых цитостатиков показатели эффективности лечения и медиана продолжительности жизни больных РШМ значительно возросли (табл. 1).
Увеличение числа больных с распространенными стадиями заболевания вызывает необходимость изучения возможности внедрения в клиническую практику противоопухолевых лекарственных препаратов и их сочетания с уже существующими стандартными методами лечения.
Прошедший 2014 г. дал достаточно оснований для изменения тактики лечения больных с распространенным РШМ благодаря регистрации новых лекарственных препаратов и открытию новых перспектив для применения старых лекарственных средств.
Основным достижением лечения РШМ в 2014 г. стала публикация окончательных результатов исследования GOG240 по оценке эффективности бевацизумаба и регистрации этого препарата Управлением по контролю качества пищевых продуктов и лекарственных препаратов США (FDA).
На сегодняшний день стандартной химиотерапией 1-й линии метастатического РШМ и рецидивов заболевания после локальных методов лечения является комбинация бевацизумаба, цисплатина и паклитаксела.
По итогам исследования GOG240 эта комбинация оказалась лучше с точки зрения продолжительности жизни. «Выводы данного клинического исследования важны, поскольку могут изменить клиническую практику и дают возможность улучшить исход у пациенток с рецидивирующим РШМ, которые ранее имели очень ограниченные варианты лечения», – сообщил руководитель проекта Кришнансу Тевари.
 В рамках исследования GOG240 суммарно 452 больных с рецидивирующим или метастатическим РШМ рандомизировались в одну из четырех групп химиотерапии 1-й линии: паклитаксел+цисплатин±бевацизумаб или топотекан+паклитаксел±бевацизумаб.
В рамках исследования GOG240 суммарно 452 больных с рецидивирующим или метастатическим РШМ рандомизировались в одну из четырех групп химиотерапии 1-й линии: паклитаксел+цисплатин±бевацизумаб или топотекан+паклитаксел±бевацизумаб.
Исследование отвечало на два вопроса: 1) есть ли польза от добавления бевацизумаба к химиотерапии и 2) можно ли отказаться от цисплатина и использовать бесплатиновые режимы химиотерапии с учетом того, что большинство больных получали цисплатин ранее в качестве радиосенсибилизатора на фоне лучевой терапии и опухоли могут быть к нему резистентны.
Исследование продемонстрировало примерно равную пользу при добавлении бевацизумаба к комбинациям цисплатина с паклитакселом и топотекана с паклитакселом (табл. 2).
Сравнительный анализ режимов химиотерапии с бевацизумабом или без него показал, что комбинация на основе цисплатина немного выигрывает по сравнению с бесплатиновой (медианы продолжительности жизни – 15 и 12,5 мес соответственно), однако различия статистически не значимы (р=0,88). Данная тенденция сохранялась и в случае, если больные ранее получали цисплатин как радиосенсибилизатор при проведении лучевой терапии.
Исследование продемонстрировало, что добавление бевацизумаба к химиотерапии приводит к статистически значимому увеличению продолжительности жизни больных: медиана увеличивалась с 13,3 до 17 мес за счет добавления бевацизумаба. Польза от бевацизумаба не зависела от режима химиотерапии.
Результаты подгруппового анализа не позволяют выявить подгруппу, получающую больше или меньше преимуществ от добавления бевацизумаба.
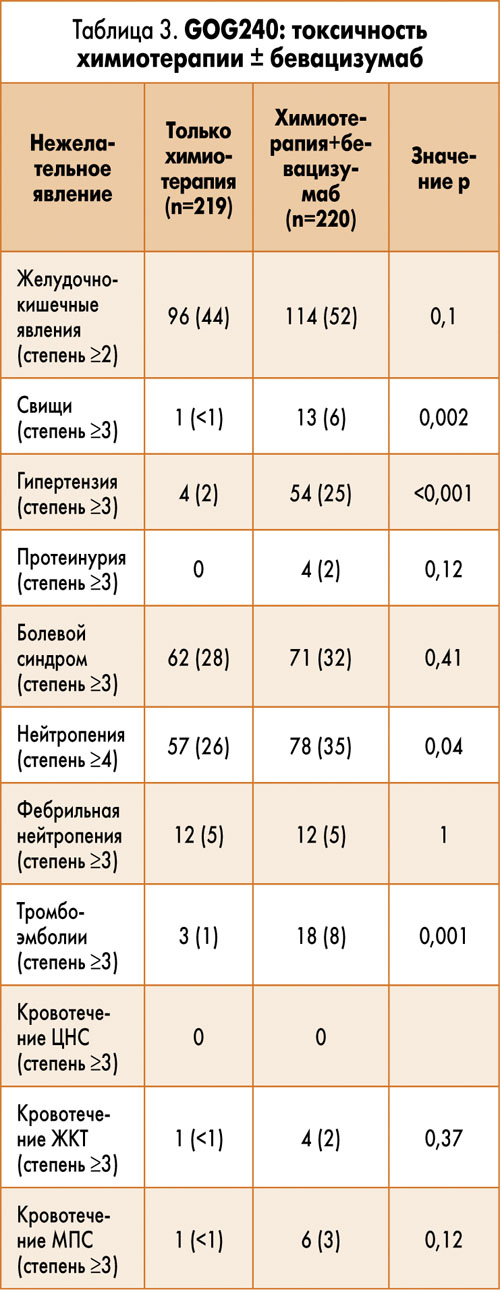 Токсичность химиотерапии с бевацизумабом оказалась удовлетворительной. Отмечено статистически значимое увеличение частоты артериальной гипертензии, тромбоэмболических осложнений, а также формирования свищей за счет добавления бевацизумаба. Частота других осложнений, в том числе кровотечений, оказалась сопоставимой (табл. 3).
Токсичность химиотерапии с бевацизумабом оказалась удовлетворительной. Отмечено статистически значимое увеличение частоты артериальной гипертензии, тромбоэмболических осложнений, а также формирования свищей за счет добавления бевацизумаба. Частота других осложнений, в том числе кровотечений, оказалась сопоставимой (табл. 3).
На основании проведенного анализа литературных данных и результатов рандомизированных исследований, посвященных лечению больных РШМ, мы также проводили паллиативное лечение больным РШМ с включением бевацизумаба в Одесском областном онкологическом диспансере (ОООД). Приведем наиболее интересный случай.
Больная В. 1978 г.р. находится под наблюдением и на лечении в ОООД с марта 2013 г. по настоящее время с диагнозом: рак шейки матки T1b2N0M0 ст. I2В, состояние после комбинированного лечения (IV.13), метастазы в легких, печени, лимфоузлах средостения, метастатический плеврит слева (V.14), состояние после полихимиотерапии (ПХТ), таргетной терапии. Клиническая группа II.
12.03.13 в отделении онкогинекологии ОООД была произведена операция – фракционно-диагностическое выскабливание слизистой оболочки полости матки и цервикального канала (ПГЗ № 8639-54: G2 аденокарцинома секреторно-папиллярного типа).
С 18.03.13 по 19.04.13 проведен курс предоперационной лучевой терапии на область малого таза, регионарные лимфоузлы и первичную опухоль, СОД т.В – 34,54 Гр, СОД т.А – 43,2 Гр, суммарная доза от двух компонентов. 24.04.13 в отделении онкогинекологии ОООД была произведена операция – нижнесрединная лапаротомия, пангистерэктомия III типа (ПГЗ № 15693-711: G2-3 аденокарцинома секреторного типа с папиллярными структурами цервикального канала, с переходом на шейку матки, с инвазией в стенку на глубину до 0,3 см протяженностью более 1 см).
В послеоперационном периоде пациентка специальное лечение не получала, так как отказалась от предложенной лучевой терапии.
В течение 1 года у больной отмечалась полная ремиссия опухолевого процесса. В мае 2014 г., по данным клинико-инструментального обследования, выявлено прогрессирование заболевания с поражением легких, лимфоузлов средостения, печени.
С учетом удовлетворительного состояния больной с целью достижения возможной стабилизации процесса и увеличения общей выживаемости с 14.05.14 ей было проведено 8 курсов лечебной ПХТ по схеме паклитаксел+карбоплатин на фоне таргетной терапии (бевацизумаб).
 Компьютерная томография в динамике была выполнена на 16-срезовом мультиспиральном томографе.
Компьютерная томография в динамике была выполнена на 16-срезовом мультиспиральном томографе.
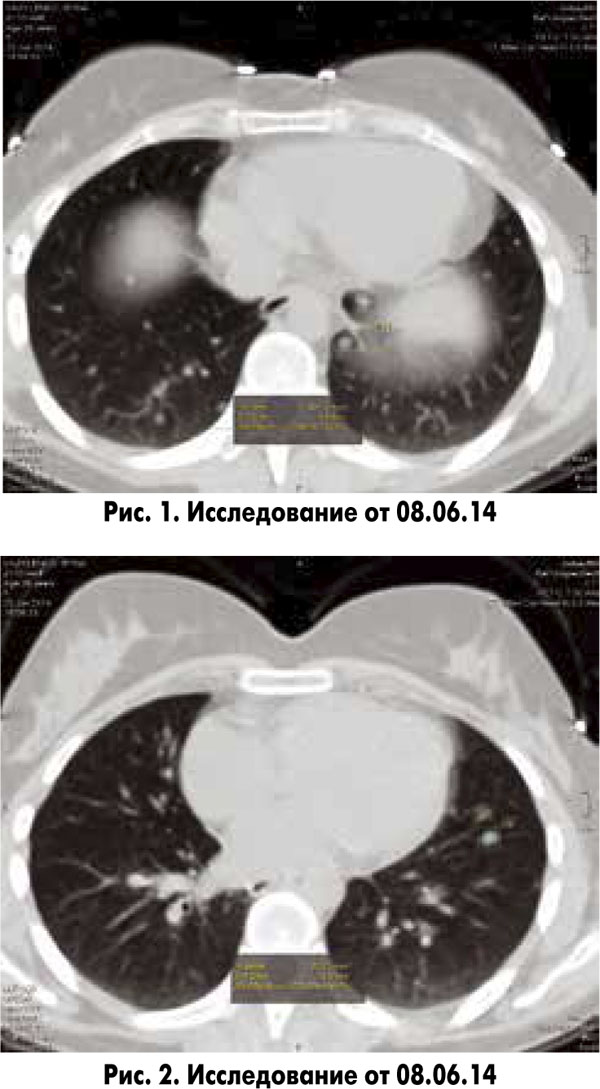
КТ ОГК от 08.06.14: в легочной паренхиме периваскулярно и субплеврально определяются множественные участки повышенной плотности округлой формы диаметром от 2 до 10 мм.
Легочный рисунок усилен преимущественно за счет интерстициального компонента. Междолевая плевра подчеркнута.
В левой плевральной полости определяется скопление неосумкованной жидкости, приблизительный объем составляет около 100 мл (рис. 1, 2).
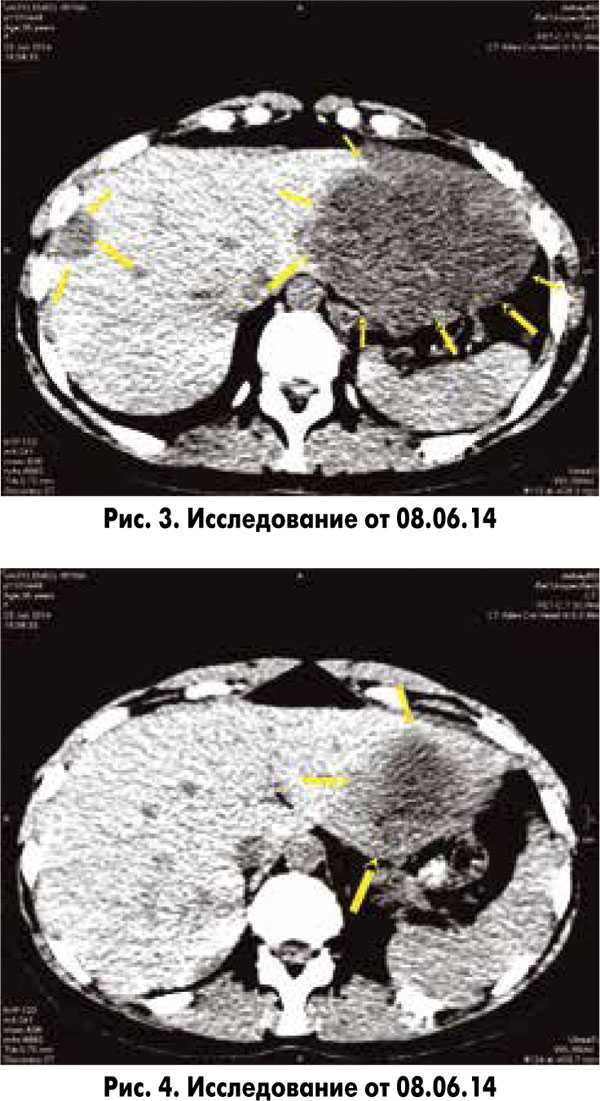
КТ ОБП от 08.06.14: печень увеличена в размерах (265×131×101 мм) за счет патологически измененной левой доли, имеет гладкие наружные контуры, нижний край закруглен.
В правой доле печени определяются множественные участки пониженной плотности, не накапливающие контрастное вещество, размерами от 5 до 34 мм диаметром.
Левая доля диффузно изменена за счет объемного образования до 137 мм диаметром, структура неоднородная (рис. 3, 4).
КТ ОГК от 02.09.14: в легочной паренхиме периваскулярно и субплеврально определяются множественные участки повышенной плотности округлой формы от 2 до 5 мм (максимальное количество очагов – до 8).
 Легочный рисунок усилен преимущественно за счет интерстициального компонента.
Легочный рисунок усилен преимущественно за счет интерстициального компонента.
Лимфоузлы средостения и корней легких не увеличены.
Диагностируемый ранее выпот в плевральной полости отсутствует.
КТ ОБП от 02.09.14: печень не увеличена, имеет гладкие наружные контуры, нижний край закруглен.
Структура печени неоднородная, в правой доле участок пониженной плотности, расположенный подкапсульно в SVII 20×11×12 мм.
Левая доля диффузно изменена за счет объемного образования до 75 мм в диаметре, структура неоднородная (ранее диагностировалось свыше 4 образований).
Выпот в брюшной полости отсутствует.
Костно-деструктивных изменений не выявлено.
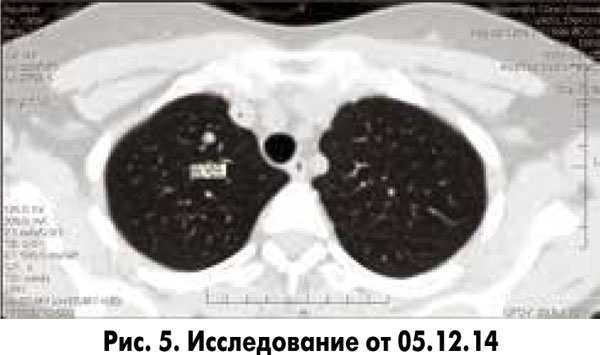
КТ ОГК от 05.12.14: в легочной паренхиме периваскулярно и субплеврально определяются множественные участки повышенной плотности округлой формы от 2 до 5 мм (динамика стабильная).
Легочный рисунок усилен преимущественно за счет интерстициального компонента. Лимфоузлы средостения и корней легких не увеличены (рис. 5).
КТ ОБП от 05.12.14: печень не увеличена, имеет гладкие наружные контуры, нижний край закруглен. Структура печени неоднородная, в правой доле участок пониженной плотности, расположенный подкапсульно в SVII 20×11×12 мм.
 Левая доля диффузно изменена за счет объемного образования до 75 мм в диаметре, структура неоднородная. Выпот в брюшной полости отсутствует. Костно-деструктивных изменений не выявлено (рис. 6, 7).
Левая доля диффузно изменена за счет объемного образования до 75 мм в диаметре, структура неоднородная. Выпот в брюшной полости отсутствует. Костно-деструктивных изменений не выявлено (рис. 6, 7).
На фоне проведенной паллиативной химио- и таргетной терапии удалось достичь значительной регрессии опухолевых очагов в легких и печени (регрессия на 45%, появление множественных кальцинатов), субъективного улучшения общего состояния больной, купирования болевого синдрома.
Качество жизни больной на фоне паллиативного лечения было удовлетворительным, с минимальным спектром токсических проявлений (тошнота и рвота умеренной степени, алопеция, сенсорная периферическая нейропатия).
Продолжительность жизни составила 12,5 мес.
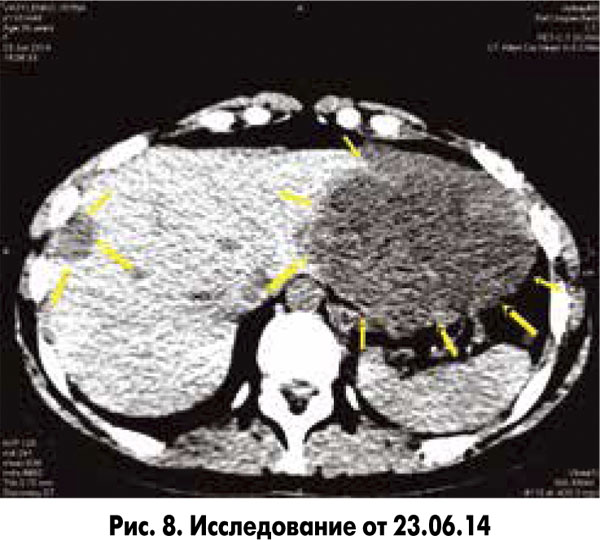
Динамика одного из измеримых очагов наглядно показывает эффективность проведенной паллиативной терапии с включением современного таргетного препарата – бевацизумаба (рис. 8).
П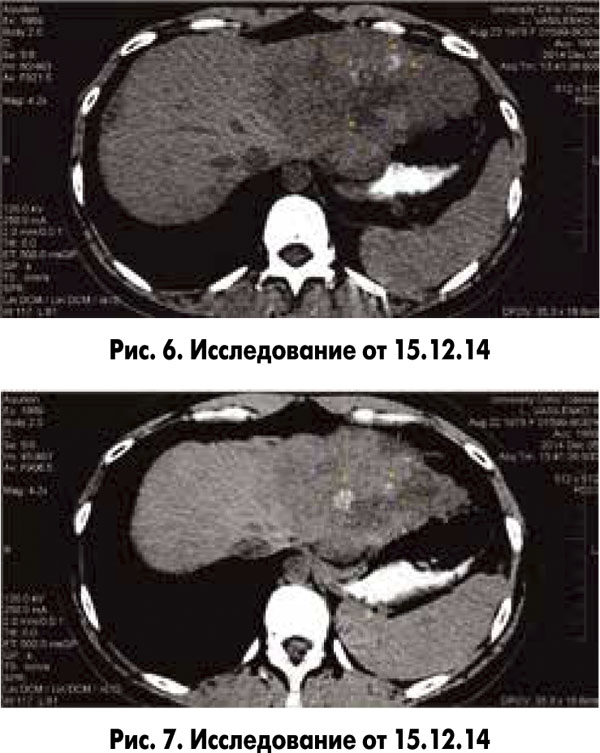 роведение паллиативной химиотерапии больным с распространенным злокачественным процессом сопряжено с высоким риском смерти в течение 30 дней после введения цитостатиков. И обусловлено это также потенцирующим действием химиотерапии, высокой токсичностью и т.д. Но мы не можем повернуть время вспять и назначать паллиативную химиотерапию только пациентам с прогнозируемым низким риском осложнений и смерти. Шанс должен быть у каждого.
роведение паллиативной химиотерапии больным с распространенным злокачественным процессом сопряжено с высоким риском смерти в течение 30 дней после введения цитостатиков. И обусловлено это также потенцирующим действием химиотерапии, высокой токсичностью и т.д. Но мы не можем повернуть время вспять и назначать паллиативную химиотерапию только пациентам с прогнозируемым низким риском осложнений и смерти. Шанс должен быть у каждого.
У 394/657 (60%) пациентов, которым были проведены курсы паллиативной химиотерапии, на момент последнего курса были зарегистрированы следующие осложнения: гипоальбуминемия (143 случая – 36%), плеврит (94 случая – 23,8%), асцит (72 случая – 18,2%), нарушение функции почек (65 случаев – 16,5%) и нарушение функции печени (65 случаев – 16,5%).
По данным Н.С. Филатовой и соавт., 2-летняя выживаемость больных с распространенным/рецидивирующим РШМ при назначении только лучевой терапии составила 29,7%, паллиативной химиотерапии – 33,3%, только симптоматической терапии – 3%.
Итак, данные литературы и международных клинических исследований свидетельствуют о том, что назначение комбинированной химиотерапии обеспечивает больший процент непосредственных результатов, улучшает качество жизни, но в большинстве случаев не повышает безрецидивную и общую выживаемость больных с распространенными формами РШМ, т.е. проблема лечения больных с рецидивами РШМ далека от успешного решения.
 Поэтому основные усилия онкогинекологов в будущем должны быть сосредоточены на активном предотвращении рецидива и определении риска его возникновения при лечении первичных больных с РШМ.
Поэтому основные усилия онкогинекологов в будущем должны быть сосредоточены на активном предотвращении рецидива и определении риска его возникновения при лечении первичных больных с РШМ.
А усилия онкологов-химиотерапевтов должны быть направлены на виртуозный выбор правильной схемы химиотерапии распространенного РШМ с учетом индивидуальных особенностей пациентки, риска развития резистентности, наличия коморбидности и т.д.
Таким образом, как и при любой другой патологии, на современном этапе развития онкологии обязательно должен иметь место индивидуализированный поход в лечении. «Ни один врач не знает такого лекарства для усталого тела и измученной души, как надежда» (С. Цвейг).
ВЫВОДЫ:
1. Считаем оправданным проведение паллиативной химиотерапии пациенткам с распространенным РШМ после индивидуального консультирования, оценки риска осложнений и токсических проявлений, тем самым следуя обязательному индивидуализированному подходу в лечении онкологических больных.
2. Считаем целесообразным добавление бевацизумаба к паллиативной химиотерапии пациенткам с распространенным РШМ, что приводит к статистически значимому увеличению продолжительности жизни больных, а также обеспечивает удовлетворительное качество жизни пациенток.
3. Главный принцип паллиативной помощи – от какого бы заболевания пациент ни страдал, каким бы тяжелым это заболевание ни было, какие средства ни были бы использованы для его лечения, всегда можно найти способ повысить качество жизни больного в оставшиеся дни. Возможность продлить жизнь пациента еще на несколько недель или месяцев, даже при условии развития токсических осложнений и наличии материальных затрат, стоит того. Жизнь человека намного дороже любых материальных ценностей. «Надежда, сопровождающая нас всю жизнь, не покидает нас даже в час смерти» (А. Поп).
Список литературы находится в редакции.
Тематичний номер «Онкологія», №4, 2016 р.


