18 січня, 2017
Генитальный кандидоз: актуальность проблемы
Rerum omnium magister usus
(«Во всех делах наставник – опыт»)
 Трудно найти иной диагноз, который столь часто встречается в медицинской документации акушеров-гинекологов и в то же время является актуальной темой для обсуждения представительницами прекрасного пола. «Ах, опять эта несносная молочница!» – восклицают многие женщины, обнаружив у себя хорошо знакомые и весьма неприятные симптомы заболевания, описанного еще отцом медицины Гиппократом. «Ничего страшного, у вас просто молочница» – успокаивают некоторые врачи. Но как говорили древние мудрецы, даже самый умный может ошибаться, и многочисленные научные исследования последних лет это наглядно подтверждают.
Трудно найти иной диагноз, который столь часто встречается в медицинской документации акушеров-гинекологов и в то же время является актуальной темой для обсуждения представительницами прекрасного пола. «Ах, опять эта несносная молочница!» – восклицают многие женщины, обнаружив у себя хорошо знакомые и весьма неприятные симптомы заболевания, описанного еще отцом медицины Гиппократом. «Ничего страшного, у вас просто молочница» – успокаивают некоторые врачи. Но как говорили древние мудрецы, даже самый умный может ошибаться, и многочисленные научные исследования последних лет это наглядно подтверждают.
Актуальность проблемы
По данным ряда авторов, около 75% женщин в течение жизни перенесли минимум один эпизод генитального кандидоза (ГК), а у половины из них заболевание часто рецидивирует, нарушая не только качество жизни, но и состояние здоровья (J.D. Sobel, 1994; F.C. Odds, 1997; Г.Р. Байрамова, 1999). У 5-8% взрослых женщин наблюдается часто рецидивирующий ГК, определяемый, как ≥4 эпизодов ежегодно (J.D. Sobel, 1994).
Наблюдаемый в последнее время рост заболеваемости (в 2 раза за последние 10 лет), во многом связанный с рядом различных внешних факторов, позволяет присвоить ГК модный нынче ярлык «болезни цивилизации».
Клинические проявления ГК общеизвестны: бели и зуд, нередко дизурические расстройства. Бели могут быть жидкими, профузными, с примесью творожисто-крошковатых включений, густыми, мазеподобными, желтого и зеленовато-белого цвета. Обычно отмечается зависимость между степенью распространенности процесса и количеством выделений из влагалища. Весьма частым симптомом ГК является зуд, особенно сильный при наличии вульвита, постоянный или беспокоящий во второй половине дня, вечером или ночью. Он обостряется после физической нагрузки и во время менструации. Зуд вызывает бессонницу и связанные с ней расстройства нервной системы.
Характерным признаком ГК являются серовато-белые налеты на слизистой оболочке влагалища и шейки матки, могут быть точечными или до 3-5 мм в диаметре. Округлые или с неправильными очертаниями они расположены изолированно или сливаются друг с другом, состоят из псевдомицелий гриба, слущившихся клеток эпителия и лейкоцитов; в острой стадии снимаются с трудом, в дальнейшем – легко. Слизистая оболочка в острой стадии ГК гиперемирована, отечна; наблюдаются явления цервицита и эктопии шейки матки. Воспалительные изменения локализуются и в области наружных гениталий, а также отмечается поражение кожи крупных складок (перианальная область и бедра). В хронической стадии указанные симптомы выражены менее значительно, слизистая оболочка обычной окраски.
Результаты некоторых исследований указывают на ненадежность самодиагностики ГК пациентками. Так, например, Ferris и соавт. (2002) обнаружили, что только у 34% женщин, которые приобрели безрецептурные противогрибковые средства для борьбы с предполагаемым ГК, действительно имелась эта инфекция.
С.С. Леуш и соавт. (2003) выделяют следующие варианты клинического течения ГК.
1. Бессимптомное носительство – Candida отмечается у 15-20% небеременных женщин репродуктивного и перименопаузального возраста, наблюдается бессимптомное течение – отсутствуют клинические признаки заболевания, в вагинальном секрете преобладают лактобациллы, а кандиды присутствуют в низком титре.
2. Истинный кандидоз – кандиды являются моновозбудителем, вызывают клинически выраженную картину вагинального кандидоза, при этом в вагинальном биоценозе присутствуют грибы рода Candida и лактобациллы в высоком титре.
3. Рецидивы ГК (5-25% пациенток) обусловлены особенностями макроорганизма и возбудителя. Однако в последнее время некоторые авторы считают рациональным рассматривать грибы рода Candida как патогенную микрофлору даже при отсутствии клинических проявлений ГК.
Из более 100 видов дрожжеподобных грибов рода Candida в клинической практике наиболее часто встречаются: Candida albicans – в 85-90% случаев, Candida parapsilosis, tropicans – в 5-10% случаев, Candida glabrata – в 1-3% случаев.
Клетки грибов Candida имеют округлую, вытянутую, розеткообразную, иногда неправильную форму. При соприкосновении узких оснований удлиняющихся клеток друг с другом образуются цепочки – псевдомицелии. Размножение осуществляется путем многополюсного почкования. Грибы рода Candida – аэробы, относящиеся к условно-патогенным возбудителям, нередко являются сапрофитами слизистых оболочек (рта, кишечника, влагалища) и кожи.
Диагностика ГК обычно не представляет сложности и основана на жалобах пациенток, характерных клинических признаках и данных лабораторных методов: микроскопии в неокрашенном или окрашенном (по Граму, Цилю-Нильсену, Романовскому – Гимзе) препаратах, культуральной диагностики, серологических методов (реакция агглютинации, реакция связывания комплемента), иногда ДНК-методов (полимеразная цепная реакция).
По мнению В.В. Аковбяна (2000), к группам риска по возникновению ГК относятся: больные с заболеваниями крови (например, различными анемиями), эндокринными нарушениями (сахарным диабетом), туберкулезом, тяжелыми гнойными процессами, длительно получающие терапию антибиотиками, гормонами, иммунодепрессантами, а также пациентки, получающие лучевую терапию, работницы заводов по переработке фруктов, овощей, кондитерских изделий, по производству антибиотиков, белково-витаминных концентратов и других биологически активных веществ, медицинские работники.
Провоцирующими факторами развития ГК могут быть: антибиотикотерапия, применение оральных контрацептивов – длительно или с высоким содержанием эстрогенов, вагинальные спринцевания и применение спермицидов, диабет, неконтролируемые нарушения углеводного обмена, острая респираторная инфекция, различные гинекологические манипуляции (введение внутриматочной спирали, гистероскопия, гистеросальпингография и др.), беременность.
Очевидным фактом является значительно более высокая заболеваемость ГК у беременных (в 2-3 раза), обусловленная сдвигом pH вагинальных выделений в кислую сторону, что связано с гормональной перестройкой организма, вызывающей изменения клеточного иммунитета и активности лейкоцитов (Е.Ф. Кира, 2000). Высокие концентрации половых гормонов, повышающих содержание гликогена в тканях влагалища, обеспечивают наличие источника углерода для грибов рода Candida. Эстрогены также улучшают адгезию дрожжеподобных грибов к клеткам влагалищного эпителия.
Одной из основных особенностей течения ГК является способность сочетания кандидозной инфекции с прочей условно-патогенной бактериальной флорой, имеющей высокую ферментативную и лизирующую активность, что способствует пенетрации кандид в слизистую оболочку гениталий.
Особенностями ГК на современном этапе являются способность к распространению, хроническому и рецидивирующему течению, а также частому развитию у грибов типа Сandida резистентности ко многим лекарственным препаратам. По мнению J. Pollak и соавт. (1994), хронический рецидивирующий ГК является формой осложненного течения ГК, который характеризуется наличием ≥4 эпизодов доказанной инфекции за год.
Генитальный кандидоз и иммунитет
При наличии хронического рецидивирующего ГК нередко наблюдаются нарушения в системе клеточного иммунитета, которые проявляются в виде приобретенной, иногда транзиторной, неполноценности антигенспецифической функции Т-лимфоцитов, что в определенной степени способствует бесконтрольной пролиферации и размножению дрожжеподобных грибов. Основное значение в структуре причин развития хронического рецидивирующего ГК имеет состояние макроорганизма, его защитных сил и, следовательно, его восприимчивость к инвазии дрожжеподобных грибов.
Исследования последних лет установили, что рецидивирующий ГК весьма часто не является результатом реинфицирования половых путей кандидами, а обусловлен ослаблением иммунного статуса макроорганизма, повышением вирулентности микроорганизмов и приобретенной резистентностью к полиеновым или имидазольным препаратам (P.J. Fidel, J.D. Sobel,1996).
В научной литературе имеется немало неоднозначных данных о состоянии эндокринной системы при хроническом ГК. Известно, что частота ГК возрастает от периода полового созревания и достигает максимума у женщин детородного возраста, увеличивается при сахарном диабете и гипотиреозе; в периоде менопаузы частота ГК уменьшается. Доказано, что кортикостероиды, андрогены, эстрогены и прогестерон угнетают иммунные реакции, а гормон роста, тироксин и инсулин их стимулирует. Однако их действие зависит от концентрации: высокие – оказывают иммуносупрессивное, низкие – напротив, иммуностимулирующее действие. Так, например, высокие дозы эстрогенов в высокодозированных комбинированных оральных контрацептивах (КОК) могут повышать риск развития ГК за счет насыщения гликогеном тканей наружных гениталий, увеличения рН и количества рецепторов к кандидам. Введение же медроксипрогестерона ацетата (депо-провера), по мнению некоторых исследователей, в определенной мере защищает от кандидозной инфекции (P.J. Fidel, J.D. Sobel, 1996).
По мнению Т.Ф. Татарчук и соавт. (2003), следует рассматривать изменения на уровне микробиоценоза, нарушения иммунного и гормонального статуса не только как причину развития хронического ГК, но и как его возможные последствия. Нарушения нормальной функции нейроэндокринной и иммунной систем могут обусловливать возникновение хронического рецидивирующего ГК, а расстройства функционирования этих систем нередко возникают вследствие наличия хронической кандидозной инфекции.
Нарушения иммунной системы, развивающиеся вследствие кандидозной инфекции, не только могут обусловливать риск развития эндокринных аутоиммунных заболеваний, но и влиять на метаболизм гормонов, их биоактивность, синтез нейромедиаторов и нейротрансмиттеров в ЦНС (В.И. Заболотная и соавт., 2000; J.D. Sobel,1994).
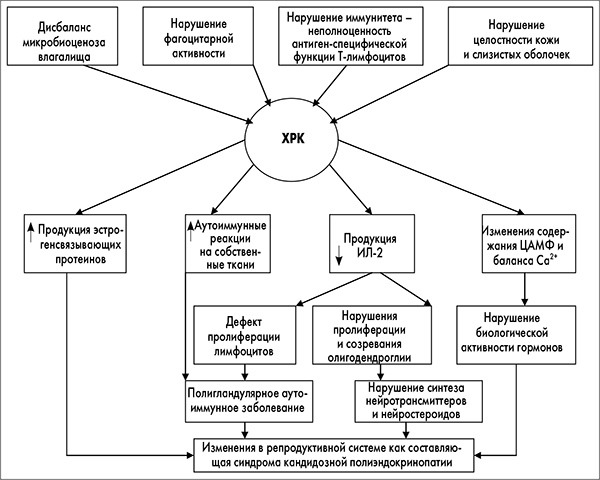
Таким образом, нарушения иммунного статуса являются основой, на которой развивается хронический кандидоз, который, в свою очередь, вызывает дальнейшие расстройства иммунной системы и нейроэндокринной регуляции, описанные K.A. Ginsburg (1995) как синдром кандидозной полиэндокринопатии (рис. 1).
Подтверждением неблагоприятного воздействия кандидозной инфекции на гормональный гомеостаз является выявление у 75% (!) женщин с хроническим рецидивирующим ГК патологических состояний, связанных с дисфункцией яичников. Исследованиями Т.Ф. Татарчук и соавт. (1999) показано, что, например, наличие хронического рецидивирующего ГК является фактором высокого риска развития предменструального синдрома (ПМС), а системное лечение кандидоза способствует положительной динамике клинических проявлений ПМС (И.Б. Венцковская и соавт., 2001).
По мнению А.М. Савичевой и соавт. (2016), ГК нередко осложняется развитием воспалительных заболеваний органов малого таза, возможно вовлечение в воспалительный процесс мочевыделительной системы. При ГК повышается частота осложненного течения беременности, а также увеличивается риск анте- или интранатального инфицирования.
Лечение
Лечение ГК является довольно сложной задачей ввиду отмечающегося в последнее время значительного снижения чувствительности кандид к большинству применяемых препаратов. Необходимо учитывать клиническую форму ГК, его распространенность и предрасполагающие факторы. Иногда лечение может быть назначено и без предварительного лабораторного обследования. Однако в случаях рецидивирования процесса или безуспешности проводимой терапии необходимо проведение лабораторного исследования с определением чувствительности к антимикотическим препаратам.
В течение многих лет для эффективного лечения ГК наиболее широко применяются производные азола, в частности, клотримазол. Механизм его антимикотического действия связан с угнетением синтеза эргостерола, что приводит к структурному и функциональному повреждению цитоплазматической мембраны; препарат имеет широкий спектр антимикотической активности in vitro и in vivo и действует на дерматофиты, дрожжевые и плесневые грибы. Механизм действия обусловлен фунгистатической или фунгицидной активностью в зависимости от концентрации клотримазола в месте инфекции. In vitro активность ограничена пролиферирующими элементами гриба; споры гриба имеют лишь незначительную чувствительность.
Дополнительно к антимикотической активности клотримазол также действует на грамположительные (стрептококки, стафилококки, Gardnerella vaginalis) и грамотрицательные микроорганизмы (Bacteroides). In vitro клотримазол подавляет размножение Corynebacteria и грамположительных кокков (за исключением Enterococci); резистентные штаммы чувствительных видов грибов встречаются редко, угнетения микрофлоры гениталий не наблюдается.
Доклинические исследования, проводившиеся с участием добровольцев с применением одноразовой и повторной токсической дозы, не выявили повреждающего токсического, генотоксического воздействия и влияния на репродукцию. Исследования фармакокинетики после вагинального применения показали, что лишь незначительное количество клотримазола (3-10%) всасывается, абсорбированный клотримазол быстро метаболизируется в печени до неактивных метаболитов, возникновение системных эффектов или побочного действия после интравагинального применения маловероятно.
Преимущества и особенности применения вагинальных форм
Весьма эффективным и надежным «представителем» семейства азолов в течение длительного времени является Канестен® (Bayer Consumer Care), выпускаемый в виде вагинальных таблеток c аппликатором, содержащих 100 мг (N6), 200 мг (N3) и 500 мг (N1) клотримазола.
Канестен® нарушает продукцию эргостерола, что приводит к повреждениям (функциональным и структурным) цитоплазматической мембраны грибов, он активен относительно большинства дрожжевых и плесневых грибов, а также дерматофитов. Помимо противогрибковой активности Канестен® также проявляет активность в отношении отдельных грамположительных микроорганизмов, трихомонад, а также некоторых штаммов Gardnerella vaginalis.
Согласно современным практическим рекомендациям (Канада, 2015), одну вагинальную таблетку применяют вечером, при дозировке 100 мг курс лечения составляет 6 дней, 200 мг – 3 дня, 500 мг – 1 день, что обеспечивает высокий уровень комплайенса.
Необходимо иметь в виду следующие особенности местной терапии: введение вагинальных таблеток осуществляется без предшествующего спринцевания, не следует одновременно пользоваться тампонами, а также другими вагинальными средствами, например, спермицидами.
При рецидивирующих формах ГК целесообразно назначение препаратов системного действия (флуконазол, итраконазол), а также применение витаминов, эубиотиков, метаболической и иммунокорригирующей терапии (желательно, после оценки иммунного статуса пациентки).
Поддерживающая терапия при рецидивирующих формах ГК предусматривает интравагинальное введение препарата Канестен® в дозе 500 мг 1 р/мес в течение 6 мес.
Выводы
Правильная и своевременная диагностика, комплексное и рациональное лечение генитального кандидоза с учетом всего многообразного спектра особенностей этого не такого уж «простого» заболевания являются весьма актуальными и насущно необходимыми.
Успешное применение по-прежнему высокоэффективного (несмотря на многолетнюю историю) препарата Канестен® для местной терапии ГК и его рецидивов служит залогом результативной борьбы со столь «несносной молочницей».
Список литературы находится в редакции.