9 липня, 2016
Cовременные представления о гиперплазии эндометрия

Гиперпластические процессы эндометрия (ГПЭ) представляют собой патологическую диффузную или очаговую пролиферацию слизистой оболочки матки с преимущественным поражением железистых структур и в меньшей степени ее стромального компонента.
Актуальность проблемы
В структуре гинекологических заболеваний на долю ГПЭ приходится от 15 до 50% (J.V. Lacey et al., 2010; R.L. Giuntoli et al., 2012; Н.А. Шешукова и соавт., 2011). В последние годы отмечен рост патологии эндометрия у женщин всех возрастных групп (G. Acmaz et al., 2014; К.А. Мартиросян и соавт., 2011). Причем до 40% женщин молодого возраста с ГПЭ подвергаются хирургическому лечению, что зачастую приводит к потере репродуктивной функции (M.G. Munro et al., 2011; C.L. Trimble et al., 2012). Гиперплазия эндометрия (ГЭ) в 20-25% случаев является основой для формирования злокачественных опухолей эндометрия (S. Pennant et al., 2008; D. Daya, 2014; В.Н. Запорожан и соавт., 2012).
Факторами риска ГПЭ являются: возраст старше 35 лет, отсутствие беременностей, поздняя менопауза, раннее менархе, заболевания печени и желчного пузыря, аутоиммунные процессы, ожирение, курение, семейный анамнез рака эндометрия, яичников, толстого кишечника, ожирение и диабет II типа.
Согласно данным литературы, ведущее значение в этиопатогенезе ГПЭ отводится избыточной эстрогенной стимуляции, сочетающейся с недостаточностью прогестерона (X. Peng et al., 2009; A. Takreem et al., 2009; Н.И. Свиридова, 2009; Т.Ф. Татарчук и соавт., 2011), гормон-независимой пролиферации (В.И. Киселев и соавт., 2011), воспалению (T. Wang et al., 2011; А.Н. Стрижаков и соавт., 2011), сниженному апоптозу (V. Chandra et al., 2011; Г.Е. Чернуха и соавт., 2013), патологическому неоангиогенезу (B. Hvingel et al., 2012), а также нарушениям иммунного статуса
в эндометрии (A.K. Witkiewicz et al., 2010; Н.А. Шешукова и соавт., 2012). Ключевыми звеньями реализации каскада данных механизмов являются процессы взаимодействия широкого спектра цитокинов: фактора некроза опухоли, хемокинов, интерферонов, факторов роста и др. (C. Wang et al., 2011; N. Eritja et al., 2013; О.В. Лысенко и соавт., 2011; Е.П. Коваленко и соавт., 2011). Эти цитокины, обладая рядом медико-биологических эффектов (таких, как регуляция иммунного ответа, участие в воспалительных реакциях, контроль апоптоза, пролиферация и ангиогенез), могут быть вовлечены в этиопатогенез ГПЭ (K. Kusakabe et al., 2009; B. Dobrzycka et al., 2011; P. Xuebing et al., 2011; Н.В. Колесникова и соавт., 2010; Е.П. Коваленко и соавт., 2012).
Основным методом для определения характера ГПЭ является морфологический – исследование гистологических препаратов соскобов эндометрия. Несмотря на длительную историю изучения этой патологии, среди патологов и гинекологов до настоящего времени отсутствует единое мнение относительно критериев оценки выраженности пролиферативных изменений эндометрия, что приводит к отсутствию универсальной клинико-морфологической классификации ГПЭ. В то же время осведомленность о морфологических признаках различных видов ГЭ является исключительно важной для своевременного выбора оптимальной индивидуализированной тактики ведения и прогноза течения заболевания.
Вопросы классификации гиперплазии эндометрия
В течение длительного времени наиболее распространенной и приемлемой для отечественных морфологов и гинекологов остается «Гистологическая классификация опухолей женского полового тракта», разработанная экспертами ВОЗ в 1975 г. Она включает две группы ГПЭ:
А. Доброкачественные:
1. Полип эндометрия.
2. Гиперплазия эндометрия.
Б. Атипическая гиперплазия эндометрия.
Наиболее дискуссионными по-прежнему остаются вопросы оценки малигнизации эндометрия и их терминологии. Впервые термин «атипическая гиперплазия эндометрия» для описания поражений слизистой оболочки матки, схожих с карциномой эндометрия, был предложен в 1948 г. E. Novak и F. Rutledge.
В 1993 г. Б.И. Железнов внес дополнения в классификацию ВОЗ (1975), которые касались доброкачественной гиперплазии эндометрия и позволили выделить железистую (железисто-кистозную) гиперплазию, гиперплазию с секреторным превращением, гиперплазию базального слоя.
Особого внимания заслуживают вопросы терминологии, используемой для оценки различных видов ГПЭ. Так, согласно Международной классификации болезней 10 пересмотра (МКБ‑10), выделяют следующие ГПЭ:
N84. Полип женского полового органа.
N84.0. Полип тела матки. Полип эндометрия.
N85. Другие невоспалительные поражения матки, за исключением шейки матки.
N85.0. Железистая гиперплазия эндометрия: кистозная, железисто-кистозная, полиповидная.
N85.1. Аденоматозная гиперплазия эндометрия. Гиперплазия эндометрия атипичная (аденоматозная).
В 1994 г. ВОЗ была принята 2-я редакция классификации опухолей женской половой системы, согласно которой ГЭ делится на гиперплазию без клеточной атипии и гиперплазию с клеточной атипией. В каждой группе выделяют простую гиперплазию с незначительными структурными изменениями желез и комплексную гиперплазию с нарушенной архитектоникой эндометрия.
По классификации ВОЗ (1994) выделяют следующие виды ГЭ:
1.1. ГЭ – пролиферация эндометриальных желез без цитологической атипии:
1.1.1. Простая ГЭ.
1.1.2. Комплексная, или сложная (аденоматоз), ГЭ: отличается от простой ГЭ структурной перестройкой желез и пролиферацией желез эпителия.
1.2. Атипическая ГЭ – пролиферация эндометриальных желез с признаками цитологической атипии:
1.2.1. Простая атипическая ГЭ.
1.2.2. Комплексная, или сложная, атипическая ГЭ: имеет признаки клеточного и ядерного полиморфизма наряду с дезорганизацией эпителия эндометриальных желез.
Полип эндометрия в классификации ВОЗ (1994 г.) отдельно не выделен, ибо он трактуется как результат продуктивного хронического эндометрита, что требует адекватного противовоспалительного лечения.
В 1995 г. в работах R.J. Kurman и H.J. Norris была предложена морфологическая характеристика этих форм ГЭ. Для простой ГЭ без атипии характерно увеличение числа желез и изменение их формы, незначительное изменение соотношения стромального и железистого компонентов при отсутствии цитологической атипии. Комплексная (аденоматозная) ГЭ отличается от простой более выраженной пролиферацией и тесным расположением желез, которые приобретают сложную архитектонику и характеризуются папиллярными разрастаниями, а также более выраженным увеличением соотношения железистого и стромального компонентов.
Атипическая ГЭ предполагает наличие цитологической атипии, которая заключается в отсутствии полярности, увеличении ядер и изменении их формы, повышении ядерно-цитоплазматического соотношения, определении нерегулярных комплексов хроматина.
Выраженность изменений железистого компонента лежит в основе деления атипической ГЭ на простую и комплексную. Простая атипическая ГЭ встречается достаточно редко. Ее отличительным признаком является наличие атипии клеток желез, хотя выраженные структурные изменения самих желез при этом отсутствуют. Клеточный атипизм часто сопровождается тканевым атипизмом. Поэтому в практике обычно встречается сложная атипическая гиперплазия (аденоматоз с атипией), при которой количество желез неправильной формы увеличено; располагаются они плотно. Эпителиальная выстилка желез имеет неровный внутренний контур, стратифицирована с утратой полярности, формирует внутрижелезистые выросты в виде подушек или участков вида «железа в железе». В отличие от аденокарциномы комплексная атипическая гиперплазия эндометрия характеризуется отсутствием стромальной инвазии.
Существующая морфологическая классификационная схема эндометриальной гиперплазии основывается на множестве характеристик, включающих размер и форму желез, стратификацию и форму эпителиальных клеток, митотическую активность, изменения стромальных клеток, а также цитологические признаки, такие как размер и форма ядер, утрата полярности, увеличение ядерно-цитоплазматического соотношения, неравномерность структуры хроматина. Большинство из этих признаков являются скорее качественными, нежели количественными, и вполне понятно, что при их оценке это нередко вносит элемент субъективности интерпретации полученных данных. Указанное обстоятельство в значительной степени объясняет низкую воспроизводимость диагноза атипической ГЭ, что выражается как в недооценке тяжести поражения, так и в его гипердиагностике.
В настоящее время многие исследователи считают возможным принципиальное деление ГЭ на две основные группы в зависимости от степени риска малигнизации. Согласно их мнению, степень риска во многом определяется морфологическим состоянием эндометрия и соответственно типом ГЭ, а классификация ВОЗ 1994 г., допуская излишне широкие возможности трактовки атипической гиперплазии в прогностическом плане, не всегда способна оптимально разделить пациентов по риску возникновения злокачественной трансформации для выработки более адекватной тактики их ведения. Слепые рандомизированные исследования с участием 6 независимых специалистов в области патоморфологии гинекологических заболеваний, посвященные вопросам воспроизводимости диагнозов гиперпластических изменений эндометрия в соответствии с критериями ВОЗ 1975 г. и 1994 г., продемонстрировали высокую частоту несовпадения диагнозов при использовании обеих классификаций. Это свидетельствует как о необходимости уточнения морфологических критериев гиперпластических процессов и предраковых состояний эндометрия, так и указывает на важность дальнейшего совершенствования классификации этой группы заболеваний.
G.L. Мutter и соавт. (1997) предложили практически ориентированную классификацию патологии эндометрия, в которой к первой группе должны быть отнесены гиперплазии как таковые – доброкачественные состояния, которые отвечают на гормональную коррекцию и имеют незначительный риск озлокачествления. Для второй группы по аналогии с цервикальной интраэпителиальной неоплазией предложен термин Endometrial Intraepithelial Neoplasia (EIN) – «эндометриальная интраэпителиальная неоплазия» (ЭИН), что отражает состояние с высоким риском трансформации в инвазивную карциному. Диагностические критерии ЭИН были разработаны с учетом проведения корреляции между гистопатологией и клиническими исходами, при изучении которых было выявлено, что у пациенток, имеющих диагноз ЭИН, в 41% случаев в течение одного года развилась эндометриальная карцинома, а у остальных пациенток риск развития рака эндометрия в будущем увеличивался в 45 раз. В этом же исследовании приведены данные о том, что ретроспективный анализ гистологических заключений соскобов эндометрия 67 пациенток, имеющих эндометриальную карциному, выявлял ЭИН-изменения по предлагаемой классификации в 97% случаев и только в 78% – эндометриальную гиперплазию с атипией по классификации ВОЗ.
На сегодняшний день доказано, что простая и сложная неатипическая ГЭ являются результатом абсолютной или относительной гиперэстрогении, в то время как атипическая гиперплазия представляет собой прогрессирующее моноклональное мутационное повреждение с независимым от гормонального воздействия локальным ростом. Морфологическим признаком ЭИН является железистое переполнение, при котором объем железистого компонента составляет более 55% в сочетании с клеточной атипией.
В результате такого подхода в 1999 г. появилась ЭИН-классификация, согласно которой простая и комплексная неатипическая ГЭ интерпретируются как эндометриальная гиперплазия (ЭГ), являясь результатом эстрогенной стимуляции, и, соответственно, хорошо поддаются гормональной терапии. Простая и комплексная атипические формы гиперплазии соответствуют понятию ЭИН и трактуются как предрак, требуя индивидуального подхода и нередко – хирургического лечения.
В основу ЭИН-номенклатуры положены следующие принципы:
• все виды предрака выделены в отдельную диагностическую категорию, отличающуюся от заболеваний, которые могут быть связаны с доброкачественным эффектом воздействия гормонов;
• термин «ЭИН» предложен на основании доказательств того, что все виды предрака эндометрия являются моноклональными и, следовательно, неопластическими и часто сочетаются с другими видами предрака женских половых органов;
• диагностика предрака эндометрия осуществляется путем использования гистологических диагностических критериев ЭИН;
• эндометрий, в котором отсутствуют изменения, определяемые как диагностические критерии ЭИН, и при этом отмечены обусловленные гиперэстрогенным влиянием вторичные признаки, оценивается как ЭГ;
• неопределенные случаи остаются в любой системе классификации.
При использовании понятия ЭИН, отражающего невозможность в ряде случаев четкого определения «точки» перехода гиперпластического процесса в неопластический, отсутствует прямое соответствие с предшествующим подклассом классификации ВОЗ. Компьютерная морфометрия гистологических изменений позволила разработать диагностические критерии ЭИН, которые могут быть использованы для постановки клинико-морфологического диагноза.
Необходимо отметить, что знание морфологических признаков и унификация терминологии гиперпластических процессов и минимальных карцином эндометрия важны не только для взаимопонимания между патологами и клиницистами, но и для корреляции отношений между патологоанатомами, о диагностических разногласиях которых известно мало. Однако частота расхождения мнений между патологоанатомами при исследовании одних и тех же микропрепаратов некоторых заболеваний может достигать 87%, что свидетельствует о трудностях воспроизводимости морфологического диагноза. Так, результаты исследования Н.М. Хмельницкой и соавт. (2004) показали, что при микроскопической диагностике атипической ГЭ по соскобам полости матки между патологоанатомами лечебных учреждений и специализированного онкологического диспансера существуют значительные диагностические разногласия. Процент расхождения диагнозов между этими учреждениями составил 93,2. Совпадение диагнозов атипической ГЭ отмечено лишь у 47 (6,8%) из 687 больных. При этом наибольшее количество расхождений (85,3%) относилось к категории ложноположительных.
По данным R.J. Zaino и соавт., воспроизводимость диагноза атипической ГЭ была более высокой (38%) и зависела от способа получения материала для морфологической оценки. При анализе диагностического соскоба эндометрия воспроизводимость была выше, чем при другом способе получения материала (например, вакуумной аспирации). Ряд патологов, работающих в области гинекологической онкологии, считают, что постановка диагноза атипической ГЭ по материалу биопсии эндометрия (выскабливания) крайне затруднительна и практически невозможна.
Современные генетические, биологические и гистологические данные указывают на необходимость введения в клиническую практику четкого разграничения терминов «доброкачественная ЭГ» и «ЭИН». Основным их отличием является отсутствие клеточной атипии при морфологическом исследовании субстрата.
Поэтому, по рекомендациям К.Г. Серебренниковой и М.В. Самойлова (2008), на современном этапе вне зависимости от классификационных и терминологических нюансов в патоморфологическом заключении должны быть отражены следующие моменты:
1) наличие или отсутствие гиперплазии как таковой;
2) наличие аденоматоза (сложной гиперплазии) с указанием его диффузного или очагового характера;
3) наличие атипии (атипической гиперплазии, ЭИН) с указанием очагового или диффузного характера поражения и степени выраженности атипических проявлений.
Многочисленные исследования последних десятилетий доказали, что простые и комплексные неатипические ГПЭ являются результатом абсолютной или относительной гиперэстрогении, в то время как атипическая ГЭ представляет собой прогрессирующее моноклональное мутационное повреждение с независимым от гормонального воздействия локальным ростом.
В настоящее время в специализированной литературе все шире используется так называемая ЭИН-номенклатура ГПЭ, с учетом которой атипические формы (ЭИН) рассматривают как предрак. Неатипические формы интерпретируют как ЭГ в результате эстрогенной стимуляции, которая хорошо поддается гормональной терапии.
Гистологическим признаком ЭИН является железистое переполнение, то есть уменьшение объемного соотношения стромы желез (при ЭГ объем железистого компонента составляет более 55%). Соответственно, первым ключевым диагностическим признаком является фокальное изменение желез (величина фокуса должна быть не менее 1 мм в диаметре), при этом в пределах зоны неоплазии строма составляет менее 45% от общей площади измененной ткани. Второй признак – атипия эпителия неопластических желез. Таким образом, адекватная клиническая трактовка результатов гистологического исследования эндометрия чрезвычайно важна не только для оценки потенциального онкориска, но и как метод опосредованного определения гормонального гомеостаза и реакции органов-мишеней.
С учетом современных представлений об этиологии и патогенезе, клиническом течении и прогнозе ГПЭ в 2014 г. ВОЗ была предложена новая классификация, которая включила не только ранее описанные категории (ЭИН и ЭГ), но и результаты генетических исследований, что позволило рассматривать патологию в свете современного понимания молекулярно-генетических механизмов формирования новообразований эндометрия. Выделение только двух категорий ГПЭ (без атипии и с атипией) – ЭИН и ЭГ – значительно упростит терминологию и понимание проблемы для клинициста.
Согласно классификации ВОЗ (2014), гиперплазия с низкой вероятностью малигнизации ЭГ включает простую, а также комплексную неатипическую ГЭ и характеризуется низким уровнем соматических мутаций в отдельно расположенных железах, не окрашивается гематоксилин-эозином. Железы плотно прилегают друг к другу с потерей стромы между ними. Другой важный признак этого вида гиперплазии – повышенная структурная сложность желез с многочисленными латеральными и внутрижелезистыми выступами эпителия в просвет желез и строму. В железах обычно наблюдается более выраженная многорядность эпителия, чем в случае простой гиперплазии. Соприсутствие инвазивного рака эндометрия составляет менее 1%.
ЭИН, характеризующаяся уменьшением объема стромы и клеточной атипией, которую относят к предраковому состоянию, включает простую, а также комплексную атипическую ГЭ. Основным признаком ЭИН является наличие многих генетических изменений, микросателлитная нестабильность, инактивация PAX2, мутация PTEN, KRAS и CTNNB1 (β-катенин). Простая атипическая железистая ГЭ отличается от простой и комплексной неатипической гиперплазии наличием атипии клеток желез, что проявляется потерей полярности расположения и необычной конфигурацией ядер, которые часто приобретают округлую форму. Ядра клеток при данном виде гиперплазии – полиморфные, и в них нередко выделяются большие ядрышки. Этот вариант атипической гиперплазии встречается достаточно редко. Комплексная атипическая ГЭ характеризуется выраженной пролиферацией эпителиального компонента, которая сочетается с тканевой и клеточной атипией без инвазии базальной мембраны железистых структур. Железы теряют обычную для нормального эндометрия регулярность расположения, они крайне разнообразны по форме и размерам. Выстилающий железы эпителий состоит из крупных клеток с полиморфными, округлыми или вытянутыми ядрами с нарушенной полярностью и многорядностью их расположения. Соприсутствие инвазивного рака эндометрия составляет менее 25-59%.
Патогенетические механизмы развития гиперплазии эндометрия
Согласно данным разных авторов, выделяют следующие звенья патогенеза ГПЭ:
• избыточная эстрогенная стимуляция эндометрия на фоне недостаточности прогестеронового воздействия (И.В. Кузнецов, 2009);
• приобретение отдельными клетками эндометрия пролиферативной автономии путем нарушения сигнальной трансдукции, в том числе металлопротеиназ, в частности MMP‑9 и СD1, и угнетения процессов апоптоза в целом (Г.Е. Чернуха, В.П. Сметник, 2009; M. Paulouskaya, L. Hutsikava, 2016). Виявлена зависимость между активностью металлопротеиназ и апоптозом эндометрия;
• резистентность к терапии прогестинами вследствие дисфункции рецепторов плазматических мембран и митохондриального аппарата клеток эндометрия (И.В. Кузнецов, Г.Т. Сухих, S. Wang et al., 2009);
• нарушение тканевого ремоделирования и гистологической дифференциации клеток эндометрия с возникновением озлокачествления процессов неоплазии под воздействием дисметаболизации матриксных металлопротеиназ (F. Amant, P. Moerman, 2010).
Согласно современным представлениям, гиперэстрогения может быть обусловлена:
• избыточной периферической конверсией андрогенов в эстрогены при ожирении, особенно висцеральном, характеризующемся наибольшим ферментным потенциалом, обеспечивающим ароматизацию;
• наличием гормонопродуцирующих опухолей яичников;
• нарушением инактивационной и белковосинтетической функции печени, приводящей к увеличению биологически активной фракции стероидных гормонов;
• патологией надпочечников;
• гиперинсулинемией.
Ожирение рассматривают как независимый фактор риска развития гиперплазии и рака эндометрия. В жировой ткани происходит ароматизация андростендиона в эстрон, увеличивающаяся с возрастом, а эстрон активно превращается в эстрадиол.
Гиперэстрогения в настоящее время рассматривается как основная, но не единственная причина возникновения пролиферативных процессов эндометрия. В основе развития ГЭ также лежат нарушения процессов пролиферации и апоптоза клеток, которые регулируются клеточными и внеклеточными компонентами на молекулярном уровне. Причем влияние половых стероидов на развитие опухолевого процесса эндометрия реализуется в большей степени путем стимуляции клеточной пролиферации, чем посредством действия на процессы апоптоза. В этой связи факторы, способствующие повышению клеточной пролиферации в миометрии и эндометрии, следует рассматривать как факторы риска развития патологических процессов в матке.
В ряде исследований показана возможность инициации ГПЭ под воздействием экзогенных эстрогенов. Так, монотерапия синтетическими эстрогенами, их метаболитами и селективными модуляторами эстрогеновых рецепторов в течение длительного времени может привести к стимуляции пролиферативной активности клеток эндометрия (L.E. Hann et al., 2001; Л.В. Ткаченко и соавт., 2009).
Гиперплазия клеток как ответ на действие определенного патологического стимула приводит к адаптационным изменениям в эндометрии, а в связи с особенностями генотипа эти изменения могут приобретать патологический характер.
С другой стороны, пролиферацию клеток эндометрия могут вызывать:
• дисгормональные прогестерон/эстрогеновые нарушения путем индуцирования факторов роста и их рецепторов, регулирования процессов ангиогенеза (R.А. Nowak, 2000; Н.А. Шешукова и соавт., 2012);
• травматические повреждения клеток, вследствие индуцирования факторов, стимулирующие рост стромы, и протеолитических ферментов, разрушающих экстрацеллюлярный матрикс;
• вирусные заболевания, ингибирующие апоптоз вследствие ускорения трансформации поврежденных клеток (G.L. Mutter et al., 2007, А.И. Ищенко и соавт., 2008). Значение апоптоза в развитии ГПЭ показано в работах W.K. Chan и соавт. (1995), O. Bozdogan и соавт. (2002), Г.Т. Сухих и соавт. (2005), Т.В. Слукиной и соавт. (2008);
• другие факторы.
Установлено, что в регуляцию клеточной пролиферации вовлечены не только эстрогены, но и другие биологические амины (мелатонин, норадреналин, паратгормон, брадикинин, инсулин, гистамин, простагландины, серотонин, гастрин), хориогонин и другие пептиды, которые вырабатываются клетками эндокринной APUD-системы (О.В. Лысенко, 2008). При этом доказано, что в неизмененном эндометрии апудоциты, как правило, отсутствуют или могут содержаться в малых концентрациях, тогда как при аденокарциноме и диффузной гиперплазии их концентрация может увеличиваться в 20 и 5 раз, соответственно (А.Н. Стрижаков и соавт., 2011).
Таким образом, в основе развития ГПЭ лежат сложные многоэтапные, гормональные, пролиферативно-апоптотические воспалительные механизмы.
Диагностика и лечение ГЭ
Клинически ГПЭ могут проявляться менометроррагией. В 10-30% случаев ГЭ протекает бессимптомно, что служит предпосылкой для поздней диагностики предрака и рака эндометрия, поэтому женщинам из группы риска развития рака эндометрия даже без клинических проявлений рекомендуется скрининговое ультразвуковое обследование гениталий не менее 2 р/год.
К основным задачам диагностики относятся: выявление гиперпластического процесса и клиническая интерпретация результатов гистологического исследования эндометрия; установление гормонозависимости гиперпластического процесса и оценка особенностей гормонального дисбаланса у данной конкретной женщины.
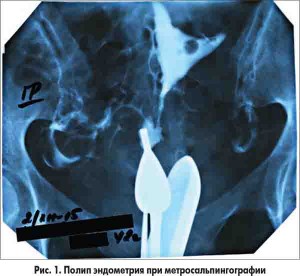
Для диагностики патологических процессов в эндометрии, выбора метода лечения и определения дальнейшего прогноза сейчас в основном используется ультразвуковой, эндоскопический и гистологический методы исследования. Полип эндометрия как диагностическая находка может быть выявлен при рентгенологическом исследовании проходимости маточных труб пациенток с бесплодием.
Одной из задач современной науки является поиск генетических маркеров онкологических заболеваний, которые позволят не только распознавать опухолевый процесс, но и выявлять пациенток, предрасположенных к возникновению злокачественных новообразований.
Перспективным, но малоизученным направлением в исследовании патологии эндометрия на молекулярном уровне является определение наличия метилирования гена ESR и микросателлитной нестабильности (microsatellite instability – MSI) различных локусов генома. Определение метилирования гена ESR и MSI позволит определить факторы риска развития у женщин с определенным фенотипом различной патологии эндометрия (гиперплазия, полипы и др.). Наличие или отсутствие таких прогностических факторов, как метилирования гена ESR и MSI, позволит индивидуализировать подходы к методам лечения (гормонотерапия, аблация эндометрия, гистерэктомия и др.), выработать новые алгоритмы лечения больных с патологией эндометрия, оценить эффективность и целесообразность различных методов терапии, а также определить вероятность малигнизации процесса (В.Н. Запорожан и соавт., 2012; Т.Ф. Татарчук и соавт., 2015; V. Karountzos et al., 2016).
K.M. Cornel и соавт. (2016) выявили прямую зависимость между высокими уровнями 17β-гидроксистероиддегидрогеназой 1-го типа (HSD17β1) и раком эндометрия (p=0,007), что позволяет рассматривать его в качестве потенциального прогностического маркера.
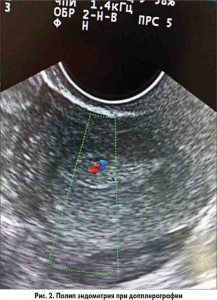
Одним из основных методов ранней диагностики ГПЭ является ультразвуковое исследование, диагностическая ценность которого особенно возрастает при бессимптомном течении патологии. При диагностике ГЭ предпочтительно использование трансвагинальной эхографии, в ходе которой, кроме определения толщины эндометрия и эндометриально-маточного коэффициента (ЭМК) – отношение толщины эндометрия к величине переднезаднего размера матки – следует обязательно оценивать однородность структуры, особенности эхогенности и контуров М-эхо. В ранней доклинической диагностике ГПЭ для определения показаний к гистологическому исследованию не утратила своей актуальности ультразвуковая диагностика, преимущественно трансвагинальная эхография с проведением допплерографических и допплерометрических исследований эндометрия, количественной оценки его кровоснабжения.
Важным этапом диагностики ГПЭ служит забор материала, поскольку окончательным является гистологический диагноз. В этом контексте особую значимость приобретают способы гистероскопической визуализации эндометрия, диагностическая ценность которых позволяет определять их особенности и локализацию, контролировать качество диагностического выскабливания с прицельным удалением возможных остатков гиперплазированного эндометрия, полипов при минимальном травматизме здоровой ткани и выполнять внутриматочные операции с применением электро- и лазерной хирургии.
Преимуществом гистероскопии является возможность ее использования в амбулаторных условиях. Панорамная гистероскопия обеспечивает прямой осмотр всей полости матки и помогает установить топографическую связь выявленных аномалий в отношении всего эндометрия, что помогает дифференцировать субмукозные миомы, полипы и региональные утолщения эндометрия, дает возможность оценить сосудистый рисунок эндометрия. Использование двойного канала обеспечивает проведение хирургических манипуляций.
Основным методом получения образцов эндометрия для гистологического исследования является фракционное диагностическое выскабливание цервикального канала и полости матки, возможности которого значительно увеличиваются при использовании гистероскопии, проведенной за 7 дней до очередной менструации.
Золотым стандартом в диагностике внутриматочной патологии на современном этапе является диагностическое выскабливание под контролем гистероскопии с последующим гистологическим исследованием соскоба. По данным Л.А. Ашрафяна (2004), чувствительность метода составляет 93,8%, специфичность – 91,3%.
В Европе одной из наиболее распространенных диагностических манипуляций в практике гинеколога является аспирационная (Пайпель) биопсия эндометрия. По точности диагностики патологических изменений эндометрия аспирационная биопсия не уступает диагностическому выскабливанию. Чувствительность метода составляет 62,5-91,5%, специфичность – 94%, ложноположительные результаты встречаются в 31% случаев, ложноотрицательные – 7,9%. Необходимо отметить, что этот метод имеет следующие существенные преимущества: может производиться амбулаторно; является малоболезненной процедурой; длительность проведения манипуляции менее одной минуты; вызывает минимальную травматизацию, поскольку не требует расширения цервикального канала; позволяет получить ткань из любых отделов полости матки; снижает риск воспалительных осложнений.
На начальном этапе диагностического алгоритма осуществляются:
• комплексная оценка данных анамнеза;
• определение гормонального статуса пациентки;
• выявление степени гормонозависимости ГПЭ: оценка клинических симптомов прогестероновой недостаточности (прибавка массы тела, слабость, снижение либидо, депрессия, головная боль, артралгия, перемены настроения) и относительной эстрогенной доминантности (гипертензия, задержка соли и воды, отеки, повышенная свертываемость крови, гиноидное ожирение, аутоиммунный тиреоидит с гипотиреозом, мастодиния, гиперпролиферация эпителия протоков молочных желез, различного вида мастопатии);
• анализ данных исследования общего статуса каждой больной с подозрением на ГПЭ и результатов общего, а также бимануального гинекологического обследования;
• оценка симптоматики у пациенток с ГПЭ, указывающей на наличие того или иного преморбидного состояния, способствующего развитию и поддержанию патологических изменений в эндометрии (дисгормональные нарушения метаболизма гормонов гипоталамо-гипофизарно-яичниковой системы, экстрагенитальные обменно-эндокринные нарушения).
На следующем этапе диагностического поиска проводятся лабораторные исследования (общий анализ крови с формулой, определение количества тромбоцитов и ретикулоцитов, тест на беременность, коагулограмма, антиген фактора Виллебранда при отягощенном семейном анамнезе, тест на толерантность к глюкозе при отягощенном семейном анамнезе; определение уровня тиреотропного, фолликулостимулирующего и лютеинизирующего гормонов, эстрадиола, прогестерона, индекса свободного тестостерона, концентрации дегидроэпиандростерон-сульфата, 17-оксипрогестерона, пролактина, кортизола в суточной моче; бактериологическое и бактериоскопическое обследования на инфекции, передающиеся половым путем, у сексуально активных пациенток).
Заключительный этап диагностического алгоритма включает:
• забор ткани эндометрия или взятие аспирата из полости матки;
• раздельное выскабливание слизистой канала шейки и тела матки;
• гистероскопию по показаниям;
• цитологическое или патогистологическое исследование (ПГИ) эндометрия; если при клинической интерпретации результатов гистологического исследования эндометрия находят злокачественный процесс, следует определить локализацию метастазов с помощью ядерно-магнитно-резонансной томографии, лимфографии и др.
В связи с широким внедрением в клиническую практику гормональной терапии при клинической интерпретации морфологических исследований следует учитывать ятрогенные изменения эндометрия. Доминирование гестагенов является причиной развития неполноценной секреции, неравномерной атрофии, нерегулярной регенерации, очаговой стромальной гиперплазии и даже очаговой аденоматозной гиперплазии. Высокие концентрации прогестерона на фоне повышенного уровня эстрогенов способствуют инволютивным изменениям в железах и строме или же к предецидуальным изменениям стромы эндометрия. Данная картина может наблюдаться при применении высокодозированных комбинированных гормональных контрацептивов в увеличенных дозах по гемостатической схеме.
Высокие дозы эстрогенов на фоне сниженной продукции приводят к чрезмерной пролиферации и кистозному расширению желез, к недоразвитию стромы, что способствует преобладанию железистого компонента, то есть возникновению гиперплазии.
Лечение пациенток с ГПЭ согласно протоколу, утвержденному Приказом МЗ Украины от 31.12.2004 г. № 676, включает следующие этапы:
І этап – удаление измененного эндометрия с последующим морфологическим исследованием. Детализация дальнейшей тактики лечения проводится в зависимости от вида патологии эндометрия.
Как уже отмечалось выше, наиболее распространенным методом диагностики и лечения ГПЭ является фракционное выскабливание стенок матки с гистологическим исследованием соскоба. Однако в последние годы многие авторы подчеркивают относительно невысокую диагностическую ценность этого метода и настоятельно рекомендуют применение гистероскопии, информативность которой достигает 94,5%. Преимуществом гистероскопии является визуализация изменений, характерных для данного вида патологии, и возможность целенаправленного забора материала для ПГИ.
Традиционная тактика лечения больных с гиперплазией слизистой оболочки тела матки предусматривает проведение гормональной терапии в течение 3 мес с последующим гистологическим исследованием полного соскоба слизистой. При отсутствии клинического и/или морфологического эффекта консервативного лечения показано хирургическое вмешательство. Во многом эффективность гормональной терапии зависит от типа гормонального средства, назначаемого врачом. Однако, несмотря на успехи современной гормональной терапии, оперативное вмешательство по-прежнему остается ведущим методом лечения пациенток с гиперплазией слизистой тела матки.
При стойких рецидивирующих ГПЭ, особенно развивающихся на фоне заболеваний желез внутренней секреции, ожирения, гипертонической болезни, заболеваний печени, применяют хирургическое лечение. Основным его методом у больных с ГПЭ считалась гистерэктомия. В последнее время отмечается тенденция к повышению хирургической активности при данной патологии. В некоторых странах Европы и Северной Америки значительно чаще, чем это принято, прибегают к радикальному оперативному вмешательству, особенно у женщин старше 40 лет. Так, в Великобритании ежегодно выполняется до 100 тыс. гистерэктомий. При этом частота послеоперационных осложнений составляет 9%, из них 1% являются достаточно тяжелыми. Летальность при этом достигает 0,8 на 1000 больных. В некоторых случаях рекомендуют аблацию эндометрия как альтернативу гистерэктомии при лечении таких пациенток.
Среди эндохирургических методов лечения пациенток с ГПЭ наибольшее распространение получила электрохирургическая гистерорезектоскопия. Электрохирургическое воздействие на слизистую тела матки, более известное как «аблация эндометрия», объединяет различные методы воздействия на эндометрий – непосредственно деструкцию слизистой с помощью электродов с широким основанием или ее резекцию с применением электрода-петли.
Электрохирургическая гистероскопия и гистерорезектоскопия представляют собой наиболее современные методы хирургического лечения больных с ГПЭ, субмукозной миомой матки, внутриматочными сращениями и перегородками. С внедрением в клиническую практику гистерорезектоскопии частота радикальных операций по поводу маточных кровотечений снизилась на 30-40%. Резектоскоп работает от монополярного тока, поэтому при использовании данного инструмента надо применять неэлектролитную, непроводящую расширяющую среду, которая при попадании в системный кровоток не вызовет выраженных нарушений гомеостаза. Резектоскоп состоит из петельного и пунктирующего электродов, а также устройства, имеющего на конце вращающийся шарик или цилиндр. Все три электрода могут быть использованы для аблации эндометрия. Петельный электрод служит для удаления полипов и биопсии эндометрия.
При удалении эндометрия используют режущую петлю резектоскопа и вращающийся электрод или коагулирующую петлю. Одни хирурги соскабливают ткань эндометрия режущим электродом-петлей, другие – удаляют ее вращающимся шаровым или цилиндрическим электродом. В настоящее время разработаны гибкие и полужесткие инструменты, позволяющие врачу произвести более тонкие операции в полости матки.
Резекция слизистой обеспечивает глубокое иссечение эндометрия, включая окружающие пласты мышечной ткани, и предусматривает возможность получения материала для гистологического исследования. В то же время данная методика сопряжена с высоким риском осложнений.
Для обеспечения непосредственного визуального контроля и доступа к полости матки при выполнении гистероскопических хирургических вмешательств используется биполярная гистерорезектоскопическая система.
Аблация эндометрия электродом с широким основанием абсолютно безопасна в отношении таких серьезных осложнений, как ранение маточных сосудов и перфорация матки, однако не позволяет получить ткань для морфологического анализа. Термическая аблация эндометрия по сравнению с характеристиками электродной или лазерной аблации более проста в выполнении и не менее эффективна.
Достижением современной техники являются устройства для внутриматочной аппликации термической энергии. Существует несколько разновидностей таких аппликаторов, выполняющих свою функцию с помощью специальных шариков, которые наполняются жидкостью, прогревающейся расположенной в центре шарика спиралью. Использование этих систем эффективно при патологии эндометрия с целью уничтожения его избыточного слоя путем воздействия термической энергии.
Частота аменореи после аблации эндометрия колеблется от 9 до 60%. Согласно данным зарубежной литературы, беременность после аблации эндометрия наступает в 0,24-0,7% случаев. Риск наступления беременности возрастает у женщин с овуляторными циклами, не использующих контрацепцию.
В последние годы ведется поиск и разработка способов безопасной доставки лазерной энергии к патологическим участкам эндометрия. Применяется диодный лазер для деструкции эндометрия у пациенток с меноррагиями, так называемая эндометриальная лазерная внутриматочная термальная терапия (Endometrial Laser Intrauterine Thermal Therapy – ELITT). Лазерное излучение достигает всех участков полости матки, включая труднодоступные зоны, такие как устья маточных труб (что не всегда удается с помощью электрохирургической гистерорезектоскопии). При гистологическом исследовании макропрепаратов (матка) выявляется полное разрушение эндометрия и прилегающих к нему участков мышечной ткани на протяжении 1-3,5 мм под воздействием рассеянного диодно-лазерного излучения. Отдаленные результаты ELITT показывают, что у 62% больных с рецидивирующими маточными кровотечениями наступает аменорея, у 38% – менструации приобретают скудный характер. Современный взгляд на использование лазерной терапии окончательно не определен.
ІІ этап – гормональная терапия, направленная на супрессию эндометрия с применением гестагенов и/или агонистов гонадотропин-рилизинг гормона (ГнРГ). Длительность терапии – 6 мес с повторным гистологическим исследованием каждые 3 мес (при простой гиперплазии возможна гистология через 6 мес при отсутствии ультразвуковых критериев гиперплазии). При наличии гиперплазии через 3 мес лечения – коррекция терапии, а при атипической гиперплазии – лечение у гинеколога-онколога.
Согласно действующему клиническому протоколу, гормонотерапия проводится в репродуктивном периоде, а в пери- и постменопаузе – только при неатипичных формах ГПЭ.
Используются следующие группы препаратов.
Гестагены:
– дидрогестерон (дуфастон) – при неатипичной ГЭ в репродуктивном возрасте с 5-го по 25‑й день в дозе 20‑30 мг/сут;
– медроксипрогестерона ацетат (Депо-Провера) – до 40 лет по 200-400 мг в/м 1 р/нед, 41-50 лет по 400 мг в/м 1 р/нед);
– 12,5% 17-оксипрогестерона капронат – до 40 лет по 500 мг в/м 2 р/ нед, 41-50 лет по 500 мг в/м 3 р/нед).
Агонисты ГнРГ:
– гозерелин (Золадекс) – 3,6 мг п/к 1 раз в 28 дней;
– бусерелин (Бусерелин-депо) – 3,75 мг п/к 1 раз в 28 дней;
– бусерелин спрей назальный – 900 мг/сут непрерывно на протяжении всего курса лечения, курс лечения – 4-6 мес;
– трипторелин (Декапептил Депо) – 3,75 мг п/к 1 раз в 28 дней.
В последнее время появились сообщения о перспективном применении нового синтетического прогестина линестренола для лечения женщин с ГПЭ, который продемонстрировал более высокие показатели по подавлению пролиферации в эндометрии (56%) в сопоставлении с медроксипрогестерона ацетатом (36,7%) и норэтистероном (37%) в сравнительном рандомизированном проспективном исследовании 82 пациенток с ГПЭ без атипии.
По данным Кокрановского сообщества доказательной медицины при медикаментозном лечении гиперплазии без атипии эффективно назначение прогестагенов в непрерывном режиме перорально или локально (внутриматочная система с левоноргестрел (ЛНГ-ВМС) – Мирена спираль внутриматочная 20 мкг/сут). Согласно этим данным, ЛНГ-ВМС должна быть первой линией медикаментозного лечения, поскольку по сравнению с пероральным назначением прогестагенов обеспечивает более высокую скорость регрессии заболевания с более благоприятным профилем кровотечений и меньшим количеством побочных эффектов (уровень доказательности – А).
ІІІ этап – оптимизация гормонального статуса с целью предупреждения дальнейшего развития гиперэстрогенемии.
При необходимости сохранения репродуктивной функции с целью восстановления двухфазного менструального цикла у женщин репродуктивного возраста применяются комбинированные оральные контрацептивы с гестагеном, обладающим антипролиферативным действием на эндометрий, и локальная гестагенная гормонотерапия (левоноргестрел-выделяющая внутриматочная система).
В климактерическом периоде – меностаз, при необходимости с использованием агонистов ГнРГ, а при показаниях к ЗГТ – монофазные препараты, содержащие гестаген с выраженным антипролиферативным эффектом либо применение ЗГТ на фоне локальной гормонотерапии.
IV этап – диспансерное наблюдение в течение 5 лет после эффективной гормональной терапии и 6 мес после оперативного лечения (УЗИ органов малого таза 2 р/год).
В связи с тем, что ныне действующий протокол ведения женщин с ГПЭ был принят более десяти лет назад и не пересматривался с появлением новых данных, некоторые его позиции не соответствуют современным рекомендациям. По сообщению Т.Ф. Татарчук (2015), в настоящее время мультидисциплинарной рабочей группой, утвержденной приказом МЗ Украины от 19.02.2015 г., проводится работа по подготовке новой версии медицинского стандарта оказания помощи при ГПЭ с учетом рекомендаций ACOG и SGO от 2015 г., согласно которым пациенткам с ГПЭ без атипии на ІІ этапе назначается консервативная терапия гестагенами (пероральные гестагены, левоноргестрел-высвобождающая внутриматочная система – ЛНГ-ВМС). Также допустима резектоскопическая аблация эндометрия.
Таким образом, возможности современной диагностики и лечения гиперпластических процессов эндометрия постоянно совершенствуются, открывая новые перспективы их лечения. Залогом успеха лечения гиперпролиферативных процессов эндометрия является правильная интерпретация результатов гистологического исследования и понимание этиологии и патогенеза выявленных изменений. Важными этапами диагностического процесса являются ультразвуковое трансвагинальное исследование, допплерометрия, гистероскопия, а также применение унифицированных современных классификаций ГЭ. Перспективным является применение генетических диагностических методик, позволяющих прогнозировать течение процесса, а также выбор тактики лечения.
Литература
1. Absolute risk of endometrial carcinoma during 20-year follow-up among women with endometrial hyperplasia / J.V. Lacey, M.E. Sherman, B.B. Rush [et al.] // J. Clin. Oncol. – 2010. – Vol. 28, № 5. – P. 788-792.
2. Stage I noninvasive and minimally invasive uterine serous carcinoma: comprehensive staging associated with improved survival / R.L. Giuntoli, M.A. Gerardi, A.V. Yemelyanova [et al.] // Int. J. Gynecol. Cancer. – 2012. – Vol. 22, № 2. – P. 273-279.
3. Шешукова Н.А. Гиперпластические процессы эндометрия: особенности пролиферативной активности при сочетании с хроническим эндометритом / Н.А. Шешукова, И.О. Макаров, Т.В. Овсянникова // Акушерство, гинекология и репродукция. – 2011. – Т. 5, № 3. – С. 10-15.
4. Evaluation of endometrial precancerous lesions in postmenopausal obese women-a high risk group? / G. Acmaz, H. Aksoy, E. Albayrak [et al.] // Asian. Pac. J. Cancer Prev. – 2014. – Vоl. 15, № 1. – P. 195-198.
5. Комплексное лечение гиперпластических процессов эндометрия у больных периода пре- и постменопаузы / К.А. Мартиросян, И.В. Караченцова, А.П. Политова [и соавт.] // Вестник РГМУ. – 2011. – Спец. вып. № 2. – С. 109-112. – (Современные вопросы акушерства, гинекологии и перинатологии: материалы V междунар. конф. молодых ученых, Москва, 20 мая 2011 г.).
6. The Surgical Treatments Outcomes Project for Dysfunctional Uterine Bleeding: summary of an Agency for Health Research and Quality-sponsored randomized trial of endometrial ablation versus hysterectomy for women with heavy menstrual bleeding / M.G. Munro, K. Dickersin, M.A. Clark [et al.] // Menopause. – 2011. – Vol. 18, № 4. – P. 445-452.
7. Management of endometrial precancers / C.L. Trimble, M. Method, M. Leitao [et al.] // Obstet. Gynecol. – 2012. – Vol. 120, № 5. – P. 1160-1175.
8. Pennant S. Endometrial atypical hyperplasia and subsequent diagnosis of endometrial cancer: a retrospective audit and literature review / S. Pennant, S. Manek, S. Kehoe // J. Obstet. Gynaecol. – 2008. – Vol. 28, № 6. – P. 632-633.
9. Daya D. Endometrial hyperplasia and carcinoma with superimposed secretory changes: a double whammy / D. Daya // Int. J. Gynecol. Pathol. – 2014. – Vol. 33, № 2. – P. 105-106.
10. Гинекология. Руководство для врачей. / Под ред. В.Н. Серова, Е.Ф. Кира. – Москва, 2008. – 840 с. 11. Железнов Б.И. Опухоли женского полового тракта. Патологоанатомическая диагностика опухолей человека. Руководство. // Под ред. Н.А. Краевского, А.В. Смольянникова, Д.С. Саркисова. – М. Медицина, 1993.
12. Кузнецова И.В. Гиперпластические процессы эндометрия / И.В. Кузнецова. – Москва, 2009. – 48 с.
13. Международная гистологическая классификация опухолей № 13. Поулсен Г.Е., Тейлор К.У., Собин Л.Г. Гистологическая классификация опухолей женского полового тракта. – ВОЗ, Женева, 1981.
14. Хмельницкая Н.М. Трудности и ошибки диагностики атипичной гиперплазии эндометрия / Хмельницкая Н.М., Нейштадт Э.Л., Халимджанов З.К. // Арх. пат. – 2006. – Вып. 6. – С. 39-42.
15. Хмельницкий О.К. Цитологическая и гистологическая диагностика заболеваний шейки и тела матки / О.К. Хмельницкий. – СПб.: SOTIS, 2000. – 333 с.
16. Kurman R.J. Endometrial hyperplasia and related cellular changes. / R.J. Kurman, H.J. Norris // Blaustein’s pathology of the female genital tract / ed. by R.J. Kurman – 5th ed. – New York, 1995. – P. 411-437.
17. Мutter G.L. Benign endometrial hyperplasia sequence and endometrial intraepithelial neoplasia / Мutter G.L., Zaino R.J., Baak J.P.A. [et al.] // Int. J. of Gyn. Pathol. – 2007. – Vol. 26, № 2. – P. 103-114.
18. Orbo A. Computerised morphometrical analysis in endometrial hyperplasia for the prediction of cancer development. A long-term retrospective study from northern Norway / Orbo A., Baak J.P., Kleivan I. [et al.] // J. of Clin. Pathol. – 2000. – Vol. 53, № 9. – P. 697-703.
19. Silverberd S.G., Kurman R.J., Nogales F. // WHO Classifications of Tumors. Pathology and Genetics. Tumors of the Brest and female genital organs / Eds F.A. Tavassali, P. Deviler. – Lyon, 2003. – P. 33-37.
20. Skov B.G., Broholm, Engel U. [et al.] // Int. J. Gynecol. Pathol. – 1997. – Vol. 16. – P. 33-37.
21. Zaino R.J. Reproducibility of the Diagnosis of Atypical Endometrial Hyperplasia / Zaino R.J., Kanderer J., Trimble C.L. // Cancer. – 2006. – Vol. 106. – P. 804-811.
22. Запорожан В.Н., Татарчук Т.Ф., Дубинина В.Г., Косей Н.В. Современная диагностика и лечение гиперпластических процессов эндометрия // Репродуктивная эндокринология. – 2012. – № 1 (3). – С. 5-12.
23. Татарчук Т.Ф., Калугина Л.А. К вопросу о лечении гиперплазии эндометрия // Репродуктивная эндокринология. – 2012. – № 2 (4). – С. 88-92.
24. Татарчук Т.Ф., Калугина Л.В., Тутченко Т.Н. Гиперпластические процессы эндометрия: что нового? // Репродуктивная эндокринология. – 2015. – № 5 (25). – С. 7-13.




