9 травня, 2016
Современный взгляд на синдром гиперандрогении у пациенток пубертатного возраста

Синдром гиперандрогении является одним из самых частых гормональных нарушений у женщин репродуктивного возраста. Актуальность изучения гиперандрогении обусловлена высоким риском развития метаболических нарушений, сердечно-сосудистых расстройств и бесплодия. Однако в настоящее время этиология и патогенез данного заболевания все еще остаются не до конца ясными. Особенностью синдрома гиперандрогении является его манифестация в период полового созревания, определяющая необходимость проведения диагностики с применением наиболее информативных методов именно в этот период. И поэтому основная роль в своевременном установлении диагноза гиперандрогении принадлежит врачу-эндокринологу.
4-5 июня 2015 года в г. Харькове под эгидой ГУ «Институт проблем эндокринной патологии им. В.Я. Данилевского НАМН Украины», Харьковской медицинской академии последипломного образования и Харьковского национального медицинского университета состоялась 59-я научно-практическая конференция с международным участием «Украинская школа эндокринологии». В рамках этого мероприятия ведущие отечественные специалисты рассмотрели множество докладов, посвященных современным представлениям о механизмах развития различных эндокринных патологий, новейшим диагностическим и терапевтическим технологиям в лечении эндокринных заболеваний, в том числе и гиперандрогений. Наше внимание привлек доклад заведующей отделом эндокринологии ГУ «Институт охраны детей и подростков НАМН Украины», доктора медицинских наук, профессора Елены Анатольевны Будрейко «Дифференциальная диагностика гиперандрогений у девочек пубертатного возраста», который представляет особый интерес для акушеров-гинекологов. Предлагаем читателям ознакомиться с его кратким обзором.
Гиперандрогения – патологическое состояние, обусловленное воздействием избытка андрогенов на органы и ткани-мишени. Гиперандрогения зависит не только от гиперпродукции мужских половых гормонов яичниками и/или надпочечниками, но и от избыточной трансформации андрогенов-предшественников в андрогенчувствительных тканях в более активные формы (тестостерон, дигидротестостерон). Кроме того, при гиперандрогении в случае повышенной чувствительности органов-мишеней (кожи) к тестостерону и дигидротестостерону часто отмечается увеличение утилизации андрогенов, а также снижение уровня глобулина, связывающего половые гормоны (ГСПГ).
Как известно, синдром гиперандрогении чаще встречается у женщин молодого возраста, нежели у мужчин. При этом нарушения менструального цикла (аменорея, олигоменорея) являются не единственными проявлениями данной патологии. Довольно часто синдром гиперандрогении сопровождается как общей вирилизацией (огрубение голоса, уменьшение молочных желез, увеличение мышечной массы, увеличение соотношения окружности талии к окружности бедер как следствие преимущественного скопления подкожной клетчатки на туловище), так и вирилизацией наружных половых органов (гипертрофия клитора, больших половых губ). Также может отмечаться гипоплазия внутренних половых органов. Помимо этого при гиперандрогении нередко наблюдаются изменения кожи и ее придатков – гиперандрогенная дермопатия (повышенная сальность кожи и, как следствие, себорейный дерматит, угревая сыпь и фурункулез), гирсутизм, андрогенная алопеция.
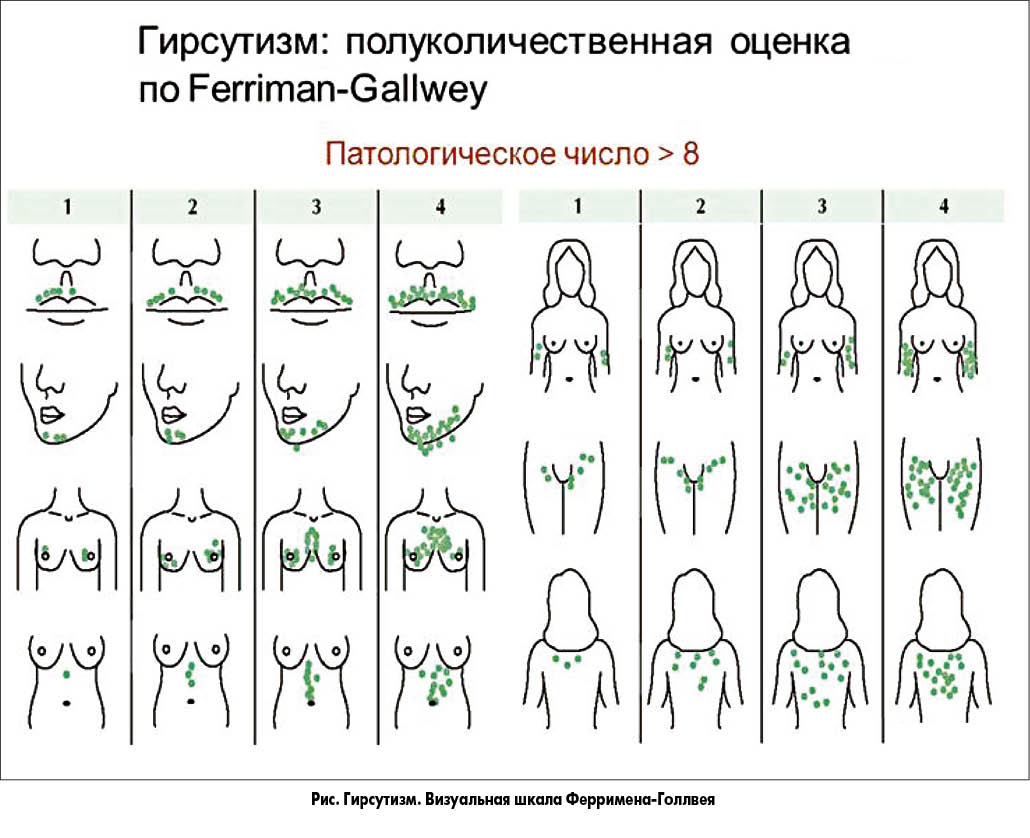
Гирсутизм – избыточный рост терминальных волос у женщин, напоминающий таковой у мужчин (на подбородке, верхней части груди – в области грудины, верхней части спины и живота). Согласно общепринятой классификации и визуальной шкале Ферримена-Голлвея (рис.) гирсутизм можно разделить на: физиологический – ≤10 баллов, пограничный – 11-13 баллов, и патологический – ≥14 баллов. Так, в средней полосе Российской Федерации и в Украине средний показатель гирсутизма у женского населения составляет 4,5±0,1. Для сравнения физиологический гирсутизм у жительниц Кавказа – 9,5±0,6 балла. Стоит заметить, что для пограничного и патологического гирсутизма с учетом национальных особенностей и возраста характерно наличие гипертрихоза – избыточного роста пушковых и терминальных волос в тех местах, где обычный волос является нормой как у женщин, так и у мужчин.
Причины гиперандрогении у девочек весьма разнообразны и включают нарушения как функционального, так и опухолевого генеза в органах, продуцирующих андрогены (яичники и/или надпочечники). Кроме того, данная патология может развиться на фоне нарушения баланса между различными фракциями андрогенов вследствие активизации или снижения их связывания белками и ростом уровня свободных (несвязанных) андрогенов крови. Еще одной причиной является увеличение числа андрогеновых рецепторов или повышение их чувствительности к андрогенам на фоне нормальной их концентрации (в последнем случае развивается идиопатический гирсутизм). Стоит также отметить, что при повышенной активности 5α-редуктазы (энзим, превращающий в коже тестостерон в более активный андроген – дигидротестостерон), то есть при изменении ферментативной активности на различных этапах трансформации андрогена, риск развития синдрома гиперандрогении значительно увеличивается.
Итак, рассмотрев основные клинические проявления, а также факторы, влияющие на формирование синдрома гиперандрогении, следует более детально изучить физиологическую роль андрогенов, а также их непосредственное воздействие на различные системы и функции организма. Как известно, половым стероидным гормонам (в том числе андрогенам) отводится основная роль в различных процессах, начиная от участия в сложных процессах созревания костной ткани (усиление остеосинтеза, рост костной ткани, окостенение эпифизарных хрящей), выработки β-эндорфинов, факторов роста и инсулина, а также синтеза липидов различной плотности, и заканчивая стимуляцией функции сальных желез и волосяных фолликулов, участием в развитии лобкового, подмышечного оволосения и регуляции полового поведения (регуляция либидо и половой потенции). Также доподлинно известно об анаболическом свойстве андрогенов (усиление процессов синтеза белка в организме, нарастание мышечной ткани) и их немалой значимости в процессах водно-электролитного обмена (задержка жидкости и некоторых электролитов).
Исходя из того, что андрогены имеют такой широкий спектр воздействия на организм человека, его можно разделить на несколько условных категорий:
- внутригонадное действие: процессы образования доминантного фолликула, рост фолликула, регрессия фолликула в яичниках, при высоких концентрациях – атрезия фолликула;
- периферическое воздействие: атрофические процессы в эндометрии и миометрии, гипоплазия матки, атрофия железистой ткани молочной железы, подавление лактации;
- центральное воздействие: регуляция секреции гонадотропного рилизинг-гормона и гонадотропина по принципу обратной связи, подавление секреции фолликулостимулирующего гормона путем стимуляции ингибина в клетках гранулезы.
Что же касается биосинтеза андрогенов, то, несмотря на способность некоторых органов и тканей продуцировать андрогены (печень, кожа, жировая и мышечная ткани), основными их источниками все же являются надпочечники и яичники. При этом объем суточной продукции андрогенов в яичниках и коре надпочечников различается. К примеру, в ранней фолликулиновой фазе дневная продукция андрогенов надпочечниками превышает таковую в яичниках, а по мере созревания фолликула андростендион и тестостерон в большем количестве секретируются яичниками (F. Fruzzetti et al. 1995).
Немаловажно, что определяющим моментом в биосинтезе андрогенов является строгая последовательность реакции гидроксилирования с участием ферментов семейства цитохром Р450, строго специфичных для каждого субстрата (Р45017а, Р45011b, P450C21 и Р450С18).
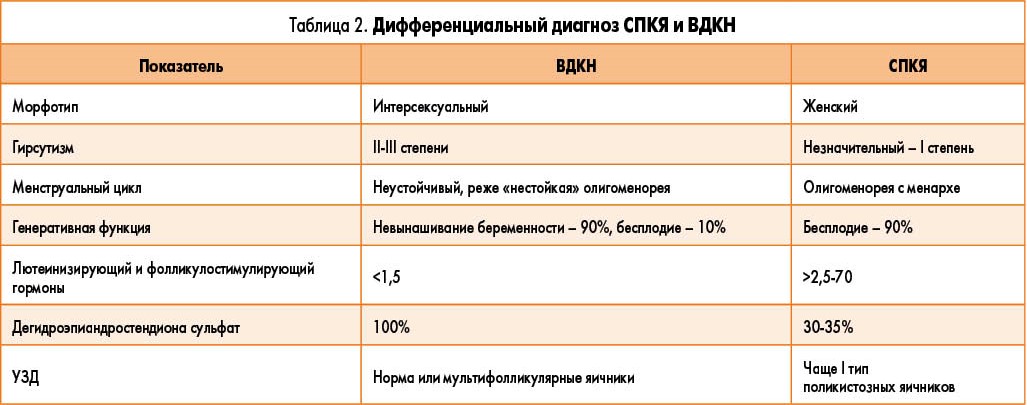
К одним из наиболее распространенных причин нарушения стероидогенеза относятся врожденная дисфункция коры надпочечников (ВДКН) и синдром поликистозных яичников (СКПЯ). Самой распространенной (классической) формой ВДКН (90-95% случаев) является недостаточность 21-гидроксилазы (простая вирилизирующая и сольтеряющая формы врожденной гиперплазии коры надпочечников), которая характеризуется дефицитом кортизола и альдостерона (из-за нарушения синтеза 11-дезоксикортизола из 17-гидроксипрогестерона и нарушения синтеза 11-дезоксикортикостерона из прогестерона), а также избытком надпочечниковых андрогенов (преимущественно андростендиона). Симптомы ВДКН (высокорослость в раннем пубертатном периоде и низкий окончательный рост, раннее закрытие зон роста, выраженное лобковое и подмышечное оволосение, гирсутизм или гипертрофия клитора, аменорея, олигоменорея у женщин) характерны именно для неклассической ее формы и чаще встречаются у детей старшего возраста, в пубертатном периоде и у взрослых (чаще у женщин).
Особого внимания заслуживает рассмотрение влияния инсулина на стероидогенез в яичниках:
- гиперсекреция инсулина стимулирует выработку андрогенов тека-клетками яичников;
- андрогены нарушают нормальное развитие фолликулов, приводя к множественной атрезии;
- избыток инсулина усиливает выброс лютеинизирующего гормона в ответ на стимуляцию гипофиза гонадолиберином, что приводит к увеличению выработки андрогенов тека-клетками яичников;
- избыток инсулина снижает синтез ГСПГ печенью, что приводит к увеличению свободного (биологически активного) тестостерона.
Исходя из вышеизложенного, становится понятно, что любые нарушения стероидогенеза в яичниках или в коре надпочечников, например, вследствие СПКЯ или ВДКН, приводят к серьезным сбоям в продукции андрогенов, что и является одной из первопричин развития гиперандрогении.
На первой международной конференции Национального института здоровья США (NIH) в 1990 г. впервые был рассмотрен вопрос диагностики СПКЯ. В результате основными его критериями было принято считать нарушение менструального цикла (олиго- или ановуляция), а также клинические и гормональные признаки гиперандрогении при отсутствии других причин (гиперпролактинемия, ВДКН, синдром Кушинга, тиреоидная патология, прием лекарственных препаратов). Однако в 2003 г. в Нидерландах на Международном консенсусе объединенных рабочих групп Европейского общества человеческой репродукции и эмбриологии и Американского общества репродуктивной медицины (European Society of Human Reproduction and Embryology & American Society for Reproductive Medicine – ESHRE & ASRM) была впервые достигнута договоренность о необходимости присвоения результатам ультразвуковой диагностики (УЗД) статуса равноправного диагностического критерия в оценке структуры ткани яичников и их размеров. В результате чего последним критерием диагностики СПКЯ стало наличие признаков «поликистозных яичников» по данным УЗД (табл. 1).
Возрастные особенности клинических проявлений гиперандрогении у девочек в препубертатном периоде (преждевременное адренархе) характеризуются ранним оволосением лобковой области (реже – лобковой и аксиллярной области), появлением запаха пота, увеличением скорости роста (не более чем на 2 единицы по стандартному отклонению – SD) и костного созревания (не более чем на 2 года от фактического). В пубертатном периоде у девочек с гиперандрогенией обычно наблюдаются гирсутизм, жирная себорея, угревая сыпь, нарушение менструального цикла, а также наличие признаков поликистоза яичников по результатам УЗД.
Алгоритм обследования девочек с гиперандрогенией должен включать:
- определение уровня гонадотропных гормонов и пролактина;
- определение основных стероидов: общего и свободного тестостерона, 17-ОН-прогестерона, дегидроэпиандростендиона сульфата, андростендиона;
- определение уровня ГСПГ;
- УЗД яичников;
- определение уровней иммунореактивного инсулина и глюкозы для исключения инсулинорезистентности.
Как мы уже выяснили, одними из основных причин нарушения стероидогенеза являются СПКЯ и ВДКН, однако для исключения возможной неэффективности терапии и определения направления лечения существует необходимость в дифференциальной диагностике этих заболеваний (табл. 2).
Функциональные пробы
Для подтверждения овариального происхождения андрогенов используют методы функциональных проб, в частности тест с аналогом люлиберина, при котором определяют уровень 17-ОН-прогестерона, андростендиона и тестостерона через 24 ч после введения аналога (диферелин 0,1 п/к). Повышение уровня 17-ОН-прогестерона и андростендиона в два и более раз свидетельствует об овариальном происхождении гиперандрогении. Для подтверждения надпочечникового происхождения андрогенов используют тест с синактеном (25 мг в/в). Повышение уровня 17-ОН-прогестерона и дегидроэпиандростендиона сульфата через 60 мин после введения синактена более чем в два раза, свидетельствует о функциональной надпочечниковой гиперандрогении.
Яичниковая (овариальная) гиперандрогения диагностируется:
- при появлении аменореи или олигоменореи после периода нормальных регулярных менструаций. Часто манифестирует после стрессовых ситуаций, прослеживается также отягощенная наследственность;
- при наличии женского морфотипа с умеренно выраженным гирсутизмом и ожирением по женскому типу;
- при увеличении яичников и поликистозе яичников по данным УЗД и при лапароскопии, а также при наличии ановуляции на фоне относительной и абсолютной гиперэстрогении;
- по результатам лабораторных данных и гормональных проб: высокий уровень тестостерона, лютеинизирующего гормона, повышенный индекс лютеинизирующего/фолликулостимулирующего гормонов, иногда гиперпролактинемия, а также положительная проба с хорионическим гонадотропином и др.
Надпочечниковая (адреналовая) гиперандрогения диагностируется:
- при характерном анамнезе (наследственность, позднее менархе, нарушение менструальной функции);
- при специфическом морфотипе со значительным гирсутизмом, гипоплазией половых органов и молочных желез, слабым развитием подкожно-жирового слоя;
- при наличии положительных результатов обследования (ановуляция, аменорея, неполноценность лютеиновой фазы цикла и др.);
- при определении по результатам лабораторных данных и гормональных проб высоких показателей: 17-кетостероида, дегидроэпиандростендиона сульфата, дегидроэпиандростендиона, тестостерона, 17α-гидропрогестерона, а также при положительной пробе с дексаметазоном и адренокортикотропным гормоном;
- при раннем закрытии зон роста по данным рентгенографического исследования.
Диагностика гиперандрогении у девочек должна осуществляться не ранее чем через 1-2 года после менархе. Наибольшую диагностическую ценность имеет выявленная при лабораторном анализе олигоменорея, продолжающаяся более 2 лет. Ультразвуковая картина мультифолликулярных яичников у подростков должна оцениваться в совокупности с другими клиническими проявлениями. У детей больше внимания должно уделяться исключению неклассической формы ВДКН.
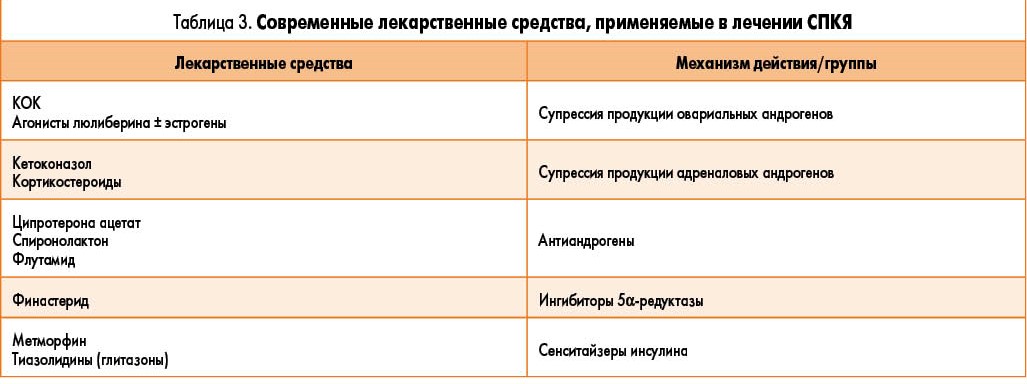
Медикаментозная терапия гирсутизма, акне и нарушений менструального цикла является методом первой линии в лечении СПКЯ (табл. 3).
В случае неэффективности медикаментозной терапии показано оперативное лечение. В настоящее время на смену устаревшим методам оперативных вмешательств (лапаротомия), характеризующимся высокой вероятностью последующего развития спаечного процесса, пришли более безопасные в плане послеоперационных осложнений и менее травматичные хирургические методики (лапароскопия с электрокаутеризацией поликистозных яичников). При этом оперативное лечение СПКЯ является наиболее эффективным по сравнению с другими методами и приводит к восстановлению менструального цикла у 95% и устранению бесплодия у 87% женщин (Р.А. Манушарова, Р.Г. Чарекишвили, 2003).
Подготовил Антон Вовчек