24 червня, 2020
І МІЖНАРОДНИЙ РЕСПІРАТОРНИЙ ФОРУМ З ІНГАЛЯЦІЙНОЇ ТЕРАПІЇ: практичні аспекти застосування світових рекомендацій
Внаслідок особливої чутливості до впливу факторів довкілля дихальна система є однією з найвразливіших в організмі людини. Це зумовлює високий рівень захворюваності та інвалідизації, асоційованої з респіраторною патологією. Так, гострі респіраторні інфекції нижніх дихальних шляхів (ДШ) – одна з трьох основних причин смерті та втрати працездатності як серед дитячої, так і серед дорослої популяції, а бронхіальна астма (БА) є найпоширенішим хронічним захворюванням, що маніфестує в дитинстві та вражає 14% дітей в усьому світі. У зв’язку з регулярним оновленням Глобальних рекомендацій з лікування обов’язковою умовою належного ведення пацієнтів із захворюваннями ДШ є безперервне навчання лікарів. Одним із науково-освітніх заходів, який дав можливість спеціалістам із різних сфер медицини поглибити свої знання щодо особливостей інгаляційного лікування респіраторної патології, став І Міжнародний респіраторний форум з інгаляційної терапії за участю топових експертів із пульмонології, алергології та педіатрії. Захід було проведено у форматі онлайн через ситуацію, що склалася внаслідок пандемии SARS-CoV-2. Форум був організований Асоціацією безперервної професійної освіти лікарів та фармацевтів за підтримки Національної медичної академії післядипломної освіти імені П.Л. Шупика та Міжнародної фармацевтичної корпорації «Юрія-Фарм», медіапартнером виступив журнал «Астма та алергія». Він об’єднав фахівців не лише з України, але й з Молдови, Узбекистану, Таджикистану, Грузії, Азербайджану та Киргизстану. Найкращим підтвердженням успіху заходу, його актуальності та зацікавленості аудиторії є кількість переглядів, яка сягнула 10 тис протягом 2 тиж після проведення форуму.
 Знаковим можна вважати факт, що форум проходив 1 червня, у Міжнародний день захисту дітей, тому акцент у виступах був зроблений на ведення саме цієї найбільш уразливої когорти пацієнтів. Модератором заходу виступив провідний науковий співробітник ДУ «Національний інститут фтизіатрії і пульмонології ім. Ф.Г. Яновського НАМН України» (м. Київ), доктор медичних наук, професор Ярослав Олександрович Дзюблік.
Знаковим можна вважати факт, що форум проходив 1 червня, у Міжнародний день захисту дітей, тому акцент у виступах був зроблений на ведення саме цієї найбільш уразливої когорти пацієнтів. Модератором заходу виступив провідний науковий співробітник ДУ «Національний інститут фтизіатрії і пульмонології ім. Ф.Г. Яновського НАМН України» (м. Київ), доктор медичних наук, професор Ярослав Олександрович Дзюблік.
З першою доповіддю, яку було присвячено єдиному хронічному алергічному респіраторному синдрому в дітей, виступила завідувачка кафедри педіатрії № 1 Національної медичної академії післядипломної освіти ім. П.Л. Шупика (м. Київ), віцепрезидент Асоціації дитячих алергологів України, доктор медичних наук, професор Олена Миколаївна Охотнікова.
.jpg) Європейська алергологічна школа вже давно пропонує не розділяти ДШ на верхні та нижні, а розглядати їх як єдине ціле – об’єднані ДШ (united airways), оскільки алергія вражає одночасно верхні та нижні відділи респіраторного тракту, хоча частіше починається з місця первинного контакту з алергеном – верхніх ДШ, алергічного риніту (АР).
Європейська алергологічна школа вже давно пропонує не розділяти ДШ на верхні та нижні, а розглядати їх як єдине ціле – об’єднані ДШ (united airways), оскільки алергія вражає одночасно верхні та нижні відділи респіраторного тракту, хоча частіше починається з місця первинного контакту з алергеном – верхніх ДШ, алергічного риніту (АР).
Встановлений зв’язок між алергічними захворюваннями (АЗ), такими як АР, БА та атопічним дерматитом (АД). Асоціація АР та БА пояснюється низкою анатомо-фізіологічних факторів, зокрема схожістю епітелію та однаковою адренергічною та вагусною інервацією носа та бронхіол. Патогенез обох захворювань теж спільний: внаслідок інфільтрації мастоцитами, Т-лімфоцитами та еозинофілами виникає хронічне алергічне запалення, яке й зумовлює головну функціональну ознаку АР та БА – обмеження повітряного потоку. Ризик розвитку астми в пацієнтів з АР втричі вищий, ніж у пацієнтів з АД, але без АР; також важливо розуміти, що без адекватного лікування саме АР контроль над наявною БА неможливий (European Respiratory Society, 2017).
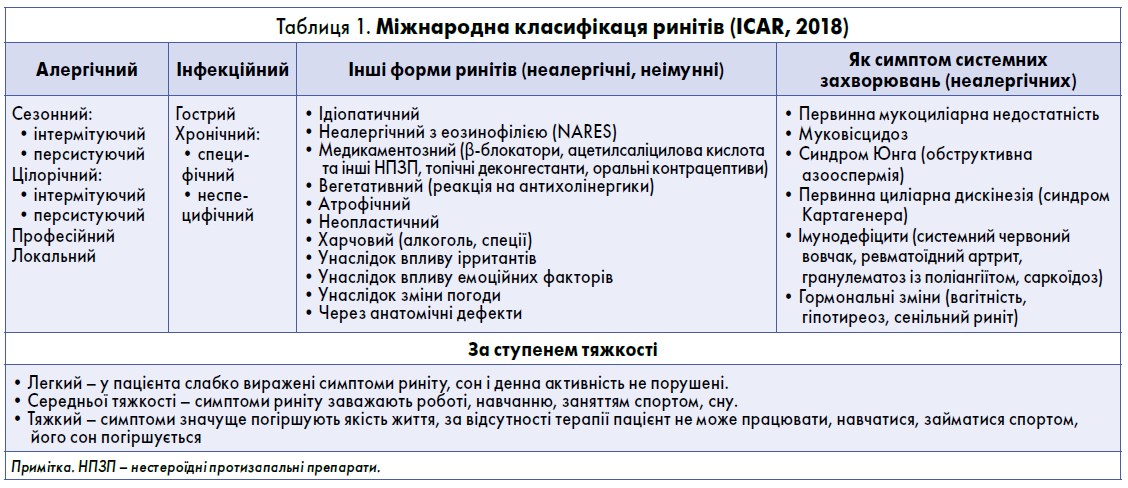
Риніт – найпоширеніше у світовій популяції серед усіх хронічних захворювань. Частота виникнення риніту в дітей становить 35-37%, з них 50% випадків – стають хронічними. Риніт негативно впливає на якість життя пацієнтів та асоційований з високими прямими й непрямими витратами, що робить його значущим соціально-економічним тягарем. Міжнародна класифікація ринітів (табл. 1) включає низку захворювань, з яких лише АР детально охарактеризований в послідовних версіях міжнародних програм ARIA (2016) та ICAR (2018) (ARIA 2008; ARIA 2010; ARIA 2016; Bousquet J. et al., 2015).
У масштабному шведському дослідженні BAMSE, яке включило 2916 дітей з алергічною патологією, оцінювали частоту АЗ у дітей від народження й до 12 років та простежували розвиток коморбідності АР, БА та АД. Було встановлено, що майже в 60% спостережуваних у віці 12 років було наявне одне із захворювань або їх комбінація (Ballardini N. et al., 2012).
Згідно з результатами власних досліджень, які велися в Київському регіоні в період із 2017 по 2019 рік, у дітей перших 6 років життя частота АР становила 50,8%, з них АР із повторними епізодами бронхообструкції (підозра на БА) – 27,4%, поєднання АР та БА – 23,9%; загальна коморбідність АР з повторним обструктивним бронхітом та діагностованою БА – 51,2%, поєднання АР з АД зазначено в 19% випадків, а комбінація усіх трьох патологій – у 10%. Дані про поширеність симптомів АР, за результатами програми ISAAC, представлені в таблиці 2.
Результати досліджень, як власного, так і BAMSE, показали, що в 70-80% дітей БА маніфестує в перші 5-6 років життя, у 15-20% – на 1-му році життя. При цьому асоціація БА з АР та/або АД спостерігалася в 38% випадків у дітей віком до 1 року та в 67% – до 12 років (Ballardini N. et al., 2012).
Рання діагностика та контроль симптомів АР є невід’ємною складовою успішного контролю інших АЗ, зокрема БА та АД. Діагностика ринітів включає (Hellings et al., 2017):
1. Збір анамнезу та фізикальне обстеження.
2. Риноскопію – обов’язкова для всіх лікарів первинного контакту.
3. Активний пошук додаткових проявів: «алергічний салют», «алергічне обличчя».
4. Алергологічну діагностику, у тому числі сучасну: шкірні прик-тести, специфічні IgE, провокаційні проби з алергенами.
5. За наявності симптомів зниження слуху – тимпанометрію, акустичну імпендансометрію.
6. Комп’ютерну томографію (КТ) приносових синусів (за показами).
7. Ендоскопію носоглотки (за показами).
8. Назальний мукоциліарний кліренс і вміст NO в слизовій носа.
9. Полісомнографію за підозри на синдром обструктивного апное сну.
10. Консультацію сурдолога, ендокринолога.
11. Цитологію мазків слизової носа.
12. Вміст еозинофілів та загального IgE в сироватці крові.
13. Рівень показників функції зовнішнього дихання, тести з бронхолітиком та фізичним навантаженням.
Наступним кроком після встановлення діагнозу АР є підбір оптимальної лікувальної тактики.
Доповідачка наголосила, що головною метою теріпії є полегшення симптомів захворювання. Лікування АР має призначатися вже на етапі первинного контакту з пацієнтом. Воно включає:
- обмеження контакту з патогенетично значимими алергенами та іншими тригерами;
- пробну патогенетичну терапію;
- навчання пацієнта та його батьків;
- алерген-специфічну імунотерапію (АСІТ).
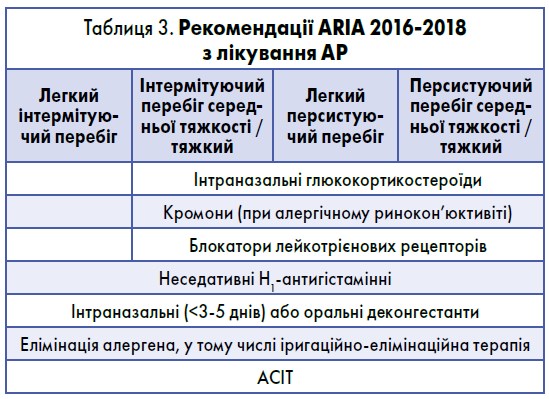 Останній пункт потребує направлення до алерголога, але перші три абсолютно доступні й для лікарів загальної практики – сімейної медицини. Варіанти пробної терапії на етапі первинного контакту з хворим на АР згідно з рекомендаціями ARIA відображені в таблиці 3.
Останній пункт потребує направлення до алерголога, але перші три абсолютно доступні й для лікарів загальної практики – сімейної медицини. Варіанти пробної терапії на етапі первинного контакту з хворим на АР згідно з рекомендаціями ARIA відображені в таблиці 3.
Оскільки хворі на АР найчастіше скаржаться на закладеність носа, необхідно обрати засіб, який буде ефективно та безпечно відновлювати носове дихання. Це передусім важливо в дітей, в яких порушення носового дихання не лише погіршує щоденну якість життя, але й загрожує розвитком віддалених ускладнень, зокрема зниженням когнітивної функції (Lack G. et al., 2001).
Найчастіше використовують деконгестанти, однак профіль безпеки цих препаратів характеризується ризиком виникнення низки небажаних реакцій, таких як сухість слизових оболонок, синдром «рикошета» та отруєння, особливо в дітей раннього віку. За даними відділення токсикології НДСЛ «Охматдит», назальні деконгестанти посідають 3-тє місце в структурі дитячих отруєнь (Пухлик С.М., 2012; Пухлик С.М., 2008).
Найбільш дієвою та ефективною альтернативою назальних деконгестантів є елімінаційно-іригаційна терапія гіпертонічними сольовими розчинами. Внаслідок осмотичного впливу на слизову носа вони зменшують набряк, відновлюють носове дихання та зменшують локальні прояви запалення. Цей вид терапії високоефективний не лише при АР, але й при інших ринітах, навіть якщо механізм розвитку невідомий.
Перспективним є застосування гіпертонічних розчинів у комбінації з речовинами, які б посилювали властивості перших, впливаючи на інші ланки патогенезу. У даному аспекті все більше уваги приділяється гіалуроновій кислоті (ГК), яка є одним з основних компонентів позаклітинного матриксу та відіграє важливу роль у процесах проліферації та міграції клітин (Охотникова Е.Н., 2018). Механізм дії ГК полягає в тому, що вона з перших годин після пошкодження зв’язується з фібриновою сіткою, формуючи перехідний матрикс. Указана речовина має високі гідрофільні властивості, завдяки яким на пошкодженій поверхні формується вологе середовище, посилюється міграція фібробластів, проліферація епітеліальних клітин і відновлюються пошкоджені тканини.
Вдосконалений гіпертонічний розчин, який поєднує в собі ГК і 3% хлорид натрію, представлений на ринку України міжнародною спеціалізованою фармацевтичною корпорацією «Юрія-Фарм» (м. Київ, Україна) під торговою назвою LORDE® hyal. Продукт дозволений для використання у дітей від народження. LORDE® hyal є ефективним для іригаційно-елімінаційної терапії, рекомендованої ARIA, оскільки впливає на безліч ланок патогенезу риніту. Так, при проведенні досліджень ефективності застосування комбінації ГК із 3% хлоридом натрію в якості іригаційної терапії було продемонстровано, що таке лікування:
- зменшує набряк і полегшує дихання завдяки осмотичному впливу (Rayahin J.E., et al., 2015);
- пригнічує запалення шляхом інгібування продукції протизапальних медіаторів;
- покращує мукоциліарний кліренс унаслідок виведення з носа пилу та алергенів (Gelardi M. et al., 2013);
- посилює процеси репарації (Gouteva I. et al., 2014).
Наприкінці доповіді Олена Миколаївна акцентувала увагу на тому, що слизова оболонка носа в немовлят потребує особливого щоденного догляду не лише в разі захворювання. Це пояснюється анатомо-фізіологічними особливостями будови ДШ, нездатністю малюків самостійно очищувати носові ходи та частими зригуваннями після годування, які зумовлюють подразнення слизової носа та носоглотки внаслідок потрапляння кислого вмісту шлунка, що призводить до утруднення носового дихання [16]. Для полегшення цього симптому прийнято застосовувати ізотонічні засоби, суттєвим недоліком яких є невелика тривалість дії, адже вони зволожують слизову лише в момент закрапування. Застосування ГК дає можливість досягти тривалого зволоження, що покращує мукоциліарний кліренс, запобігає адгезії вірусів, бактерій та алергенів і сприяє процесам репарації та регенерації, які відбуваються постійно навіть за відсутності захворювань.
NASISOFT , який є по суті розчином ГК, може застосовуватися для щоденного догляду та профілактики захворювань носа в дітей починаючи з 1-го дня життя.
 Особливості ведення гострих респіраторних вірусних інфекцій (ГРВІ) у дітей з обтяженим алергологічним анамнезом стали темою доповіді заступниці директора з наукової роботи Міжнародного центру молекулярної алергології (м. Ташкент, Узбекистан), доктора медичних наук Гульнари Сулейманівни Джамбекової.
Особливості ведення гострих респіраторних вірусних інфекцій (ГРВІ) у дітей з обтяженим алергологічним анамнезом стали темою доповіді заступниці директора з наукової роботи Міжнародного центру молекулярної алергології (м. Ташкент, Узбекистан), доктора медичних наук Гульнари Сулейманівни Джамбекової.
У загальній популяції на гострі респіраторні захворювання (ГРЗ) припадає більш як 90% усієї інфекційної патології та не менше 70% загальної захворюваності. Щороку на ГРЗ хворіє 500 млн людей, 2 млн з яких гине. У 80% випадків причиною цих захворювань є віруси. Діти з алергічними захворюваннями хворіють на ГРВІ ще частіше, при цьому перебіг захворювань зазвичай затяжний, погано піддається терапії звичними схемами лікування, протікає важче, ніж у пацієнтів із необтяженим алергологічним анамнезом і часто супроводжується розвитком ускладнень (Зайцев А.А., 2009; Ciprandi G. et al., 2006).
Спікерка зазначила, що прослідковується зв’язок між ГРВІ та ризиком розвитку БА. Так, у дослідженні Inoue та співавт. було виявлено, що частота епізодів ГРВІ в 1-й рік життя асоційована з підвищеним ризиком виникнення БА у віці 7 років. Одним із предикторів розвитку БА в майбутньому можуть бути вірус-індуковані епізоди свистячого дихання, так званого візингу (Inoue Y., Shimojo N., 2013).
У 2008 р. робоча група Європейської респіраторної спілки (ERS) виділила (Brand P.L. et al., 2008):
- «епізодичний візинг, викликаний вірусами», який виникає лише в епізоди ГРВІ;
- «рецидивуючий візинг, викликаний багатьма тригерами» – симптоми виникають не лише при ГРВІ, але й під впливом інгаляційних, харчових алергенів, зміни погоди, фізичних та емоційних навантажень.
У подальшому ERS було ініційовано низку додаткових досліджень, у ході яких було виявлено:
- на тлі ГРВІ візинг і кашель виникали в більшості дітей протягом перших трьох років життя, кожна 3-тя дитина мала хоча б 1 епізод візингу на 1-му році життя (Eber Е. et al., 2013);
- ГРВІ грають роль тригера бронхіальної обструкції в 60% дошкільнят (Martinez F.D. et al., 2013);
- епізоди бронхіальної обструкції продовжувалися в 40% дітей шкільного віку, що було асоційовано з екземою, сімейним анамнезом БА і підвищенням рівня IgE (Lasso-Pirot A. et al., 2015).
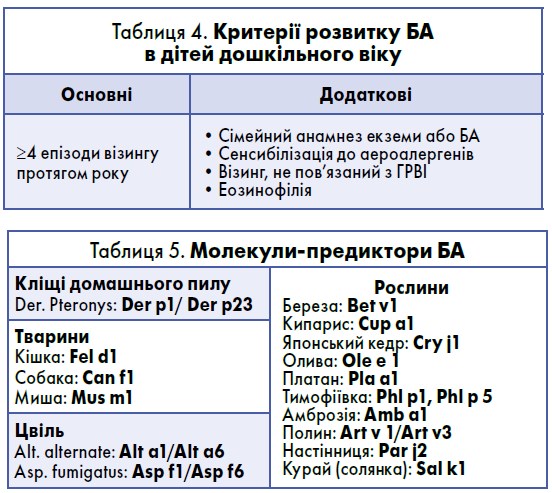 Однак синдром візингу в дітей дошкільного віку не є єдиним предиктором БА і може бути проявом інших захворювань. Критерії, за якими можна виявити дітей, схильних до розвитку астми, відображені в таблиці 4 (Tenero L. et al., 2016).
Однак синдром візингу в дітей дошкільного віку не є єдиним предиктором БА і може бути проявом інших захворювань. Критерії, за якими можна виявити дітей, схильних до розвитку астми, відображені в таблиці 4 (Tenero L. et al., 2016).
Відповідно до консенсусу WAO-ARIA-GA2LEN з молекулярної діагностики алергії чутливість до певних молекул (табл. 5) також підвищує ризик виникнення БА (Canonica G.W. et al., 2013).
Рецидивуючі респіраторні інфекції верхніх та нижніх ДШ, які супроводжуються прийомом антибіотиків (АБ), підвищують ризик виникнення АЗ (АР і БА), що необхідно враховувати при виборі лікування дітей з ГРВІ (Tiago Bittencourt de Oliveira et al., 2020). Гульнара Сулейманівна підкреслила важливість пояснення батькам етіологічних чинників ГРВІ та небезпеки, яка криється за призначенням АБ без достатніх на те підстав.
Безумовними перевагами локальних та інгаляційних препаратів у лікуванні ГРВІ в дітей вважають такі:
- місцева дія, яка мінімізує системні побічні ефекти;
- відсутні допоміжні речовини й барвники, які можуть спровокувати алергічні реакції;
- ліки потрапляють безпосередньо у вогнище захворювання та діють відразу.
Вибір противірусного препарату залежить від рівня ураження ДШ. Так, при ринофарингіті доцільно використовувати інтраназальні лікарські засоби, які мають противірусний і протиалергічний ефект. Таким препаратом є амінокапронова кислота (АКК®). Ця речовина блокує на ранніх етапах взаємодію вірусу з чутливими клітинами, пригнічує протеолітичний процесинг гемаглютиніну, інгібує протеолітичну активність вірусу грипу. Клінічна ефективність препарату підтверджена результатами дослідження Лозицького та співавт., які вивчали вплив препарату на частоту ГРВІ у часто хворіючих дітей віком 3-6 років (>6 ГРВІ на рік). Дітям було призначено 2 двотижневі курси АКК® інтраназально: перший – у вересні, а другий – у період епідеміологічного підйому захворюваності на грип. У результаті частота ГРВІ в досліджуваній групі скоротилася на 60%, а середня тривалість епізоду захворювання – на 2,7 дня, причому епідеміологічна ефективність, згідно з даними досліджень, зберігалася протягом 4 місяців (Гридіна Т.Л., 2010).
При гострому бронхіті, який є найбільш поширеною причиною нераціонального застосування АБ у педіатричній практиці, доцільно призначити місцевий антимікробний препарат, який матиме не лише широкий бактерицидний, але й віруліцидний спектр дії. Таким препаратом є Декасан® виробництва корпорації «Юрія-Фарм». Доповідач зауважила, що Декасан® завоював велику прихильність серед медичної спільноти завдяки широті спектра дії та низькому ризику розвитку побічних реакцій. Ці переваги допомагають запобігти приєднанню вторинної інфекції в дітей з бронхітом, у тому числі і в імуноскомпрометованих осіб, до яких належать і діти зі схильністю до алергій. Механізм дії активної діючої речовини препарату – декаметоксину полягає у зв’язуванні з ліпідами суперкапсиду і порушенні цілісності мікроорганізму.
Рандомізоване відкрите порівняльне дослідження з ефективності та безпеки препарату Декасан® проводилося на базі ДЗ «Дніпропетровська медична академія МОЗ України» (м. Дніпро). У дослідження були включені 146 пацієнтів віком 12–18 років із підтвердженим діагнозом інфекційного загострення хронічного бронхіту, типовою перкуторною та аускультативною картиною та даними рентгенографії. Оцінку симптомів проводили під час 2-го (3–5-й день) та 3-го (10–14-й день) візиту. У результаті було виявлено, що додаткове призначення препарату Декасан® в контейнерах інгаляційно зменшує тривалість та тяжкість симптомів інтоксикації та катаральних симптомів у середньому на 2 дні, скорочує тривалість загострення на 1,6 дня. Застосування Декасану в іншому дослідженні продемонстровало можливість уникнення невиправданого призначення АБ у разі нетяжкого перебігу інфекційного загострення хронічного бронхіту (Гуменюк М.І., 2019).
 У багатьох пацієнтів виникають труднощі з використанням інгаляторів, що призводить до неправильного розподілу лікарського засобу в ДШ, необґрунтованого збільшення об’єму терапії, появі побічних реакцій та підвищення вартості лікування. З практичними аспектами небулайзерної терапії ознайомила присутніх науковий керівник відділення дитячої пульмонології та алергології ДУ «Національний інститут фтизіатрії і пульмонології ім Ф.Г. Яновського НАМН України», доктор медичних наук Олена Олександрівна Речкіна.
У багатьох пацієнтів виникають труднощі з використанням інгаляторів, що призводить до неправильного розподілу лікарського засобу в ДШ, необґрунтованого збільшення об’єму терапії, появі побічних реакцій та підвищення вартості лікування. З практичними аспектами небулайзерної терапії ознайомила присутніх науковий керівник відділення дитячої пульмонології та алергології ДУ «Національний інститут фтизіатрії і пульмонології ім Ф.Г. Яновського НАМН України», доктор медичних наук Олена Олександрівна Речкіна.
Небулайзер представляє собою інгаляційний пристрій для розпилення лікарських речовин, який дає можливість отримати дрібнодисперсний аерозоль з оптимальним розміром частинок від 0,5 до 5 мкм, які легко проникають у дрібні бронхи, бронхіоли та альвеоли.
Головним параметром ефективності інгаляційного пристрою є легенева депозиція, яка може коливатися від 4 до 85% від обраної дози та залежить від:
1. Розміру частинок аерозолю.
Необхідно використовувати лише розчини, призначені для небулізації і в жодному разі – відвари трав, сиропи, подрібнені таблетки чи мінеральну воду. Також заборонено призначати в одній інгаляції суміш із 4-5 препаратів. Дозволяється змішувати не більше двох препаратів, сумісність яких описана в інструкції для медичного застосування кожного лікарського засобу.
2. Правильності техніки інгаляції.
У дітей старше 3-4 років необхідно проводити процедуру за допомогою мундштука, а не маски, оскільки нещільне прилягання маски знижує поступлення ліків до легень.
3. Факторів із боку пацієнта (вік, анатомо-фізіологічні особливості ДШ).
Носова депозиція збільшується з віком: у дітей до 8 років у носовій порожнині осідає приблизно 13% аерозолю, а в дорослих цей показник становить уже 22%. Протипоказів до застосування небулайзерів небагато, але вони існують. Абсолютними протипоказаннями до використання небулайзера є легенева кровотеча, травматичний або спонтанний пневмоторакс, бульозна емфізема, серцева аритмія або тяжка серцева недостатність, тоді як гарячка не вважається протипоказом до небулайзерної терапії (Дубиніна В.П., 2005).
4. Типу інгаляційного пристрою.
Незважаючи на тривалий досвід використання небулайзерів у клінічній практиці, досі допускаються помилки, які роблять цей вид лікування неефективним. Передусім це стосується гігієни користування небулайзером. Лікар має пояснювати пацієнту, що пристрій може бути забруднений патогенними мікроорганізмами. У домашніх умовах небулайзери потрібно очищати після кожної процедури та використовувати для інгаляцій одноразові контейнери. Якщо для небулізації призначено суміш розчинів, її необхідно використати протягом 30 хв після приготування, а відкрита небула придатна до інгаляції не довше 12 год: ранок – вечір; вечір – ранок (Douglas S. Gardenhire et al., 2017).
Спікерка наголосила на тому, що важливий момент небулайзерної терапії пов’язаний з використанням інгаляційних кортикостероїдів (ІКС). Регулярне використання ІКС для лікування БА та бронхообструктивного синдрому (БОС) не призводить до звикання та побічних реакцій, характерних для системних стероїдів. Ці препарати не потрібно відміняти поступово або в першу чергу: синдрому відміни при використанні ІКС не буває.
До того ж усі світові респіраторні спілки (GINA, Asthma and Allergy Foundation of America, European Lung Foundation, British Thoracic Society – BTS, World Allergy Organization – WAO), Центр контролю захворювань США (CDC), ВООЗ та інші наголошують на необхідності постійної підтримувальної терапії БА, навіть в умовах пандемії, бо відміна ІКС може спровокувати потенціально гірші ризики для здоров’я, ніж COVID‑19. Експерти Британської респіраторної спілки акцентували увагу на тому, що небулайзер не утворює вірус-вмісного аерозолю, оскільки краплинки аерозолю формуються від небулайзера, а не від пацієнта (BTS, 2020).
Аналогічний підхід до використання небулайзерної терапії застосовують і експерти NICE, коротка настанова з ведення пацієнтів із тяжкою БА в умовах пандемії COVID-19 включає наступні рекомендації для пацієнтів, їхніх батьків або опікунів:
1. Продовжити використання ІКС, тому що їх відміна може підвищити ризик загострення БА.
2. Немає жодних доказів того, що ІКС підвищують ризик зараження COVID-19.
3. Необхідно регулярно мити руки та очищувати маски, мундштуки та пристрої для вимірювання пікової швидкості видиху за допомогою миючого засобу або згідно з інструкцією виробника стосовно очищення.
4. Не ділитися своїми інгаляторами та пристроями ще з кимось.
Флютиказон (Небуфлюзон®) – це саме той ІКС, ефективність та безпека якого в пацієнтів із БА та БОС доведені не лише в ході клінічних досліджень, але й тривалим досвідом використання в умовах реальної клінічної практики. У рекомендованих для інгаляцій дозах
Небуфлюзон® чинить потужну протизапальну дію на дихальну систему, що сприяє зменшенню симптоматики і частоти нападів астми. Пероральна біодоступність препарату – <1%, тому системна дія виражена мінімально, що робить його безпечним навіть для наймолодших пацієнтів.
 Доцент кафедри педіатрії № 2 Вінницького національного медичного університету (НМУ) ім. М.І. Пирогова, кандидат медичних наук Наталія Іванівна Сінчук присвятила свою доповідь проблемі кашлю в дітей раннього віку.
Доцент кафедри педіатрії № 2 Вінницького національного медичного університету (НМУ) ім. М.І. Пирогова, кандидат медичних наук Наталія Іванівна Сінчук присвятила свою доповідь проблемі кашлю в дітей раннього віку.
За даними США, Британії та ERS, саме кашель є найчастішою причиною звернення пацієнтів або їхніх батьків до сімейного лікаря. Це не окрема нозологія, а саме симптом, який може супроводжувати десятки захворювань, і не обов’язково дихальної системи (рис. 1) (Таточенко В.К., 2008).
Щодо кашлю в дітей раннього віку, слід пам’ятати, що анатомо-фізіологічні особливості бронхіального дерева в цей період зумовлюють схильність до бронхіальної обструкції, в основі якої лежить набряк слизової.
Одним із проявів вірусного ураження нижніх ДШ у дітей до 2 років є бронхіоліт. Патогенез цього стану зумовлений поєднанням набряку стінки ДШ, посиленою секрецією слизу і порушенням кліренсу, що призводить до обструкції ДШ, зниження сатурації.
Клінічно бронхіоліт проявляється у вигляді швидкого розвитку дихальної недостатності за відсутності вираженої інтоксикації в дітей віком до 2 років. Фізикально реєструється задишка змішаного характеру з великою кількістю мілких вологих двосторонніх хрипів, ціаноз та відсутність реакції на бронхіолітики. Рентгенологічно виявляється посилення легеневого малюнку та явища емфіземи (перибронхіального ущільнення).
Доповідачка сфокусувала увагу на тому, що оскільки бронхообструкція при бронхіоліті спровокована не бронхоспазмом, а набряком слизових оболонок, то й лікування має бути направлене саме на цю патогенетичну ланку. 3% натрія хлорид значно ефективніший порівняно з сальбутамолом при гострому бронхіоліті, що підтверджено в подвійному сліпому дослідженні, проведеному в лікарні Хаджар (м. Шахрекорд, Іран) з 2011 по 2012 рік. Було показано, що використання сальбутамолу в дітей із гострим бронхіолітом було достовірно менш ефективним, ніж терапія порівняння (3% NaCl) (Mohammad-Ali Zamani et al., 2015). Більшість рандомізованих досліджень показують, що інгаляція 3% розчином NaCl достовірно скорочувала тривалість перебування в стаціонарі та покращувала показники клінічної картини у дітей віком до 2 років із гострим вірусним бронхіолітом.
Гіпертонічний розчин завдяки осмотичній дії усуває набряк слизової, який є причиною обструкції в дитини віком до 2-х років, забезпечуючи ефективну роботу війок та очищення ДШ (Mandelberg A. et al., 2010). Ефективність гіпертонічного розчину натрію хлориду (ГРНХ) має вагому доказову базу.
Метааналіз 11 рандомізованих досліджень за участю 1090 пацієнтів із бронхіолітом показав, що гіпертонічний розчин NaCl скорочує середню тривалість перебування в стаціонарі на 1,2 дня та покращує показники клінічної тяжкості як для амбулаторних, так і для стаціонарних груп пацієнтів (Zhang L. et al., 2016; Sarrell E.M. et al., 2002).
Ефективним і безпечним гіпертонічний розчин виявився в лікуванні не лише бронхіоліту, але й муковісцидозу. M. Rosenfeld та співавт. в дослідженні за участю дітей віком 12-30 міс, які отримували ГРНХ протягом 2 тиж, показали, що засіб добре переносився маленькими пацієнтами (Rosenfeld M. et al., 2012). Особливе клінічне значення мало використання препарату в дітей раннього віку, оскільки ГРНХ стимулює кашльовий рефлекс, що полегшує відходження мокроти (Шерман В.Д., 2013).
LORDE® hyal – єдиний в Україні інгаляційний засіб для полегшення кашлю, який містить 3% розчин NaCl із ГК та може розглядатися в якості продукту вибору при лікуванні БОС у дітей раннього віку. Застосування 3% розчину NaCl в лікуванні кашлю визнано доцільнім у низці міжнародних рекомендацій, зокрема в «Настанові з використання небулайзерів у домашніх умовах» Британської торакальної спілки, ERS та Американської торакальної спілки.
 На аспектах діагностики й лікування БОС у дітей зосередив свою увагу доцент кафедри пропедевтики дитячих хвороб Вінницького НМУ ім. М.І. Пирогова, засновник громадської організації «Подільський союз педіатрів» (м. Вінниця, Україна), кандидат медичних наук Олександр Васильович Катілов.
На аспектах діагностики й лікування БОС у дітей зосередив свою увагу доцент кафедри пропедевтики дитячих хвороб Вінницького НМУ ім. М.І. Пирогова, засновник громадської організації «Подільський союз педіатрів» (м. Вінниця, Україна), кандидат медичних наук Олександр Васильович Катілов.
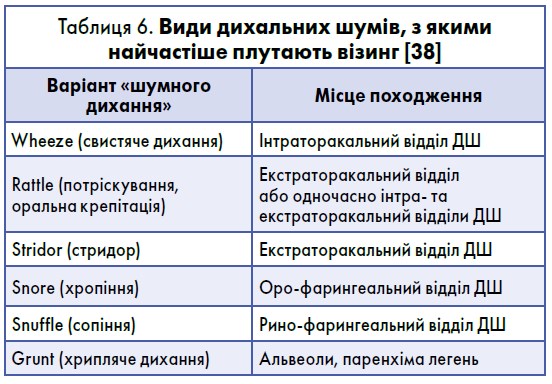
Більш поширеним терміном, який наразі використовується лікарями для опису епізодів свистячого дихання, є не «бронхообструкція», а «візинг» (Brand P.L. et al., 2008). Практичне значення диференціювання візингу з іншими дихальними шумами, описаними в таблиці 6, полягає в різниці їх патоетіології, а отже й підході до лікування.
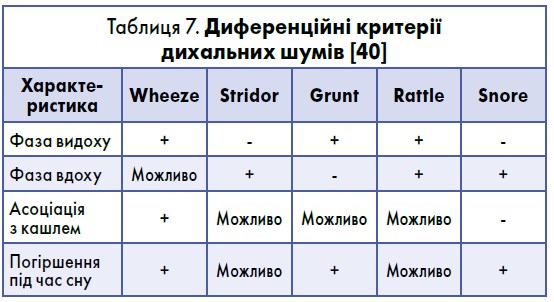
Найчастіше батьки плутають візинг саме з rattle (потріскування, оральна крепітація). Помилки в розмежуванні цих термінів можуть стати причиною гіпердіагностики БА в дітей раннього віку (ERS, 2013). Принципи диференційної діагностики дихальних шумів представлені в таблиці 7.
Олександр Васильович зауважив, що ще одним важливим критерієм диференціальної діагностики візингу є відповідь на бронходилататори (сальбутамол), що дає можливість відрізнити БА та вірус-індукований візинг від інших захворювань, які супроводжуються візингом (Lisa Noble Weiss, 2008).
Вірус-індукований візинг не завжди є предиктором астми в дітячій популяції. Ризик розвитку БА в майбутньому підвищений лише в тих дітей, які відповідають певним критеріям (табл. 8) (Castro-Rodriguez J.A. et al., 2000).
Для терапії загострень вірус-індукованого візингу використовують покрокову терапію препаратами, які відображені на рисунку 2 (BTS/SIGN, 2019).
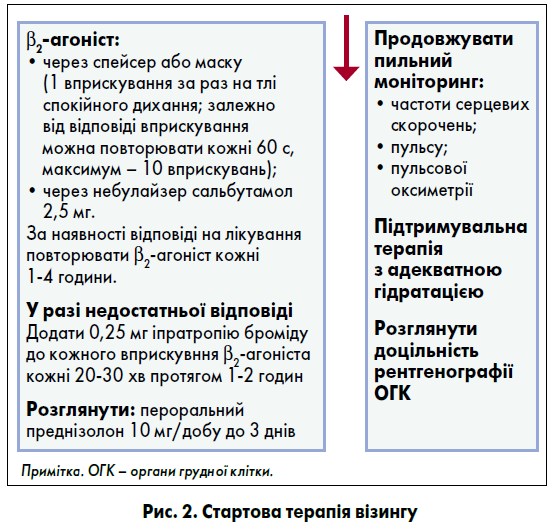 Крок 1: β2-агоніст короткої дії. Відповідно до більшості міжнародних настанов саме сальбутамол серед усіх β2-агоністів має використовуватися для стартової терапії візингу (Британська торакальна спілка (BTS) / Шотландська міжколегіальна мережа клінічних настанов (SIGN), 2019). Цікавим є те, що в рекомендаціях Національного інституту здоров’я та клінічного вдосконалення Великої Британії за 2019 рік було вказано, що в цій країні β2-агоніст фенотерол навіть не зареєстрований.
Крок 1: β2-агоніст короткої дії. Відповідно до більшості міжнародних настанов саме сальбутамол серед усіх β2-агоністів має використовуватися для стартової терапії візингу (Британська торакальна спілка (BTS) / Шотландська міжколегіальна мережа клінічних настанов (SIGN), 2019). Цікавим є те, що в рекомендаціях Національного інституту здоров’я та клінічного вдосконалення Великої Британії за 2019 рік було вказано, що в цій країні β2-агоніст фенотерол навіть не зареєстрований.
Потрібно надавати перевагу інгаляційному сальбутамолу над пероральним. Якщо порівняти інструкції цих двох лікарських форм, можна побачити, що частота таких побічних явищ, як тремор, тахікардія та аритмія, при використанні інгаляційного сальбутамолу спостерігається вдесятеро рідше. Саме тому не треба одночасно призначати інгаляційний і пероральний сальбутамол, адже це потенціює згадані побічні ефекти. Режим введення залежить від тяжкості загострення:
- при легкому загостренні сальбутамол призначають по 1 дозі (2,5 мг через небулайзер) 3-4 р./добу;
- при помірному й тяжкому візингу призначають 3 послідовні дози сальбутамолу кожні 20 хв;
- при загостренні, яке загрожує життю (status asthmaticus), рекомендована безперервна терапія сальбутамолом через небулайзер протягом першої години.
β2-агоністи призначають у високих дозах (Shilpa J. Patel et al., 2019):
- у дітей вагою ≥5 кг (3 міс) до 30 кг (10 років) разова доза при введенні через небулайзер становить 2,5 мг;
- разова доза сальбутамолу в дітей вагою ≥30 кг становить 5 мг.
Підбирати дози 2,5-5 мг потрібно за допомогою одного або більше контейнеру Небутамолу. У разі невираженого ефекту сальбутамол можна повторювати кожну годину.
Перевагою сальбутамолу над іншими β2-агоністами є висока селективність до рецепторів бронхів (в 11,5 раза вища за фенотерол), менша взаємодія з рецепторами міокарду і, відповідно, менший ризик тахікардії (Чачулін А.Г. та ін., 2008; Billington C.K. et al., 2017).
Рекомендується віддавати перевагу інгаляційному введенню сальбутамолу перед пероральними формами. Адже порівняльний аналіз двох інструкцій - для перорального та інгаляційного введення сальбутамолу показує, що частота побічних дій, зокрема тремору, тахікардії, аритмії, удесятеро рідша при використанні саме інгаляційного сальбутамолу. Необхідно також пам'ятати про небезпеку одночасного призначення перорального та інгаляційного сальбутамолу або іншого β2-агоніста.
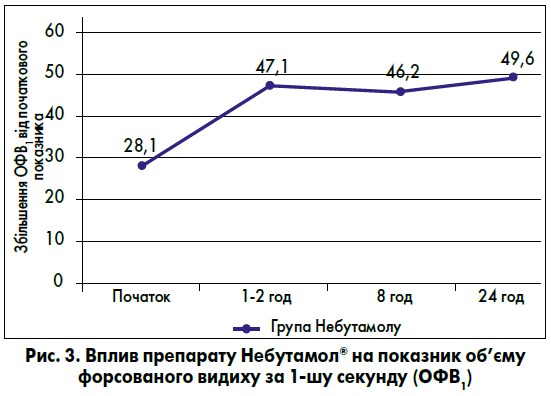 На ринку України сальбутамол представлений під торговою назвою Небутамол®, ефективність і безпека якого доведені в порівняльному клінічному дослідженні, проведеному на базі ДУ «Інститут фтизіатрії і пульмонології ім. Ф.Г. Яновського НАМН України». Вплив препарату Небутамол® на показники функції зовнішнього дихання показано на рисунку 3.
На ринку України сальбутамол представлений під торговою назвою Небутамол®, ефективність і безпека якого доведені в порівняльному клінічному дослідженні, проведеному на базі ДУ «Інститут фтизіатрії і пульмонології ім. Ф.Г. Яновського НАМН України». Вплив препарату Небутамол® на показники функції зовнішнього дихання показано на рисунку 3.
Препарат Небутамол® достовірно зменшував задишку, кашель, свистячі хрипи та покращував прохідність ДШ (Ящина Л.Я., 2013).
Крок 2: Комбінація β2-агоністу короткої дії з іпратропію бромідом. При недостатній ефективності сальбутамолу необхідно доповнити терапію іпратропію бромідом в дозі 250 мкг (1 мл) одночасно з сальбутамолом кожні 20-30 хвилин. У подальшому препарат можна використовувати кожні 4-6 год (Британська торакальна спілка (BTS) / Шотландська міжколегіальна мережа клінічних настанов (SIGN), 2019).
Комбінація сальбутамолу з іпратропію бромідом збільшує бронхорозширювальний ефект у пацієнтів із візингом. Але треба пам’ятати, що, згідно з даними літератури, монотерапія холінолітиками не рекомендована в дітей з астмою. У Кокранівському метааналізі було показано, що спільне застосування β2-агоніста короткої дії з іпратропію бромідом не дає значущих переваг при легкому та помірному загостренні БА, тому дана комбінація рекомендована пацієнтам лише в разі тяжкого загострення візингу (Cutrere R. et al., 2017).
Це підтверджується рекомендаціями авторитетної настанови – Британської торакальної спілки (BTS) / Шотландської міжколегіальної мережі клінічних настанов (SIGN) 2019 року, згідно з якою холінолітик додається лише за умови недостатнього ефекту сальбутамолу, тобто при тяжкому візингу.
Відповідно до висновків ще одного Кокранівського метааналізу, комбінація β2-агоніста короткої дії з холінолітиком викликає на 44% більше побічних ефектів, ніж монотерапія β2-агоніста короткої дії (Kirkland S.W. et al., 2017).
Крок 3: Преднізолон. Призначають перорально в дозі 10 мг протягом 3 днів.
У дітей раннього віку з вірус-індукованим візингом часто діагностують бронхіоліт. Препаратом вибору при лікуванні цієї категорії пацієнтів є 3% розчин NaCl (наприклад, зареєстрований в Україні продукт LORDE® hyal). У подвійному сліпому контрольованому дослідженні за участю дітей віком від 6 міс до 5 років було показано, що інгаляції гіпертонічного розчину не лише зменшували симптоми, але й достовірно скорочували тривалість оксигенотерапії (Thanakorn Kanjanapradap et al., 2017).
Доповідач акцентував увагу на тому, що лікування вірус-індукованого візингу не закінчується на терапії загострення. Наступним етапом є профілактика повторних епізодів. Для цього призначають монотерапію або комбіноване лікування такими препаратами:
1. Монтелукаст.
2. ІКС (Небуфлюзон®).
За результатами метааналізу Kaiser та співавт., щоденне застосування ІКС достовірно знижує частоту епізодів візингу в дітей дошкільного віку (Kaiser S.V. et al., 2016). Небуфлюзон® – небулізований флютиказон високої якості, якій може розглядатися як профілактика епізодів візингу в педіатричній популяції. Для цього в разі загострення препарат призначають курсом 4-8 тиж, а в разі рецидиву – курс повторюють.
Цікавими є фармакологічні властивості молекули Небуфлюзону, передусім її висока ліпофільність, тобто здатність розчинятися в тканинах. Завдяки цьому забезпечується місцевий протизапальний ефект у бронхіальному дереві, без виникнення системних побічних ефектів.
Необхідно пам’ятати, що ми лікуємо пацієнта із захворюваннями, а не свистяче дихання. Для цього в дітей у віці до 5 років із візингом потрібно виділити одну з трьох основних груп:
- візинг у дитини з вірус-індукованим візингом;
- візинг у дитини з БА;
- візинг у дитини з іншою патологією (муковісцидоз, вада розвитку дихальної системи та ін.).
Лише встановлення причини дасть можливість підібрати оптимальну терапію та зменшити ризик виникнення ускладнень.
І МІЖНАРОДНИЙ РЕСПІРАТОРНИЙ ФОРУМ З ІНГАЛЯЦІЙНОЇ ТЕРАПІЇ дав можливість усім учасникам сформувати алгоритми сучасного підходу до ведення пацієнтів із респіраторною патологією та розвіяти міфи щодо використання інгаляційної терапії. Захід було проведено вперше, і актуальність розглянутої проблематики та інтерактивна подача матеріалу знайшли позитивний відгук у слухачів, які з нетерпінням чекатимуть на наступний, знаковий для української медичної спільноти, міжнародний респіраторний форум з інгаляційної терапії.
Підготувала Ганна Кирпач
Тематичний номер «Пульмонологія, Алергологія, Риноларингологія» № 2 (51), 2020 р.