30 червня, 2020
Хвороба Фабрі: відкриття дерматологів, досліджують неврологи
 У межах організованого ТОВ «Санофі-Авентіс Україна» онлайн-вебінару «Орфанні захворювання. Хвороба Фабрі – як надати шанс пацієнту» слухачі отримали сучасну інформацію про основні клінічні прояви, забезпечення діагностики та лікування цієї рідкісної генетично детермінованої недуги. Пропонуємо до вашої уваги огляд однієї з найцікавіших доповідей, яку представив завідувач кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету, д. мед. н., професор Михайло Михайлович Орос.
У межах організованого ТОВ «Санофі-Авентіс Україна» онлайн-вебінару «Орфанні захворювання. Хвороба Фабрі – як надати шанс пацієнту» слухачі отримали сучасну інформацію про основні клінічні прояви, забезпечення діагностики та лікування цієї рідкісної генетично детермінованої недуги. Пропонуємо до вашої уваги огляд однієї з найцікавіших доповідей, яку представив завідувач кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету, д. мед. н., професор Михайло Михайлович Орос.
М.М. Орос розпочав доповідь з історичного екскурсу до перших згадок про хворобу накопичення глікосфінголіпідів. Так, 1898 р. німецький дерматолог Й. Фабрі виявив у пацієнта 13 років нодулярну пурпуру, що була надалі класифікована як один із варіантів дифузної ангіокератоми. Згодом у дитини розвинулась альбумінурія. Того ж року дерматолог із Великої Британії В. Андерсон описав клінічний випадок хворого 39 років з ангіокератомою, протеїнурією, варикозним розширенням вен нижніх кінцівок та лімфатичним набряком.
Натепер відомо, що хвороба Фабрі – Андерсона є захворюванням накопичення ліпідів, що зумовлене дефектом гена GLA, який відповідає за синтез лізосомного ферменту α-галактозидази A (α-GAL-A). Для розвитку хвороби Фабрі (ХФ) достатньо точкової мутації гена GLA (Desnick et al., 2001). Поширеність захворювання становить від 1 на 40 тис. до 1 на 120 тис. новонароджених; воно зустрічається в усіх расових групах: із частотою 1 на 117 тис. в Австралії, 1 на 476 тис. у Нідерландах, 1 на 40‑60 тис. чоловіків у США (Arends et al., 2017).
Професор М.М. Орос додатково поділився власним досвідом діагностики ХФ.
Клінічний випадок
Пацієнт Ю. 17 років скаржився на виразний пекучий та нестерпний біль у стопах і кистях, періодичне виникнення суїцидальних думок внаслідок неможливості витримувати інтенсивність больового синдрому; додатково зазначав періодичну сухість кистей рук. З анамнезу відомо, що пацієнт хворіє шість років – від часу першої появи болю. Неодноразово лікувався у сімейного лікаря та невролога, але без успіху. Інтенсивність болю періодично зменшується терапією декскетопрофеном або кеторолаком. У матері пацієнта виникає подібний біль меншої інтенсивності, вона додатково страждає від ранньої катаракти. За допомогою електронейроміографії у хворого було виявлено ознаки аксональної поліневропатії, що спрямувало діагностичний пошук у напряму цукрового діабету, а надалі – ХФ.
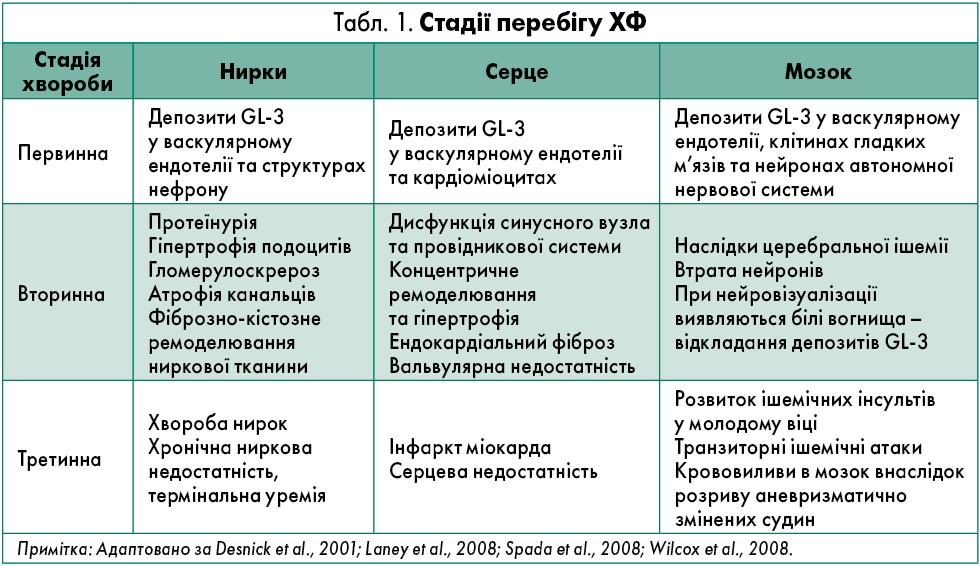
Слід зауважити, що патогенез ХФ зумовлений дефіцитом α-GAL-A, що призводить до накопичення глоботріаозилцерамідів (GL‑3) у різних функціональних клітинах: ендотеліоцитах (кровоносні судини), подоцитах (нирки), нейронах (ганглії вегетативної нервової системи); кардіоміоцитах, клітинах провідникової системи (серце), потових залозах (шкіра).
Клінічні прояви ураження органів-мішеней на кожній зі стадій клінічного перебігу ХФ представлені в таблиці 1.
Професор М.М. Орос докладно представив перелік клінічних ознак, що можуть підвести лікаря до підозри наявності ХФ і скерування пацієнта на відповідне обстеження:
- Ангіокератоми (Orteu et al., 2007; Zampetti et al., 2012).
- Кризи Фабрі: лихоманка, каузалгії, прискорення швидкості осідання еритроцитів.
- Помутніння рогівки, лійкоподібна кератопатія, катаракта Фабрі, звивистість та аневризми судин сітківки, ретинопатія, сліпота (Samiy, 2008).
- Ураження нирок:
- зміни сечового залишку: протеїнурія, гематурія, ліпідурія;
- проксимальна та дистальна тубулярна дисфункція: аміноацидурія, глюкозурія, ренальний тубулярний ацидоз, порушення концентраційної функції канальців;
- кінцева стадія хронічної ниркової недостатності: уремія, потреба в діалізі; накопичення глікосфінголіпідів спричиняє зменшення і кістозну мальформацію паренхіми нирок (Tondel et al., 2008).
5. Неврологічні прояви:
- больові кризи;
- акропарестезії;
- ураження автономної нервової системи;
- інсульти: ішемічні та геморагічні;
- зміни особистості (Desnick et al., 2001).
6. Кардіальні прояви:
- артеріальна гіпертензія;
- вроджена хвороба коронарних артерій;
- ішемія/інфаркт міокарда, стенокардія;
- гіпертрофія лівих відділів серця;
- електрокардіографічні феномени;
- пошкодження клапанів (Laney et al., 2008; Spada et al., 2008; Wilcox et al., 2008).
7. Фенотипові ознаки:
- збільшені ніс, вуха, язик, слинні залози;
- диспропорційний ріст кісток черепа;
- збільшення розмірів хребців, розширення грудної клітки, кіфоз, лопатоподібне збільшення кистей, стоп (Zampetti et al., 2012).
На думку М.М. Ороса, для оптимального призначення терапії достовірне встановлення діагнозу відіграє одну з вирішальних ролей. Доповідач докладно розглянув простий та доступний спосіб діагностики ХФ: скринінг за методом сухої плями крові (DBS). Карти для забору біоматеріалу та лабораторну діагностику надає ТОВ «Санофі-Авентіс Україна». Для пацієнтів обстеження є абсолютно безкоштовне. Ферментна діагностика проводиться в Метаболічній лабораторії ARCHIMED Life Science GmbH Laboratories (Австрія) або в лабораторії Центру орфанних захворювань НДСЛ «ОХМАТДИТ» (м. Київ). Підставою для остаточного встановлення діагнозу і призначення лікування є виключно генетичне обстеження, що виконують (після виявлення зниження активності ферменту) в лабораторії ARCHIMED Life Science GmbH Laboratories (Австрія).
При підтвердженні діагнозу за методом DBS пацієнта слід направити до Центру орфанних захворювань НДСЛ «ОХМАТДИТ» для внесення до реєстру та призначення терапії.
Остаточне встановлення діагнозу в одного пацієнта дозволяє виявити у середньому п’ять хворих на ХФ у цій же родині. Істотну роль відіграють збирання сімейного анамнезу та складання генеалогічного древа (Laney et al., 2008). Обґрунтування необхідності своєчасного виявлення ХФ полягає у наявності та доступності патогенетичної ферментнозамісної терапії (ФЗТ), що дозволяє запобігти накопиченню ліпідів, прогресуванню хвороби та незворотному ураженню органів. ФЗТ здатна рятувати життя пацієнтів за умови раннього призначення: агалcидази альфа (α-GAL-A) (препарат Реплагал*, Shire) у дозі 0,2 мг/кг внутрішньовенно кожні два тижні або агалcидази бета (препарат Фабразим®**, Sanofi Genzyme) у дозі 1 мг/кг внутрішньовенно кожні два тижні.
Професор М.М. Орос наголосив: ефект ФЗТ залежить від статі та віку пацієнта:
- Ефективність ФЗТ у чоловіків і жінок приблизно однакова, однак у зв’язку з наявністю у жінок залишкової активності ферменту в них рідше формуються антитіла до препарату ФЗТ.
- Лікування дітей проводять із тим же дозуванням препарату, що й дорослих: 1 мг/кг кожні два тижні.
- У дітей ФЗТ здатна суттєво зменшити біль, гастроінтестинальні прояви, кількість днів невідвідування школи та поліпшити якість життя (Wiloox et al., 2008; Hollak et al., 2009; Wraith et al., 2008).
У численних дослідженнях доведено, що лікування за допомогою препарату Фабразим® сприяє зменшенню розміру серця, поліпшує серцеву функцію та підвищує толерантність до фізичного навантаження (Weidemann et al., 2009; Beer et al., 2006; Breunig et al., 2006; Kalliokoski et al., 2006; Imbriaco et al., 2009; Strotmann et al., 2007).
Додатково підтверджено вплив на інші клінічні прояви. Так, терапія препаратом Фабразим® дозволяє:
- зменшити виразність больового синдрому (Eng et al., 2001; Germain et al., 2007; Wilcox et al., 2004; Hilz et al., 2004; Breunig et al., 2006);
- знизити частоту небажаних явищ із боку шлунково-кишкового тракту (Guffon et al., 2004; Banikazemi et al., 2005; Wraith et al., 2008);
- поліпшити відвідуваність школи пацієнтами відповідного віку (Wraith et al. 2008);
- підвищити якість життя (Eng et al., 2001; Germain et al., 2007; Wilcox et al., 2004; Guffon et al., 2004; Wraith et al., 2008).
Симптоматична терапія дозволяє відкоригувати додаткові клінічні прояви та поліпшити якість життя пацієнтів (табл. 2).
Професор М.М. Орос навів дані дослідження J. Krämer et al. (2017), присвяченого порівнянню ефективності препаратів агалcидази альфа та агалcидази бета. У цьому перспективному обсерваційному дослідженні оцінювали ураження кінцевих органів та клінічні симптоми у 112 пацієнтів, які отримували агалсидазу бета (в дозуванні 1,0 мг/кг) протягом більш ніж одного року та в наступному періоді.
Пацієнтів розподілили на три групи:
- група стандартного дозування: 37 хворих продовжували отримувати агалсидазу бета у дозуванні 1 мг/кг/2 тижні;
- перехідна група: 38 пацієнтів отримували знижену дозу агалсидази бета і згодом переходили на агалсидазу альфа в дозуванні 0,2 мг/кг/2 тижні або одразу ж – на агалсидазу альфа по 0,2 мг/кг/2 тижні і лишалися на агалсидазі альфа в дозі 0,2 мг/кг/2 тижні;
- група повторного переходу: 37 хворих знову переводили на агалсидазу бета у дозуванні 1 мг/кг/2 тижні після того, як вони отримували агалсидазу альфа по 0,2 мг/кг/2 тижні протягом щонайменше 12 місяців.
Швидкість клубочкової фільтрації (ШКФ) у хворих групи регулярного приймання залишалася стабільною. У пацієнтів групи переходу спостерігали щорічне зниження ШКФ: -4,6±9,1 мл/хв/1,73 м2 (p<0,05). Хворі групи повторного переходу також показали зниження ШКФ: -2,2±4,4 мл/хв/1,73 м2 після повторного переходу на агалсидазу бета, але меншою мірою порівняно із групою переходу (p<0,05). Пацієнти групи повторного переходу рідше страждали на діарею (відносний ризик 0,42; 95% довірчий інтервал 0,19‑0,93; p=0,02). Вміст Lyso-GL-3 залишався стабільним у пацієнтів групи переходу (p=0,97) та регулярного приймання (p=0,48), але зменшився у групі повторного переходу після зміни режиму терапії (p<0,05).
Таким чином, було встановлено, що після переходу на терапію агалсидазою альфа у пацієнтів із ХФ спостерігалося постійне зниження ШКФ, тоді як ця динаміка сповільнювалася у тих, яких повторно переводили на агалсидазу бета. Зниження рівня Lyso-GL-3 може свідчити про кращу реакцію на лікування у групі приймання агалсидази бета (препарат Фабразим®, Sanofi Genzyme).
Додатково питання вибору між препаратами агалсидази бета та агалсидази альфа було вивчене у багатоцентровому ретроспективному когортному дослідженні М. Arends et al. (2018). Мало місце більш стійке зниження рівня Lyso-GL-3 у плазмі крові після лікування агалсидазою бета (р<0,001); така різниця зберігалася навіть за наявності антитіл. Ризик вироблення антитіл був вищим у пацієнтів, які отримували агалсидазу бета (р=0,04). Ступінь зменшення індексу маси міокарда лівого шлуночка виявився більшим після першого року лікування агалсидазою бета (р=0,03), тоді як зниження ШКФ було подібним.
Таким чином, ефективнішу біохімічну реакцію, навіть за наявності антитіл, та значніше зменшення індексу маси лівого шлуночка спостерігали за умови приймання агалсидази бета. За словами доповідача, даний результат є навіть переконливішим з огляду на те, що середній вік пацієнтів на початку ФЗТ складав 46 (±15) років, що свідчить про серйозніше ураження органів-мішеней. Також більшу частку хворих становили чоловіки із класичною формою ХФ, яка характеризується тяжчим перебігом.
Завершуючи доповідь, професор М.М. Орос прогнозував у майбутньому всеосяжне інформування про дану нозологічну одиницю, за якої вчасна діагностика має вирішальне значення. На його думку, додатково до ФЗТ поступово впроваджуватимуться: лікування із застосуванням шаперонів, cубстрат-редукційна терапія та інші методи, спрямовані на корекцію геному осіб із ХФ. Завданням лікарів на сучасному етапі є вчасне виявлення таких пацієнтів та призначення препарату Фабразим® із метою збереження функціональної здатності органів-мішеней і запобігання їхньому незворотному пошкодженню, адже в майбутньому хворі мають шанс позбутися генетично-запрограмованого процесу накопичення глікосфінголіпідів.
На сьогодні у нашій країні ХФ безкоштовно діагностується за допомогою вимірювання ферментативної активності й генотипування та може ефективно лікуватися препаратом ФЗТ, що став доступним завдяки гуманітарній програмі Sanofi Genzyme та державній програмі.
Підготувала Маргарита Марчук
Тематичний номер «Неврологія, Психіатрія, Психотерапія» № 2 (53) 2020 р.