7 липня, 2020
Методы лабораторного анализа для диагностики нового коронавируса SARS-CoV-2, вызывающего опасное инфекционное заболевание COVID-19
Специфическая лабораторная диагностика коронавирусной инфекции SARS-CoV‑2
Латеральный проточный иммуноанализ (экспресс‑тесты)
Для диагностики острых инфекций существует лаг-период, так как антитела против вируса обычно появляются через 7-14 дней после начала заболевания. Иммуноанализ с использованием тест-полосок может обеспечить быстрое и качественное обнаружение антител для скрининга с последующим проведением подтверждающих тестов. Исследователи из Сингапура (Медицинская школа Duke-NUS) разработали тесты для определения антител к SARS-CoV‑2 [9, 10]. Тест-полоски для быстрого определения антител IgM (руководитель Dr. Zhong Nanshan, Гуанчжоуский медицинский университет) используются в Китае [11]. Такие компании, как Guangzhou Wondfo Biotech и Innovita Biological Technology получили одобрение EUA от Китайской национальной медицинской службы по надзору за продукцией для применения их наборов при определении антител [12-15]. Компания Guangzhou Wondfo Biotech также получила знак CE для набора Wondfo SARS-CoV‑2 для определения антител (метод латерального потока), который тестирует антитела IgM и IgG [16, 17]. Компании Pharmact AG из Германии [18], Zhejiang Orient Gene Biotech [19, 20] и SD Biosensor [21] имеют коммерчески доступные тест-полоски для иммуноанализа с целью качественного обнаружения антител, которые могут использоваться для тестирования в месте оказания медицинской помощи. Также предпринимаются другие усилия по разработке и коммерциализации наборов для экспресс-тестирования Jiangsu Medomics Medical Technologies [22], Shenzhen Tisenc Medical Devices [23] и Nankai University [24]. Ожидается, что время проведения тестирования с использованием этих тест-полосок будет варьировать от 15 до 20 мин, что значительно меньше по сравнению с использованием ОТ-ПЦР. Компания Jiangsu Medomics Medical Technologies разработала иммуноанализ латерального потока в месте оказания медицинской помощи, который одновременно обнаруживает антитела IgM и IgG против SARS-CoV‑2.
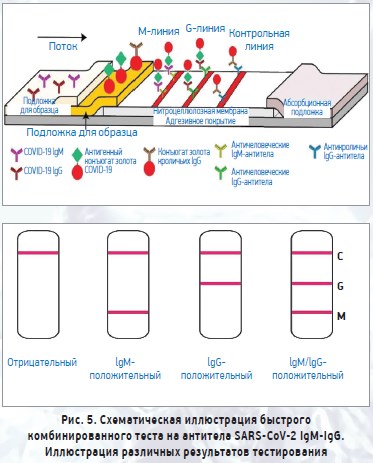 Экспресс-кассета IgG/IgM 2019-nCoV (цельная кровь / сыворотка / плазма) представляет собой иммунохроматографический анализ с боковым течением. В тесте используются антитела против IgM человека (тестовая линия IgM), IgG (тестовая линия IgG) и антикроличьи IgG (контрольная линия C), иммобилизованные на нитроцеллюлозной мембране. Подложка для конъюгата бордового цвета содержит коллоидное золото, конъюгированное с рекомбинантными антигенами COVID‑19, конъюгированным с коллоидным золотом и кроличьими конъюгатами IgG-золота. Когда образец, за которым следует буфер для анализа, добавляют в лунку образца, антитела IgM и/или IgG, если они присутствуют, будут связываться с конъюгатами COVID‑19, образуя комплекс антиген-антител. Этот комплекс мигрирует через нитроцеллюлозную мембрану под действием капиллярной силы. Когда комплекс встречается с линией соответствующего иммобилизованного антитела (человеческого IgM и/или человеческого IgG), происходит его захват, при этом образуется полоска бордового цвета, что подтверждает положительный результат теста. Отсутствие цветной полосы в тестовой области свидетельствует об отрицательном результате. Тест содержит внутренний контроль (С-полоса), который должен иметь бордовую цветную полосу иммунокомплексного козьего антикроличьего IgG / кроличьего IgG-конъюгата золота независимо от развития цвета на любой из тестируемых полос. В противном случае результат теста является недействительным и образец должен быть повторно протестирован на другом устройстве (рис. 5).
Экспресс-кассета IgG/IgM 2019-nCoV (цельная кровь / сыворотка / плазма) представляет собой иммунохроматографический анализ с боковым течением. В тесте используются антитела против IgM человека (тестовая линия IgM), IgG (тестовая линия IgG) и антикроличьи IgG (контрольная линия C), иммобилизованные на нитроцеллюлозной мембране. Подложка для конъюгата бордового цвета содержит коллоидное золото, конъюгированное с рекомбинантными антигенами COVID‑19, конъюгированным с коллоидным золотом и кроличьими конъюгатами IgG-золота. Когда образец, за которым следует буфер для анализа, добавляют в лунку образца, антитела IgM и/или IgG, если они присутствуют, будут связываться с конъюгатами COVID‑19, образуя комплекс антиген-антител. Этот комплекс мигрирует через нитроцеллюлозную мембрану под действием капиллярной силы. Когда комплекс встречается с линией соответствующего иммобилизованного антитела (человеческого IgM и/или человеческого IgG), происходит его захват, при этом образуется полоска бордового цвета, что подтверждает положительный результат теста. Отсутствие цветной полосы в тестовой области свидетельствует об отрицательном результате. Тест содержит внутренний контроль (С-полоса), который должен иметь бордовую цветную полосу иммунокомплексного козьего антикроличьего IgG / кроличьего IgG-конъюгата золота независимо от развития цвета на любой из тестируемых полос. В противном случае результат теста является недействительным и образец должен быть повторно протестирован на другом устройстве (рис. 5).
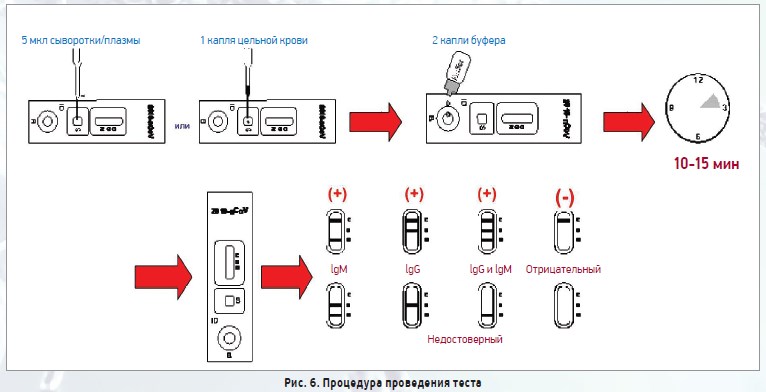
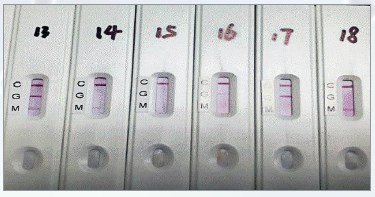
Непосредственно процедура проведения теста представлена на рисунке 6. Репрезентативное фото для различных результатов анализа крови пациентов представлено на рисунке 7.
Рис. 7. Фото различных результатов анализа крови пациента
Примечания:
№ 13 – IgM- и IgG-положительные;
№ 14 – IgM-слабоположительный;
№ 15 – IgM- и IgG-отрицательные;
№ 16 – IgG-слабоположительный;
№ 17 – IgG-положительный;
№ 18 – IgM-положительный.
Преимущества
Новый набор для быстрого тестирования комбинированных антител SARS-CoV‑2 IgG-IgM имеет несколько преимуществ. По сравнению с методом ОТ-ПЦР он экономит время, нет необходимости в оборудовании, простой в исполнении и требует лишь минимального обучения. Анализ может быть выполнен у постели больного, в любой клинике или лаборатории, в аэропорту или на вокзале [25]. Для внеклинического скрининга будет удобнее использовать кровь из пальца или пятки вместо крови из вены. Другим потенциальным применением этого теста является скрининг бессимптомных носителей SARS-CoV‑2, которые могут распространять данный вирус [26, 27]. Этот набор для тестирования комбинированных антител IgM/IgG дает возможность проводить крупномасштабный скрининг бессимптомных носителей. По крайней мере, некоторые, если не все носители, вероятно, имеют антитела против SARS-CoV‑2, что продемонстрировано бессимптомными носителями вируса Зика [28]. Поскольку этот тест может одновременно определять IgM и IgG, его можно использовать как для ранней диагностики (IgM), так и для мониторинга во время лечения. Инфекция SARS-CoV‑2 начинается в легких, а не в верхних дыхательных путях [29], поэтому отбор проб на ранней стадии инфекции с использованием мазка из горла или мокроты может не обнаружить вирус. Это одно из возможных объяснений высоких ложноотрицательных результатов в тесте ОТ-ПЦР.
Ограничения
Причины ложноотрицательных результатов могут быть связаны, во‑первых, с низкими концентрациями антител. Когда уровни IgM и IgG ниже предела обнаружения (пока не определено), результаты теста будут отрицательными. Во-вторых, разница в выработке антител индивидуального иммунного ответа может быть одной из причин ложноотрицательных результатов у пациентов с COVID‑19. И последнее, но не менее важное: антитела IgM снижаются и исчезают через 2 нед. В некоторых случаях трудно точно знать, когда пациент был инфицирован или как долго он был инфицирован. Таким образом, когда пациент проходил тестирование, уровень IgM мог быть значительно ниже его пика и не обнаруживаться этим тестом.
Полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР)
Для обнаружения вирусного генетического материала органы здравоохранения Китая опубликовали полный геном SARS-CoV‑2 в GenBank и на портале GISAID [30] (рис. 8). 
ВОЗ на своей веб-странице опубликовала пять протоколов диагностики с применением ОТ-ПЦР. К ним относятся протоколы Института вирусологии Charité в Германии и Гонконгского университета (HKU), а также протоколы из Таиланда, Японии и Китая. Шестой протокол Центров по контролю и профилактике заболеваний (CDC) США был добавлен на веб-страницу ВОЗ 29 января 2020 года [31]. С тех пор веб-страница ВОЗ была обновлена с использованием другого URL-адреса и дополнена руководящими документами [32]. Седьмой протокол их Института Пастера в Париже (Франция) был добавлен в марте 2020 года [33]. Следует отметить, что протоколы диагностики с использованием ОТ-ПЦР, опубликованные на веб-странице ВОЗ, являются именно руководствами, а не исчерпывающими документами. Различные учреждения и правительства разработали собственные протоколы, которые ВОЗ может не публиковать на своих страницах.
Первый валидированный диагностический тест был разработан группой профессора Christian Drosten из Института вирусологии Charité в Берлине [34]. Первоначальный дизайн анализа ОТ-ПЦР основан на совпадении вирусов SARS-CoV или SARS с вирусом из Уханя. Для диагностики использовали RdRP- и E-гены, где Е выступал в качестве инструмента первой линии, а анализ гена RdRP – в качестве подтверждающего. Все анализы были высокочувствительными и специфичными, не реагировали перекрестно с другими коронавирусами, а также с клиническими образцами человека, которые содержали респираторные вирусы.
Эксперты US CDC поделились протоколом для анализа ОТ-ПЦР с праймерами и зондами, предназначенными для универсального обнаружения SARS-подобного коронавируса и специфического обнаружения SARS-CoV‑2 [35, 36].
Некоторые группы исследователей также поделились своими протоколами. В определенных случаях они будут готовы отправлять реагенты либо смеси реагентов с соответствующей оплатой или без нее (табл. 3). 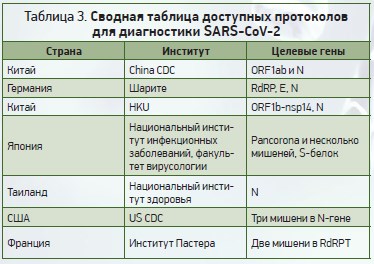
Тест концерна ROCHE под торговым наименованием Cobas® SARS-CoV‑2 получил разрешение на экстренное использование (Emergency Use Authorization – EUA) от Управления по контролю качества продуктов питания и лекарственных средств США (Food and Drug Administration, FDA) и будет доступен на рынках, поддерживающих маркировку СЕ. Об этом компания сообщила 2 марта 2020 года. Молекулярный тест на SARS-CoV‑2 позволит провести ускоренное тестирование при помощи автоматизированных систем Roche Сobas® 6800 и Сobas® 8800. Их пропускная способность позволяет получать 1440 результатов (Сobas® 6800) и 4128 результатов (Сobas® 8800) за 24 ч, при этом результаты первых 96 тестов получают через 3,5 ч, а в дальнейшем – по 96 тестов каждые 30 или 90 мин. Больницы и референтные лаборатории могут проводить тестирование на полностью автоматизированных системах Roche Сobas® 6800 и Сobas® 8800, которые широко доступны в США и во всем мире.
Многими международными организациями с помощью тест-систем ОТ-ПЦР коронавирус SARS-CoV-2 рекомендуется выявлять по следующим генетическим маркерам: RdRP-gene, N-gene и Е-gene.
Процедура проведения теста для выявления SARS-CoV‑2 гибридизационно-флуоресцентной детекцией
Выявление РНК SARS-CoV‑2 методом ОТ-ПЦР с гибридизационно-флуоресцентной детекцией включает в себя три этапа: экстракцию РНК из образцов исследуемого материала, реакцию обратной транскрипции и амплификацию участка комплементарной ДНК (кДНК) данного коронавируса с гибридизационно-флуоресцентной детекцией, которая производится непосредственно в ходе ПЦР. Экстракция РНК из биологического материала проводится в присутствии внутреннего контрольного образца, который позволяет контролировать выполнение процедуры исследования для каждого образца. Отдельно используются положительный контроль экстракции и отрицательный контроль экстракции РНК. Реакция обратной транскрипции проводится с целью образования кДНК на матрице РНК. Затем с полученными пробами кДНК проводится реакция амплификации участков при помощи специфичных к этим участкам кДНК праймеров и фермента Taq-полимеразы. В составе реакционной смеси присутствуют флуоресцентно меченые олигонуклеотидные зонды, которые гибридизуются с комплементарными участками амплифицируемых мишеней кДНК, в результате чего происходит нарастание интенсивности флуоресценции. Это позволяет регистрировать накопление специфического продукта амплификации путем измерения интенсивности флуоресцентного сигнала. Детекция флуоресцентного сигнала осуществляется непосредственно в ходе ПЦР с помощью амплификатора с системой детекции флуоресцентного сигнала в режиме реального времени.
Ограничения ПЦР
Несколько последовательных отрицательных результатов тестирования совсем не исключают возможности наличия инфекции. К появлению ложноотрицательных результатов может приводить ряд таких факторов:
- низкое качество образцов;
- образец был взят слишком рано или слишком поздно в течение заболевания;
- при обращении с образцом или в ходе его транспортировки не были соблюдены необходимые требования;
- технические факторы, связанные с выполнением теста (например, мутация вируса или ингибирование ПЦР).
Методы на основе микрочипов
Метод обнаружения коронавируса на основе микрочипов является быстрым анализом с высокой пропускной способностью. Его принцип состоит в том, что с помощью обратной транскриптазы РНК коронавируса продуцирует кДНК, меченную специфическими зондами. Затем эти меченные кДНК помещаются в лунки и гибридизуются с твердофазными олигонуклеотидами, закрепленными на микрочипе, с последующей промывкой для удаления свободных ДНК. В результате РНК коронавируса может быть определена путем исследования специфических зондов [37]. Shi и соавт. [38] разработали 60-мерный олигонуклеотидный микрочип и успешно применили его для обнаружения коронавируса ОРВИ. Тем не менее, учитывая быструю мутацию SARS-CoV, Guo и соавт. [39] разработали микрочип для обнаружения однонуклеотидного полиморфизма (SNP) мутации в гене spike (S) SARS-CoV со 100% точностью. Поскольку коронавирус может привести к внезапной вспышке эпидемии, большое значение имеет обнаружение широкого спектра коронавирусов, при этом диагностика должна проводиться Point of Care (анализ по месту лечения). В связи с этим Luna и соавт. [40] разработали недорогой нефлуоресцентный олигонуклеотид низкой плотности для обнаружения всего рода коронавирусов в реальном времени с чувствительностью, равной ОТ-ПЦР. Hardick и соавт. [41] создали новую портативную POC-диагностическую платформу на основе микрочипов – Mobile Analysis Platform (MAP), которая имеет отличные показатели в выявлении различных вирусов и допустимый предел обнаружения.
Уникальная технологическая платформа компании Randox позволяет, используя технологию Biochip, проводить экспресс-анализ SARS-CoV‑2, обрабатывая одновременно 54 образца пациентов и представляя результаты 540 анализов в течение 5 ч на анализаторе Evidence Investigator (рис. 9).
Петлевая изотермическая амплификация нуклеиновых кислот
Петлевая изотермическая амплификация (LAMP) является новым методом амплификации нуклеиновых кислот, была разработана Tsugunori Notomi и его коллегами в 2000 году [42]. Суть данного метода заключается в удвоении участка ДНК с высокой специфичностью, эффективностью и скоростью в условиях постоянной температуры. При совмещении с обратной транскрипцией LAMP может с высокой эффективностью амплифицировать последовательности РНК. Данный метод основан на автоматическом цикле синтеза цепи ДНК со смещением при использовании ДНК-полимераз с высокой активностью смещения и 4 (6) специально созданных праймеров. Четыре праймера сконструированы так, чтобы быть нацеленными на шесть определенных регионов гена-мишени. LAMP-анализ является быстрым, не требует дорогостоящего оборудования и реагентов, что может снизить стоимость обнаружения коронавируса [43]. Poon и соавт. [44] сообщили о простом LAMP-анализе и продемонстрировали возможность использования данной технологии для обнаружения SARS-CoV. Область ORF1b SARS-CoV была выбрана для диагностики SARS и усилена LAMP-реакцией в присутствии 6 праймеров, после чего амплифицированные продукты были проанализированы с помощью электрофореза. Частота обнаружения и чувствительность к SARS-CoV в анализе LAMP аналогична обычным методам на основе ПЦР. Анализ RT-LAMP разработан Shirato и соавт. [45], способен обнаруживать всего 3 копии РНК MERS-CoV, является высокоспецифичным без перекрестной реакции с другими респираторными вирусами. Thai и соавт. [46] разработали одношаговую единичную пробирку для количественного анализа RT-LAMP в реальном времени с измерением окрашивания раствора для ранней и быстрой диагностики SARS-CoV. Этот анализ в 100 раз чувствительнее, чем обычная ОТ-ПЦР.
В работе Zhang и соавт. [47] представлены тестирование и валидизация 5 наборов праймеров LAMP как целевых для двух фрагментов SARS-CoV‑2 с использованием коротких (~300 bp) РНК-фрагментов, полученных транскрипцией in vitro, и образцов РНК пациентов (рис. 10).
Культивирование вируса
ВОЗ не рекомендует культивирование вируса в качестве рутинной диагностической процедуры.
Перспективные методы для диагностики SARS-CoV‑2
РНК-таргетированный CRISP-ассоциированный фермент Cas13 недавно был адаптирован для быстрого определения нуклеиновых кислот [48, 49]. C.A. Freije и соавт. [50] было показано, что Cas13 может быть запрограммирован для разрушения геномов разнообразных вирусов одноцепочечной РНК (рис. 11).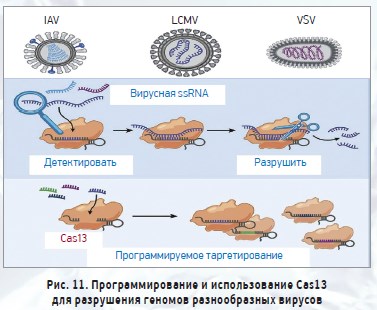
Они разработали платформу под названием SHERLOCK (специфический высокочувствительный ферментативный репортер разблокировки), которая объединила изотермическую преамплификацию с Cas13 для обнаружения отдельных молекул РНК или ДНК [51]. Их последний протокол для COVID‑19 под названием «Протокол обнаружения COVID‑19 с использованием диагностики CRISP» опубликован на веб-сайте https://broad.io/sherlockprotocol, что может представлять интерес для исследователей в дальнейшем развитии данной системы диагностики и как платформу для обнаружения нуклеиновых кислот.
Выводы
Для подтверждения случаев COVID‑19 такие клинические симптомы, как лихорадка, кашель, миалгия или повышенная усталость, не являются уникальными признаками, поскольку они могут быть похожими на симптомы других вирусных заболеваний – ОРВИ, грипп и др. В настоящее время для подтверждения COVID‑19 основным инструментом является использование лабораторных методов исследования. К ним относятся латеральная иммунодиффузия (экспресс-тесты), ОТ-ПЦР, микрочиповая технология и др., при этом очень важно выбрать методы обнаружения ввиду того, что каждый метод имеет свои уникальные преимущества и, безусловно, недостатки.
Список литературы находится в редакции.
Медична газета «Здоров’я України 21 сторіччя» № 10 (479), травень 2020 р.