13 липня, 2020
Епілепсія в осіб похилого віку та лікування епілепсії після хірургічних втручань
У квітні 2020 р. ГО «Українська протиепілептична ліга», ДУ «Інститут неврології, психіатрії та наркології НАМН України» та Благодійний фонд розвитку інновацій медицини «РІМОН» провели вебінари на теми «Лікування епілепсії після хірургічних втручань» та «Епілепсія у людей похилого віку». Представляємо до вашої уваги огляд доповідей, що лунали у межах цих заходів.
Загальні особливості епілепсії у пацієнтів похилого віку
 Президент Української протиепілептичної ліги (УПЕЛ), д. мед. н., професор Андрій Євгенійович Дубенко акцентував увагу на передумовах формування епілепсії у літніх пацієнтів. Основну роль відіграє електрогенез головного мозку: ослаблення гальмівного і посилення збуджувального процесів, порушення їхньої врівноваженості, ослаблення коркового тонусу. Обстеження хворих із першою в житті пароксизмальною подією є стандартним: ЕЕГ, за потреби з відеомоніторингом, домашня відеореєстрація, ЕКГ, МРТ мозку.
Президент Української протиепілептичної ліги (УПЕЛ), д. мед. н., професор Андрій Євгенійович Дубенко акцентував увагу на передумовах формування епілепсії у літніх пацієнтів. Основну роль відіграє електрогенез головного мозку: ослаблення гальмівного і посилення збуджувального процесів, порушення їхньої врівноваженості, ослаблення коркового тонусу. Обстеження хворих із першою в житті пароксизмальною подією є стандартним: ЕЕГ, за потреби з відеомоніторингом, домашня відеореєстрація, ЕКГ, МРТ мозку.
У клінічній картині літніх пацієнтів переважають фокальні напади з/без порушення свідомості, які часто переходять у білатеральні тоніко-клонічні. Характерні автоматизми та унілатеральні напади з розвитком паралічу Тодда в постіктальному періоді. Напади без втрати свідомості та її порушення <1 хв є специфічною клінічною особливістю. Постіктальний період більш тривалий і виразний, характерними є: фокальний моторний дефіцит у вигляді паралічу Тодда, сплутаність свідомості, стан психомоторного збудження, транзиторний амнестичний синдром у вигляді дезорієнтації з ретро- і антероградною амнезією.
Показання до призначення протиепілептичних препаратів (ПЕП) при епілепсії в осіб похилого віку за підтвердженого епілептичного характеру нападів та протипоказання представлені в таблиці 1.
 Терапія епілепсії у пацієнтів похилого віку передбачає врахування таких особливостей, як: усунення провокувальних чинників (депривація сну, приймання алкоголю, виключення специфічного стимулу при рефлекторній епілепсії); можливість призначення ≤2 разів на добу, щоб уникнути нерегулярності застосування; рекомендоване приймання ретардних форм препаратів 1‑2 рази на добу.
Терапія епілепсії у пацієнтів похилого віку передбачає врахування таких особливостей, як: усунення провокувальних чинників (депривація сну, приймання алкоголю, виключення специфічного стимулу при рефлекторній епілепсії); можливість призначення ≤2 разів на добу, щоб уникнути нерегулярності застосування; рекомендоване приймання ретардних форм препаратів 1‑2 рази на добу.
А.Є. Дубенко представив «лінії» препаратів вибору залежно від типів епілептичних припадків:
1. Білатеральні, генералізовані тоніко-клонічні (тонічні, клонічні):
- вальпроат, ламотриджин, леветирацетам;
- карбамазепін, окскарбазепін, фенобарбітал, топірамат;
- прегабалін, клоназепам, фенітоїн.
2. Фокальні з/без порушення свідомості, парціальні прості та складні, а також фокальні з переходом у білатеральні тоніко-клонічні та вторинно генералізовані:
- вальпроат, ламотриджин, карбамазепін, топірамат, окскарбазепін, леветирацетам;
- фенітоїн, прегабалін, габапентин;
- фенобарбітал, клоназепам.
3. Недиференційовані:
- вальпроат, топірамат, леветирацетам;
- ламотриджин;
- клоназепам, фенобарбітал.
Важливо відзначити, що застосування у даної категорії пацієнтів карбамазепіну як препарату першої лінії терапії вкрай небажане. За словами доповідача, з урахуванням ефективності та переносимості оптимальними лікарськими засобами у хворих похилого віку з епілепсією можна вважати ламотриджин та леветирацетам.
У зв’язку з тим, що в осіб похилого віку метаболізм низки ПЕП може відрізнятися від такого в молодих пацієнтів, за аналогічних доз ПЕП спостерігається інша концентрація у крові. Це зумовлює необхідність ретельнішого титрування та контролю плазмоконцентрації навіть на початкових стадіях лікування літніх пацієнтів. Насамкінець А.Є. Дубенко наголосив, що терапевтичний діапазон слід розглядати як орієнтир, а концентрацію препарату в плазмі оцінювати в контексті клінічних симптомів і перебігу захворювання.
Симптоматична епілепсія при судинних та нейродегенеративних захворюваннях
 Тетяна Анатоліївна Літовченко, д. мед. н., професорка (Харківська медична академія післядипломної освіти), розглянула проблему взаємозв’язку виникнення епілепсії та інших патологій в осіб похилого віку. Епілепсія може розвинутися в момент після інсульту, а також буває раннім клінічним проявом хронічних цереброваскулярних захворювань: за клінічним перебігом більшість є вогнищевими (36%) або вогнищевими з подальшою генералізацією (28%); половина з них – моторні.
Тетяна Анатоліївна Літовченко, д. мед. н., професорка (Харківська медична академія післядипломної освіти), розглянула проблему взаємозв’язку виникнення епілепсії та інших патологій в осіб похилого віку. Епілепсія може розвинутися в момент після інсульту, а також буває раннім клінічним проявом хронічних цереброваскулярних захворювань: за клінічним перебігом більшість є вогнищевими (36%) або вогнищевими з подальшою генералізацією (28%); половина з них – моторні.
Патофізіологія постінсультної епілепсії, ймовірно, полягає у структурних та функціональних змінах у нейронних мережах зі стійкою схильністю до синхронізованої гіперзбудливості й судом. До факторів високого ризику відносять: субарахноїдальний крововилив, великий за обсягом крововилив у півкулі, кардіоемболічний інфаркт, порушення свідомості в гострій стадії, повторний інсульт, лівобічний кортикальний інфаркт, вік >84 роки, ураження середньої/передньої мозкової артерії із залученням кори, застосування тромболітиків. Додатковими чинниками розвитку постінсультної епілепсії є ураження «малих» судин та мікроваскулярні захворювання, тромбоз церебральних вен і синусів чи мальформації судин, куріння, вживання алкоголю, гіперглікемія, ниркова недостатність, інфекції, супутня фармакотерапія тощо.
Т.А. Літовченко акцентувала увагу на специфічних нюансах терапії «судинної» епілепсії:
1. ПЕП однозначно призначають при розвитку одного пізнього нападу після інсульту. Поодинокий вогнищевий «ранній» епілептичний напад не є обов’язковим для лікування.
2. ПЕП, що індукують цитохром Р450, підвищують рівень ліпідів у сироватці, впливають на інші атерогенні маркери, тому можуть збільшувати ризик розвитку судинних явищ.
3. Слід враховувати, що деякі ПЕП спричиняють низку негативних ефектів:
- підсилюють прояви деменції, ризик остеопорозу, дефіцит фолієвої кислоти;
- барбітурати потенціюють апное, збільшують ризик падінь;
- карбамазепін, окскарбазепін підсилюють кардіальну дисфункцію;
- дифенін і барбітурати підвищують ризик гіпотензії.
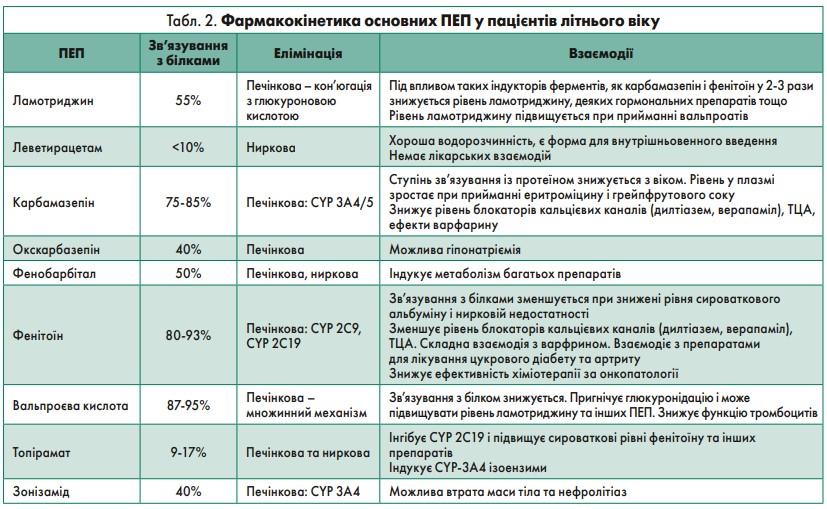
За словами доповідачки, пацієнти з деменцією (за хвороби Альцгеймера та інших нейродегенеративних патологій) характеризуються у 5‑10 разів вищим ризиком появи епілепсії порівняно з аналогічною віковою популяцією без деменції. Є кілька причин, які можуть бути пов’язані з розвитком епілепсії при деменції: накопичення β-амілоїду, втрата гальмівних нейронів і гліоз, біохімічні зміни, застосування препаратів проти деменції. Що стосується терапії, на основі аналізу низки досліджень оптимальними ліками для терапії епілепсії у пацієнтів похилого віку можуть бути ламотриджин і леветирацетам. Фармакокінетику основних ПЕП у літніх хворих представлено в таблиці 2.
Підсумовуючи доповідь, Т.А. Літовченко виділила основні принципи лікування епілепсії в осіб похилого віку:
1. При першому вогнищевому «ранньому» епілептичному нападі лікування не є обов’язковим (за виключенням геморагічних інсультів з ураженням кори, при яких можливе короткочасне лікування тривалістю не менш ніж шість місяців). Деякі ПЕП знижують ризик ранніх нападів, але не впливають на ймовірність розвитку епілепсії надалі.
2. «Пізні» судоми після цереброваскулярної події, особливо повторні, є показанням до лікування ПЕП: ризик повторення – 71,5%.
3. Перший епілептичний напад на тлі хвороби Альцгеймера та інших первинних нейродегенерацій є показанням до початку лікування, що не тільки значно поліпшує прогноз епілепсії але й уповільнює прогресування когнітивної дисфункції.
4. Слід враховувати підвищену чутливість пацієнтів віком від 65 років до побічних ефектів ПЕП та вплив супутніх захворювань. Необхідно також брати до уваги взаємодію з іншими препаратами.
5. Можливе лікування ПЕП у «низьких» дозах (1/2, 1/3 від стандартних) із повільним збільшенням дозування та ретельним титруванням. Потрібне визначення концентрації ПЕП у плазмі крові.
6. Рекомендоване застосування ПЕП, які не пригнічують когнітивні функції, не впливають на метаболізм ліпідів, масу тіла, не викликають аритмій, мінімально взаємодіють з іншими ліками.
7. Препаратами вибору для літніх пацієнтів, особливо з когнітивними порушеннями, мають бути леветирацетам (Левіцитам, «Асіно») і ламотриджин (Ламотрин, «Асіно»), за можливості у монотерапії.
Симптоматична епілепсія, спричинена черепно‑мозковими травмами, оперативними втручаннями, пухлинами
Секція вебінару щодо лікування епілепсії після хірургічних втручань була представлена доповідями Т.А. Літовченко, А.Є. Дубенка та К.Р. Костюка. Актуальність розвитку симптоматичної епілепсії після черепно-мозкової травми (ЧМТ), за словами Т.А. Літовченко, зумовлена тим, що її ризик коливається від 2 до 57%. Вона залежить від: тяжкості ураження, тривалості втрати свідомості, пошкодження мозкових оболонок, крововиливу, контузії / забиття мозку, наявності металевих та кісткових уламків у рані, пошкодження передньої центральної звивини, інфікування рани / формування абсцесу, відкладення гемосидерину навколо осередків гліозу, генетичних факторів.
Лікування та запобігання епілептичним нападам при ЧМТ, на думку доповідачки, передбачає наступні кроки.
1. Хірургічні втручання, спрямовані на мінімізацію вторинного ушкодження мозкової тканини, запобігання інфікуванню, набряку мозку, геморагіям та реактивному гліозу.
2. Призначення ПЕП усім хворим, як із ранніми, так і з пізніми нападами (навіть поодинокими) із превентивною метою для поліпшення прогнозу в плані розвитку ранніх епілептичних нападів (протягом семи днів).
3. Усім особам із тяжкою відкритою ЧМТ рекомендовано лоразепам, діазепам, фенітоїн для профілактики ранніх нападів.
4. При генералізованих нападах препарати першої лінії – вальпроєва кистота, ламотриджин, при комплексних парціальних – вальпроати, карбамазепін, фенітоїн.
5. Превентивне лікування для пізніх нападів не визначене.
6. Профілактичне приймання ПЕП у хворих із ЧМТ, в яких не було нападів у гострому періоді, неефективне, та його доцільність не підтверджено з позицій доказової медицини.
7. Скасування ПЕП слід проводити індивідуально; якщо нападів немає, воно можливе вже через 3‑6 місяців.
Ризик епілептичних нападів після оперативного втручання асоційований із видаленням абсцесу, інтракраніальної гематоми, аневризми, супратенторіальним втручанням, стереотаксичними операціями, вентрикуляним дренуванням. Керуючись світовим підходом та власним досвідом, спікерка зазначила, що гострі післяопераційні напади внаслідок перенесеного втручання фактично є провокованими та не мають значного впливу на розвиток нападів у майбутньому. Також відсутня єдина думка щодо призначення ПЕП після резекції пухлин, незалежно від наявності нападів: на думку експертів Американської академії неврології (AAN), ефективність ПЕП дорівнює такій плацебо. Інші автори вважають за необхідне призначати ПЕП протягом 2‑3 місяців після супратенторіальних втручань. Профілактичне застосування ПЕП може бути ефективним при ранніх нападах та неефективним щодо пізніх.
Останнім варіантом симптоматичної епілепсії, яку розглянула доповідачка, була епілепсія, пов’язана з новоутвореннями головного мозку. Патогенез розвитку нападів зумовлений безліччю факторів, серед яких гістологічний варіант пухлини, цілісність гематоенцефалічного бар’єру, зміна концентрації іонів, гіпоксія, надлишок глутамату, зменшення концентрації γ-аміномасляної кислоти.
На додаток, Т.А. Літовченко перелічила доступні можливості зменшення ризику та/або позбавлення нападів. Так, коротша тривалість епілепсії (<1 року) та максимально успішне оперативне лікування пухлини є запорукою досягнення свободи від нападів та необхідності приймати ПЕП. Профілактичне застосування ПЕП за відсутності судом не рекомендоване. ПЕП призначають після першого нападу, пов’язаного з пухлиною (але не карбамазепін та фенітоїн через ризик взаємодії з хіміопрепаратами). Вальпроєва кислота забезпечує ефективний контроль нападів та навіть поліпшує виживаність пацієнтів із гліобластомою, однак необхідний контроль кількості тромбоцитів. Леветирацетам – сучасний антиконвульсант, який пригнічує спалахи епілептиформної активності, не впливаючи на нормальну нейрональну збудливість та має сприятливий фармакокінетичний профіль (відсутність печінкового метаболізму та міжлікарської взаємодії).
Симптоматична епілепсія після оперативного втручання через фармакорезистентність
Фармакорезистентна епілепсія, за визначенням Міжнародної протиепілептичної ліги (ILAE), має місце у разі неефективності терапії двома зважено обраними і використовуваними в адекватній комбінації та дозуванні лікарськими засобами. Натомість, успішним лікування вважається за умови припинення нападів упродовж одного року.
Консультація нейрохірурга обов’язкова за наявності фармакорезистентної епілепсії і таких умов: постійне вогнище епілептиформної активності за даними ЕЕГ-досліджень (навіть рутинної ЕЕГ) у хворих із парціальними (фокальними) нападами; склероз гіпокампа; збіг локалізації стабільного морфологічного осередкового ураження мозку і вогнищевої епілептиформної активністі за даними ЕЕГ-досліджень; мономорфність рефрактерних комплексних парціальних нападів; прогресивне погіршення перебігу фокальної епілепсії.
Логічним є питання щодо зміни тактики призначення ПЕП за умови проведення операції. За словами спікера, на сьогодні доказова база для обґрунтування раціональних рекомендацій щодо тактики постхірургічного медикаментозного лікування є недостатньою. Тому він поділився власним поглядом на оптимальну стратегію:
- Оцінювати ремісію внаслідок оперативного втручання можна тільки через рік, успішність хірургічного лікування – раніше.
- Хірургічне втручання у таких хворих має на меті подолання фармакорезистентності, що складає передумову для подальшого призначення антиконвульсантів.
- Протягом першого року змінювати схему терапії ПЕП недоцільно при контролі нападів (за винятком приймання ≥3 ПЕП та наявності побічних дій ПЕП, які погіршують якість життя хворого).
- При появі епілептичних нападів одразу після оперативного втручання не слід змінювати схему лікування.
- Якщо в пацієнта трапляються напади (навіть у разі значущого порідшання) чи аури, доцільно переглянути схему лікування для досягнення повного контролю нападів.
- Через рік повного контролю нападів тактика має бути такою ж, як у пацієнтів зі стійкою ремісією, але у разі політерапії можна переглянути зниження дозування одного з ПЕП та його вірогідне скасування раніше, ніж у хворого без операції в анамнезі.
- Тактику зниження дозування ПЕП викладено відповідно до світових рекомендацій (МОЗ, 2014; NICE, 2020):
- перед прийняттям рішення про можливе скасування ПЕП слід обстежити хворого з обов’язковим проведенням довготривалого ЕЕГ-дослідження та повторенням МРТ;
- збіг морфологічного та епілептогенного вогнищ ставить під сумнів можливість та доцільність скасування ПЕП у пацієнта;
- тривалість ремісії повинна становити ≥2 роки, але приймати рішення щодо зниження дозування ПЕП для подальшого скасування доцільно через 3‑5 років контролю нападів і лише за відсутності інших симптомів епілепсії;
- зменшення дози та скасування ПЕП слід проводити під контролем ЕЕГ-дослідження; у разі погіршення показників необхідно призупинити скасування;
- при відновленні нападів після скасування ПЕП варто поновити лікування – призначити препарат у тих самих дозах, які пацієнт приймав до відміни; але слід бути готовими до того, що може знадобитися корекція схеми терапії ПЕП.
Підготували А.Є. Дубенко, Т.А. Літовченко, М. Марчук
UA-LEVI-PUB-062020-042
Тематичний номер «Неврологія, Психіатрія, Психотерапія» № 2 (53) 2020 р.