12 грудня, 2016
Нефротический синдром в педиатрии

Нефротический синдром (НС) или нефроз, диагностируется при обнаружении нефротической протеинурии (НП), отеков, гиперлипидемии и гипоальбуминемии. НП у взрослых определяется как экскреция белка с мочой ≥3,5 г/сут, у детей этот симптомокомплекс распознается при уровне экскреции белка >40 мг/м2/ч или при значениях индекса белок/креатинин в первой порции утренней мочи ≥2-3 мг/мг.
У детей НС характеризуется наличием НП, отеков, гиперлипидемии и гипоальбуминемии. НП у взрослых диагностируется при экскреции белка ≥3,5 г/сут. В педиатрии применение этой основанной на НП дефиниции НС проблематично в связи с большим диапазоном размеров тела у детей. Нефротическая протеинурия у детей определяется на основании экскреции белка >40 мг/м2/ч. Поскольку 24-часовой сбор мочи достаточно ненадежен и затруднителен (особенно у маленьких детей), большинство педиатров-нефрологов предпочитают использовать разовый сбор первой утренней мочи для количественного определения экскреции белка по соотношению белок/креатинин. Анализ образца первой утренней мочи позволяет исключить потенциальное влияние непатологической ортостатической протеинурии, которая могла бы увеличить уровень белка в образце мочи, собранном после активного трудового дня. Значение соотношения белок/креатинин, превышающее 2-3 мг/мг, свидетельствует о НП и коррелирует с результатами 24-часового сбора мочи. Нефротический синдром представляет собой совокупность клинических симптомов, проявляющихся массивной почечной потерей белка. Таким образом, НС нельзя назвать самостоятельным заболеванием, он представляет собой клиническое проявление разнообразной патологии клубочков. Течение одних заболеваний может быть острым и непродолжительным (постинфекционный гломерулонефрит) или хроническим и прогрессирующим (фокально-сегментарный гломерулосклероз, ФСГС); другим нозологиям свойственно рецидивирующе-ремиттирующее течение (нефротический синдром с минимальными изменениями, НСМИ). Патологию клубочков, вызывающую НС, как правило, можно классифицировать на первичную и вторичную. Первичный НС, также известный как идиопатический НС (ИНС), ассоциирован с истинным поражением клубочков в почках и не связан с системными заболеваниями. Несмотря на то что более подробная систематизация ИНС основывается на данных гистологического исследования, существует четкая корреляция между клиническими проявлениями и гистопатологическими данными. Самые разнообразные поражения клубочков можно наблюдать при ИНС: это и НСМИ, и мембранозная нефропатия, мембранозно-пролиферативный гломерулонефрит, С3-гломерулонефрит, IgA-нефропатия, диффузная мезангиальная пролиферация и др.
В соответствии с определением вторичный НС развивается при воздействии внешних (по отношению к почке) этиологических факторов. Его причинами являются:
– аутоиммунные и сосудистые заболевания (болезнь Шенлейн-Геноха, системная красная волчанка и антинейтрофильные цитоплазматические антитела (ANCA)-ассоциированные васкулиты);
– инфекционные заболевания (врожденный сифилис, малярия, вирус иммунодефицита человека, гепатиты В и С);
– злокачественные новообразования;
– влияние факторов окружающей среды и воздействие наркотических веществ (героин, ртуть);
– системные заболевания (сахарный диабет и др.).
НС может бать также следствием генетической патологии. НС новорожденных (развивающийся в первые 3 мес жизни) и врожденный НС (проявляющийся в возрасте 4-12 мес) ассоциирован с мутациями гена нефрина (NPHS1), фосфолипазы С эпсилон‑1 (PLCE1), гена-супрессора опухоли Вильямса (WT1). Мутации гена подоцина (NPHS2) связаны с развитием аутосомно-доминантной формы семейного ФСГС. Мутации гена α-актинин‑4 (ACTN4) и гена TRPC6 ассоциированы с аутосомно-доминантной формой семейного ФСГС.
Другие генетические заболевания (синдром ногтей-надколенника или наследственная онихо-артроостеодисплазия, синдром Пирсона, иммунокостная дисплазия Шимке) также могут протекать с развитием НС.
ИНС дополнительно классифицируют на стероид-чувствительный и стероид-резистентный, поскольку ответ на терапию кортикостероидами имеет высокую корреляцию с гистологическим подтипом заболевания и прогнозом. Одним из самых масштабных исследований НС в педиатрии является Международное исследование заболеваний почек у детей (International Study of Kidney Disease in Children, ISKDC); эта научная работа доказала, что у подавляющего большинства детей преподросткового возраста с ИНС при проведении биопсии почек обнаруживают НСМИ. Необходимо отметить, что 90% больных НСМИ отвечают на терапию кортикостероидами развитием ремиссии заболевания, тогда как в группе пациентов с ФСГС на назначение кортикостероидов реагирует только 20% детей.
В данной статье рассматривается ИНС, преимущественно его стероид-чувствительная форма (на примере НСМИ). Лечение и прогноз для стероид-резистентного НС (в виде ФСГС у детей) обсуждается кратко. Рассмотрение врожденного и вторичного НС выходит за рамки данной публикации.
Патофизиология
Протеинурия и гипоальбуминурия
Иммунная система. Отличительным признаком ИНС является протеинурия, приводящая к снижению уровня альбумина, циркулирующего в сосудистом русле. Фактор, инициирующий появление протеинурии, в настоящее время точно не известен. Имеются убедительные доказательства того, что иммунные реакции играют существенную роль в патогенезе ИНС.
Способность глюкокортикоидов индуцировать ремиссию ИНС подразумевает вовлеченность иммунной системы, в частности Т-лимфоцитов, в патогенез заболевания. Глюкокортикоиды, опосредующие свое влияние через транскрипционный ядерный фактор «каппа-би» (NF-κB), оказывают самое разнообразное действие, включая ингибирование синтеза цитокинов, продукции Т-клеток и их пролиферации.
Результаты различных исследований предоставляют новые данные, доказывающие роль Т-клеток в развитии ИНС. У пациентов с ИНС в стадии ремиссии выявлены изменения сигнального пути NF-κB по сравнению со здоровыми лицами. При рецидиве ИНС активность транскрипции NF-κB возрастает в отличие от таковой в стадии ремиссии. Имеются также сообщения о развитии ИНС у пациентов с лимфомой Ходжкина (Т-клеточным заболеванием). По данным других наблюдений, у больных ИНС имеет место нарушение регуляции процессов дифференциации Т-клеток в вилочковой железе, а также изменение их субпопуляций по сравнению со здоровыми лицами.
Кроме Т-клеток значительная роль в патогенезе ИНС отводится В-клеткам: недавно опубликованы сообщения о ремиссии ИНС после лечения ритуксимабом, анти-CD20 моноклональным антителом, применение которого приводит к полному исчезновению В-лимфоцитов.
Циркулирующий фактор может играть значимую роль в развитии протеинурии при ИНС. Данный факт подтверждается быстрым развитием протеинурии при рецидиве НС после трансплантации почек и уменьшением выраженности НС у таких пациентов на фоне лечения плазмаферезом, а также индукцией протеинурии у экспериментальных животных плазмой больных ИНС.
Природа этого циркулирующего фактора мало изучена. Различные цитокины и молекулы могут быть вовлечены, в том числе:
– интерлейкин (ИЛ)-2, ИЛ‑4, ИЛ‑12, ИЛ‑13, ИЛ‑15, ИЛ‑18;
– рецептор ИЛ‑2;
– γ-интерферон;
– фактор роста опухоли-β;
– фактор сосудистой проницаемости;
– ядерный фактор NF-κB;
– фактор некроза опухоли-α.
Относительно недавно исследователи выявили высокий уровень циркулирующего растворимого рецептора урокиназы (suPAR) у детей и взрослых, больных ФСГС. Лечение иммуносупрессивными препаратами приводило к снижению концентрации suPAR, а падение уровня suPAR через 26 нед иммуносупрессивной терапии было ассоциировано с уменьшением степени протеинурии. Необходимо отметить, что наиболее высокие концентрации suPAR были зафиксированы у больных семейным ФСГС и пациентов с мутациями гена подоцина. Вероятно, suPAR может действовать как фактор, увеличивающий проницаемость клубочков.
Взаимосвязь аллергических реакций с НС также иллюстрирует роль иммунной системы в развитии ИНС. Известны случаи возникновения НС после аллергической реакции на укус пчел и других насекомых, употребления грибов, контакта с ядовитым плющом, амброзией, домашней пылью, медузами, кошачьей шерстью. Пищевая аллергия может стать причиной рецидива ИНС; по данным одного исследования, соблюдение гипоаллергенной диеты ассоциируется с уменьшением степени протеинурии и достижением полной ремиссии заболевания.
Кроме того, ИНС в 3-4 раза чаще диагностируется у детей, носителей человеческого лейкоцитарного антигена (HLA)-DR27. Стероид-чувствительный ИНС также ассоциирован с носительством HLA-B8 и наличием гена DQB1 из HAL-DQW2. Более высокая заболеваемость ИНС отмечена у детей, страдающих атопией и являющихся носителями HLA-B12.
Биология подоцитов и генетика. Возможно, наиболее важное открытие последних лет в понимании патофизиологии НС было сделано в области биологии подоцитов (рис.).
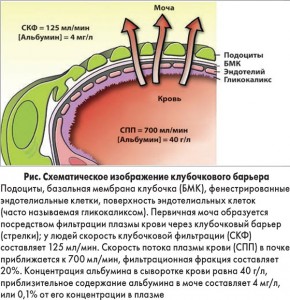
Фильтрационный барьер состоит из эндотелия фенестрированных капилляров, внеклеточной базальной мембраны и вставочных цитоподий подоцитов, соединенных щелевыми диафрагмами шириной 34-45 нм. По данным биопсии, при НС происходит сглаживание цитопедикул подоцитов. Долгое время считалось, что именно это является побочным проявлением НС.
В настоящее время патогенетические теории изменились, и теперь главная роль в развитии протеинурии отводится подоцитам. Понимание патофизиологии возникновения протеинурии при заболеваниях почек значительно расширилось с появлением новых знаний о молекулярной биологии подоцитов. Были описаны различные формы ИНС с генетическими мутациями, связанные:
– с щелевой диафрагмой и цитоскелетом подоцитов – NPHS1, NPHS2, TRCP6, CD2AP, ACTN4, INF2, MYH9, MYO1E;
– фосфолипазой и системой вторичных посредников – PLCE1;
– БМК – LAMB2;
– транскрипционными факторами – WT1, LMX1B;
– лизосомальными протеинами – SCARB2;
– митохондриальными протеинами – COQ2;
– ДНК-нуклеосомным медиатором реконструкции – SMARCAL1.
Нефрин представляет собой трансмембранный белок, он является основным структурным элементом щелевой диафрагмы и кодируется геном NPHS1, расположенным на 19-й хромосоме. Мутации гена NPHS1 ответственны за возникновение врожденного, аутосомно-рецессивного НС финского типа, который характеризуется массивной протеинурией, развивающейся в течение 1-го года жизни (как правило, в первые 3 мес), и быстрым, на протяжении первых 10 лет, прогрессированием в терминальную стадию болезни почек; однако описаны и более мягкие формы заболевания. Мутации гена NPHS1, как правило, ассоциированы с развитием врожденного НС, но Philipe и соавт. описали мутации NPHS1 у детей в возрасте от 6 мес до 8 лет с более поздним началом стероид-резистентного НС. Santin обнаружил мутации NPHS1 у детей более старшего возраста, а также у взрослых пациентов со стероид-резистентным НС.
Подоцин – еще один протеин подоцитов, который взаимодействует с нефрином и CD2AP и является неотъемлемой частью структурной организации щелевой диафрагмы. Подоцин кодируется геном NPHS2, расположенным на 1-й хромосоме. Мутации гена NPHS2 описаны у пациентов с аутосомно-рецессивным, стероид-резистентным ИНС и гистологически подтвержденным ФСГС. Мутации подоцина выявляют в 45-55% наследственных и 8-20% спорадических случаев стероид-резистентного НС.
α-Актинин‑4, кодируемый геном ACTN4, картированным в районе 19-й хромосомы, связывает актиновые филаменты цитосклелета подоцитов и прикрепляет их к БМК. Ген TRPC6, расположенный на 11-й хромосоме, кодирует кальциевые каналы, связанные со щелевой диафрагмой. Повреждение гена ACTN4 или TRPC6 приводит к развитию аутосомно-доминантной формы ФСГС.
CD2AP кодирует белок подоцитов, связывающий подоцин и нефрин, и ассоциирован с развитием НС у экспериментальных животных. Однако его роль в развитии НС у людей остается пока неясной. В ряде клинических случаев выявлены гетерозиготные мутации CD2AP у пациентов с НС и ФСГС. В одном сообщении описывается один пациент с гомозиготной мутацией CD2AP и ранним началом НС, ФСГС и диффузным мезанглиальным склерозом.
Поскольку риск развития терминальной стадии болезни почек у афроамериканцев в 3-4 раза выше, чем у лиц европеоидной расы, генетические исследования попытались объяснить выявленную зависимость. В 2008 г. зафиксирована сильная взаимосвязь у лиц афроамериканского происхождения между идиопатическим и ВИЧ-индуцированным ФСГС, а также гипертензивной терминальной стадией болезни почек и мутациями тяжелых цепей немышечного миозина 9 (MYH9). Немышечный MYH9 представляет собой белок подоцитов, который связывается с актинами цитоскелета подоцита для выполнения внутриклеточных двигательных функций.
Однако последние исследования доказали, что увеличение риска заболевания почек, ранее объяснявшееся наличием MYH9, на самом деле тесно взаимосвязано с изменениями смежного гена аполипопротеина L1 (APOL1). Интересно, что эти мутации APOL1, чаще выявляемые у афроамериканцев и отсутствующие у европеоидов, способны приводить к лизису трипаносом и могут придавать резистентность к развитию африканской сонной болезни (инфекции, вызываемой Trypanosoma brucei rhodesiense).
Еще один ген немышечного миозина MYO1E, по последним данным, ассоциирован с развитием ФСГС у детей. Мутации гена MYO1E способствуют деструкции цитоскелета подоцитов.
Другие генетические формы НС продолжают проливать свет на патогенез ИНС. Мутации, возникающие в регуляторном гене WT1, ассоциированы с врожденной формой НС и мужским псевдогермафродитизмом, опухолью Вильмса (синдром Дениса-Драша) и гонадобластомой (синдром Фрейзера).
Мутации фосфолипазы С эпсилон‑1 (PLCE1), цитоплазматического фермента, необходимого для созревания подоцитов, выявляются в 28% случаев врожденного НС, вызванного изолированным (несиндромным) диффузным мезанглиальным склерозом. Синдром ногтей-надколенника – заболевание, характеризующееся дисплазией костей, ногтей и развитием НС, обусловленное мутацией гена LMX1B, регулирующего экспрессию IV типа коллагена и белков подоцитов (нефрина, подоцина и CD2AP).
Синдром Пирсона, который сопровождается микрокорией, аномальной формой хрусталика, катарактой, слепотой, тяжелым неврологическим дефицитом, врожденным НС и прогрессирующей почечной недостаточностью, вызывается мутацией гена LAMB2, кодирующим β2-ламинин (расположенный в базальной мембране клубочка, сетчатке, хрусталике и нейромышечных синапсах).
Остальные редкие формы НС ассоциированы с мутациями гена SCARB2, кодирующего лизосомальный протеин; повреждение этого гена вызывает синдром миоклонической эпилепсии и гломерулосклероз. Изменения митохондриального протеина, кодируемого геном COQ2, ассоциированы с синдромом энцефалопатии и нефропатии. Наконец, мутации гена SMARCAL1 вызывают иммунокостную дисплазию Шимке – синдром, характеризующийся спондилоэпифизарной дисплазией, приводящей к диспропорциональной низкорослости, нефропатии и Т-клеточному дефициту.
Роль изменений щелевой диафрагмы при НСМИ остается неясной. Уровень экспрессии подоцина, по всей видимости, при НСМИ не изменяется, но снижается при ФСГС. В настоящее время мутациям нефрина и подоцина не придают большого значения в развитии стероид-резистентного НС. Тем не менее приобретенные в архитектуре щелевой диафрагмы изменения могут сыграть значимую роль в развитии ИНС, за исключением истинных мутаций в генах, кодирующих белки подоцитов. Различные авторы сообщали об изменении уровня экспрессии и распределения нефрина при НСМИ.
Coward и соавт. доказали, что нефротическая плазма индуцирует транслокацию в щелевой диафрагме белков нефрина, подоцина и CD2AP от плазматической мембраны в цитоплазму подоцита. Эти авторы также установили, что нормальная плазма может содержать факторы, поддерживающие целостность архитектуры щелевой диафрагмы, а отсутствие некоторых факторов (реже, чем наличие патологических циркулирующих факторов) может быть ответственно за изменение архитектуры подоцитов и развитие ИНС.
Таким образом, в дополнение к традиционной иммунологической теории патогенеза ИНС, в последние годы стало ясно, что ИНС также является подоцитопатией. Подоциты обладают глюкокортикоидными рецепторами, способными стабилизировать цитоскелет подоцита и ингибировать апоптоз. Циклоспорин (еще одно эффективное лекарственное средство для лечения ИНС) может непосредственно воздействовать на подоцит посредством ингибирования фосфорилирования синаптоподина – белка подоцита, играющего важную роль в поддержании целостности БМК.
Помимо подоцита и щелевой диафрагмы изменения БМК могут сыграть важную роль в развитии протеинурии при НС. При ИНС капиллярная проницаемость клубочков для альбумина возрастает; это увеличение фильтрационной нагрузки превышает незначительную способность канальцев к реабсорбции белка.
В нормальном состоянии БМК имеет отрицательный заряд из-за наличия на ее поверхности различных полианионов, таких как гепарина сульфат, хондроитина сульфат и сиаловая кислота. Этот отрицательный заряд действует в качестве сдерживающего фактора фильтрации отрицательно заряженных белков, в том числе альбумина. Результаты экспериментальных исследований, в которых отрицательные заряды удалялись с поверхности базальной мембраны, доказали, что их отсутствие приводит к увеличению альбуминурии. По последним данным, у детей с НСМИ снижается анионный заряд БМК.
Отеки. Классическое объяснение образования отеков заключается в снижении онкотического давления плазмы и, как следствие, уменьшении уровня сывороточного альбумина, приводящее к пропотеванию жидкой части плазмы в интерстициальное пространство. В результате уменьшения объема плазмы происходит стимуляция ренин-ангиотензин-альдостероновой оси и антидиуретического гормона. Возникающая вследствие этого задержка натрия и воды почечными канальцами приводит к распространению и поддержанию отеков.
Несмотря на то что классическая модель развития отеков (известная также как «гипотеза недостаточного заполнения») представляется логичной, некоторые клинические и экспериментальные исследования не полностью поддерживают этот традиционный подход. Во-первых, объем плазмы не всегда уменьшается – у большинства взрослых больных измерение объема плазмы доказало увеличение этого показателя. Только у маленьких детей с НСМИ (но не у всех) в ходе исследований зафиксировано снижение объема плазмы.
Кроме того, во многих исследованиях зарегистрировано увеличение концентрации ренина, ангиотензиногена, альдостерона, даже при повышенной задержке натрия. Активная реабсорбция натрия продолжается, несмотря на действия, которые должны противостоять влиянию ренина (инфузия альбумина или прием ИАПФ).
С этими несоответствиями связан еще один факт: при стероид-чувствительном НС диурез, как правило, начинается еще до значительного увеличения концентрации альбумина в плазме крови и изменения онкотического давления. Некоторые исследователи доказали снижение чувствительности к воздействию предсердного натрийуретического пептида (ПНП), несмотря на высокий уровень ПНП, циркулирующего в плазме крови.
Еще одна модель образования отеков (гипотеза «чрезмерного заполнения») постулирует первичный дефект в почечной регуляции баланса натрия. Первичное увеличение реабсорбции натрия в почках приводит к увеличению суммарной задержки соли и воды, а затем – к гипертензии.
ПНП может играть важную роль в этом механизме, исследования доказали ухудшение ответа на воздействие данного гормона при НС. Выявленная резистентность к ПНП частично может быть обусловлена чрезмерной эфферентной активностью симпатических нервных волокон, а также усилением тубулярной недостаточности под воздействием циклического гуанозинмонофосфата.
Другими механизмами, способствующими первичному увеличению задержки натрия в почках, являются гиперактивность Na+-K+-АТФазы и почечных эпителиальных натриевых каналов, расположенных в кортикальных собирательных канальцах, а также сдвиг Na+/H+ обменника 3-типа (NHE‑3) от неактивного до активного пула в проксимальных канальцах.
Существующая в настоящее время теория образования отеков утверждает, что массивная протеинурия способствует развитию тубулоинтерстициального воспаления, высвобождению локальных вазоконстрикторов и ингибированию вазодилатации. Все это приводит к снижению СКФ и задержке натрия и воды.
Таким образом, точная причина возникновения отеков и их дальнейшей персистенции пока до конца не выяснена. Вероятно, свой вклад в развитие отеков вносит сложное взаимодействие между различными физиологическими факторами, в том числе:
– снижение онкотического давления;
– увеличение активности альдостерона и вазопрессина;
– снижение уровня предсердного натрийуретического гормона;
– активность различных цитокинов и физических факторов в нисходящих прямых сосудах почек.
Гиперлипидемия. ИНС сопровождается нарушением метаболизма липидов. Содержание аполипопротеин-В‑содержащих липопротеинов увеличиваются, включая липопротеины очень низкой плотности, липопротеины промежуточной плотности, липопротеины низкой плотности (ЛПНП), в результате чего происходит увеличение концентрации общего холестерина и холестерина ЛПНП. Уровень холестерина липопротеинов высокой плотности остается нормальным или низким. Рост концентрации триглицеридов наблюдается на фоне тяжелой гипоальбуминурии.
Традиционное объяснение возникновения гиперлипидемии при ИНС сводится к увеличению образования липопротеинов и возрастанию синтеза альбумина в печени, вызванными гипоальбуминемией. Было доказано, что уровень сывороточного холестерина не зависит от скорости синтеза альбумина.
Снижение онкотического давления плазмы может играть важную роль в увеличении синтеза липопротеинов в печени, данный факт был доказан снижением уровня гиперлипидемии у больных ИНС, получающих инфузии альбумина или декстрана. Свой вклад в развитие дислипидемии при ИНС вносит патология регуляторных ферментов, таких как лецитин-холестерин-ацилтрансфераза, липопротеинлипаза, белок – переносчик эфиров холестерина.
Тромбоз. Пациентам с НС свойственен высокий риск развития тромбоза. Распространенность тромбоэмболических осложнений (ТЭО) у взрослых больных НС составляет 25%. Риск ТЭО варьирует в зависимости от основного заболевания. У детей с врожденным НС распространенность ТЭО составляет ~10%. Вероятность тромбоза возрастает в период детства: риск ТЭО у подростков выше, чем у маленьких детей 1-го года жизни. Вероятность ТЭО при вторичном НС превосходит таковую при первичном. У детей с мембранозной нефропатией и НС существует высокий риск ТЭО, его распространенность составляет ~25%. В одном из исследований на основании результатов сцинтиграфического анализа легочной вентиляции и других перфузионных исследований было доказано, что субклиническая скорость возникновения легочной эмболии у детей с НС составляет 28%.
Наибольший риск развития ТЭО зафиксирован при раннем развитии НС. По некоторым данным, среднее время от установления диагноза НС до развития ТЭО составляет 70 дней. В других исследованиях установлено, что большинство ТЭО возникает в течение первых 3 мес после подтверждения диагноза.
Тромбоз почечных и глубоких вен, легочная эмболия наиболее часто осложняют течение НС у детей. Другими характерными локализациями венозного тромбоза являются верхний сагиттальный синус, иные церебральные венозные образования, нижняя полая вена.
Артериальный тромбоз менее характерен, чем венозные ТЭО, но он тоже может возникать; зафиксированы случаи его локализации в подмышечных, подключичных, бедренных, коронарных и мезентериальных артериях.
НС относится к гиперкоагуляционным состояниям. Увеличение риска тромбоза может быть связано с двумя основными механизмами: потерей с мочой антитромботических белков и увеличением синтеза протромботических факторов.
Аномалии, описанные при ИНС, включают уменьшение синтеза антитромботических факторов и увеличение образования протромботических факторов.
Имеет место снижение содержания следующих антитромботических факторов:
– антитромбина III;
– протеина С и S (спорные данные).
Увеличение синтеза протромботических факторов связывают:
– с возрастанием количества тромбоцитов, активацией тромбоцитов и их агрегацией;
– ростом концентрации V, VIII факторов, фактора фон Виллебранда, ингибитора α2-плазмина, ингибитора активатора плазминогена‑1, фибриногена;
– увеличением активности тканевого активатора плазминогена и ингибитора активатора плазминогена‑1.
Эти нарушения в системе гемостаза, ассоциированных с потенциальной гиповолемией, неподвижностью, высокой распространенностью инфекционных заболеваний, приводят к гиперкоагуляционному состоянию при ИНС.
Инфекции
Пациентам с ИНС свойственен высокий риск развития инфекционных заболеваний. Перитонит и сепсис относятся к наиболее распространенной и тяжелой инфекционной патологии. Перитонит развивается приблизительно у 2-6% больных и может сопровождаться сепсисом или бактериемией. Доминирующими бактериями, вызывающими эти заболевания, являются Streptococcus pneumoniae и такой грамотрицательный кишечный микроорганизм, как Escherichia coli.
Могут возникать и другие инфекционные заболевания, в том числе менингит, целлюлит, вирусные инфекции и др. Ветряная оспа представляет наибольшую опасность для пациентов, которые проходят курс иммуносупрессивной терапии, т. к. может стать причиной летального исхода. Большое значение в профилактике развития этой жизнеугрожающей инфекции имеют своевременная диагностика и лечение ацикловиром (или проведение постконтактной профилактики с использованием иммуноглобулина против ветряной оспы). Рутинная иммунизация детей смягчает некоторую настороженность в отношении этого осложнения.
Инфекционные заболевания вирусной или бактериальной природы могут вызвать рецидив ИНС и осложнить течение этого заболевания.
Риск инфицирования при ИНС возрастает из-за снижения уровня иммуноглобулина (Ig) G. Низкое содержание IgG является не следствием его потери с мочой, а результататом ухудшения его синтеза, что снова указывает на первичное нарушение регуляции лимфоцитов при ИНС.
Кроме того, отмечается увеличение потерь с мочой фактора В. Он является кофактором С3b в альтернативном пути активации комплемента, которому отводится важная роль в опсонизации инкапсулированных организмов (S. pneumoniae). При ИНС также может наблюдаться ухудшение функционирования Т-клеток, что также способствует росту восприимчивости к инфекционным заболеваниям. Наконец, лекарственные препараты, применяющиеся для лечения ИНС (кортикостероиды, алкилирующие агенты), подавляют иммунную систему и увеличивают риск развития инфекционной патологии.
Острая почечная недостаточность
Острая почечная недостаточность (ОПН) представляет собой достаточно редкое осложнение ИНС, развивающееся примерно в 0,8% случаев.
Причины возникновения этой патологии:
– быстрое прогрессирование основного заболевания (НС, за исключением НСМИ, вторичный НС);
– билатеральный тромбоз почечных вен;
– острый интерстициальный нефрит, обусловленный медикаментозной терапией (антибиотики, нестероидные противовоспалительные препараты (НПВП), диуретики);
– острый тубулярный некроз, вызванный гиповолемией или сепсисом.
Применение ИАПФ или БРА II в сочетании с уменьшением объема межклеточной жидкости может ускорить наступление ОПН.
Диагностика
Объективные и субъективные симптомы
Пастозность – один из первых симптомов, обнаруживаемых у 95% детей с НС. Как правило, пастозность локализуется на нижних конечностях, лице и в периорбитальных областях, мошонке или на половых губах, животе (асцит).
Другие субъективные и объективные проявления НС могут включать:
– инфекции респираторного тракта (часто в анамнезе жизни имеются указания на перенесенную инфекцию дыхательных путей непосредственно перед возникновением НС);
– аллергию (~30% детей с НС имеют отягощенный анамнез по аллергии);
– макрогематурию;
– симптомы инфекции (лихорадка, вялость, раздражительность или абдоминальная боль, обусловленная сепсисом или перитонитом);
– гипотензию и симптомы шока (обнаруживаются у детей с сепсисом);
– респираторный дистресс-синдром (обусловлен массивным асцитом и компрессией грудной клетки, выраженным отеком легких и/или экссудатом);
– тахипноэ (с целью компенсации механических помех дыханию);
– эпилептические припадки (вызваны церебральным тромбозом);
– анорексию;
– раздражительность;
– усталость;
– абдоминальный дискомфорт;
– диарею;
– гипертензию.
Лабораторные методы исследования
Диагноз НС правомочен, если при лабораторном обследовании обнаружены:
– нефротическая протеинурия;
– гипоальбуминемия;
– гиперлипидемия.
Поэтому первоначальное лабораторное обследование нужно начать:
– с клинического анализа мочи;
– количественного определения белка в моче;
– определения концентрации альбумина в сыворотке крови;
– липидограммы.
Нижеперечисленные исследования необходимы, чтобы установить, является ли НС идиопатическим или вторичным (при подозрении на ИНС следует исключить хроническую болезнь почек, почечную недостаточность, а также НСМИ):
– клинический анализ крови;
– метаболическая панель (электролиты сыворотки крови, кальций, фосфор, ионизированный кальций, остаточный азот мочевины и креатинин);
– тестирование на ВИЧ-инфекцию;
– тестирование на гепатиты В и С;
– исследование комплемента (С3, С4);
– антинуклеарные антитела (ANA), антитела к двухцепочечной нативной ДНК (у некоторых пациентов).
Некоторым больным могут понадобиться дополнительные тесты и процедуры:
– генетическое исследование;
– ультразвуковое исследование почек;
– рентгенологическое исследование грудной клетки;
– проба Манту;
– биопсия почек.
Лечение
Кортикостероиды
В случае если первоначально биопсия почек не проводилась, первым шагом в лечении ИНС может стать назначение кортикостероидов.
Диуретики
Петлевые диуретики, например фуросемид (стартовая доза 1-2 мкг/кг/сут), могут уменьшать выраженность отеков. Метолазон может назначаться в комбинации с фуросемидом для лечения резистентных отеков.
Гипотензивные препараты
Ингибиторы ангиотензин-превращающего фермента (ИАПФ) и блокаторы рецептора ангиотензина II (БРА) могут снизить высокое артериальное давление и способствовать уменьшению протеинурии. Однако эти препараты провоцируют появление врожденных дефектов у плода, поэтому девочки-подростки, принимающие ИАПФ и БРА, должны быть проинформированы относительно необходимости использования средств контрацепции, а перед тем, как назначать этой категории пациентов указанные лекарственные средства, девочкам-подросткам следует провести тест на беременность.
Блокаторы кальциевых каналов и бета-блокаторы также могут использоваться в качестве препаратов первой линии для лечения гипертонии.
Алкилирующие препараты
Применение алкилирующих агентов (циклофосфамида, хлорамбуцила, азотистого иприта) сопряжено с вероятностью достижения стойкой ремиссии после завершения установленного курса лечения, а также с возможным риском развития бесплодия и других побочных эффектов.
Ингибиторы кальциневрина
Ингибиторы кальциневрина (циклоспорин А, такролимус) являются стероидсберегающими препаратами и могут назначаться детям, не ответившим на ранее назначенное лечение, а также пациентам, у которых возник рецидив заболевания после приема циклофосфамида, или тем детям, родители которых возражают против назначения циклофосфамида.
Домашний мониторинг
Контроль степени протеинурии и состояния водного обмена – важный аспект терапии. Все пациенты и их родители должны уметь определять в домашних условиях содержание белка в первой утренней моче при помощи индикаторных тест-полосок. Исследование мочи в домашних условиях также целесообразно для мониторинга состояния пациентов, ответивших / не ответивших на лечение стероидами.
Этиология
Причины возникновения ИНС:
– НСМИ;
– ФСГС;
– мембранопролиферативный гломерулонефрит;
– мембранозный гломерулонефрит;
– С3-гломерулонефрит;
– IgA-нефропатия;
– идиопатический серповидный гломерулонефрит.
Причины развития генетического или врожденного НС:
– финский тип врожденного НС (NPHS1, нефрин);
– синдром Дениса-Драша (WT1);
– синдром Фрейзера (WT1);
– диффузный мезангиальный склероз (WT1, PLCE1);
– аутосомно-рецессивный, семейный ФСГС (NPHS2, подоцин);
– аутосомно-доминантный, семейный ФСГС (ACTN4, α-актинин, TRPC6);
– синдром ногтей-надколенника (LMX1B);
– синдром Пирсона (LAMB2);
– иммунокостная дисплазия Шимке (SMARCAL1);
– синдром Галлоуэя-Мовата;
– синдром Лоу.
Инфекционные заболевания могут спровоцировать развитие вторичного НС:
– врожденный сифилис, токсоплазмоз, цитомегаловирус, ветряная оспа;
– гепатит В и С;
– ВИЧ/синдром приобретенного иммунодефицита (СПИД);
– малярия.
Лекарственные препараты, способные вызвать вторичный НС:
– пеницилламин;
– золото;
– НПВП;
– интерферон;
– ртуть;
– героин;
– памидронат;
– литий.
Причиной возникновения вторичного НС могут стать некоторые системные заболевания:
– системная красная волчанка;
– васкулиты – гранулематоз Вегенера (гранулематоз с ангиопатией), синдром Черджа-Стросса (эозинофильный гранулематоз с ангиопатией), узелковый периатериит, микроскопический полиангиит, пурпура Шенлейна-Геноха;
– иммунокомплексно-опосредованный постинфекционный гломерулонефрит.
Эпидемиология
В США ежегодно регистрируется 2-7 случаев НС на 100 тыс. детей младше 16 лет. Суммарная распространенность составляет ~16 случаев на 100 тыс. человек. По данным исследования ISKDC, при проведении биопсии у 76,6% детей с ИНС диагностируют НСМИ и только в 7% случаев выявляют признаки ФГС.
В исследовании, проведенном в Новой Зеландии, были получены другие сведения о распространенности НС: 20 случаев на 1 млн детей младше 15 лет. В отдельных популяциях (финны, меннониты) врожденный НС развивается у 1 ребенка на 10 тыс. детей или на 500 родов соответственно.
Расовые, гендерные и возрастные особенности
У детей афро- и латиноамериканцев имеется высокий риск развития стероид-резистентного НС и ФСГС. Увеличение распространенности ИНС регистрируется у азиатских детей (в 6 раз выше, чем у европейцев), а также у детей, проживающих в Индии, Японии, Юго-Западной Азии.
Первичный и стероид-чувствительный НС редко развивается в странах Африканского континента, здесь чаще встречаются вторичная или стероид-резистентная формы. Указанные этнические и географические различия подчеркивают влияние генетических факторов и окружающей среды на развитие НС у детей.
По данным различных исследований, у детей младше 8 лет соотношение между мальчиками и девочками варьирует от 2:1 до 3:2. У старших детей, подростков и взрослых гендерные различия практически нивелируются. Согласно результатам исследования ISKDC 66% пациентов с НСМИ или ФСГС – это представители мужского пола, тогда как ~65% больных мембранопролиферативным гломерулонефритом – женщины.
В когорте больных НСМИ 70% пациентов моложе 5 лет. Только у 20-30% подростков с ИНС при биопсии выявляют признаки НСМИ. На протяжении первого года жизни доминируют генетически детерминированный ИНС и вторичный НС, вызванный врожденными инфекциями.
Прогноз
С появлением кортикостероидов показатели общей летальности при ИНС значительно снизились – с 50 до 2-5%. Несмотря на очевидное увеличение выживаемости больных ИНС, качество жизни большинства пациентов осложнено многими серьезными проблемами, вызванными этим хроническим, рецидивирующим заболеванием. Больные нуждаются в постоянном родительском и врачебном наблюдении, они могут принимать препараты, способные вызвать опасные нежелательные реакции. Кроме того, для ИНС характерны высокая вероятность рецидива (>60% больных), потенциальное прогрессирование в хроническую почечную недостаточность и терминальную стадию заболевания почек.
Кроме этого ИНС ассоциирован с увеличением риска возникновения множественных осложнений: отеков, инфекционной патологии, тромбозов, гиперлипидемии, ОПН, кардиоваскулярных заболеваний. Прогноз зависит от того, является ли НС стероидчувствительным или стероидрезистентным.
Стероидчувствительный НС
Пациенты, отвечающие на терапию кортикостероидами ремиссией протеинурии, несмотря на частые рецидивы, как правило, имеют хороший прогноз. По данным исследования ISKDC, примерно у 93% детей с ИНС, ответивших на терапию стероидами, при биопсии почек обнаружили признаки НСМИ. И наоборот, у 75% пациентов, не ответивших на инициальную терапию кортикостероидами, получены гистологические результаты, отличные от НСМИ.
Около 90% детей с НСМИ (и только 20% детей с ФСГС) достигают ремиссии после инициального курса терапии стероидами.
Несмотря на благоприятный прогноз для пациентов, ответивших на прием стероидов, данные исследования ISKDC свидетельствуют: в 60% случаев имеет место рецидив заболевания, что может привести к развитию осложнений, росту числа случаев летальности и снижению качества жизни. Длительный курс инициальной терапии стероидами (12-недельный, а не оригинальный 8-недельный, использованный в протоколе ISKDC) может уменьшить вероятность рецидива до 36%; однако этот процент остается достаточно высоким и по-прежнему представляет большое количество пациентов, которые подвергнутся повторным курсам иммуносупрессивной терапии, вероятной госпитализации и у которых возникнут отеки, инфекционные заболевания, разовьются побочные действия и появятся сопутствующие заболевания.
Результаты одного продолжительного исследования (n=398 с ИНС) продемонстрировали, что количество детей, у которых после завершения курса лечения не развивались рецидивы, возросло с 44% в течение одного года после подтверждения диагноза до 69% на протяжении 5 лет и достигло 84% в течение 10 лет после установления диагноза. Несмотря на то что большинство ответивших на терапию стероидами детей с ИНС достигают длительной ремиссии, в зрелом возрасте у них могут развиться рецидивы заболевания.
Данные других исследований свидетельствуют, что >90% детей, достигших длительной ремиссии, не страдают от рецидивов во время полового созревания. Тем не менее данный факт недавно был поставлен под сомнение результатами опросов, показавшими, что частота рецидивов заболевания в зрелом возрасте составляет 27-42%.
В ретроспективном исследовании Vivarelli и соавт. установили, что время между началом инициальной терапии стероидами и наступлением ремиссии следует рассматривать как ранний прогностический фактор для детей с ИНС. В этом исследовании у пациентов без рецидивов или у больных, у которых они редко возникали, среднее время от назначения лечения до начала ремиссии составляло <7 дней, а у пациентов с частыми рецидивами или со стероид-зависимым НС – >7 дней.
Исследование, проведенное с участием 42 взрослых пациентов, перенесших в детстве ИНС, показало, что у 33% больных рецидивы заболевания продолжались в зрелом возрасте. К счастью, уровень общей заболеваемости (патология костной ткани, инфекционные болезни, опухоли, кардиоваскулярные осложнения) оставался низким, и взрослые пациенты имели нормальные показатели роста, индекса массы тела, функции почек. Предикторами рецидива заболевания у взрослых являлись количество рецидивов в детском возрасте и прием иммуносупрессантов, отличных от стероидов (циклоспорин, хлорамбуцил, циклофосфамид).
Стероидрезистентный НС
Около 10% пациентов с ИНС (и 2% больных НСМИ) не отвечают на инициальную терапию стероидами. Кроме того, ~1-3% больных, первоначально ответивших на прием стероидов, позже становятся резистентными к их применению («поздние неответчики»).
Большинство пациентов, не достигших ремиссии протеинурии при помощи стероидов, по данным биопсии почек имеют патологию, отличную от НСМИ. Наиболее частым диагнозом у этих больных является ФСГС.
Течение заболевания у более чем 60% больных с НС и ФСГС, не достигших ремиссии при помощи какой-либо терапии, быстро прогрессирует в терминальную стадию болезни почек. Заслуживает внимания тот факт, что у 15% пациентов с ФСГС, достигших ремиссии посредством применения любого вида лечения, происходит трансформация болезни в терминальную стадию заболевания почек. Gipson и соавт. сообщили о 90% снижении риска прогрессирования в терминальную стадию болезни почек у больных ИНС, достигших ремиссии.
Таким образом, пациенты со стероид-резистентным ИНС имеют хороший прогноз, если ремиссия протеинурии может быть достигнута посредством применения других медикаментов. Отсутствие ответа на терапию (т. е. невозможность достичь ремиссии) и наличие клинических признаков почечной недостаточности на момент установления диагноза являются предикторами неблагоприятного исхода и прогрессирования заболевания в терминальную стадию болезни почек.
Основные осложнения
Осложнения ИНС подробно рассмотрены в разделе Патофизиология:
– отеки;
– гиперлипидемия;
– тромбоз (наиболее частыми ТЭО у детей являются тромбоз почечных и глубоких вен, легочная эмболия; другие частые локализации венозного тромбоза: верхний сагиттальный синус, церебральные венозны, нижняя полая вена);
– инфекции (спонтанный бактериальный перитонит, сепсис, целлюлит);
– ОПН;
– нежелательные реакции на применение медикаментов (стероидов, диуретиков, альбумина, стероид-сберегающих агентов).
Обучение пациентов
Вскоре после подтверждения диагноза НС пациент и члены его семья должны быть проинформированы о сути заболевании, возможном лечении и предполагаемой длительности терапии. Родственникам следует принимать участие в принятии терапевтических решений, их необходимо поощрять придерживаться схем приема назначенных препаратов.
Как и при остальных хронических заболеваниях, могут возникнуть различные психосоциальные проблемы, и, чтобы они не осложняли не только лечение, но и жизнь ни больному, ни его родным, необходимо:
– придерживаться поведенческой терапии;
– контролировать приверженность больного к приему медикаментов;
– обеспечить адекватный надзор за ним со стороны родителей / лиц, осуществляющих временный уход;
– иметь медицинскую страховку;
– предусмотреть пропуски учебы и работы в связи с госпитализацией и амбулаторными визитами.
Необходимо также иметь в виду, что могут понадобиться консультации представителей социальных служб и работников службы охраны психического здоровья.
Lane J.C. Pediatric Nephrotic Syndrome. 2016. http://emedicine.medscape.com/article/982920
Перевела с англ. Лада Матвеева


