29 липня, 2020
Роль лізоциму в реакціях вродженого імунітету при респіраторній інфекції у дітей
.jpg) Гострі і хронічні запальні захворювання глотки у дітей є однією з найбільш частих причин звернення до лікарів первинної ланки. При цьому у дітей часто спостерігається порушення резистентності організму, зокрема зниження здатності вродженого імунітету протистояти інфекціям.
Гострі і хронічні запальні захворювання глотки у дітей є однією з найбільш частих причин звернення до лікарів первинної ланки. При цьому у дітей часто спостерігається порушення резистентності організму, зокрема зниження здатності вродженого імунітету протистояти інфекціям.
Першою лінією захисту проти вторгнення мікроорганізмів є вроджений імунітет. Він включає фізичний (механічний), хімічний, мікробний бар’єри, секрецію захисних субстанцій (антимікробні пептиди, лізоцим, комплемент, білки гострої фази, цитокіни), клітини (дендритні, моноцити, макрофаги, гранулоцити, мастоцити, натуральні кілери) [9].
Основною причиною розвитку запальних захворювань глотки (фарингіту, тонзиліту, ринофарингіту та ін.) є респіраторні віруси – риновіруси, віруси парагрипу, ентеровіруси, коронавіруси, герпетичні віруси (вірус простого герпесу, цитомегаловірус, вірус Епштейна – Барр). Серед бактеріальних збудників ключову роль відіграють піогенні стрептококи, особливо b-гемолітичний стрептокок групи А, а також стрептококи груп С і G, Mycoplasma рneumonia, Chlamydia pneumonia, Arcanobacterium hemolyticum, Haemophilus Influenzae, Moraxella catarrhalis тощо [9]. Найпершим захисником організму людини від патологічних збудників стає вроджений імунітет. У ході еволюції вроджена імунна система виникла раніше адаптивної. Її рецептори, закодовані в геномі, мають ряд відмінностей від рецепторів антигенів. Вони експресуються декількома ефекторними клітинами вродженої імунної системи (макрофагами, дендритними клітинами і В-лімфоцитами – професійними антиген-представляючими клітинами) [6]. Оскільки набір генів у геномі обмежений, а мікроби та віруси досить гетерогенні і здатні швидко мутувати, вроджене імунне розпізнавання опосередковане образ- або патерн-розпізнавальними рецепторами (PRR – pattern-recognition receptors) із фокусуванням на кількох висококонсервативних структурах – патогенасоціаційованих молекулярних патернах (PAMP – pathogen-associated molecular patterns), які відсутні в організмі людини. Найбільш відомі PAMP – це бактеріальний ліпополісахарид, пептидоглікан, бактеріальна ДНК, двоспіральні РНК, глюкани тощо.
Після того як PRR ідентифікують PAMP, відбувається активація сигнальних каскадів і продукція протимікробних сполук, включаючи фосфоліпазу А2, антимікробні пептиди, лізоцим, реактивні форми кисню та нітрогену. Ці молекули забезпечують ліквідацію інфекції. Крім того, розпізнавання патогенів призводить до вироблення цитокінів, які додатково активізують адаптивну імунну систему [23]. Запуск сигнальних систем відбувається швидко без необхідності проліферації, що пояснює високу швидкість вроджених імунних реакцій [6].
Лізоцим (катіонна мурамідаза) є антибактеріальним агентом, ферментом класу гідролаз, що був відкритий О. Флемінгом у 1922 р. [26]. Лізоцим відіграє особливо важливу роль у вродженому імунітеті [10, 21], забезпечуючи захист макроорганізму від екзогенної й ендогенної мікрофлори [14, 17]. Як відомо, лізоцим присутній у людини майже в усіх секретах – слині, сльозах, сироватці крові, навколоплідних водах, материнському молоці, мокротинні, дуоденальному і шлунковому соку, кишковому слизу, а також у тканинах серця, селезінки, лімфатичних вузлів, нирок, печінки, легень, хрящів, скелетних м’язів, мозку, плаценти, підшлункової та щитоподібної залоз [7, 25]. У ротовій рідині основним джерелом лізоциму є привушні і піднижньощелепні слинні залози [2].
Відомо про два механізми знищення лізоцимом бактерій (рис. 1). Лізоцим руйнує клітинні стінки бактерій, гідролізуючи β-1,4-глікозидні зв’язки між N-ацетилглюкозаміном (NAG – N-acetylglucosamine) і N-ацетилмурамовою кислотою (NAM – N-acetylmuramic acid) пептидоглікану. Як відомо, пептидоглікан відіграє структурну роль у бактеріальній клітинній стінці, надаючи їй форму і структурну міцність [19]. Особливо багато пептидоглікану міститься в клітинних стінках грампозитивних бактерій (до 80%), у той час як у клітинних стінках грамнегативних бактерій – лише 10%, тому лізоцим переважно діє на грампозитивні бактерії. При лізисі грамнегативних бактерій лізоцим діє спільно з системою комплементу [2].
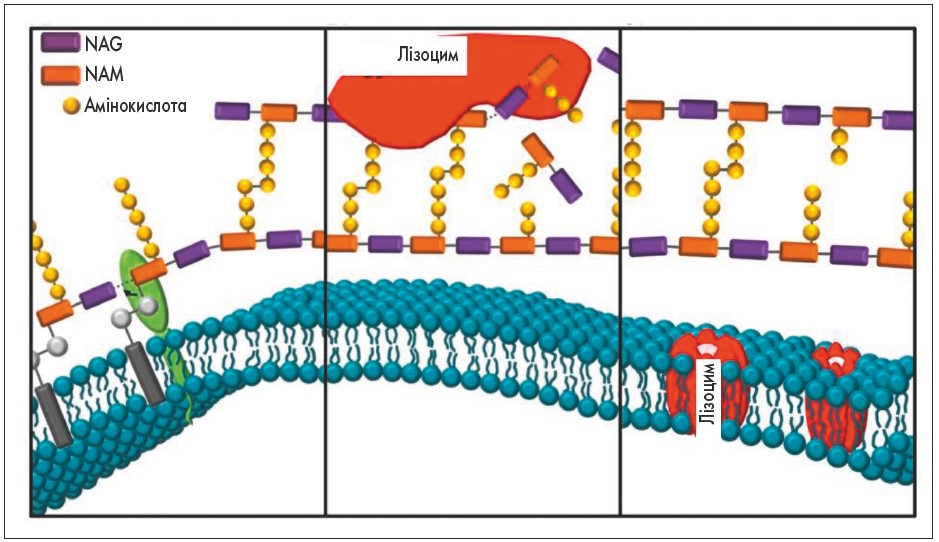 Рис. 1. Бактеріальна дія лізоциму через 2 основні механізми: NAG – N-acetylglucosamine і NAM –
Рис. 1. Бактеріальна дія лізоциму через 2 основні механізми: NAG – N-acetylglucosamine і NAM –
Лізоцим також може здійснювати бактерицидну дію незалежно від ферментативної активності. Це пов’язано з його позитивним зарядом і формуванням пори в негативно заряджених бактеріальних мембранах [19, 20]. Завдяки цьому механізму лізоцим не лише викликає осмотичну загибель бактеріальної клітини, але й збільшує проникність мембран бактерій для інших антимікробних молекул, у тому числі антибактеріальних фармакологічних речовин.
Наявність двох взаємодоповнювальних бактерицидних механізмів знижує ймовірність повного уникнення патогенними бактеріями антибактеріальної дії лізоциму. В разі модифікації структури пептидоглікана, що збільшує стійкість мікроорганізму до ферментативної дії лізоциму, і навіть при повній втраті клітинної стінки
Відомо, що бактерії можуть формувати біоплівки, створюючи таким чином фізико-хімічний бар’єр, який захищає патогени від етіотропних препаратів. Лізоцим руйнує біоплівки, зокрема S. aureus [16], P. aeruginosa [16, 24], підвищуючи також бактерицидні властивості інших антибактеріальних засобів [13, 15].
Крім того, вже доведено роль лізоциму в забезпеченні сигналізації через PRRs щодо патогенів і запуск запальної відповіді. При бактеріальній інвазії лізоцим викликає розщеплення пептидоглікану та вивільнення мономерів, що складаються з пептиду GlcNAc-MurNAc. Цей мономер діє як сигнальна молекула, зв’язуючи PRRs на поверхні імунних клітин, наприклад з TLR2. Також сигнальні мономери можуть зв’язуватися з внутрішньоклітинними нуклеотидзв’язуючими олігомеризаційними білками, що містять домен (NOD), який також генерує сигнал для ініціювання запальної відповіді. Цитоплазматичний нуклеарний фактор NF-kB у спокої інгібується IkB. Активація NF-kB ініціюється вивільненням IkB за рахунок пізнього фосфорилювання. Активований NF-kB переміщується до ядра, де функціонує як фактор транскрипції для вироблення запальних цитокінів, таких як TNFα,
Описано противірусну активність лізоциму. Зокрема продемонстровано здатність лізоциму білка курячого яйця, а також людського лізоциму с-типу, виділеного з різних джерел (сечі, молока й нейтрофілів), дозозалежно пригнічувати реплікацію ВІЛ-1 у культурах Т-лімфоцитів і моноцитів, чутливих до цього вірусу. При цьому навіть найвищі концентрації лізоциму, використані в роботі, не чинили цитотоксичної дії на Т-клітини і моноцити [18]. Також виявлено властивість лізоциму пов’язувати вірусні ДНК і РНК [22]. Ідентифіковано два пептиди, що складаються з 18 і 9 амінокислот (HL18 і HL9), відповідних фрагментів 98-115 і 107-115 лізоциму людини, що є потужними інгібіторами реплікації й інфекційної активності ВІЛ-1. Зміна амінокислотної послідовності чи заміна ключових залишків аргініну або триптофану в цих пептидах призводили до втрати противірусної дії. Встановлено, що HL9 (ArgAlaTrpValAlaTrpArgAsnArg) є найменшим пептидом, що повністю відтворює анти-ВІЛ-ефекти лізоциму. Цей нанопептид блокує проникнення в клітини-мішені й реплікацію ВІЛ-1, а також модулює експресію ряду генів ВІЛ-інфікованих клітин [18]. Також лізоцим обмежує прикріплення ВІЛ-1 до молекули CD4 на мембрані клітин-мішеней [11].
Основні механізми впливу лізоциму показані на рис. 2.
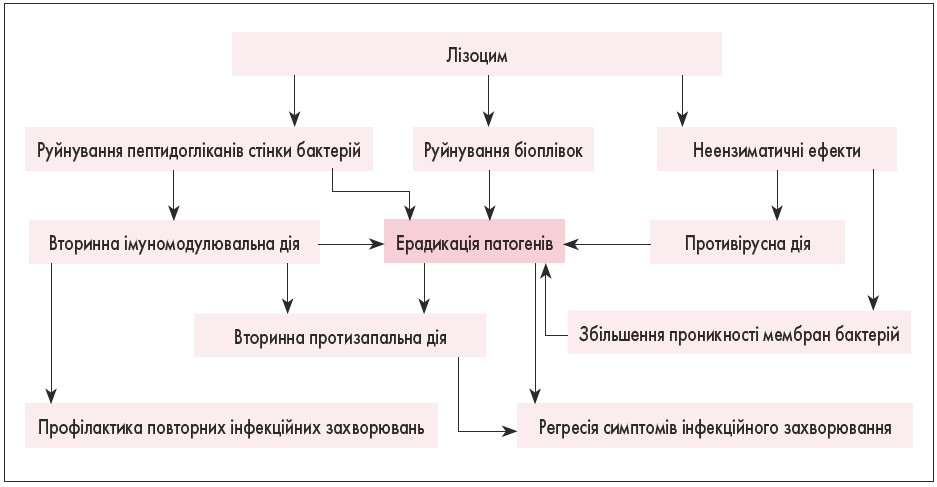 Рис. 2. Механізми дії лізоциму [3]
Рис. 2. Механізми дії лізоциму [3]
Серед представлених в Україні лікарських засобів найбільший вміст лізоциму мають льодяники лінійки Лісобакт® (один льодяник містить 20 мг лізоциму гідрохлориду та 10 мг піридоксину гідрохлориду; льодяник Лісобакт Дуо – 20 мг лізоциму гідрохлориду та 1,5 мг місцевого антисептика цетилпіридинію хлориду). Спрей для носа Лісобакт Рино містить лізоциму гідрохлорид та розчин натрію хлориду.
Ефективність та безпечність препарату Лісобакт® оцінена за результатами декількох клінічних досліджень. Так, у ході проспективного рандомізованого клінічного дослідження [8] за участю 60 дітей віком 3-7 років було встановлено, що включення препарату Ліcобакт® у комплексну терапію гострої респіраторної інфекції з явищами ринофарингіту (п=30) сприяло більш ранньому купіруванню лихоманки (3,8±1,2 проти 4,96±1,1 доби; P<0,001), млявості (2,3±1,2 проти 3,9±1,1 доби; P<0,001), зниження апетиту (2,8±0,9 проти 4,3±1,3 доби; P<0,001). Зникнення катаральних проявів відбувалося в середньому на 2 дні раніше, також меншою була частота бактеріальних ускладнень та потреба в антибактеріальній терапії у дітей, що приймали Лісобакт®. Під дією засобу Лісобакт® відбувалися позитивні зміни мікробіоценозу порожнини рота і глотки (підвищення чисельності та активності облігатної мікрофлори, зниження активності факультативних та залишкових мікроорганізмів, нормалізація балансу аеробних/анаеробних популяцій мікроорганізмів і відновлення процесів протеолізу і муцинопродукції) [8].
Застосування препарату Лісобакт® при лікуванні гострої респіраторної інфекції у дітей, які часто і тривало хворіють, асоціювалося зі скороченням інтоксикаційного синдрому в 1,2 раза, зменшенням тривалості катаральних проявів у середньому на 3,5 дня та частоти бактеріальних ускладнень вдвічі (індекс ефективності комплексної терапії був у 3,4 раза вище, ніж у групі контролю) [1].
Призначення препарату Лісобакт® на тлі базисної терапії дітям віком 3-5 років із гострим гнійним тонзилітом сприяло скороченню тривалості лихоманки в середньому на 1,7 доби, гіперемії слизової, гіперплазії лімфоїдних утворень із наявністю фолікулярних або гнійних змін у тканині мигдаликів на 2 доби, більш швидкій нормалізації гематологічних показників [5].
Включення препарату Лісобакт® до схеми лікування дітей із хронічним аденоїдитом та ексудативним середнім отитом асоціювалося із суттєвим покращенням загального стану пацієнтів та пришвидшенням зникнення таких симптомів, як зниження слуху, відчуття закладеності у вухах, утруднення носового дихання, вираженість виділень з носа, гугнявість голосу [4].
Отже, вроджений імунітет при респіраторній інфекції забезпечує швидку реакцію організму. Лізоцим проявляє бактерицидну дію через безпосередній вплив на бактерії, мікробну біоплівку, а також через підвищення антимікробної активності інших факторів імунологічного захисту та антибіотиків. Противірусна активність лізоциму пояснюється здатністю погіршувати адгезію вірусів до клітин організму людини. Включення препаратів лізоциму до комплексного лікування дітей із респіраторною інфекцією асоціюється зі зменшенням тривалості симптомів захворювання, частоти бактеріальних ускладнень, потреби в антибіотикотерапії.
Список літератури знаходиться в редакції.
Тематичний номер «Педіатрія» №3 (54) 2020 р.


