26 червня, 2015
Разбор клинического случая мелкоклеточного рака простаты с кожными метастазами
Заболеваемость раком предстательной железы (РПЖ) возросла во всем мире после того, как простатический специфический антиген (ПСА) стал использоваться в рамках скринингового обследования мужчин. В США ежегодно диагностируется 192,280 новых случая РПЖ [1].
На сегодняшний день РПЖ является второй по частоте причиной смерти в мужской популяции. Несмотря на то что злокачественные эпителиальные новообразования простаты обычно бывают представлены аденокарциномами, могут встречаться и другие подтипы РПЖ [2]. Они имеют специфические клинико-патологические особенности, клиническую значимость и прогноз. К ним относятся плоскоклеточный рак, саркоматоид, уротелиальный, базальноклеточный, аденоматозно-кистозный и мелкоклеточный рак [2].
Мелкоклеточный рак предстательной железы (МКРПЖ) характеризуется определенными клинико-патологическими особенностями и занимает до 0,5-2% в структуре всех злокачественных новообразований предстательной железы [2]. Примерно в половине случаев МКРПЖ сопутствует течению аденокарциномы [3]. Это очень агрессивный тип рака, который чаще всего диагностируется на поздних стадиях из-за отсутствия четкой корреляции между тяжестью патологического процесса и повышением уровня ПСА [4]. Основные клинические проявления заболевания представлены симптомами инфравезикальной обструкции (50% пациентов), болями в костях, неврологическими расстройствами, гидронефрозом или болями в животе (у 33% больных) [5]. Чаще всего МКРПЖ метастазирует в кости, печень, регионарные и отдаленные лимфатические узлы [6]. Агрессивный характер и особенности течения МКРПЖ значительно затрудняют выбор оптимального алгоритма лечения для данной группы пациентов. В частности установлено, что МКРПЖ очень плохо отвечает на андрогендепривационную терапию. Общепризнанными методами лечения этого состояния считаются лучевая терапия, химиотерапия, а также хирургическое лечение [6]. Локализация метастазов МКРПЖ в коже – очень редкое явление.
Клинический случай
В 2003 г. в связи с симптомами нижних мочевых путей легкой степени тяжести в урологический центр поступил 74-летний мужчина, в ходе ректального обследования которого была обнаружена увеличенная предстательная железа с узелковым образованием на ее правой стороне. Пациенту были проведены общий и биохимический анализ крови, а также общий и микробиологический анализ мочи, единственным отклонением в которых был повышенный уровень ПСА (23 нг/мл). Учитывая результаты физикального обследования и показатель ПСА, больному назначили трансректальную биопсию простаты под ультразвуковым наведением, показавшую наличие аденокарциномы предстательной железы, дифференцированность клеток которой была оценена в 7 баллов по шкале Глисона. После получения результатов гистологического исследования для определения стадии онкологического процесса мужчину направили на компьютерную томографию брюшной полости с контрастированием и сцинтиграфическое исследование костей. Согласно полученным данным опухоль была классифицирована как T2N0M0. Обсудив с пациентом возможные варианты лечения, онкологи назначили ему облучение тазовых лимфатических узлов (46 Гр за 23 фракции), а также трехмерное конформационное облучение простаты (26 Гр за 12 фракций).
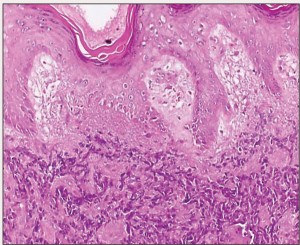
Проведенная терапия индуцировала наступление безрецидивного периода заболевания, который продлился до 2009 г. Спустя шесть лет после установления диагноза, когда больному исполнилось 80 лет, он обнаружил у себя подкожное образование размерами 2×2 см, пальпируемое позади лопатки с левой стороны. По словам пациента, оно появилось около 2 мес назад. При этом результаты его лабораторных тестов, включая концентрацию кислой фосфатазы в сыворотке крови и уровень ПСА, не выходили за пределы нормальных значений. Мужчине был установлен предварительный диагноз «липома», по поводу чего его направили на консультацию в отделение общей хирургии, где была проведена эксцизия и биопсия новообразования. Гистологическое исследование показало наличие в биоптате метастазов мелкоклеточного рака с позитивной реакцией на хромогранин. В связи с этим патоморфолог рекомендовал пациенту обследовать легкие и предстательную железу для выявления первичного очага опухоли (рис. 1).
Анализ образца, полученного в ходе трансректальной биопсии простаты под ультразвуковым наведением, показал наличие МКРПЖ с элементами резидуальной аденокарциномы (рис. 2).
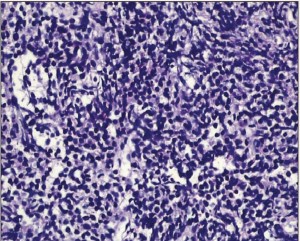 Рис. 2. МКРПЖ, образованный злокачественными эпителиальными клетками с узким участком цитоплазмы в фиброзно-мышечной строме
Рис. 2. МКРПЖ, образованный злокачественными эпителиальными клетками с узким участком цитоплазмы в фиброзно-мышечной стромеАденокарцинома простаты, сопровождавшаяся МКРПЖ, была оценена по шкале Глисона в 2+2 балла. Как и в очаге метастазирования, образец имел признаки нейроэндокринной дифференцировки с положительной реакцией на хромогранин. Последующее обследование выявило метастатический очаг в печени размером около 1 см. При этом метастазов в костной ткани, по данным сцинтиграфии, обнаружено не было.
В качестве лечения онкологи предложили больному комбинированную химиотерапию с применением этопозида и цисплатина (6 циклов). После четвертого цикла был зарегистрирован частичный ответ на терапию, выражавшийся в уменьшении размеров метастатического очага в печени (по данным компьютерной томографии). Пациент скончался из-за инфаркта миокарда до начала пятого цикла химиотерапии.
Обсуждение
МКРПЖ – крайне редкая патология, на долю которой приходится 0,5-2% всех случаев РПЖ [2]. Как и аденокарцинома, это заболевание может возникать в периферических отделах простаты и не сопровождаться симптомами со стороны мочевой системы [7]. МКРПЖ имеет агрессивный характер и тенденцию к раннему метастазированию в печень, кости, мочевой пузырь, прямую кишку, центральную нервную систему, легкие, отдаленные и тазовые лимфатические узлы, а также в перикард [8]. На сегодняшний день в литературе имеется всего несколько сообщений, указывающих на то, что МКРПЖ может метастазировать в кожу [9, 10]. В ряде случаев единственными проявлениями заболевания могут быть симптомы, связанные с метастазами опухоли. Из-за этого у большинства больных МКРПЖ диагностируется несвоевременно, когда онкологический процесс достигает поздней стадии развития. В данном случае при первом поступлении в больницу и в течение периода наблюдения пациент не предъявлял жалоб, связанных с мочевой системой, а верификация МКРПЖ основывалась только на результатах трансректальной биопсии простаты, проведенной после гистологического исследования образца, взятого из образования на коже. При повторном изучении биоптатов простаты была обнаружена резидуальная аденокарцинома, сопутствовавшая МКРПЖ. Она имела более дифференцированную структуру в сравнении с образцами, полученными при первичном обследовании больного (оценка по шкале Глисона 2+2 против 3+4 баллов), что, вероятно, было связано с проведенной лучевой терапией.
Клинико-патологические особенности МКРПЖ схожи с таковыми при мелкоклеточном раке легких (МКРЛ). Как для МКРЛ, так и для МКРПЖ характерны сосудистая инвазия, высокий митотический индекс и наличие некрозов. В настоящее время существует 3 теории гистогенеза МКРПЖ [7]. Наибольшее признание получила гипотеза, согласно которой МКРПЖ возникает из тотипотентных стволовых клеток предстательной железы, которые могут дифференцироваться в любые виды нейроэндокринных или эпителиальных клеток. Другая теория предполагает, что мелкоклеточный рак формируется в результате захвата клетками предшественников аминов и декарбоксилирования клеток энтодермы. Согласно последней гипотезе МКРПЖ относится к аденокарциномам простаты. Это предположение подтверждается тем фактом, что у половины пациентов с МКРПЖ обнаруживается сопутствующая аденокарцинома предстательной железы [3].
В связи с гистологическим сходством с МКРЛ паранеопластические синдромы при МКРПЖ также встречаются редко [2]. Они могут быть представлены гиперпаратиреозом, тиреотоксикозом, гиперкальциемией, гиперглюкагонемией и синдромом Иценко-Кушинга. В рассматриваемом случае признаки подобных изменений не были зарегистрированы. Результаты лабораторных тестов, включая уровень ПСА, в период наблюдения не выходили за пределы нормы. Повышенные значения ПСА в сыворотке крови могут наблюдаться только у мужчин с МКРПЖ, содержащим большое количество аденокарциноматозного компонента. В описываемом случае показатель ПСА был в пределах нормы, а удельный вес аденокарциномы, обнаруженной при биопсии, – очень низким.
Нарушения нейроэндокринной дифференцировки при МКРПЖ крайне слабо отвечают на андрогендепривационную терапию. Концентрация хромогранина А, являющегося нейроэндокринным маркером, может повышаться, если карцинома имеет признаки нейроэндокринной дифференцировки [2]. По мнению Berruti и соавт., наличие хромогранина при впервые выявленном РПЖ является независимым предиктором гормонорезистентного заболевания у пациентов, получающих андроген-депривационную терапию, и связано с уменьшением общей выживаемости [11]. Этот маркер способен активировать андрогенные рецепторы независимо от наличия в среде андрогенов. Учитывая то, что в рассматриваемом случае у пациента была обнаружена положительная реакция на хромогранин, назначение андрогендепривационной терапии вместо химиотерапии, скорее всего, ассоциировалось бы с плохим ответом опухоли на лечение.
Средняя выживаемость больных с МКРПЖ составляет 5-17 мес. Менее чем в 5% случаев она может достигать более 24 мес [5]. Редкость, агрессивный характер и особенности течения МКРПЖ значительно затрудняют выбор алгоритма лечения для данной группы пациентов. В целом подходы к лечению больных МКРПЖ схожи с таковыми у пациентов с МКРЛ. В качестве химиотерапевтических агентов при МКРПЖ могут использоваться циклофосфамид, этопозид, доксорубицин, винкристин и цисплатин в монотерапии или в комбинации с доксорубицином [9, 10]. Определенные преимущества и удовлетворительный профиль побочного действия в ходе исследований по изучению подходов к лечению МКРПЖ удалось продемонстрировать карбоплатину, гемцитабину и доцетакселу [12]. В рассматриваемом случае по рекомендациям онкологов пациенту была назначена комбинированная химиотерапия на основе этопозида и цисплатина (6 циклов), но курс лечения не был завершен из-за смерти больного после окончания четвертого цикла химиотерапии. Тем не менее проведенное лечение привело к уменьшению размеров метастатических очагов в печени.
Помимо химиотерапии, при МКРПЖ могут использоваться хирургические методы лечения и лучевая терапия. В литературе имеется всего одно сообщение об излечении от МКРПЖ после проведения радикальной простатэктомии [12]. В то же время Papandreou и соавт. предполагают, что оперативное вмешательство не может рассматриваться в качестве оптимальной лечебной стратегии для пациентов с МКРПЖ, поскольку у большинства из них на момент постановки диагноза уже присутствуют отдаленные метастазы [13]. Лучевую терапию целесообразно использовать в сочетании с химиотерапией для локального контроля над заболеванием [14]. В описываемом случае из-за наличия у больного метастазов в печени предпочтение было отдано химио-, а не лучевой терапии.
Выводы
МКРПЖ сопутствует аденокарциноме предстательной железы у 50% пациентов. Заподозрить МКРПЖ можно по распространению метастазов, не характерных для аденокарциномы. Следует помнить о том, что ранняя диагностика этой патологии крайне затруднена в связи с ранним метастазированием опухоли и отсутствием корреляции между тяжестью заболевания и повышением уровня ПСА. В настоящее время не существует общепринятого стандарта терапии МКРПЖ, а прогноз заболевания в целом плохой.
Литература
1. Eldefrawy A., Katkoori D., De Los Santos R., Manoharan M., Soloway M.S. Basal cell carcinoma of the prostate: a case report and review of the literature. Uro Today Int J 2009, 2(3).
2. Shohreh I.D. Premalignant and malignant prostate lesions: pathologic review. Cancer Control 2010, 17(4): 214-222.
3. Yashi M., Terauchi F., Nukui A., Ochi M., Yuzawa M., Hara Y., Morita T. Small-cell neuroendocrine carcinoma as a variant form of prostate cancer recurrence: a case report and short literature review. Urol Oncol 2006, 24: 313-317.
4. Helpap B., Kollermann J., Oehler U. Neuroendocrine differentiation in prostatic carcinomas: histogenesis, biology, clinical relevance, and future therapeutical perspectives. Urol Int 1999, 62: 133-138.
5. Umar S.A., Maclenna G.T. Small cell carcinoma of the prostate. J Urol 2009, 181(2): 838-839.
6. Barcons L.A.L. Small cell neuroendocrine carcinoma of the prostate: are heterotransplants a better experimental model? Asian J Androl 2010, 12: 308-314.
7. Trotz C. Prostate cancer with a normal PSA: small cell carcinoma of the prostate – a rare entity. JABFP 2003, 16(4): 343-344.
8. Rubenstein J.H., Katin M.J., Mangano M.M., Dauphin J., Salenius S.A., Dosoretz D.E., Blitzer P.H. Small cell anaplastic carcinoma of the prostate: seven cases, review of the literature, and discussion of a therapeutic strategy. Am J Clin Oncol 1997, 20: 376-380.
9. Yildirim Y., Akcay Y., Ozyilkan O., Celasun B. Prostate small cell carcinoma and skin metastases: a rare entity. Med Princ Prac 2008, 17:250-252.
10. Aygun C. Small cell carcinoma of the prostate: a case report and review of the literature. Md Med J 1997, 46: 353-356.
11. Berruti A., Mosca A., Porpiglia F., Bollito E., Tucci M., Vana F., Cracco C., Torta M., Russo L., Cappia S., Saini A., Angeli A., Papotti M., Scarpa R.M., Dogliotti L. Chromogranin A expression in patients with hormone naive prostate cancer predicts the development of hormone refractory disease. J Urol 2007, 178: 838-843.
12. Aoki H., Ishidoya S., Ito A., Endoh M., Shimazui T., Arai Y. Experience of the treatment with gemcitabine, docetaxel, and carboplatin (GDC) chemotherapy for patients with small-cell carcinoma of the prostate. Int J Urol 2006, 13: 1254-1258.
13. Papandreou C.N., Daliani D.D., Thall P.F., Tu S.M., Wang X., Reyes A., Troncoso P., Logothetis C.J. Prostate cancer with small-cell morphology: an immunophenotypic subdivision. Scan J Urol Nephrol 2005, 39: 455-463.
14. Asmis T.R., Reaume M.N., Dahrouge S., Malone S. Genitourinary small cell carcinoma: a retrospective review of treatment and survival patterns at the Ottowa Hospital Regional Cancer Center. BJU Int 2006, 97: 711-715.
Сокращенный перевод с англ. Антона Пройдака