1 квітня, 2015
Современные стандарты диагностики и лечения кастрационно-резистентного рака предстательной железы
 Согласно рекомендациям рабочей группы по вопросам диагностики и лечения рака предстательной железы Европейской ассоциации урологов (European Association of Urology – EAU; 2008) кастрационно-резистентный рак предстательной железы (КРРПЖ) подразумевает биохимическую и радиологическую прогрессию опухолевого процесса у пациентов, имеющих кастрационные уровни тестостерона (<50 нг/мл или 1,7 нмоль/л). При этом биохимическая прогрессия характеризуется тремя последовательными повышениями уровня простатспецифического антигена (ПСА) в сыворотке крови с интервалом определения не менее 1 нед, два из которых на 50% превышают надир (минимальное значение ПСА, достигнутое в результате гормональной терапии), при уровне ПСА >2 нг/мл. В свою очередь, радиологическая прогрессия констатируется при появлении двух и более метастатических очагов в костях (по данным остеосцинтиграфии), обнаружении новых очагов в мягких тканях или их увеличении в размерах согласно Критериям оценки ответа солидной опухоли на лечение (RECIST). Установлено, что выживаемость пациентов с КРРПЖ может варьировать в широком диапазоне: от 9-12 мес при массивном метастатическом поражении и повышении уровня ПСА (независимо от наличия клинических симптомов заболевания) до 24-27 мес в группе больных, у которых диагностируется изолированное увеличение сывороточной концентрации ПСА на фоне отсутствия метастазов.
Согласно рекомендациям рабочей группы по вопросам диагностики и лечения рака предстательной железы Европейской ассоциации урологов (European Association of Urology – EAU; 2008) кастрационно-резистентный рак предстательной железы (КРРПЖ) подразумевает биохимическую и радиологическую прогрессию опухолевого процесса у пациентов, имеющих кастрационные уровни тестостерона (<50 нг/мл или 1,7 нмоль/л). При этом биохимическая прогрессия характеризуется тремя последовательными повышениями уровня простатспецифического антигена (ПСА) в сыворотке крови с интервалом определения не менее 1 нед, два из которых на 50% превышают надир (минимальное значение ПСА, достигнутое в результате гормональной терапии), при уровне ПСА >2 нг/мл. В свою очередь, радиологическая прогрессия констатируется при появлении двух и более метастатических очагов в костях (по данным остеосцинтиграфии), обнаружении новых очагов в мягких тканях или их увеличении в размерах согласно Критериям оценки ответа солидной опухоли на лечение (RECIST). Установлено, что выживаемость пациентов с КРРПЖ может варьировать в широком диапазоне: от 9-12 мес при массивном метастатическом поражении и повышении уровня ПСА (независимо от наличия клинических симптомов заболевания) до 24-27 мес в группе больных, у которых диагностируется изолированное увеличение сывороточной концентрации ПСА на фоне отсутствия метастазов.
Причиной формирования КРРПЖ становится нарушение регуляции и функционирования андрогенных рецепторов (АР) и связанного с ними сигнального пути. АР относятся к семейству ядерных транскрипционных факторов, в которое также входят рецепторы ретиноидных и тиреоидных гормонов, рецептор для витамина D3 и рецепторы-«сироты». После связывания АР с дигидротестостероном инициируется процесс трансформации рецептора в транскрипционный фактор – образование комплекса из двух лигандсвязанных фосфорилированных молекул АР с одновременным отщеплением белка теплового шока. После этого транскрипционный фактор транслоцируется в ядро, где связывается со специфичным участком ДНК, что сопровождается активацией генов и интенсификацией процесса синтеза белка.
В основе формирования резистентности лежат мутации, амплификации и эпигенетические модификации гена АР, гиперэкспрессия, сращение АР, изменение их активности под действием коактиваторов и корепрессоров, а также лиганд-независимая активация АР факторами роста (эпидермальным, инсулиноподобным), HER2/neu (трансмембранным гликопротеином, являющимся представителем семейства рецепторов эпидермального фактора роста), интерлейкином-6 и витамином D, реализуемая через митоген-активируемую протеинкиназу (MAPK) и фосфоинозитол-3-киназу (PI3K), активирующую серин-треонин-киназу (Akt). Доказано, что при КРРПЖ, в отличие от локализованного рака простаты, мутации регистрируются одновременно в 9 различных генах и еще 3 дополнительных, роль которых в развитии этого заболевания в настоящее время не уточнена.
Преобладание тех или иных генных мутаций имеет ключевое значение для выбора стратегии лечения пациентов с КРРПЖ. В частности, S. Carreira и соавт. (2014) показали, что при проведении биопсии предстательной железы на начальных стадиях развития рака простаты обнаруживается только 1 вид опухолевых клеток, тогда как при переходе заболевания в КРРПЖ в кровеносном русле больных циркулирует гетерогенный по структуре геномный материал, чувствительность отдельных клеточных клонов которого к лекарственным препаратам варьирует в широком диапазоне.
На сегодняшний день в лечении пациентов с КРРПЖ используют несколько групп препаратов: селективные ингибиторы фермента 17α-гидроксилазы/ С17,20-лиазы (CYP17), являющегося изоформой цитохрома P450 и принимающего участие в биосинтезе андрогенов в яичках, надпочечниках и клетках опухоли предстательной железы (абиратерон); противоопухолевые препараты растительного происхождения из группы таксанов (доцетаксел, кабазитаксел); ингибиторы АР (энзалутамид); иммунопрепараты (активированная клеточная вакцина, в состав которой входит комплекс антигенов предстательной железы и простатической кислой фосфатазы, конъюгированных с гранулоцитарно-макрофагальным колониестимулирующим фактором [PAP-GM-CSF] – сипулейцел-Т) и радиофармацевтические средства (радиоизотоп радий-223 дихлорид). Алгоритм лечения пациентов, у которых определяется повышение уровня ПСА после проведения гормональной терапии, рекомендованный EAU в 2014 г., представлен на рисунке 1.
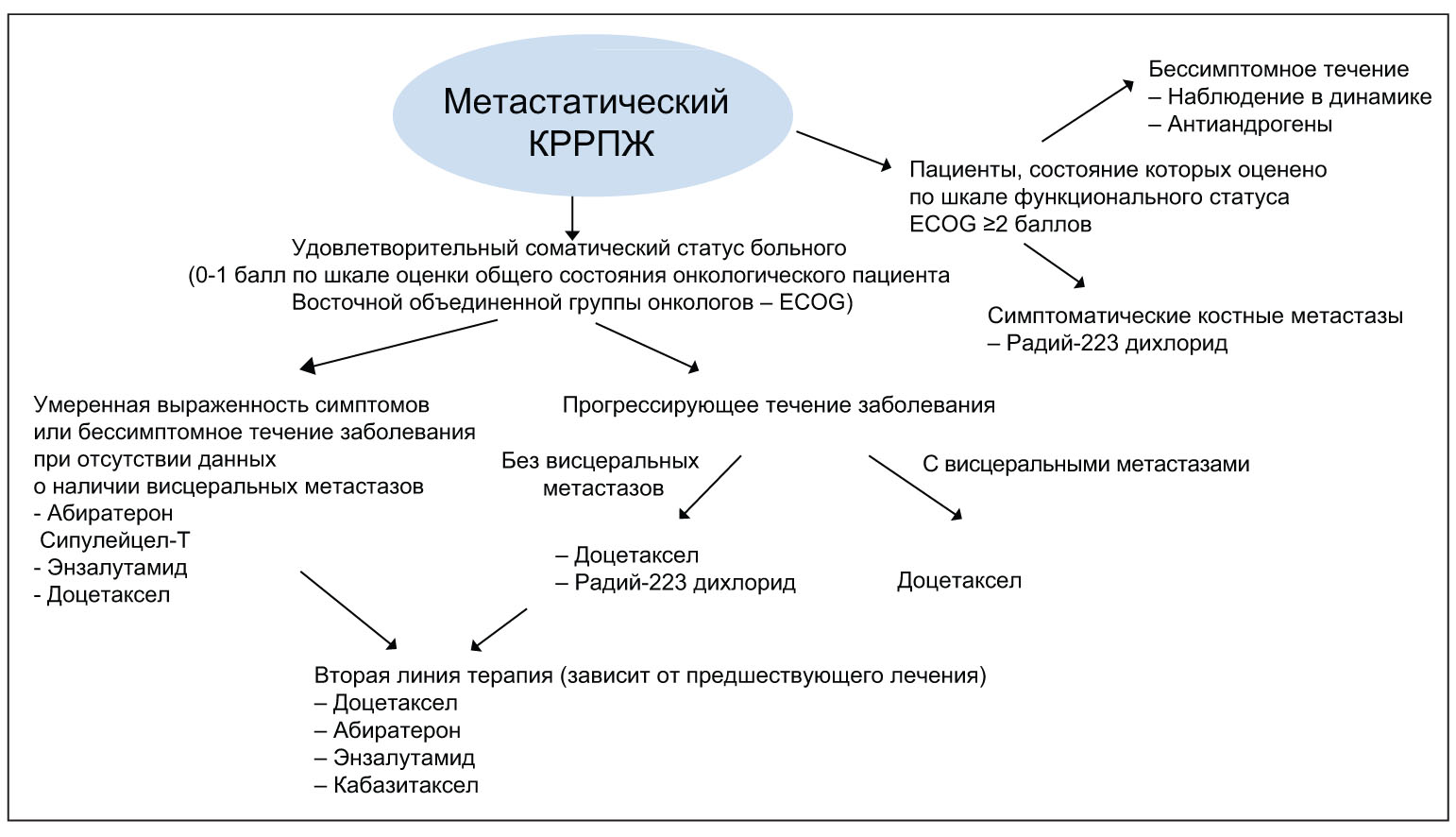 Рис. 1. Алгоритм лечения пациентов, у которых определяется повышение уровня ПСА после проведения гормональной терапии
Рис. 1. Алгоритм лечения пациентов, у которых определяется повышение уровня ПСА после проведения гормональной терапииВажно отметить, что в настоящее время онкоурологами из разных стран мира ведется активное изучение эффективности и безопасности современных химиотерапевтических и таргетных препаратов, которое играет важнейшую роль в разработке оптимальной стратегии ведения пациентов с КРРПЖ. Так, P.F. Schelhammer и соавт. (2013), проанализировав показатели общей выживаемости у пациентов с метастатическим КРРПЖ, получавших в ходе исследования IMPACT в качестве первой линии терапии плацебо или сипулейцел-Т (3 инфузии с интервалом не менее 2 нед), показали, что к середине наблюдения (34 мес) общая выживаемость больных, принимавших сипулейцел-Т, достоверно превосходила таковую в группе плацебо: 25,8 против 21,7 мес. При этом лучшие показатели выживаемости на фоне приема сипулейцела-Т регистрировались у пациентов с низким риском (уровень ПСА уменьшался на 13 нг/мл по отношению к исходному). В другом исследовании (COU-AA-302) сравнивалась эффективность первой линии лечения метастатического КРРПЖ на основе абиратерона в комбинации с преднизолоном и монотерапии преднизолоном у пациентов со средней степенью выраженности симптомов или бессимптомным течением заболевания (D.E. Rathkopf et al., 2014). Оказалось, что к моменту достижения медианы наблюдения (27,1 мес) улучшение показателей выживаемости без признаков радиологической прогрессии заболевания и общей выживаемости было более значимым у пациентов, получавших абиратерон (медианы выживаемости: 16,5 против 8,2 мес и 35,3 против 30,1 мес соответственно). Интересные результаты были получены в III фазе двойного слепого многоцентрового рандомизированного исследования PREVAIL, в котором сравнивалась эффективность аналогов гонадотропин-рилизинг-гормона (ГнРГ), комбинируемых с энзалутамидом или плацебо в лечении пациентов с метастатическим КРРПЖ, не проходивших химиотерапию.
Использование энзалутамида в комбинации с ГнРГ сопровождалось увеличением показателя медианы выживаемости в сравнении с плацебо (32,4 против 30,2 мес соответственно).
Особое внимание необходимо уделить эффективности таксанов в лечении пациентов с КРРПЖ, поскольку среди вышеперечисленных препаратов только они официально зарегистрированы в Украине. В 2004 г. I.F. Tannock и соавт. провели исследование (TAX 327), направленное на изучение возможности использования преднизолона в комбинации с доцетакселом (75 мг/м2 один раз в 3 нед и 30 мг/м2 еженедельно) или митоксантроном (12 мг/м2 один раз в 3 нед) в качестве средств первой линии терапии метастатического КРРПЖ. Анализ результатов этого наблюдения показал, что медиана общей выживаемости была наибольшей в группе больных, получавших преднизолон (5 мг 2 раза в сутки) в сочетании с доцетакселом (75 мг/м2 один раз в 3 нед) и составила 19,2 мес. При этом медиана выживаемости у пациентов, у которых удвоение концентрации ПСА происходило в более позднем периоде заболевания (>6 мес), была большей (в течение 25 мес против 13,3 мес) в сравнении с больными, имеющими более агрессивный характер прироста ПСА (удвоение в течение первого месяца). Таким образом, снижение ПСА ≥30% на фоне проведенной химиотерапии показало себя в качестве лучшего опосредованного предиктора выживаемости пациентов. Фебрильная нейтропения регистрировалась всего у 3% больных, получавших лечение доцетакселом, и у 2% пациентов, принимавших митоксантрон, что указывало на эффективность и хорошую переносимость исследуемых препаратов. Учитывая то, что назначение доцетаксела ассоциировалось со снижением риска смерти больных на 21%, существенно увеличивало долю пациентов с КРРПЖ, проживших ≥3 лет, в сравнении с митоксантроном (18,6 против 13,5%), а также улучшало качество их жизни, авторы исследования предложили рассматривать 3-недельный режим терапии на основе доцетаксела в качестве стандарта лечения КРРПЖ.
Принимая во внимание результаты исследования TAX 327, а также ряда других наблюдений, подтвердивших эффективность доцетаксела (75 мг/м2 один раз в 3 нед) в лечении пациентов с КРРПЖ, этот препарат был признан экспертами EAU, Европейского общества медицинской онкологии (European Society for Medical Oncology – ESMO) и Национальной всеобщей онкологической сети (National Comprehensive Cancer Network – NCCN, США) стандартом первой линии терапии метастатического КРРПЖ. При этом в ходе многочисленных исследований было установлено, что добавление к доцетакселу других противоопухолевых препаратов (бевацизумаба, афлиберцепта, атрасентана, кальцитриола, дазатиниба и др.) не приводило к повышению эффективности терапии.
В то же время необходимо помнить, что, несмотря на применение современных противоопухолевых средств, количество пациентов с КРРПЖ, не ответивших на лечение препаратами первой линии терапии, по-прежнему остается достаточно большим, что диктует необходимость разработки новых подходов к лечению данной категории больных. Так, анализ результатов исследования COU-AA-301 (B. Montgomery, 2014), в котором изучалась возможность использования преднизолона и его комбинации с абиратероном в качестве второй линии лечения метастатического КРРПЖ у пациентов, не ответивших на химиотерапию доцетакселом, показал, что добавление в схему лечения абиратерона способствовало увеличению медианы общей выживаемости больных в сравнении с монотерапией преднизолоном (13,4 против 9,3 мес соответственно). В другом исследовании (ALSYMPCA, 2013) C. Parker и соавт. анализировали эффективность радия-223 дихлорида в лечении пациентов с КРРПЖ, не ответивших на химиотерапию. В ходе данного наблюдения было установлено, что добавление к стандартной терапии радия-223 дихлорида позволило уменьшить выраженность болевого синдрома на 29-75%, а также ассоциировалось с лучшей выживаемостью пациентов, удлинением периода до появления первых симптомных метастазов в костной ткани и нарастания уровня ПСА в сравнении с плацебо. В частности, медиана выживаемости больных на фоне применения радия-223 дихлорида в дозе 25, 50 и 80 кБк/кг (3 инъекции с интервалом в 6 нед) составила 548, 569 и 604 дня соответственно. Схожие результаты были получены F. Saad в исследовании AFFIRM в отношении другого препарата: энзалутамид (160 мг два раза в сутки) в качестве второй линии терапии КРРПЖ превосходил плацебо в отношении показателей выживаемости пациентов (18,4 против 13,6 мес), а также достижения ими вторичных конечных точек (снижения ПСА на і50%, улучшения качества жизни, времени до прогрессии ПСА, выживаемости без радиологической прогрессии заболевания и формирования костных метастазов).
Значительный интерес представляют результаты исследования TROPIC, в котором 755 пациентов с доцетакселрезистентным метастатическим КРРПЖ были рандомизированы на 2 группы: в первой больным был назначен преднизолон (10 мг/сут) в сочетании с кабазитакселом (25 мг/м2 каждые 3 нед), во второй – преднизолон в аналогичной дозировке в комбинации с митоксантроном (12 мг/м2 каждые 3 нед). Анализ полученных данных показал, что кабазитаксел был более эффективным в сравнении с митоксантроном в отношении показателей общей выживаемости пациентов (медиана общей выживаемости 15,1 против 12,7 мес), общей 2-годичной выживаемости (28 против 17% выживших), а также медианы выживаемости без прогрессии заболевания (2,8 против 1,4 мес соответственно). При этом побочные явления і3 степени несколько чаще регистрировались в группе кабазитаксела и были представлены нейтропенией (82 против 58%), фебрильной нейтропенией (8 против 1%) и диареей (6 против 1% соответственно). Кроме этого в начале лечения у пациентов, получавших кабазитаксел, отмечалось повышение уровня ПСА, не ухудшавшее показателей выживаемости. Это говорит о том, что увеличение уровня ПСА в первые 12 нед лечения таксанами может быть проигнорировано при оценке ответа больных на лечение. В свою очередь, в настоящее время назначение абиратерона после энзалутамида, а также энзалутамида после абиратерона считается нецелесообразным ввиду плохого ответа опухоли на лечение (K. Fizazi, 2012; Y. Loriot, 2013; K.I. Noonan, 2013; A. Schrader, 2014; D. Bianchini, 2014; F.B. Thomsen, 2014; S. Badrising, 2014).
В 2014 г. Di Lorenzo и соавт. опубликовали результаты ретроспективного анализа, посвященного изучению возможности использования кабазитаксела и абиратерона у пациентов с метастатическим КРРПЖ, не ответивших на терапию доцетакселом. В проведенном исследовании у больных, принимавших кабазитаксел в качестве второй линии терапии после доцетаксела, показатель общей выживаемости был большим в сравнении с таковым на фоне использования новых АР-таргетных препаратов (абиратерона, энзалутамида). В то же время назначение абиратерона в аналогичном режиме не приводило к снижению уровня ПСА, радиологическому или клиническому улучшению. Схожие результаты ранее были получены S. Oudard и соавт. (2013), пришедшими к выводу, что предварительное применение доцетаксела і2 линий, абиратерона после кабазитаксела и снижение уровня ПСА более чем на 30% в течение терапии кабазитакселом могут служить маркером лучшей выживаемости пациентов. Schadia и соавт. (2013), рассмотрев различные варианты назначения доцетаксела, кабазитаксела и абиратерона, установили, что для повышения общей выживаемости больных метастатическим КРРПЖ, получающих указанные препараты, кабазитаксел должен назначаться в составе второй линии терапии.
Накопленные к настоящему времени данные указывают на то, что резистентность метастатического КРРПЖ к абиратерону и энзалутамиду может быть связана с избыточной экспрессией АР, CYP17, наличием AR-V7 (одного из вариантов матричной РНК, кодирующей структуру АР) и ERG (онкогена, ответственного за синтез одноименного белка, выполняющего функцию транскрипционного фактора). При этом у 50% пациентов с раком предстательной железы ERG соединяется с геном TMPRSS2 (кодирует структуру трансмембранной сериновой протеазы 2 типа), формируя слитый ген TMPRSS2-ERG, оказывающий влияние на экспрессию АР. В частности, Antonarakis (2014) указывает на то, что медиана общей выживаемости у AR-V7-позитивных пациентов, получающих лечение абиратероном или энзалутамидом, меньше таковой в группе AR-V7-негативных больных (9,9 против 16 мес соответственно).
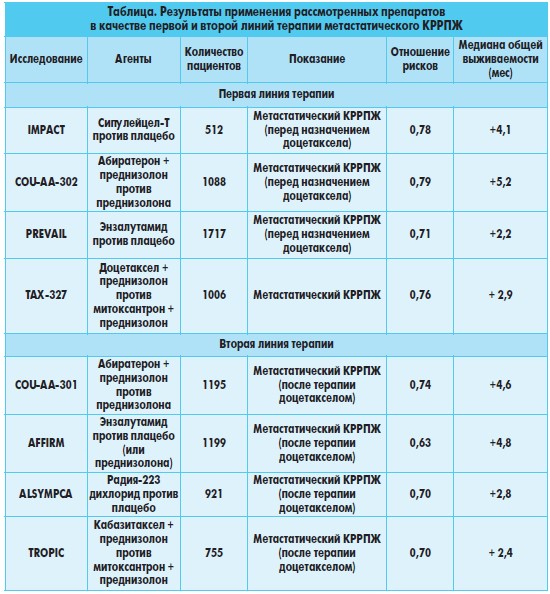
Обобщенные результаты применения рассмотренных препаратов в качестве первой и второй линий терапии метастатического КРРПЖ представлены в таблице.
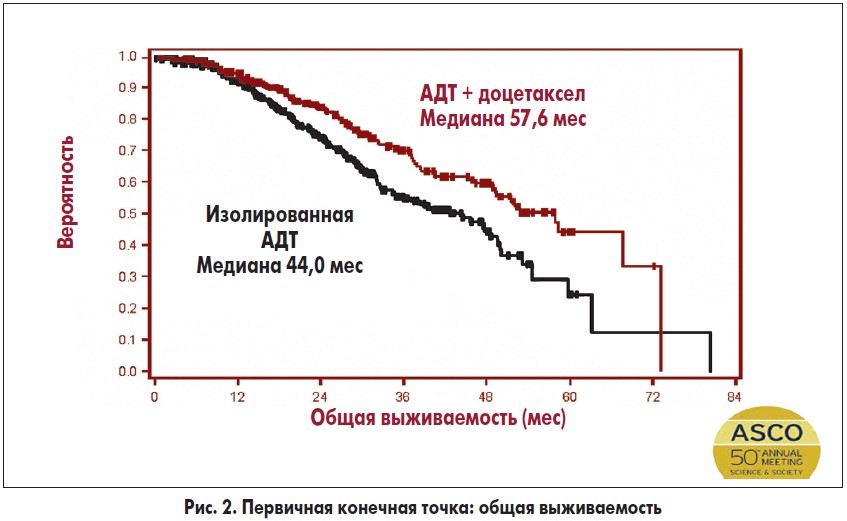
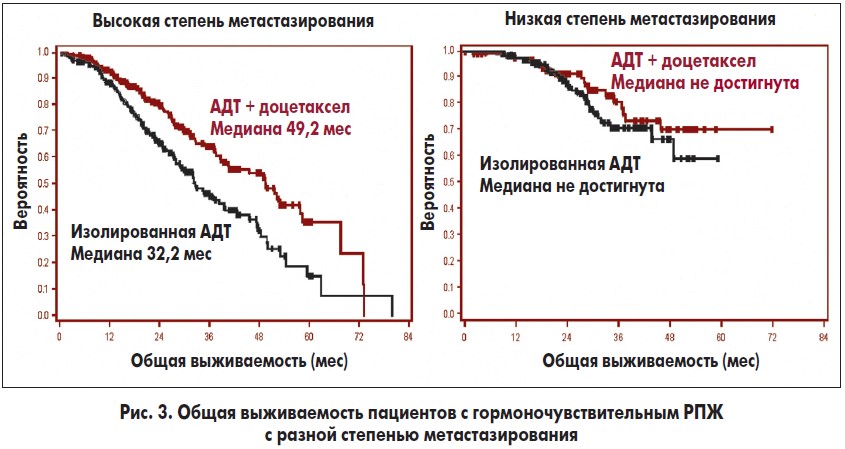
Говоря о возможностях лечения пациентов с метастатическим гормоночувствительным РПЖ (ранее не получавших гормональную терапию), отдельное внимание необходимо уделить результатам исследования CHAARTED (Chemohormonal Therapy versus Androgen Ablation Randomized Trial for Extensive Disease in Prostate Cancer), посвященного сравнению эффективности двух схем лечения пациентов с метастатическим РПЖ: стандартной андрогендепривационной терапии (АДТ) и ее сочетания с доцетакселом. В ходе анализа полученных данных было установлено, что добавление к АДТ доцетаксела ассоциировалось с улучшением общей выживаемости пациентов на 13,6 мес (рис. 2), выживаемости при различной интенсивности метастазирования (рис. 3), а также большей частотой достижения больными вторичных конечных точек.
В частности, на фоне применения доцетаксела большее количество пациентов достигли уровня ПСА <0,2 нг/мл через 6 мес терапии в сравнении с лицами, получавшими изолированную АДТ (27,5 против 14%), при этом медиана до развития КРРПЖ в группе доцетаксела была большей (20,7 против 14,7 мес), как и медиана клинического и радиологического прогрессирования заболевания (32,7 против 19,8 мес). Таким образом, у мужчин с гормоно-чувствительным РПЖ при комбинированном применении стандартной АДТ и 6 курсов лечения доцетакселом отмечается достоверное улучшение общей выживаемости в сравнении с проведением только АДТ. Преимущества лечения у пациентов с высокой интенсивностью метастазирования очевидны и оправдывают получаемую медикаментозную нагрузку.
Накопленные к настоящему времени данные свидетельствуют о том, что короткий ответ на первичную АДТ может считаться предиктором низкой эффективности предстоящей терапии АР-таргетными препаратами. Лучших показателей выживаемости в группе больных раком предстательной железы с высокой степенью метастазирования можно добиться за счет применения доцетаксела, тогда как при метастатическом КРРПЖ перед проведением лечения необходимо дообследовать пациента на предмет выявления факторов резистентности к действию АР-таргетных препаратов.