9 грудня, 2016
Применение макролидов для профилактики обострений хронических воспалительных заболеваний легких
Антибиотики класса макролидов широко применяются для лечения внебольничных инфекций дыхательных путей (стрептококковый тонзиллофарингит, острый средний отит, острый бактериальный риносинусит, обострения хронического обструктивного заболевания легких, внебольничная пневмония), инфекций кожи и мягких тканей (импетиго, фурункулез, фолликулит, эритразма и др.), инфекций, передающихся половым путем (прежде всего негонококковых уретритов) и по многим другим показаниям.
Наряду с антибактериальным эффектом макролиды обладают иммуномодулирующими и противовоспалительными свойствами, причем последние присущи 14- и 15-членным макролидам, но не 16-членным [1]. Эти свойства заключаются в уменьшении секреции мокроты [2], снижении накопления нейтрофилов в дыхательных путях вследствие уменьшения экспрессии провоспалительных цитокинов, например интерлейкина‑8 (ИЛ‑8), и продукции молекул адгезии, таких как макрофагальная молекула адгезии‑1 [3-5].
В последние десятилетия немало внимания уделяют обсуждению перспектив использования макролидов для профилактики обострений хронических воспалительных заболеваний легких. Толчком послужило случайное обнаружение позитивных эффектов длительного применения низких доз эритромицина у больных диффузным панбронхиолитом [6]. Это прогрессирующее воспалительное заболевание дыхательных путей встречается почти исключительно в Японии. Клинически оно характеризуется хроническим кашлем, избыточной продукцией мокроты, одышкой при физической нагрузке, хроническим синуситом и колонизацией Pseudomonas spp. Со временем развиваются диффузные бронхоэктазы и дыхательная недостаточность [7].
Длительное применение макролидов позволило увеличить 5-летнюю выживаемость с 63 до 92% [7, 8], причем клиническая эффективность этого класса антибиотиков установлена как при наличии хронической инфекции в дыхательных путях, так и в ее отсутствие [9].
Позитивные эффекты 14- и 15-членных макролидов при диффузном панбронхиолите имеют несколько объяснений. Во-первых, макролиды связываются с каналами, по которым в эпителиальных клетках транспортируются ионы хлора. Блокада каналов дополняется угнетением секреции воды, которая вместе с ионами хлора перемещается через клеточную мембрану [10, 11]. В результате снижается гиперсекреция мокроты. Во-вторых, при длительном использовании в низких дозах макролиды уменьшают переизбыток полиморфноядерных нейтрофилов (ПМН) в легких. Указанный эффект достигается посредством угнетения экспрессии цитокинов (ИЛ‑8), в результате чего уменьшается хемотаксис ПМН в легкие.
Спустя месяцы после начала лечения макролидами изменяется качественный состав мокроты, которая становится похожей на таковую у здоровых людей, то есть в ней доля альвеолярных макрофагов превышает долю ПМН. Вследствие уменьшения воспаления у больных диффузным панбронхиолитом улучшается функция легких и снижается частота обострений заболевания. В клинических исследованиях продемонстрирована эффективность не только эритромицина, но также кларитромицина, рокситромицина и азитромицина. Хотя позитивные эффекты макролидов закономерно выявляются во многих исследованиях, точное время наступления эффекта от начала терапии остается не установленным и колеблется, по разным данным, от 5 до 16 мес [12].
Доказанная польза от применения макролидов при диффузном панбронхиолите побудила к оценке перспектив использования этого класса антибиотиков при других хронических воспалительных заболеваниях дыхательных путей: муковисцидозе, бронхоэктатической болезни, хроническом обструктивном заболевании легких (ХОЗЛ) и бронхиальной астме.
Муковисцидоз
Муковисцидоз возникает в результате мутации гена-регулятора трансмембранной проводимости, который играет важную роль в перемещении хлорида натрия и воды через поверхность эпителия. Заболевание наследуется по аутосомно-рецессивному типу и характеризуется полиорганной дисфункцией, в особенности прогрессирующим поражением легких, панкреатической недостаточностью и повышенными концентрациями электролитов при выделении пота. Нарушение транспорта поваренной соли в дыхательных путях в конечном итоге приводит к воспалению и возникновению хронической инфекции. Именно поражение дыхательных путей оказывает самое значительное влияние на качество жизни и выживание больных.
В начальных стадиях заболевания инфекционные обострения чаще всего вызываются Staphylococcus aureus, с течением времени начинают преобладать Pseudomonas aeruginosa. Последние вырабатывают алгинат, который защищает микроорганизмы от воздействия компонентов иммунной системы больного и антибиотиков.
Макролиды проявляют активность в отношении стафилококков и гемофильных палочек, но не действуют на P. aeruginosa. При хронических воспалительных заболеваниях дыхательные пути с течением времени колонизируются мукоидными штаммами P. aeruginosa, вырабатывающими большое количество алгината и существующими внутри биопленок, где они становятся неуязвимыми для иммунной системы пациента и антибиотиков. Клиническая эволюция этих изолятов протекает в двух направлениях. Во-первых, при благоприятных условиях бактерии высвобождаются из биопленок и вызывают острую инвазивную инфекцию дыхательных путей. В подобных случаях применение системных антибиотиков может привести к временному улучшению клинической симптоматики вследствие уничтожения этих «свободноживущих» бактерий. Однако полная эрадикация (истребление) возбудителей невозможна, поскольку некоторая часть живых бактерий остается внутри биопленок [13]. Во-вторых, алгинат, входящий в состав биопленок, в качестве антигена вступает в реакции с антителами, что сопровождается массивной лимфоцитарной инфильтрацией и формированием гранулем в окрестностях мелких дыхательных путей. Накопление иммунных комплексов в ткани легких стимулирует хемотаксис ПМН, что в свою очередь приводит к усугублению местного повреждения.
Механизмы позитивных эффектов макролидов у больных муковисцидозом могут быть разными. Как полагают, 14- и 15-членные макролиды способствуют разрушению и тормозят дальнейшее образование биопленок, а при длительном использовании накапливаются внутри P. aeruginosa и нарушают в них синтез белка, что, по некоторым данным, может приводить к бактерицидным эффектам [14]. Кроме того, макролиды ослабляют факторы вирулентности у P. aeruginosa. При этом азитромицин ингибирует феномен «кооперативной чувствительности» (quorum-sensing) путем снижения продукции аутоиндукторов с последующим уменьшением образования ИЛ‑8 [15-17], а по способности ослаблять факторы вирулентности у P. aeruginosa превосходит 14-членные макролиды [15].
Макролиды с успехом используются для профилактики инфекционных обострений у больных муковисцидозом. Так, в плацебо-контролируемом исследовании у 185 больных муковисцидозом в возрасте старше 6 лет (главным образом взрослых людей) азитромицин назначали по 250 или 500 мг (в зависимости от массы тела) 3 р/нед в течение 24 нед. У всех пациентов была документирована хроническая (длительностью ≥1 года) инфекция, вызванная P. aeruginosa, а объем форсированного выдоха за первую секунду (ОФВ1) превышал 30% от должного. Частота обострений в группе вмешательства снизилась более чем в полтора раза (относительный риск (ОР) 0,65; 95% доверительный интервал (ДИ) 0,44-0,95). Разница в позитивной динамике ОФВ1 в группе приема азитромицина по сравнению с плацебо также достигла статистической значимости (р<0,001) [18].
В другое двойное слепое плацебо-контролируемое рандомизированное клиническое исследование (РКИ) были включены 82 человека с ранними стадиями муковисцидоза в возрасте 6-21 года (средний возраст 11,0±3,3 года) с ОФВ1 >40%. Чаще всего при микробиологическом исследовании материала из дыхательных путей пациентов выделяли Staphylococcus aureus, значительно реже – Haemophilus influenzae, еще реже – P. aeruginosa (у 23% больных). Азитромицин назначали внутрь по 250 мг (при массе тела <40 кг) или 500 мг (масса тела ≥40 кг) 3 р/нед на протяжении 12 мес.
Хотя через 12 мес величины ОФВ1 в контрольной группе не отличались от таковых в группе вмешательства, прием азитромицина ассоциировался с двукратным снижением числа легочных обострений и почти со столь же значительным уменьшением потребности в дополнительных курсах лечения антибиотиками для приема внутрь (рис. 1). Медиана времени до наступления обострения в группе вмешательства (8,7 мес) в три раза превосходила аналогичный показатель в контрольной группе (2,9 мес, p<0,0001) [19].
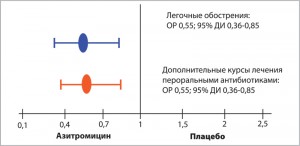 Рис. 1. Эффективность длительного (12 мес) профилактического приема азитромицина у больных с ранними стадиями муковисцидоза
Рис. 1. Эффективность длительного (12 мес) профилактического приема азитромицина у больных с ранними стадиями муковисцидозаПримечание: ОР – относительный риск; ДИ – доверительный интервал.
В 2012 г. авторы Кокрановского сотрудничества проанализировали результаты 10 исследований макролидов у больных муковисцидозом в возрасте старше 6 лет. Во всех исследованиях тестировался азитромицин. Работы с другими макролидами (к примеру, с кларитромицином) не вошли в окончательный анализ, поскольку были представлены только в виде тезисов или резюме и не публиковались в рецензируемых журналах.
Прием азитромицина, по сравнению с плацебо, ассоциировался с увеличением ОФВ1 на 3,97% (95% ДИ 1,74-6,19). Вероятность отсутствия обострений за этот период в группе вмешательства почти в 2 раза превышала таковую в группе плацебо: отношение шансов (ОШ) 1,96; 95% ДИ 1,15-3,33. Потребность в дополнительных курсах антибиотиков для приема внутрь снизилась почти в 4 раза: ОШ 0,28; 95% ДИ 0,19-0,42. В группе вмешательства зарегистрированы также лучшая прибавка в весе и меньшая частота выделения стафилококков из респираторных секретов. Побочные эффекты встречались нечасто и были нетяжелыми; переносимость была лучшей при назначении азитромицина 3 р/нед, нежели при приеме большей дозы 1 р/нед [20].
Таким образом, профилактический прием азитромицина 3 р/нед больными муковисцидозом на протяжении 6 мес ассоциируется со снижением частоты инфекционных обострений, улучшением функции легких и состояния питания. Однако первоначальное улучшение функции легких исчезает при более длительном приеме препарата. Кроме того, возрастает резистентность S. aureus к макролидам; клиническое значение этого обстоятельства еще предстоит изучить. Остается неясной и продолжительность снижения частоты инфекционных обострений. По-видимому, в настоящее время не следует рекомендовать профилактический прием азитромицина всем больным муковисцидозом. Наиболее подходящими кандидатами для такого вмешательства могут быть пациенты со значительным снижением функции легких, несмотря на адекватное лечение основного заболевания, либо лица с невысокой приверженностью к лечению. В пользу первой рекомендации свидетельствует стойкое улучшение функции легких на протяжении полугода приема азитромицина, в пользу второй – удобство дозирования препарата (3 р/нед). Однако формальная оценка эффективности вмешательства при перечисленных условиях до настоящего времени не производилась.
Бронхоэктатическая болезнь
Рекомендации по лечению больных бронхоэктатической болезнью (БЭ) часто основывались на результатах исследований у пациентов с муковисцидозом. К сожалению, подобный подход несостоятелен с научной точки зрения и может привести к нежелательным результатам. Например, такой муколитик, как рекомбинантная человеческая дезоксирибонуклеаза, с успехом используется при муковисцидозе. Однако его применение у взрослых больных БЭ ведет к увеличению обострений, госпитализаций и ускоренному снижению функции легких [21]. Другой пример: маннитол эффективен при муковисцидозе, но не при БЭ [22, 23].
При БЭ антибиотики используются как для лечения обострений, так и для предупреждения повторных обострений [24]. При бронхоэктазии расширение воздухоносных путей и утолщение стенок бронхов сопровождается повреждением эпителия и нарушением мукоцилиарного клиренса. Повышение вязкости мокроты также затрудняет отделение секрета, что способствует персистированию микроорганизмов в дыхательных путях.
Больные обычно предъявляют жалобы на хронический продуктивный кашель с периодическим усугублением клинической симптоматики (обострениями). Значимость обострений обусловлена не только их кратковременными эффектами на состояние здоровья (усиление одышки, кашля, потребность в госпитализации), но и долговременным негативным влиянием на функцию легких [25].
Воздухоносные пути больных с БЭ часто колонизированы различными микроорганизмами (табл.), что ведет к высвобождению провоспалительных цитокинов, таких как ИЛ‑1b, ИЛ‑8, лейкотриен B4 (LTB4) и фактор некроза опухоли (ФНО), привлечению нейтрофилов в очаг воспаления [26] и повышению гнойности мокроты. Нейтрофилы высвобождают нейтрофильную эластазу, протеиназы и матриксные металлопротеиназы, разрушающие эластин дыхательных путей, коллаген и протеогликан базальных мембран [27, 28]. В результате поражение дыхательных путей прогрессирует, а функция легких снижается. Таким образом, БЭ можно рассматривать как хроническое инфекционно-воспалительное заболевание.
Возможная польза от профилактики обострений БЭ заключается в снижении частоты госпитализаций, предупреждении ухудшения функции легких и поддержании приемлемого качества жизни. Однако использование антибиотиков с профилактической целью остается предметом дискуссий и четкие рекомендации по этой теме отсутствуют. Кандидатами для проведения антибиотикопрофилактики могут быть пациенты с частыми обострениями (>4-6/год), либо больные с прогрессирующим ухудшением функции легких. Отсутствие консенсуса по этим вопросам оставляет окончательное суждение за лечащим врачом. Поскольку при БЭ имеет место хроническое воспаление дыхательных путей, колонизированных бактериями (видовой состав которых с течением времени остается довольно стабильным), для оптимизации выбора антибиотиков можно рекомендовать периодическое повторение культуральных исследований мокроты с определением чувствительности выделенных микроорганизмов к антибиотикам [24].
Вариантов использования антибиотиков для профилактики обострений БЭ предлагалось множество. Это и повторные 7-10-дневные курсы каждый месяц (как одним и тем же препаратом, так и с заменой (ротацией) антибиотиков), и длительные (например, 4-недельные) курсы, и альтернирующий прием ингаляционных антибиотиков (1 мес приема антибиотиков – 1 мес перерыва), и периодические курсы внутривенной антибиотикопрофилактики [29]. В последние годы опубликовано несколько успешных исследований длительного применения азитромицина для профилактики обострений у больных с БЭ.
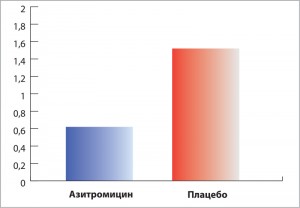
В рандомизированное плацебо-контролируемое исследование EMBRACE включили 141 взрослого пациента в возрасте 18 лет и старше с подтвержденными с помощью компьютерной томографии немуковисцидозными бронхоэктазами и хотя бы одним легочным обострением в предшествующий год. Азитромицин назначали по 0,5 г внутрь 3 р/нед на протяжении 6 мес (71 больной). В группе вмешательства число обострений снизилось более чем в 2,5 раза (рис. 2). В то же время различия в величинах ОФВ1 до назначения бронходилататора и в показателях респираторного опросника госпиталя Святого Георгия (SGRQ) в конце исследования не достигли статистической значимости [30].
Опубликованное год спустя исследование BAT также выполнено у взрослых. В него были включены 84 пациента с немуковисцидозными бронхоэктазами с 3 и более обострениями в предшествующие 12 мес. Пациенты рандомизированы в группу приема азитромицина по 250 мг/сут на протяжении 12 мес или плацебо. По завершении исследования в группе приема азитромицина документировано снижение абсолютного риска инфекционных обострений на 33,5% (95% ДИ 14,1-52,9). Кроме того, в группе вмешательства выявлено статистически значимое улучшение показателей респираторного опросника SGRQ (p=0,046, рис. 3) и спирометрии (положительная динамика ОФВ1 и форсированной жизненной емкости легких, ФЖЕЛ). Однако позитивные итоги исследования следует рассматривать в неразрывной связи с нежелательными результатами – более чем 8-кратным возрастанием риска диареи и более чем 3-кратным увеличением частоты выделения макролидорезистентных бактерий из мокроты пациентов [31].
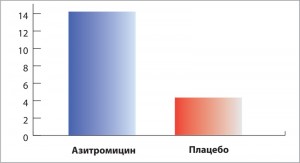 Рис. 3. Изменение показателей респираторного опросника госпиталя Св. Георгия (SGRQ) в исследовании BAT
Рис. 3. Изменение показателей респираторного опросника госпиталя Св. Георгия (SGRQ) в исследовании BATВ первое многоцентровое исследование у детей с немуковисцидозными бронхоэктазами (Bronchiectasis Intervention Study, BIS) были включены 89 человек – аборигенов Австралии и Новой Зеландии, рандомизированных в группы приема азитромицина по 30 мг/кг 1 р/нед или плацебо. Длительность наблюдения составила в среднем 20,7±5,7 мес. Частота обострений в группе вмешательства снизилась в 2 раза. Дети в этой группе лучше набирали вес. С другой стороны, носительство макролидорезистентных бактерий в группе приема азитромицина увеличилось более чем в 4 раза. Несмотря на это, в ходе анализа, проведенного после завершения исследования, выяснилось, что частота острых внелегочных инфекций, нуждающихся в применении антибиотиков, в группе приема азитромицина сократилась в 2 раза (p=0,005) [32].
В исследованиях макролидов у больных БЭ, как правило, отмечается снижение частоты инфекционных обострений и уменьшение продукции мокроты. С другой стороны, таких исследований все еще немного, количество включенных в них пациентов невелико, продолжительность наблюдения за больными после завершения исследований также небольшая.
В 2015 г. авторы Кокрановского сотрудничества проанализировали эффективность длительной антибиотикопрофилактики у детей и взрослых с немуковисцидозными бронхоэктазами [33]. Всего было отобрано 18 рандомизированных плацебо-контролируемых клинических исследований (КИ), включавших 1157 пациентов, преимущественно взрослого возраста. Антибиотики применялись внутрь в 12 КИ, ингаляционно – в 6 КИ. Макролиды (азитромицин, эритромицин и кларитромицин) тестировались в 8 КИ (чаще других – азитромицин, 5 КИ). Длительность вмешательства колебалась от 4 до 83 нед.
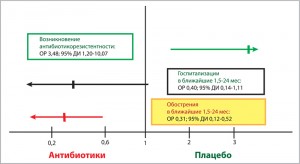
Количество обострений БЭ в группе антибиотикопрофилактики существенно снизилось (рис. 4), что означает уменьшение на 275 эпизодов обострений в каждой 1000 пациентов, принимающих антибиотики. Документирована тенденция к сокращению числа госпитализаций (на 50 меньше в каждой 1000 больных в группе вмешательства), которая, однако, не достигла статистической значимости (р=0,08). Подтверждено возрастание антибиотикорезистентности в группе приема антибиотиков. Клиническое значение этого факта еще предстоит изучить. Качество представленных доказательств авторы оценили как «умеренное».
В целом отмечена хорошая переносимость антибиотикопрофилактики. Частота прекращения приема антибиотиков из-за нежелательных лекарственных явлений оказалась сопоставимой с таковой в группе приема плацебо. Среди побочных эффектов чаще других регистрировалась диарея, особенно в случаях приема антибиотиков внутрь [33].
В других Кокрановских обзорах продемонстрированы предварительные данные о снижении частоты обострений БЭ при введении гипертонического раствора поваренной соли через небулайзер и увеличении – при использовании рекомбинантной человеческой дезоксирибонуклеазы. Положительное влияние на функцию легких оказывают ингаляционные кортикостероиды, хотя этот эффект невелик и клинического значения не имеет. Польза от использования гиперосмолярных средств убедительно не доказана.
В небольших исследованиях ингаляционных кортикостероидов и комбинаций длительно действующих β2-адреномиметиков с ингаляционными кортикостероидами сообщалось об уменьшении одышки, удушья и увеличении количества дней, когда больные не кашляют. Длительный прием антибиотиков ассоциируется со снижением продукции мокроты, в то время как эффекты гиперосмолярных средств на выработку мокроты нуждаются в уточнении [34].
Исходя из изложенного, можно заключить, что в настоящее время отсутствуют стратегии предупреждения обострений с БЭ с доказанными эффективностью и безопасностью. У больных БЭ, получающих адекватную терапию и тем не менее страдающих частыми обострениями, можно использовать длительный профилактический прием антибиотиков. В таких случаях предпочтение следует отдавать азитромицину.
Аргументами в пользу его использования служат:
• позитивные результаты исследований у больных с БЭ;
• немалый клинический опыт;
• возможность неежедневного приема (1-3 р/нед);
• хороший профиль безопасности, в том числе при длительном (многомесячном) применении.
Решение о длительной профилактике обострений БЭ азитромицином принимается в каждом случае индивидуально. Профилактический прием макролидов разумно ограничивать холодным временем года, когда риск обострений наибольший [35].
Продолжение следует.