30 травня, 2016
Гиперсенситивный пневмонит
Гиперсенситивный пневмонит (синоним: экзогенный аллергический альвеолит) – заболевание, в основе которого лежит иммунологически индуцированное воспаление легочной паренхимы с вовлечением в патологический процесс стенок альвеол и бронхов вследствие неоднократного вдыхания разнообразных органических антигенов [1].
В возникновении гиперсенситивного пневмонита (ГП) основное значение имеют бактериальные, грибковые, белковые антигены животного происхождения, антигены растительного происхождения и медикаментозные аллергены [2].
Гиперсенситивный пневмонит наблюдается у работников сельского хозяйства (птицеводческие фермы, животноводческие комплексы, зерновые хозяйства и др.), пищевой промышленности (производство пива, молочных продуктов, дрожжей, сыров и др.), текстильной и швейной промышленности (обработка меха, хлопка, льна), химической и фармацевтической промышленности (производство моющих средств, пластмасс, красителей; производство лекарственных препаратов), деревообрабатывающей промышленности (обработка древесины, производство бумаги) [3, 4].
Основную роль в патогенезе ГП играют иммунокомплексные аллергические реакции, хотя возможны аллергические реакции другого типа (цитотоксического и замедленного) [5]. Циркулирующие иммунные комплексы и специфические антитела активизируют систему комплемента и альвеолярные макрофаги. Последние выделяют интерлейкин‑2, хемотаксические факторы, протеолитические ферменты, активные кислородные радикалы, способствуют росту фибробластов, продукции коллагена. В результате развивается альвеолобронхиолит, происходит фиброзирование интерстиция. При длительном или многократном поступлении в легкие антигена или вещества, обладающего адъювантным свойством, развивается аллергическая реакция замедленного типа, что приводит к образованию гранулем [6, 7].
Морфологические изменения в легких больных ГП зависят от формы болезни: острая, подострая, хроническая [2]. Внутриклеточный и интерстициальный отек, инфильтрация альвеол и межальвеолярных перегородок лимфоцитами, плазматическими клетками, нейтрофилами, гистиоцитами характерны для острого течения ГП [8]. Образование эпителиоидноклеточных неказеозных гранулем саркоидного типа характерно для подострой стадии болезни [9]. С течением времени начинают преобладать пролиферативные процессы, гранулемы трансформируются в соединительнотканные структуры. Морфологическая картина хронической стадии ГП полностью теряет черты своей относительной специфичности. В связи с этим отсутствие гранулем в биопсийном материале не исключает диагноз ГП [10].
Клинические проявления ГП зависят от многих факторов: степени антигенности причинного аллергена, продолжительности и массивности антигенного воздействия, особенностей макроорганизма. Эти же факторы определяют и течение болезни: острое, подострое и хроническое [5].
Проявления острой фазы ГП развиваются, как правило, через 4-12 часов после попадания антигена в легкие. Характерными признаками болезни являются озноб, повышение температуры тела, одышка, кашель сухой или со скудной слизистой мокротой, общая слабость, боль в груди, мышцах, суставах, головная боль. Наряду с этим у части больных могут возникать приступы затрудненного дыхания, явления вазомоторного ринита [3].
В период острой фазы болезни при аускультации определяются мелко- и среднепузырчатые хрипы, нередко над всей поверхностью легких. При наличии явлений бронхоспазма выслушиваются сухие свистящие хрипы.
В случаях прекращения контакта с антигеном перечисленные симптомы могут исчезать без лечения в течение сравнительно короткого времени (12-48 часов). Однако в тех случаях, когда контакт с причинным агентом продолжается, острая форма болезни принимает прогрессирующее течение и прогноз заболевания становится значительно более серьезным.
При воздействии на организм небольших доз антигена далеко не всегда удается выявить четкую временную взаимосвязь между поступлением антигена в организм и клиническими проявлениями болезни. В таких случаях начало болезни не столь демонстративно и больные далеко не всегда обращаются к врачу своевременно. Постепенное развитие симптомов заболевания затрудняет (как для врача, так и для больного) выявление связи между симптомами болезни и воздействием какого-либо конкретного профессионального или бытового фактора. В этих случаях речь идет о подострой форме заболевания, которая характеризуется следующими клиническими симптомами: одышкой при умеренной физической нагрузке, кашлем с небольшим количеством слизистой мокроты, субфебрильной температурой тела, повышенной утомляемостью, снижением аппетита, похуданием [11].
Длительный (нередко многолетний) контакт с небольшими дозами антигена ведет к формированию хронической формы ГП: развитию фиброзирующего процесса в легких, сопровождающегося прогрессирующей одышкой, цианозом, похуданием и другими субъективными и объективными признаками, не отличающимися от таковых при идиопатическом легочном фиброзе (ИЛФ) [12].
Диагностика
Изменения в клиническом анализе крови у больных ГП зависят от остроты течения болезни и ее стадии. Лейкоцитоз, сдвиг лейкоцитарной формулы влево, увеличение СОЭ характерны для острого и менее характерны для подострого течения ГП. У небольшой части больных может определяться умеренная эозинофилия. Указанные изменения неспецифичны и должны учитываться в первую очередь для оценки активности и тяжести патологического процесса [2].
В диагностике ГП важное значение придается выявлению специфических преципитинов (преципитирующих антител), относящихся к классу иммуноглобулинов G [13]. Однако следует отметить, что выявление преципитирующих антител у лиц, контактирующих с определенным антигеном, не имеет самостоятельного значения. Обнаружение преципитинов свидетельствует в первую очередь о контакте с соответствующим антигеном и наличии к нему гиперчувствительности. Так, например, у фермеров, не имеющих признаков ГП, в 10-50% случаев выявляются специфические антитела [14].
Ряд исследователей предлагают использовать для диагностики ГП ингаляционный провокационный тест [15]. Он оценивается как положительный в случаях, если после вдыхания аэрозолей, содержащих предполагаемые антигены, субъективное состояние больного ухудшается (оценивается пациентом как гриппоподобное), повышается температура тела, частота дыхания, уменьшается жизненная емкость легких, снижается диффузионная способность легких. Проведение провокационных ингаляционных тестов в острой стадии наиболее информативно, однако сопряжено с ухудшением состояния больного, менее информативно в подострой и практически бесполезно в хронической стадии болезни. Применение кожных тестов не получило широкого распространения из-за высокого процента отрицательных результатов при наличии развернутой клинической картины болезни [16].
Таким образом, несмотря на наличие лабораторных тестов, диагноз ГП остается клиническим. Самое главное в диагностике ГП – помнить о его возможности, проводить детальный анализ производственных факторов, бытовых условий, географических и климатических особенностей местности проживания больного.
Рентгенологические изменения в легких при ГП также зависят от формы болезни (острая, подострая, хроническая). Стадия интерстициального отека, стадия альвеолита могут проявляться усилением легочного рисунка и участками снижения прозрачности легочной ткани по типу «матового стекла». Острое течение болезни рентгенологически может также проявляться локальными затенениями по типу инфильтрации. Распространенные двусторонние мелкоочаговые затенения отражают гранулематозную стадию болезни и чаще встречаются при подостром течении ГП. Переход болезни в хроническую форму характеризуется прогрессированием фиброзирующего процесса, что на заключительных этапах может привести к формированию «сотового легкого» [17].
Компьютерная томография высокого разрешения (КТВР) имеет преимущества в сравнении с рентгенографией. У больных с острой или подострой формами ГП на КТВР определяются более или менее распространенные зоны понижения прозрачности по типу «матового стекла» и немногочисленные центролобулярные очаги [18].
Хроническая форма ГП на КТ характеризуется наличием тонких линейных структур, морфологической основой которых является утолщение внутридолькового интерстиция. В более поздних стадиях патологического процесса выявляется картина фиброза с участками «сотового легкого» преимущественно в кортикальных отделах [2].
Исследование функции внешнего дыхания в острой фазе заболевания выявляет диффузионные нарушения, некоторое снижение статических объемов, а также нарушения бронхиальной проходимости.
Важная информация может быть получена при исследовании жидкости бронхоальвеолярного лаважа (БАЛ). Изменения клеточного состава лаважной жидкости характеризуются увеличением общего числа клеток и процентного содержания лимфоцитов (от 20-30 до 70-90% общего клеточного состава) [19].
Дифференциальная диагностика
Диагноз «пневмония» – наиболее частая диагностическая ошибка при ГП [3]. Можно выделить следующие признаки, отличающие бактериальную пневмонию от ГП:
– связь начала пневмонии с простудным фактором (как правило); начало ГП обусловлено вдыханием пыли или аэрозолей, обладающих антигенными свойствами;
– особенности клинических проявлений пневмонии: кашель, боль в груди, признаки интоксикации; у больных ГП в клинической картине доминирует инспираторная одышка;
– при пневмонии аускультативные изменения имеют преимущественно локальный характер; у больных острой формой ГП крепитирующие хрипы выслушиваются, как правило, над всей поверхностью легких;
– отсутствие у больных пневмонией прогрессирующих рестриктивных нарушений легочной вентиляции, существенного снижения диффузионной способности легких, что характерно для ГП;
– как правило, четкие границы пневмонической инфильтрации; у больных ГП рентгенологические изменения (интерстициальные, инфильтративные, очаговые) не имеют четких границ;
– противомикробная терапия эффективна при пневмонии и неэффективна при ГП;
– быстрая положительная динамика клинических проявлений и рентгенологических изменений у больных ГП на фоне терапии глюкокортикостероидами (ГКС) [20].
Дифференциальную диагностику ГП следует проводить с другими формами фиброзирующих альвеолитов, в частности с ИЛФ [2]. Основным признаком, отличающим эти две формы фиброзирующих альвеолитов, является известный причинный фактор, вызвавший заболевание при ГП, и неизвестный – при ИЛФ. Инспираторная одышка имеет место при обоих заболеваниях, однако при ИЛФ это обязательный и доминирующий признак, практически определяющий всю клиническую картину. У одной трети больных ГП имеет место бронхоспазм. Наличие этого признака практически исключает ИЛФ. Увеличение содержания лимфоцитов в БАЛ свыше 40% – достаточно надежный критерий диагноза [19].
Лечение
Глюкокортикостероиды являются основными препаратами в лечении больных ГП [2, 3, 16]. При острой и подострой формах заболевания рекомендуется применение ступенчатой терапии: дексаметазон внутривенно (по 8-16 мг в сутки в зависимости от тяжести течения) на протяжении 7-10 дней с последующим приемом ГКС per os в дозе 0,5 мг/кг массы тела в расчете на преднизолон. Дексаметазон в среднем в 5 раз превосходит метилпреднизолон и преднизолон по степени противовоспалительной активности, в связи с этим его применение обеспечивает максимальный противовоспалительный эффект на старте терапии. При хроническом течении ГП лечение начинают с приема таблетированных препаратов. Дозу ГКС сохраняют неизменной до достижения стабилизации процесса, когда отсутствует дальнейшая положительная динамика клинического состояния больного, показателей вентиляционной функции легких. С этого момента дозу ГКС снижают в среднем на 2,5 мг каждые 5 дней до полной отмены [16].
В заключение необхо димо отметить, что в отличие от острой формы ГП, при которой в значительной части случаев удается определить связь развития симптомов с ингаляцией аллергена, диагностика подострой формы часто представляет трудности. Постепенное развитие симптомов болезни затрудняет выявление связи между симптомами и воздействием какого-либо конкретного профессионального или бытового фактора.
Клиническая семиотика (одышка, непродуктивный кашель, субфебрильная температура тела) у больных подострой формой ГП имеет неспецифический характер и может рассматриваться только по критерию совместимости с диагнозом.
Достаточно специфичным для ГП является КТ-паттерн патологических изменений в паренхиме – множественные участки снижения прозрачности по типу «матового стекла», распределенные в различных зонах легких. Этот паттерн существенно отличается от характера КТ-изменений при идиопатических интерстициальных пневмониях, включая ИЛФ, но является характерным для токсических, прежде всего лекарственно индуцированных, пневмонитов, диагноз которых всегда должен рассматриваться в качестве альтернативного.
Таким образом, в случаях неустановленной связи развития клинических симптомов с ингаляцией какого-либо аллергена диагностика ГП должна основываться на характерных КТ-признаках, исключении альтернативных диагнозов при наличии совместимой клинической семиотики.
У больных ГП обычно наблюдается быстрый положительный ответ на ГКС-терапию. Отсутствие эффекта от ГКС-терапии, с нашей точки зрения, является показанием к проведению биопсии легкого.
Ниже приведено описание клинического случая ГП с неустановленной причиной.
Клинический случай
Пациентка О., 1961 года рождения, поступила в отделение интерстициальных заболеваний легких Национального института фтизиатрии и пульмонологии (НИФП) им. Ф.Г. Яновского НАМН Украины с жалобами на одышку при незначительной физической нагрузке, сухой кашель и общую слабость.
Симптомы появились 3-4 недели назад без видимых причин. Одышка постепенно усиливалась, в связи с чем обратилась к кардиологу по месту жительства. Была обследована с применением ЭКГ и ЭхоКГ – патологии сердца не выявили. На рентгенограмме легких обнаружили изменения, которые расценили как возможное проявление тромбоэмболии мелких ветвей легочной артерии (ТЭЛА), для уточнения диагноза больная была направлена и госпитализирована в кардиологическое отделение Александровской больницы. После тщательного обследования с включением КТВР органов грудной полости (ОГП) подозрение на ТЭЛА было исключено. Установлен диагноз негоспитальной пневмонии, по поводу чего была проведена антибактериальная терапия, и в связи с отсутствием эффекта от лечения больная была направлена в НИФП для уточнения диагноза и определения тактики лечения.
Пациентка работает гинекологом, за последние месяцы фактов пребывания в условиях запыленности и загазованности окружающей воздушной среды не было. Лекарственных препаратов не принимает. Бытовые условия хорошие, каких-либо изменений условий труда и быта в последнее время не отмечает.
В анамнезе редкие простудные заболевания, варикозное расширение вен голеней, калькулезный холецистит. Туберкулез, вирусные гепатиты, онкопатологию, ВИЧ-инфекцию отрицает. Вредных привычек не имеет. Аллергологический анамнез не отягощен.
Состояние пациентки тяжелое. Нормостеник, повышенного питания. Кожные покровы чистые, бледно-цианотичные. Периферические лимфатические узлы не увеличены. Зев чистый. Грудная клетка обычной формы, активно участвует в акте дыхания, ЧД – 24/мин. Насыщение крови кислородом (SaО2) по данным пульсоксиметрии – 88%. Дыхание везикулярное ослабленное, в базальном отделе справа выслушиваются субкрепитирующие хрипы. Тоны сердца приглушены, ритмичные, ЧСС – 76 уд/мин, АД – 130/70 мм рт. ст. Живот мягкий, безболезненный при пальпации. Отеков нет.
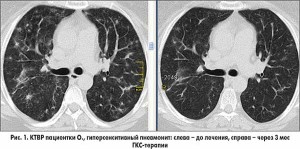
КТВР ОГП (рис. 1 слева): билатерально в легком на фоне субтотального снижения пневматизации определяются небольшие более интенсивные участки «матового стекла», единичные мелкие инфильтраты. Внутригрудные лимфатические узлы не увеличены. Бронхи проходимы. В плевральных полостях жидкости нет. Сердце в пределах нормы. Заключение: интерстициальный пневмонит.
Исследование функции внешнего дыхания: жизненная емкость легких (VC) – 68,9% от должного, форсированная жизненная емкость легких (FVC) – 67,8%; объем форсированного выдоха за 1 секунду (FEV1) – 75,5%; соотношение FEV1/FVC – 94,8%. Диффузионная способность легких (DLCO) – 43,6%.
Общий анализ крови: эритроциты (RBC) – 5,16×1012/л, гемоглобин (НGВ) – 140 г/л, лейкоциты (WBC) – 11,0×109/л, лимфоциты (Lymph) – 21,2%, моноциты, базофилы и эозинофилы (Mid) – 4,6%, гранулоциты (Gran) – 74,2%, тромбоциты (PLT) – 435×109/л, COЭ – 29 мм/ч.
Биохимический анализ, электролиты крови, анализ мочи – в пределах нормы.
Газовый состав крови: парциальное давление углекислого газа (РаСО2) – 33 мм рт. ст., парциальное давление кислорода (РаO2) – 62 мм рт. ст., SаO2 – 92%.
ЭКГ: электрическая ось сердца не отклонена, синусовый ритм с частотой 67 уд/мин, признаки умеренной гипоксии миокарда.
Иммунологическое исследование крови: незначительный лейкоцитоз, гранулоцитоз; Т-система характеризуется увеличением хелперов, сниженным процентом супрессоров и сниженным уровнем природных киллеров. Высокий иммунорегуляторный индекс свидетельствует о высокой активности иммунного ответа. Сниженный процент В-клеток сопровождается ростом иммуноглобулина E (155,0 МЕ/мл при норме до 100,0). Содержание циркулирующих иммунных комплексов в пределах нормы. Функциональная способность фагоцитирующих клеток снижена.
Больной установлен предварительный диагноз ГП, назначена пробная терапия метилпреднизолоном в дозе 24 мг/сут в сочетании с препаратами калия и кальция. К концу первой недели лечения отмечена отчетливая положительная динамика клинических симптомов – уменьшилась одышка, исчез кашель, уменьшилась слабость.
Существенно улучшилась DLCO – 56,9%.
Общий анализ крови на десятый день лечения: RBC – 5,58×1012/л, НGВ – 153 г/л, WBC – 12,6×109/л, Lymph – 23,2%, Mid – 8,6%, Gran – 68,2%, PLT – 363×109/л, COЭ – 13 мм/ч (уменьшение количества гранулоцитов, снижение СОЭ).
Клинический диагноз: ГП неустановленного генеза, подострая форма, фаза регрессии. Легочная недостаточность (ЛН) I ст.
Диагноз установлен на основании типичной КТ-семиотики, отсутствия альтернативных диагнозов, совместимой клинической картины (респираторные симптомы, субфебрильная температура тела) и выраженной положительной динамики на фоне ГКС-терапии.
Пациентке было рекомендовано продолжение терапии метилпреднизолоном в дозе 24 мг/сут на протяжении 2 нед с последующим постепенным ее снижением на 2 мг каждые 10 дней до достижения к концу 3-го месяца дозы, равной 12 мг/сут.
Визит 2 (через 3 мес лечения). Отмечает значительное улучшение состояния – одышка наблюдается при выполнении привычной нагрузки (при подъеме на 4-й этаж). Других жалоб нет.
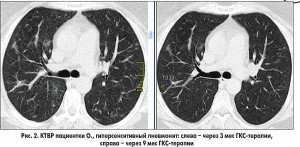
КТВР ОГП (рис. 1 справа): существенная положительная динамика – сохраняются единичные небольшие участки «матового стекла».
Больной рекомендовано дальнейшее снижение дозы метилпреднизолона до поддерживающей (4 мг), следующее обследование – через 6 мес.
Визит 3 (через 9 мес лечения). Жалоб нет, одышка не беспокоит.
КТВР ОГП (рис. 2 справа): практически полное восстановление пневматизации легких.
Больной рекомендовано снижение дозы метилпреднизолона по 2 мг в течение 2 нед до полной отмены.
Литература
- Costabel U. Chronic hypersensitivity pneumonitis / U. Costabel // Clin Chest Med. – 2012. – Vol. 33. – P. 151-163.
- Spagnolo P. Hypersensitivity pneumonitis: a comprehensive review / P. Spagnolo, G. Rossi, M. Bonifazi et al. // J. Investig. Allergol. Clin. Immunol. – 2015. – Vol. 25 (4). – P. 237-250.
- Kurup V.P. Hypersensitivity pneumonitis / V.P. Kurup, M.C. Zacharizen, J.N. Fink // Indian J. Chest Dis. Allied Sci. – 2006. – Vol. 48. – P. 115-128.
- Glazer C.S. Chronic hypersensitivity pneumonitis: important considerations in the work-up of this fibrotic lung disease / C.S. Glazer // Curr. Opin. Pulm. Med. – 2015. – Vol. 21. – P. 171-177.
- Selman M. Hypersensitivity pneumonitis: insights in diagnosis and pathobiology / M. Selman, A. Pardo, T.E. King // Am. J. Respir. Crit. Care Med. – 2012. – Vol. 186. – P. 314-324.
- Selman M. Immunopathology, diagnosis, and management of hypersensitivity pneumonitis / M. Selman, I. Buendia-Roldan // Semin. Respir. Crit. Care Med. – 2012. – Vol. 33. – P. 543-554.
- Barrera R. Functional diversity of T-cell subpopulations in subacute and chronic hypersensitivity pneumonitis / R. Barrera, F. Mendoza, J. Zuniga et al. // Am. J. Respir. Crit. Care Med. – 2008. – Vol. 177. – P. 44-55.
- Hariri L.P. Distinct histopathology of acute onset or abrupt exacerbation of hypersensitivity pneumonitis / L.P. Hariri, M. Mino-Kenudson, B. Shea et al. // Hum. Pathol. – 2012. – Vol. 43. – P. 660-668.
- Castonguay M.C. Granulomas and giant cells in hypersensitivity pneumonitis / M.C. Castonguay, G.H. Ryu, Е. Yi et al. // Hum. Pathol. – 2015. – Vol. 46. – P. 607-613.
- Churg A. Chronic hypersensitivity pneumonitis / A. Churg, N. Muller, J. Flint et al. // Am. J. Surg. Pathol. – 2006. – Vol. 30. – P. 201-208.
- Fink J.N. Hypersensitivity pneumonitis / J.N. Fink // Clin. Chest Med. – 1992. – Vol. 13. – P. 303-309.
- Morell F. Chronic hypersensitivity pneumonitis in patients diagnosed with idiopathic pulmonary fibrosis: a prospective case-cohort study / F. Morell, A. Villar, M.A. Montero et al. // Lancet Respir. Med. – 2013. – Vol. 1. – P. 684-694.
- Fenoglio C.M. Diagnostic value of serum precipitins to mould antigens in active hypersensitivity pneumonitis / C.M. Fenoglio, G. Reboux, B. Sudre et al. // Eur. Respir. J. – 2007. – Vol. 29. – P. 706-712.
- Cormier Y. Factors influencing the development of serum precipitins to farmer’s lung antigen in Quebec dairy farmers / Y. Cormier, J. Belanger, P. Durand // Thorax. – 1985. – Vol. 40. – P. 138-142.
- Ohtani Y. Inhalation provocation tests in chronic bird fancier’s lung / Y. Ohtani, K. Kojima, Y. Sumi et al. // Chest. – Vol. 118. – P. 1382-1389.
- Selman M. Hypersensitivity pneumonitis / M. Selman // Schwartz M.I., King T.E., editors: Interstitial lung disease. Shelton (CT): People’s Medical Publishing House – USA. – 2011. – P. 597-635.
- Clazer C.S. Clinical and radiologic manifestations of hypersensitivity pneumonitis / C.S. Clazer, C.S. Rose, D.A. Lynch // Thorac Imaging. – 2002. – Vol. 17. – P. 261-272.
- Patel R.A. Hypersensitivity pneumonitis: patterns on high resolution CT / R.A. Patel, D. Sellami, M.B. Gotway et al. // J. Comp. Assist.Tomogr. – 2000. – Vol. 24. – P. 265-270.
- Reynolds H.Y. Present status of bronchoalveolar lavage in interstitial lung disease / H.Y. Reynolds // Curr. Opin. Pulm. Med. – 2009. – Vol. 15. – P. 479-485.
- Lacasse Y. Clinical Diagnosis of Hypersensitivity Pneumonitis / Y. Lacasse, M. Selman, U. Costabel et al. // Am. J. Respir. Crit. Care Med. – 2003. – Vol. 15. – P. 8.952-8.958.
- Hirschmann J.V. Hypersensitivity Pneumonitis: A historical, Clinical, and Radiologic Review / J.V. Hirschmann, S.N. Pipavath, J.D. Godwin // RadioGraphics. – 2009. – Vol. 29. – P. 1921-1038.