15 квітня, 2016
Аспергиллез легких: клинические формы, диагностика, лечение

Аспергиллез – наиболее распространенный из микозов легких. Возбудители – микроскопические грибы Aspergillus fumigatus, A. flavus, A. niger, A. terreus, А. nidulans – распространены повсеместно. Они растут в почве, часто встречаются на строительных материалах, в системе вентиляции зданий, а также на некоторых пищевых продуктах, органических отбросах, гниющих растениях.
Различают четыре клинические формы аспергиллеза легких – инвазивный аспергиллез (ИАЛ), хронический некротизирующий аспергиллез (ХНАЛ), аспергиллома и аллергический бронхолегочный аспергиллез (АБЛА) [1, 2, 3, 4]. Клинические формы различаются по патогенезу, проявлениям и прогнозу заболевания, они возникают у разных контингентов больных и требуют различных диагностических и лечебных мероприятий. Клиническая форма и тяжесть течения заболевания определяются состоянием иммунной системы больного, а не особенностями возбудителя [3, 5].
Инвазивный аспергиллез легких
Заболеваемость ИАЛ в экономически развитых странах составляет 12-34 случая на 1 млн населения в год [2, 3].
Инфицирование обычно происходит в результате вдыхания конидий Aspergillus spp. От человека к человеку любые формы аспергиллеза не передаются.
Наиболее часто ИАЛ развивается у больных острым лейкозом во время цитостатической терапии, у реципиентов аллотрансплантатов костного мозга при развитии реакции «трансплантат против хозяина», у пациентов с хронической гранулематозной болезнью, а также у больных, длительно получающих глюкокортикостероиды (ГКС) и иммуносупрессанты [6]. В последнее время отмечено увеличение частоты ИАГ у больных без типичных факторов риска, например в хирургических и терапевтических отделениях реанимации и интенсивной терапии, у пациентов с ХОЗЛ, принимающих ГКС [7], алкогольным гепатитом [8].
Наиболее частыми клиническими признаками ИАЛ являются рефрактерное к антибиотикам широкого спектра повышение температуры тела выше 38 оС длительностью более 4 суток, непродуктивный кашель, боли в грудной клетке, кровохарканье и одышка. В 10-35% случаев повышение температуры тела не отмечается. У больных с выраженной иммуносупрессией типичные проявления воспаления могут отсутствовать даже при угрожающей жизни инфекции. Нередко единственными проявлениями заболевания служат изменения при рентгенографии или компьютерной томографии легких [3, 9].
Основной метод выявления очагов поражения – компьютерная томография высокого разрешения (КТВР), микробиологического подтверждения диагноза – микроскопия и посев респираторных субстратов, серологической диагностики – определение галактоманнана в сыворотке крови [6, 9].
КТВР является основным методом диагностики ИАЛ. В отличие от КТ результаты рентгенографии обычно неспецифичны, раннее выявление признаков заболевания с помощью этого метода часто невозможно.
Ранними КТ-признаками ИАЛ являются мелкие (<2 см), связанные с сосудами округлые очаги, обычно расположенные субплеврально, изменения по типу «матового стекла», симптом «ореола», а также уплотнения треугольной формы, примыкающие основанием к плевре. По мере прогрессирования заболевания при КТ легких определяют поздние признаки: очаги деструкции, а также полости с содержимым и прослойкой воздуха (симптом «полумесяца» или «погремушки»). Признаки плеврита обычно выявляют редко [3, 9].
Характерный признак ИАЛ – выявление при микроскопии мокроты, БАЛ и биопсийного материала септированного мицелия, ветвящегося под углом 45о. Однако частота обнаружения Aspergillus spp. при микроскопии и посеве БАЛ у больных с доказанным ИАЛ составляет около 50%, поэтому отрицательный результат микологического исследования мокроты и БАЛ не исключает наличия у больного ИАЛ [3].
Важным методом ранней диагностики ИАЛ является определение антигена Aspergillus (галактоманнана) в сыворотке крови. Чувствительность и специфичность теста составляют 70-90% [9].
Комплекс лечебных мер включает антифунгальную терапию (АФТ), устранение или уменьшение выраженности факторов риска и хирургическое удаление пораженных тканей. Кроме лечения ИАЛ при установленном диагнозе возможно назначение эмпирической АФТ (в ситуациях, когда имеется высокий риск ИАЛ, есть предполагаемые клинические признаки, но лабораторное подтверждение отсутствует) или превентивной АФТ (когда высок риск ИАЛ, есть предполагаемые лабораторные, но нет клинических признаков) [2, 6].
Возбудители ИАЛ чувствительны к вориконазолу, позаконазолу, итраконазолу, амфотерицину В и каспофунгину, резистентны к флуконазолу и кетоконазолу. Вторичная резистентность развивается редко, описана при длительном применении итраконазола [3].
Препаратом выбора для лечения ИАЛ является вориконазол внутривенно в дозе 6 мг/кг каждые 12 ч в первый день, затем внутривенно по 4 мг/кг каждые 12 ч, а после стабилизации состояния больного – внутрь по 200 мг/сут (при массе тела <40 кг) или по 400 мг/сут (при массе тела >40 кг). У детей (2-12 лет): внутривенно – по 7 мг/кг 2 раза в сут; внутрь – по 0,2 г 2 раза в сут.
Альтернативные препараты:
• каспофунгин по 70 мг в первый день, затем по 50 мг/сут;
• позаконазол по 800 мг/сут;
• липидный комплекс амфотерицина В по 3-5 мг/кг в сут;
• комбинированная терапия – каспофунгин в сочетании с вориконазолом или липидным амфотерицином В;
• амфотерицин В по 1,0-1,5 мг/кг в сут;
• итраконазол по 600 мг/сут – 4 дня, затем по 400 мг/сут – у клинически стабильных больных.
Антифунгальную терапию продолжают до исчезновения клинических признаков заболевания, эрадикации возбудителя из очага инфекции, купирования или стабилизации радиологических признаков, а также до завершения периода нейтропении. Средняя продолжительность лечения до стабилизации состояния больного составляет 3 недели, обычно АФТ продолжают не менее 3 мес. Однако у больных с сохраняющейся иммуносупрессией необходимо более длительное лечение [3, 9].
Без лечения ИАЛ практически всегда заканчивается летальным исходом в течение 1-4 нед после начала заболевания. При проведении лечения летальность в настоящее время составляет 30-50%. Более 80% связанных с ИАЛ летальных исходов возникают в течение 3 мес после начала заболевания. Прогностически неблагоприятным является применение высоких доз ГКС перед выявлением ИАЛ, а также сохранение иммуносупрессии и нейтропении после начала заболевания [4].
Хронический некротизирующий аспергиллез легких
ХНАЛ – относительно редкое заболевание, составляющее примерно 5% всех случаев аспергиллеза легких [3, 5].
Факторы риска – СПИД, хроническая гранулематозная болезнь, сахарный диабет, алкоголизм, применение ГКС при ХОЗЛ, повышенное количество конидий Aspergillus spp. в окружающей среде. ХНАЛ развивается преимущественно у больных с умеренными нарушениями функции фагоцитов и Т-клеток, возможно его возникновение у иммунокомпетентных людей. Кроме того, развитие ХНАЛ возможно на фоне других инфекционных заболеваний, например туберкулеза. ХНАЛ возникает преимущественно у мужчин среднего возраста [10].
Основной клинический симптом ХНАЛ – хронический продуктивный кашель, нередко с умеренным или минимальным кровохарканьем. Повышение температуры тела >38 оC не характерно, может быть субфебрилитет. Обычно развиваются общая слабость и снижение массы тела. Наиболее часто болезнь протекает хронически с периодическими обострениями и прогрессирующим нарушением функции внешнего дыхания. Осложнениями являются распространение процесса с поражением плевры, ребер, позвонков и т.д., а также легочное кровотечение, требующее хирургического вмешательства. При нарастании иммуносупрессии возможно быстрое прогрессирование заболевания с развитием типичного ИАЛ, гематогенной диссеминации с поражением головного мозга и внутренних органов [11].
Методы диагностики:
• КТ или рентгенография легких;
• бронхоскопия, БАЛ, биопсия очагов поражения;
• микроскопия и посев БАЛ, мокроты, биопсийного материала;
• определение специфического IgG к Aspergillus в сыворотке крови.
Критерии диагностики: хроническое (более 1 мес) течение заболевания, наличие КТ- или рентгенографических признаков ХНАЛ, характерные изменения при бронхоскопии, выявление мицелия Aspergillus spp. в окрашенных мазках и/или признаков инвазивного роста грибов в биопсийном материале, или выделение Aspergillus spp. при посеве биопсийного материала, БАЛ, мокроты, или выявление специфического IgG к Aspergillus в сыворотке крови [3].
На рентгенограмме легких почти всегда выявляют полости, окруженные зоной воспаления. Чаще поражаются верхние доли. Зона воспаления может быть распространенной и занимать долю или все легкое. Эти признаки изменяются относительно медленно. В отличие от обычной аспергилломы утолщение плевры не характерно, но возможно развитие специфического плеврита. Выявление связанных с сосудами узелковых образований может свидетельствовать о гематогенной диссеминации процесса. Применение КТ позволяет обнаружить изменения, не определяемые на рентгенограмме. При КТ обычно выявляют комплекс полостей, содержащих аспергилломы, окруженные зоной воспаления [10].
Чувствительность определения специфического IgG к Aspergillus в сыворотке крови у больных ХНАЛ составляет около 90%. Содержание общего IgG может быть умеренно повышено (200-2000 Ед/л), иногда определяют специфический IgЕ [3].
При гистологическом исследовании биоптата из каверны или зоны воспаления определяют признаки хронического воспаления. Основное назначение биопсии очага поражения при ХНАЛ – исключение новообразования легких, туберкулеза и др. Отсутствие гиф Aspergillus в биоптате из очага поражения не исключает диагноза ХНАЛ при наличии других критериев диагностики.
Дифференциальную диагностику проводят с аспергилломой, новообразованиями, абсцедирующей бактериальной пневмонией, а также туберкулезом легких. Важными признаками, отличающими ХНАЛ от аспергилломы, являются наличие множественных полостей, увеличение размеров полостей, появление признаков воспаления окружающей легочной ткани, вовлечение в процесс плевры и грудной клетки [10].
С учетом хронического рецидивирующего течения заболевания необходимо длительное, повторное применение противогрибковых препаратов. Наиболее часто применяют вориконазол, итраконазол, амфотерицин В. Основным показанием к хирургическому лечению является высокий риск легочного кровотечения, реже – наличие одиночного очага, рефрактерного к АФТ [3].
Аспергиллома
Аспергиллома, или «грибной шар», представляет собой массу мицелия Aspergillus spp., разрастающегося в ранее возникших полостях легких вследствие туберкулеза (40-70% случаев), деструктивной пневмонии (10-20%), буллезной эмфиземы (10-20%), бронхоэктазов (5-10%), опухолей (3-7%) у иммунокомпетентных пациентов. Аспергиллома может возникать не только в легких, но и в придаточных полостях носа. Чаще болеют мужчины в возрасте от 40 до 70 лет [12].
Вначале аспергиллома обычно протекает бессимптомно, но по мере прогрессирования процесса пациентов начинает беспокоить кашель, у части больных возникают кровохарканье, субфебрилитет. В большинстве случаев аспергиллома возникает в верхней доле правого легкого (50-75%), реже – в верхней доле левого легкого (20-30%). Приблизительно у 10% больных признаки аспергилломы проходят спонтанно без лечения. У большинства больных по крайней мере 1 раз в течение заболевания возникает эпизод кровохарканья, у 20% – легочное кровотечение. Осложнениями аспергилломы являются легочное кровотечение и инвазивный рост Aspergillus spp. с развитием ИАЛ, ХНАЛ или специфического плеврита. Риск осложнений повышен при иммуносупрессии (СПИД, длительное применение системных ГКС и др.) [13].
При рентгенографии или КТ легких выявляют полость, заполненную содержимым, смещающимся при перемене положения тела (симптом «погремушки»), с характерной прослойкой воздуха (симптом «полумесяца»). Выявление специфических IgG к Aspergillus в сыворотке крови (у 90% больных) и Aspergillus spp. при микроскопии и посеве мокроты, БАЛ (у 50%) помогает провести дифференциальную диагностику с новообразованием, туберкулезом, бактериальным абсцессом [3, 14].
Лечение проводят при развитии или высоком риске осложнений (повторное кровохарканье, легочное кровотечение, иммуносупрессия и др.), при бессимптомной аспергилломе показано наблюдение. Основным методом лечения является хирургическое удаление пораженного участка легкого. Чтобы уменьшить вероятность инфицирования тканей, до и после оперативного лечения проводят АФТ итаконазолом или амфотерицином В [3, 12].
Аллергический бронхолегочный аспергиллез
АБЛА характеризуется развитием реакции гиперчувствительности I типа при колонизации дыхательных путей Aspergillus spp. Инвазивного поражения тканей легких при АБЛА не происходит. Частота АБЛА у больных бронхиальной астмой составляет 1-5%, у больных муковисцидозом – 5-14% [5, 6, 15].
Заболевание обычно протекает хронически с периодическими обострениями бронхообструктивного синдрома и/или возникновением эозинофильных инфильтратов.
Основными признаками обострения АБЛА являются приступы удушья, повышение температуры тела, боли в грудной клетке и кашель с мокротой, содержащей коричневые включения и слизистые пробки. При рентгенографии выявляют летучие инфильтраты в легких, при микроскопии мокроты – мицелий или другие элементы грибов Aspergillus [16].
Эозинофилию крови более 0,4×109/л выявляют в острой стадии и при обострении заболевания, во время ремиссии и в стадии фиброза количество эозинофилов может быть нормальным. Специфические IgЕ и IgG к Aspergillus определяются в дебюте или при обострении заболевания. Кожная проба с антигеном Aspergillus отличается высокой диагностической чувствительностью, но низкой специфичностью [3].
Поскольку патогномоничных признаков АБЛА нет, диагноз устанавливают при наличии у больного в момент обследования или в анамнезе не менее 6 из приведенных ниже критериев диагностики:
• бронхообструктивный синдром;
• «летучие» инфильтраты на рентгенограмме или КТ легких;
• проксимальные бронхоэктазы;
• увеличение абсолютного количества эозинофилов в крови более 0,4×109/л;
• увеличение концентрации общего IgЕ в сыворотке крови более 1000 мкг/л;
• выявление специфического IgЕ к Aspergillus в сыворотке крови;
• выявление специфического IgG к Aspergillus в сыворотке крови;
• положительная кожная проба с антигеном Aspergillus.
У больных муковисцидозом минимальными диагностическими критериями являются:
• наличие бронхообструктивного синдрома;
• увеличение концентрации общего IgЕ в сыворотке крови более 1000 мкг/л;
• положительная кожная проба с антигеном Aspergillus или выявление специфического IgЕ к Aspergillus в сыворотке крови;
• резистентные к антибактериальным препаратам инфильтративные изменения на рентгенограмме или КТ либо выявление специфического IgG к Aspergillus в сыворотке крови [3].
В острой стадии АБЛА основой лечения является применение системных ГКС. Для купирования бронхообструктивного синдрома и эозинофильных инфильтратов в легких назначают преднизолон в дозе 0,5-1,0 мг/кг в сут в течение 7-10 дней. Критериями эффективности служат купирование клинических признаков, исчезновение эозинофильных инфильтратов в легких и снижение уровня общего IgЕ в сыворотке крови. После достижения эффекта дозу препарата постепенно снижают до поддерживающей (0,125 мг/кг), лечение ГКС продолжается в течение 3 мес.
Во время ремиссии больные в специфической терапии не нуждаются. При рецидиве вновь применяют преднизолон, после снижения активности АБЛА назначают итраконазол по 200-400 мг/сут в течение 2-4 мес. Применение ингаляционных ГКС и бронходилататоров позволяет уменьшить дозу системных ГКС, особенно у больных с частыми обострениями [3, 16].
Клинический случай аспергилломы легкого
Больной Л., 35 лет, госпитализирован в терапевтическое отделение в порядке скорой помощи по направлению семейного врача.
Жалобы на повышение температуры тела до 38,5 оC, общую слабость, малопродуктивный кашель, одышку при физической нагрузке.
Из анамнеза стало известно, что ухудшение самочувствия наступило за 5-6 дней до госпитализации, когда появились гипертермия и кашель. После обращения к семейному врачу был направлен в стационар с диагнозом «правосторонняя пневмония».
5 лет назад пациент лечился по поводу пневмонии, при этом во время обследования была выявлена ВИЧ-инфекция. Однако больной на учет не встал и антиретровирусную терапию не получал. Употребляет наркотики, ведет антисоциальный образ жизни.
Состояние больного средней тяжести. Сознание ясное, положение активное. Кожные покровы обычной окраски с бледным оттенком. Нормального питания, нормостенического телосложения. Увеличены подчелюстные, заднешейные и подмышечные лимфоузлы, подвижные, не спаянные с окружающими тканями.
ЧСС – 128 в мин, АД – 110/60 мм рт. ст. Перкуторно границы сердца не изменены, при аускультации тоны сердца звучны, ритмичны. Патологические шумы не выслушиваются.
Дыхательная система: ЧД – 20/мин. Грудная клетка нормальная, обе половины грудной клетки равномерно принимают участие в акте дыхания. Перкуторно – легочной звук. При аускультации – жесткое дыхание, хрипы не выслушиваются.
Живот мягкий, принимает участие в акте дыхания, при пальпации безболезненный. Печень на 2 см выступает из-под края реберной дуги, край печени сглажен.
Периферических отеков нет.
Общий анализ крови: Hb – 113 г/л, эритроциты – 3,1×1012/л, лейкоциты – 10,4×109/л, палочкоядерные – 10%, сегментоядерные – 77%, лимфоциты – 9%, моноциты – 3%, СОЭ – 63 мм/ч.
Биохимическое исследование крови: билирубин общий – 8,0 мкмоль/л, АЛТ – 76, АСТ – 76, общий белок – 63,0 г/л, креатинин – 191 мкмоль/л.
Общий анализ мочи – плотность 1016, белок не обнаружен, эритроциты – 0-1 в п/зр., лейкоциты – 4-6 в п/зр.
ИФА-тест на ВИЧ-инфекцию – выявлены антитела к ВИЧ.
Иммунологическое исследование субпопуляции лимфоцитов – резкое уменьшение Т-хелперов: CD3+CD4+ – 0,07×109/л (норма – 0,5-1,4×109/л) или 7,9% (норма – 33-52%); соотношение CD3+CD4+ / CD3+CD8+ – 0,12 (норма – 1,0-2,5).
Рентгенография органов грудной полости: интенсивные фокусы затенений в верхней доле правого легкого, усиление легочного рисунка по ячеистому типу в нижних долях, корни уплотнены, плохо дифференцируются. Синусы свободны. Купола диафрагмы четкие, ровные. Сердце обычной конфигурации.
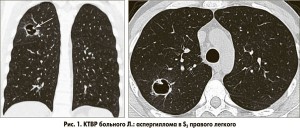
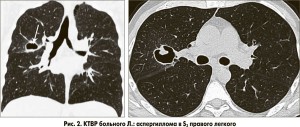
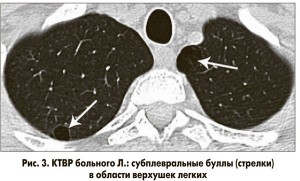
КТВР: в S2 правого легкого определяется полость размерами 2,6 см в диаметре, стенка полости умеренной толщины, имеет четкие контуры, внутри полости визуализируется небольшая плотная тень неопределенной формы, связанная со стенкой (рис. 1); в S3 правого легкого определяется аналогичная полость размерами 3 см в диаметре, связанная с корнем, с грибовидным плотным образованием, прилежащим к стенке полости (рис. 2); прилегающие к полостям участки паренхимы без существенных изменений; в области верхушек легких контурируются две тонкостенные полости (буллы) размерами 1-1,5 см (рис. 3). Заключение: аспергилломы в S2 и S3 правого легкого.
Элементов Aspergillus spp. при микроскопии мокроты не обнаружено.
Учитывая наличие высокоспецифичных КТ-признаков, больному установлен диагноз: аспергилломы в S2 и S3 правого легкого на фоне иммунодефицитного состояния. Клиническая семиотика была расценена как проявление острого трахеобронхита. После лечения аугментином, отхаркивающими средствами температура тела нормализовалась, кашель значительно уменьшился. АФТ не назначалась в связи с отсутствием признаков инвазивного поражения паренхимы легких. Пациент выписан с направлением в городской центр профилактики и борьбы со СПИД для решения вопроса о проведении антиретровирусной терапии.
Литература
1. Kousha M. Pulmonary aspergillosis: a clinical review / M. Kousha, R. Tadi, A.O. Soubani // Eur. Respir. Rev. – 2011. – Vol. 20. – P. 156-174.
2. Walsh T.J. Infectious Diseases Society of America. Treatment of aspergillosis: clinical practice guidelines of the Infectious Diseases Society of America / T.J. Walsh, E.J. Anaissic, D.W. Denning et al. // Clin. Infect. Dis. – 2008. – Vol. 46. – P. 327-360.
3. Климко Н.Н. Микозы легких / Н.Н. Климко, Н.В. Васильева // Пульмонология: Национальное руководство под ред. А.Г. Чучалина. – Москва: ГЭОТАР-Media, 2009. – С. 282-300.
4. Thompson G.R. III. Pulmonary aspergillosis: recent advances / G.R. Thompson III, T.F. Patterson // Semin. Respir. Crit. Care Med. – 2011. – Vol. 32. – P. 673-681.
5. Soubani A.O. The clinical spectrum of pulmonary aspergillosis / A.O. Soubani, P.H. Chandrasecar // Chest. – 2002. – Vol. 121. – P. 1988-1999.
6. Patterson K.C. Diagnosis and treatment of pulmonary aspergillosis syndromes / K.C. Patterson, M.E. Strek // Chest. – 2014. – Vol. 146. – P. 1358-1368.
7. Guinea J. Pulmonary aspergillosis in patients with chronic obstructive pulmonary disease: incidence, risk factors, and outcome / J. Guinea, M. Torres-Narbona, P. Gijon et al. // Cin. Microbiol. Infect. – 2010. – Vol. 16. – P. 870-877.
8. Gustot T. Invasive aspergillosis in patients with severe alcoholic hepatitis / T. Gustot, E. Maillart, M. Bocci et al. // Hepatol. – 2014. – Vol. 60. – P. 267-274.
9. De Pauw B. Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (FORTC/MSG) Consensus Group / B. De Pauw, T.J. Walsh, J.P. Donnelly et al. // Clin. Infect. Dis. – 2008. – Vol. 46. – P. 1813-1821.
10. Schweer K.E. Chronic pulmonary aspergillosis / K.E. Schweer, C. Bangard, K. Hekmat et al. // Mycoses. – 2014. – Vol. 57. – P. 257-270.
11. Nam H.S. Clinical characteristic and treatment outcomes of chronic necrotizing pulmonary aspergillosis: a review of 43 cases / H.S. Nam, K. Jeon, S.W. Um et al. // Int. J. Infect. Dis. – 2010. – Vol. 14. – P. e479-e482.
12. Lee S.H. Clinical manifestations and treatment outcomes of pulmonary aspergilloma / S.H. Lee, B.J. Lee, D.Y. Jung et al. // The Koresn J. of internal med. – 2004. – Vol. 19. – P. 38-42.
13. Adrizzo-Harris D.J. Pulmonary aspergilloma and AIDS. A comparison of HIV-infected and HIN-negative individuals / D.J. Adrizzo-Harris, T.J. Harkin, G. McGuinness et al. // Chest. – 1997. – Vol. 111. – P. 612-618.
14. Лискина И.В. Аспергиллома легкого / И.В. Лискина, С.Д. Кузовкова // Международный мед. журн. – 2011. – № 4. – С. 41-48.
15. Denning D.W. Global burden of allergic bronchopulmonary aspergillosis with asthma and its complication chronic pulmonary aspergillosis in adults / D.W. Denning, A. Pleuvry, D.C. Cole // Med. Mycol. – 2013. – Vol. 51. – P. 361-370.
16. Agarwal R. Allergic bronchopulmonary aspergillosis: lessons from 126 patients attending a chest clinic in north India / R. Agarwal, A. Khan, M. Gard et al. // Chest. – 2006. – Vol. 130. – P. 442-448.