25 січня, 2017
Особенности терапии рефрактерных форм лимфомы Ходжкина
 Успех лечения пациентов с лимфомой Ходжкина (ЛХ) зависит от ряда факторов, которые четко определены для больных с впервые установленным диагнозом, таких как: стадия и объем опухоли, наличие или отсутствие В-симптомов и экстралимфатических очагов, а также параметры крови (СОЭ) [1]. Для пациентов со стадиями 1А или 2А без факторов риска прогноз заболевания настолько хорош, что в настоящее время обсуждается возможность минимизировать химиотерапию, при этом поддерживая высокий процент излечения, так как вероятность смерти больных с наилучшим прогнозом выше от последствий терапии, чем от лимфомы. Согласно данным публикаций, около 10% пациентов с распространенными стадиями заболевания не достигают полной ремиссии в ходе терапии первой линии и от 20 до 30% ответивших больных будут иметь рецидив [2, 3]. Неудача первичной терапии значительно ухудшает прогноз. Выбор последующей терапии должен осуществляться с учетом прогностических факторов.
Успех лечения пациентов с лимфомой Ходжкина (ЛХ) зависит от ряда факторов, которые четко определены для больных с впервые установленным диагнозом, таких как: стадия и объем опухоли, наличие или отсутствие В-симптомов и экстралимфатических очагов, а также параметры крови (СОЭ) [1]. Для пациентов со стадиями 1А или 2А без факторов риска прогноз заболевания настолько хорош, что в настоящее время обсуждается возможность минимизировать химиотерапию, при этом поддерживая высокий процент излечения, так как вероятность смерти больных с наилучшим прогнозом выше от последствий терапии, чем от лимфомы. Согласно данным публикаций, около 10% пациентов с распространенными стадиями заболевания не достигают полной ремиссии в ходе терапии первой линии и от 20 до 30% ответивших больных будут иметь рецидив [2, 3]. Неудача первичной терапии значительно ухудшает прогноз. Выбор последующей терапии должен осуществляться с учетом прогностических факторов.
Прогностические факторы
Первично рефрактерные больные
Пациенты с первично рефрактерным течением, определяемым как отсутствие ответа, прогрессирование на фоне первичной терапии или в течение 90 дней после ее завершения и/или персистенция ПЭТ1-позитивной резидуальной массы (с использованием 5-балльной шкалы Deauville для интерпретации результатов ПЭТ-КТ2), составляют приблизительно 5% при локализованной опухоли и около 10% – при диссеминированной [4]. Прогноз у этих больных крайне неблагоприятный. При применении стандартной терапии шансы выжить составляют от 0 до 8% [5, 6]. Выживаемость чаще зависит от того, сможет ли пациент перенести интенсивную химиотерапию (ХТ) и аутологичную или аллогенную трансплантацию стволовых гемопоэтических клеток. По данным ретроспективного анализа базы данных Немецкой группы по изучению ЛХ (GHSG), проведенного для определения прогностических факторов и оценки результатов терапии у пациентов с первично прогрессирующим заболеванием, только в 34% (70 из 206) проанализированных случаев больные смогли получить высокодозовую химиотерапию (ВДХТ) с аутологичной трансплантацией стволовых гемопоэтических клеток (АТСГК) [7]. Пятилетняя выживаемость без прогрессирования (ВБП) у пациентов, перенесших ВДХТ с АТСГК, составила 31%, и общая выживаемость (ОВ) – 43%. При этом 5-летняя ВБП в группе в целом (у получивших и не получивших ВДХТ) была только 17%, а ОВ – 26%.
По результатам мультивариантного анализа низкий статус по шкале Карновского на момент прогрессирования, возраст >50 лет и невозможность достичь временной ремиссии в ходе сальвадж-терапии были значимыми прогностическими факторами для ОВ. При отсутствии этих факторов риска 5-летняя выживаемость составила 55% по сравнению с 0 при наличии всех трех прогностически неблагоприятных факторов. Плохое общее состояние, быстрое прогрессирование ЛХ, связанная с лечением токсичность, невозможность выполнить коллекцию стволовых гемопоэтических клеток (СГК) не позволяют большинству больных проходить ВДХТ.
Рецидивы ЛХ
Пациенты с рецидивом классической ЛХ имеют несколько лучший прогноз. До эры интенсивных реиндукционных режимов прогнозируемая 20-летняя выживаемость пациентов с ранним рецидивом (<12 мес после завершения первичной терапии) составляла 11%, а с поздним рецидивом (>12 мес после первичной терапии) – 22% [5]. Только 80% пациентов с поздним рецидивом достигнут второй ремиссии [5]. В большом ретроспективном анализе 422 пациентов с рецидивом ЛХ, проведенном GHSG, клиническими факторами плохой 5-летней выживаемости были: время до рецидива (3‑12 мес после завершения первичной терапии), стадия в рецидиве (III или IV) и анемия в рецидиве (<105 г/л у женщин и <120 г/л у мужчин) [8]. ВБП была 45, 32 и 18% у больных с 0, 1, 2 или 3 факторами риска соответственно. Причем все пациенты получили стандартные режимы сальвадж-терапии и ВДХТ с АТСГК. По данным ряда исследований, дополнительное прогностическое значение имеют наличие экстранодального очага [9, 10] и В-симптомов в рецидиве. Moskowitz и соавт. (2001) использовали 3-факторную шкалу: 1 – ранний рецидив, 2 – наличие экстранодального очага и 3 – В-симптомы в рецидиве. Все пациенты получили сальвадж-терапию по схеме ICE (ифосфамид, этопозид, карбоплатин), 2 цикла и ВДХТ с АТСГК. Пациенты с 0 или 1 неблагоприятным фактором имели бессобытийную выживаемость (БСВ) и ОВ 83 и 90% соответственно. Показатели БСВ и ОВ составили у пациентов с двумя факторами риска только 27 и 57% и с тремя факторами риска – 10 и 25% [10].
Резюмируя сказанное, можно сделать вывод, что клиническими факторами плохого прогноза перед сальвадж-терапией считают первичную химиорезистентность, ранний рецидив, стадию заболевания, наличие В-симптомов и клинический статус больного.
Ответ на сальвадж-терапию перед ВДХТ
Наличие рефрактерности к сальвадж-терапии предполагает крайне неблагоприятный прогноз [18, 19]. Так, в серии исследований с участием 494 пациентов, которым была выполнена ВДХТ с АТСГК, представленных Sureda и соавт. в 2001 году, состояние больных и число линий терапии до трансплантации являлись основными факторами прогноза. Прогноз у пациентов с полной ремиссией был существенно лучше по сравнению с больными, у которых оставалась визуализируемая опухоль. Пятилетняя БСВ у больных с полной ремиссией была 63,2%, а у пациентов с резидуальной опухолью перед ВДХТ – 32,2%. Пациенты с рефрактерным рецидивом и первично рефрактерным течением заболевания имели наихудшую выживаемость (26 и 13% соответственно). ОВ также зависела от ремиссионного статуса и числа линий терапии перед трансплантацией [20].
Ответ на терапию второй линии является в настоящее время одним из основных факторов отбора пациентов для ВДХТ.
Появление новых технологий функциональной визуализации позволило точнее оценивать статус заболевания и прогноз для пациента. Отсутствие метаболически активной опухоли по данным ПЭТ/КТ после сальвадж-терапии на сегодня считается хорошим прогностическим индикатором результатов ВДХТ с АТСГК с прогнозом 3-5-летней ВБП более 70% [21, 22, 23, 24]. Остаточное накопление опухолью радиофармпрепарата после проведенной сальвадж-терапии связано с худшим прогнозом ВДХТ, даже если трансплантация проводится пациентам, достигшим как минимум частичного ответа с учетом обычных КТ-критериев (25-30% 5-летняя ВБП). Таким образом, 55-60% больных с частичным ответом перед ВДХТ по данным КТ будут иметь ФДГ‑активную опухоль после одной линии сальвадж-терапии [22].
В 2012 г. были опубликованы результаты большого исследования II фазы, где оценивалась роль промежуточного ПЭТ-исследования у химиочувствительных больных с рецидивом или рефрактерным течением ЛХ. Пациенты, достигшие нормализации ПЭТ после двух циклов сальвадж-терапии по схеме ICE, получали ВДХТ с АТСГК. Пациенты, у которых после рестадирования сохранялась позитивная ПЭТ, получали дополнительно терапию по схеме GVD (гемцитабин, винорельбин и липосомальный доксорубицин), 2 цикла, и при отсутствии прогрессирования заболевания – ВДХТ с АТСГК. У 50% больных, получавших GVD, был достигнут полный метаболический ответ (ПЭТ-негативность). Выживаемость больных, у которых, по данным ПЭТ, наблюдалась полная ремиссия, составила более 80% как после одного, так и после двух проведенных сальвадж-режимов. Только 28,8% ПЭТ-позитивных больных имели длительную выживаемость. По мнению авторов, пациенты, не достигшие негативного ПЭТ-статуса после двух линий сальвадж-терапии, должны получать экспериментальное лечение, включая немиелоаблятивную аллогенную трансплантацию [25].
Рецидивы в зоне проведения лучевой терапии
Рецидив в зоне лучевой терапии перед ВДХТ также существенно влияет на выживаемость: только 22% пациентов с таким рецидивом не имели прогрессии по сравнению с 54% больных без рецидива в поле лучевой терапии [26].
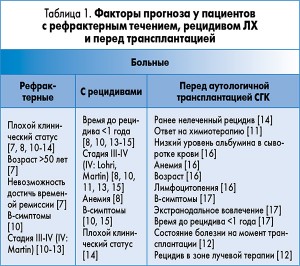
В таблице 1 представлены прогностические факторы, которые упоминаются в опубликованных литературных источниках, у пациентов с рефрактерным течением, рецидивом ЛХ и перед ВДХТ.
Таким образом, наличие остаточной опухоли после сальвадж-терапии, время до рецидива, продвинутая стадия и клинический статус больного считаются основными негативными прогностическими факторами перед ВДХТ. Выделяют и другие: экстранодулярное вовлечение, В-симптомы, рефрактерное заболевание, продолжительность первой ремиссии, проведенную ранее лучевую терапию и др.
Подходы к лечению
Роль стандартной терапии. Обычная ХТ практически не обладает куративным потенциалом при рефрактерном течении или раннем рецидиве ЛХ [5, 27]. Ее роль сводится к решению двух основных задач: достигнуть максимальной редукции опухоли перед ВДХТ/АТСГК и эффективно мобилизовать стволовые кроветворные клетки в периферическую кровь для их дальнейшей коллекции и использования после ВДХТ. Более того, обычная ХТ используется в лечении больных, которым не рекомендуется проведение ВДХТ ввиду возраста или наличия противопоказаний. В некоторых случаях очень позднего локализованного рецидива при условии отсутствия негативных факторов прогноза лечение может быть ограничено проведением стандартной химио- и/или лучевой терапии.
Так как состояние больного перед ВДХТ с АТСГК служит наиболее важным фактором конечного результата терапии, целью предтрансплантационной терапии является достижение ремиссионного статуса заболевания или минимально детектируемой опухоли без избыточной токсичности.
Преимущества аутологичной трансплантации перед стандартной ХТ. Преимущества ВДХТ с АТСГК перед стандартной терапией у пациентов с химиочувствительным рецидивом и рефрактерным заболеванием наиболее наглядно были продемонстрированы в исследованиях Британской группы по изучению лимфом и Европейской группы трансплантации крови и костного мозга (EBMT) [28, 29].
В первом исследовании пациенты получали стандартную терапию по схеме mini-BEAM или высокодозовый режим BEAM с АТСГК; актуариальная 3-летняя выживаемость была значительно лучше у пациентов, получивших ВДХТ (53 против 10%). В исследовании EBMT пациенты с рецидивом были рандомизированы в группы, получавшие 4 цикла mini-BEAM+dexamethasone (dexa-mini-BEAM) или 2 цикла dexa-mini-BEAM с последующей ВДХТ по схеме BEAM и АТСГК. Финальный анализ продемонстрировал значительно лучшую ВБП в группе BEAM+АТСГК (55 против 34%).
Был проведен и ряд других нерандомизированных исследований, сравнивавших обычную сальвадж-терапию и ВДХТ. Так, по опыту Стэндфордской группы [30], 4-летняя ВБП составила 52% в группе получивших трансплантацию и 19% в группе стандартной химиотерапии. Исследование French Transplant Registry [31] продемонстрировало 6-летнюю ВБП 25% у пациентов после трансплантации и 0 у тех, кто ее не получал. Благодаря выявлению в последние годы четкой тенденции к уменьшению смертности, связанной с трансплантацией, ВДХТ с АТСГК стала стандартом терапии больных с рецидивом или рефрактерным течением ЛХ. Аутотрансплантация является терапией выбора независимо от продолжительности первой ремиссии.
Результаты АТСГК при рефрактерном течении заболевания менее обнадеживающие. Данные терапии 64 химиорезистентных пациентов (достигнутый ответ меньше, чем частичная ремиссия) продемонстрировали 5-летнюю ВБП 17%, а ОВ – 31% [32].
Тандемная аутологичная трансплантация. Такая трансплантация на сегодняшний день считается экспериментальной, и ее роль пока не определена.
Роль аллогенной трансплантации. Рецидив заболевания – наиболее частая причина неудачного исхода АТСГК. Большинство рецидивов происходят в течение первого года после аутологичной трансплантации [33]. Медиана выживаемости после рецидива, как правило, менее 2 лет, и ответ на последующую сальвадж-терапию является самым важным фактором прогноза. Аллогенная трансплантация наряду с прямым противоопухолевым эффектом ХТ может обеспечить адаптивный иммунный ответ благодаря реакции «трансплантат против лимфомы». Число аллогенных трансплантаций при ЛХ в последние годы растет, но все еще остается относительно невысоким. В Европе в последние годы выполняется около 400 аллотрансплантаций в год. При этом летальность, связанная с трансплантацией, остается высокой (22-61%) и число выживших пациентов невелико [34‑36]. Факторы, прогнозирующие ответ на аллогенную трансплантацию, включают химиочувствительность и продолжительность ответа на аутологичную трансплантацию [37]. Трехлетняя ВБП после кондиционирующих режимов с редуцированной интенсивностью составляет около 30% [38, 39, 40]. С появлением новых препаратов – моноклональных антител против CD30 (брентуксимаб) и PD‑1-ингибиторов, таких как пембролизумаб и ниволумаб, – роль и время проведения аллогенной трансплантации требуют переосмысления.
Таким образом, часть пациентов с неудачным исходом аутологичной трансплантации могут иметь длительный ответ после проведения аллогенной трансплантации, несмотря на относительно высокую смертность и невысокий куративный потенциал. В случае если пациент из группы очень высокого риска молод и имеет совместимого родственного донора, приоритетом может быть выполнение аллогенной, а не аутологичной трансплантации.
Сальвадж-терапия
Сальвадж-терапия с последующей ВДХТ и аутологичной трансплантацией СГК на данный момент является стандартом терапии и может излечить около 50% пациентов [41].
Цель проведения терапии 2-й линии – максимальная редукция опухоли перед ВДХТ при отсутствии значимой органной токсичности, а также хорошая мобилизационная способность – возможность выполнения адекватной коллекции стволовых гемопоэтических клеток после курса терапии, то есть минимальная токсичность для стволовых кроветворных клеток.
На сегодняшний день существует ряд апробированных химиотерапевтических режимов, используемых для терапии пациентов с рецидивом или рефрактерным течением лимфомы Ходжкина [42, 43]. Основные из них суммированы в таблице 2. Общий ответ (полный и частичный ответ), ранее оцениваемый прежде всего по КТ, составляет от 70 (n=54) до 90% (n=88), из них полный ответ, по данным разных авторов, достигается у 20-55% больных. Так как рандомизированных исследований, сравнивающих эффективность режимов сальвадж-терапии, не проводилось, выбор терапии 2-й линии должен основываться на особенностях пациента (нарушение почечной функции, наличие нейропатии, риск развития энцефалопатии и т.д.), предшествовавшей терапии и возможностях отделений, где проводится терапия. Общепринятым является проведение 2-3 циклов сальвадж-режимов до оценки ответа на лечение. Учитывая соотношение риск/польза, проведение 4-го цикла может быть оправданным, если откладывается проведение ВДХТ.
Учитывая, что большинство пациентов получали ранее доксорубицин, использование потенциально кардиотоксичных препаратов группы антрациклинов невозможно, если уже достигнута кумулятивная доза 400 мг/м2. Особенно это актуально, если проводилась лучевая терапия на средостение. Химиотерапевтические сальвадж-режимы могут условно быть поделены на содержащие стандартные комбинации химиопрепаратов (mini-BEAM и dexa-BEAM) [28, 29, 44, 45], платиносодержащие комбинации (ESHAP, DHAP, ASHAP, DHAOx) [46-49], режимы на основе ифосфамида и этопозида (MINE, ICE, IVE) [10, 14, 50, 51] и гемцитабина (GVD, GDP и IGEV) [52, 53, 54].
В случае недостаточного ответа на первую сальвадж-терапию (не достигнут хотя бы частичный ответ) пациенту может быть предложено проведение второго курса с использованием препаратов, не обладающих перекрестной резистентностью. Так, по данным британских авторов, 19 пациентам с недостаточным ответом на первый сальвадж-режим – ESHAP (15, т.е. 79%, имели прогрессирование заболевания и 4, т.е. 21%, – стабильное заболевание) был проведен второй сальвадж-режим – mini-BEAM. Из них 12 (63%) достигли ответа: полного – 47% и частичного – 16%. Из этих 12 больных 10 была проведена трансплантация: восьмерым – аллогенная, двум – аутологичная. Один пациент из этой группы, не ответивший на mini-BEAM, ответил в дальнейшем на монотерапию гемцитабином [57].
Однако интенсивная ХТ перед ВДХТ cвязана со значительной токсичностью, прежде всего иммуносупрессией; возможными повторными эпизодами фебрильной нейтропении; необходимостью трансфузий продуктов крови, введения колониестимулирующих факторов, колонизации пациентов рефрактерной микрофлорой, а также избыточной органной токсичностью, что может стать причиной развития в посттрансплантационном периоде большего числа осложнений, а в некоторых случаях может препятствовать проведению ВДХТ. С другой стороны, интенсивное химиотерапевтическое лечение может не позволить провести адекватную коллекцию гемопоэтических стволовых клеток для ВДХТ/АТСГК. Процент неудачных коллекций после проведения сальвадж-терапии составляет около 15% при отсутствии плериксафора [58].
Доказанным является факт, что лучшие результаты ВДХТ и АТСГК наблюдаются у пациентов с полным анатомическим и/или метаболическим ответом на сальвадж-терапию.
Таргетные препараты
Успехи в понимании биологии опухолевого процесса при ЛХ и идентификация новых таргетных препаратов позволили улучшить терапевтические возможности и снизить токсичность терапии. В последние годы активно изучаются препараты, направленные на поверхностные клеточные антигены, онкогенную зависимость клеток Березовского – Штернберга от активации внутриклеточных сигнальных путей и индукцию иммунного ответа через модуляцию микроокружения (моноклональные антитела, ингибиторы активности гистондеацетилаз, ингибиторы PI3K/Akt/mTOR, леналидомид, ингибиторы протеасом) [59, 60, 61].
Некоторые из этих препаратов продемонстрировали значительную клиническую активность (леналидомид, эверолимус, панобиностат) [62, 63, 64]. Исследования Younes и соавт. (2012) показали эффективность ингибитора гистондеацетилаз панобиностата в режиме монотерапии у пациентов с рецидивом ЛХ после ВДХТ с АТСГК [64]. В этом исследовании редукция опухоли наблюдалась у 74% пациентов, а также 27% пациентов достигли полной или частичной ремиссии. Средняя продолжительность ответа составила 6,9 мес, а общая выживаемость в течение 1 года – 78%.
К позитивным изменениям привело добавление новых препаратов к традиционным режимам ХТ. Результаты клинического исследования I фазы с использованием комбинации панобиностата и режима ICE были доложены на съезде Американского общества гематологов (АSH) в 2013 году [65]. Полной ремиссии достигли 15 из 21 пациента (71%), 17 пациентов смогли получить ВДХТ с АТСГК. Также добавление бортезомиба к схеме ICE продемонстрировало значительную частоту достижения ремиссий и хорошую переносимость [66].
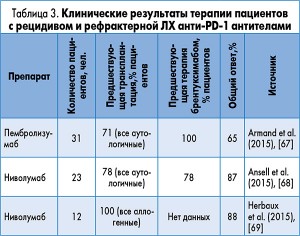
Наибольшую активность и наилучшие результаты продемонстрировали многообещающие препараты – брентуксимаб3, ниволумаб и пембролизумаб4. PD‑1 сигнальный путь является потенциальным способом «уклонения» опухоли от иммунного ответа и может быть мишенью для таргетной терапии. Блокаторы PD‑1 успешно применяются в лечении солидных опухолей и проходят испытания при гематологических заболеваниях. В таблице 3 представлены результаты недавно опубликованных клинических исследований с использованием анти-PD‑1 (рецептора программированной клеточной гибели‑1) антител – ниволумаба и пембролизумаба – у пациентов с рецидивом и рефрактерной ЛХ.
Классическая лимфома Ходжкина (кЛХ) характеризуется уникальным PD‑1-рецепторным профилем, что делает клетки опухоли особенно уязвимыми к данной таргетной терапии. Вследствие вышеперечисленного пациенты с кЛХ были включены в продолжающееся мультицентровое открытое исследование Ib фазы по изучению эффективности моноклонального антитела – пембролизумаба (МК‑3475) – у пациентов с гематологическими опухолями (KEYNOTE‑013; ClinicalTrials.gov, NCT01953692). Общий ответ у 31 пациента составил 65% (5 пациентов, т.е. 16%, достигли полного ответа, 15, т.е. 48%, – частичного и 7, т.е. 23%, сохраняли стабильное заболевание). ВБП была 69% [67].
Первые результаты применения ниволумаба были опубликованы в 2015 г. в The New England Journal of Medicine. Большинство больных получили ранее брентуксимаб и АТСГК. Ответ наблюдался у 87% из 23 включенных в исследование пациентов: 17% полных ответов и 70% – частичных. У оставшихся 3 пациентов достигнута стабилизация заболевания. ВБП через 24 недели составила 86% [68]. Более того, ниволумаб продемонстрировал свою эффективность у пациентов и после неудачного исхода аллогенной трансплантации [69]. Таким образом, терапия анти-PD‑1 антителами подтвердила свою безопасность, хорошую переносимость и клинический эффект у пациентов с «тяжело предлеченной» кЛХ.
В последние годы препаратом, изменившим привычные терапевтические подходы, стал брентуксимаб ведотин. 19 августа 2011 г. Управление по контролю качества пищевых продуктов и лекарственных препаратов (FDA) США одобрило брентуксимаб ведотин для лечения CD30-положительной ЛХ и одной из редких форм Т-клеточной неходжкинской лимфомы – системной анапластической крупноклеточной лимфомы [70]. Брентуксимаб ведотин стал первым новым препаратом для лечения ХЛ, утвержденным FDA с 1977 г., и вообще первым препаратом, одобренным специально для лечения системной анапластической крупноклеточной лимфомы [70]. Показания препарата были сфокусированы на пациентах с ЛХ в случае прогрессирования заболевания после АТСГК или проведенных 2 линий химиотерапии, а также системной анапластической крупноклеточной лимфомы при неэффективности 1-й линии химиотерапии.
В октябре 2012 г. брентуксимаб ведотин был одобрен Европейским агентством по лекарственным средствам (EMA). Такое решение было принято в результате тщательной оценки рисков и преимуществ препарата, а также на основании высоких показателей ответной реакции на лечение им [71]. В 2016 г. FDA и EMA одобрили расширение показаний к применению брентуксимаба ведотина фармацевтической компании Takeda: препарат показан для лечения взрослых пациентов с CD30-положительной ЛХ с повышенным риском рецидива или прогрессирования после АТСГК3. Основой для одобрения стали результаты клинического исследования AETHERA III фазы. Прогнозируемая 2-летняя ВБП среди пациентов, получавших брентуксимаб сразу после АТСГК, составила 65%, тогда как в группе плацебо этот показатель был равен 45% [72].
Брентуксимаб ведотин представляет собой анти-CD30 моноклональное антитело, которое связывается с рецептором CD30, экспрессируемым большинством клеток кЛХ, соединенное с цитостатическим препаратом монометилом ауристатином Е – веществом, разрушающим микротубулин в клетке. На данный момент препарат не зарегистрирован для применения в 1-й линии или в комбинации с другими препаратами для терапии ЛХ. Тем не менее брентуксимаб ведотин продемонстрировал значительный успех в терапии как рефрактерных форм, так и в 1-й линии терапии [73, 74].
Результаты более чем 45 продолжающихся клинических исследований применения брентуксимаба ведотина в монорежиме и комбинированном режиме у пациентов с ЛХ были представлены на 57-м съезде Американского общества гематологов (ASH) в декабре 2015 г., а позже по ним были опубликованы обновленные данные. Активные исследования III фазы с применением брентуксимаба ведотина3 в 1-й линии терапии продолжаются как среди пациентов с кЛХ (ECHELON‑1) и со зрелыми T-клеточными лимфомами (ECHELON‑2), так и с участием больных со многими другими экспрессирующими CD30 опухолями.
Брентуксимаб в монотерапии. Результаты базисного клинического исследования II фазы – монотерапии брентуксимабом ведотином у больных с рецидивом или рефрактерным течением кЛХ – были представлены в июне 2012 г. в журнале Blood [75]. Это первое исследование, получившее подтверждение длительной ремиссии у пациентов, у которых все остальные терапевтические опции были исчерпаны. Эффективность брентуксимаба ведотина оценивалась в режиме монотерапии у 102 пациентов с кЛХ, ранее получавших ВДХТ с АТСГК. Пациенты перед включением в исследование получали в среднем более трех ХТ-режимов. В данном исследовании было отмечено уменьшение опухолевой массы у 94% пациентов, частота общего ответа составила 75% (95% доверительный интервал 64,9-82,6), 34% пациентов достигли полного ответа [75].
После 5-летнего периода наблюдений финальные результаты продемонстрировали медиану ОВ 40,5 мес и ВБП 9,3 мес. Ожидаемые 5-летние показатели ОВ и ВБП были 41 и 22% соответственно. Из 102 пролеченных больных 34 (33%) достигли полной ремиссии, медиана ОВ и ВБП достигнута не была. У достигших полного ответа ожидаемая 5-летняя ОВ была 64% и вероятность 5-летней ВБП – 52%. Тринадцать из 34 пациентов остаются в ремиссии более 5 лет. Из них 9 не получали больше терапии, а 4 получили консолидирующую аллогенную трансплантацию. Эти данные 5-летнего наблюдения за больными продемонстрировали, что часть пациентов с рецидивом или рефрактерным течением кЛХ, которые достигли полного ответа на монотерапию брентуксимабом ведотином, имели длительный контроль над заболеванием и потенциально могут быть излечены [76].
Брентуксимаб после трансплантации3. Исследование III фазы AETHERA было предложено для оценки потенциала брентуксимаба ведотина у пациентов с высоким риском прогрессирования заболевания после ВДХТ. Пациенты получали терапию этим препаратом или плацебо каждые 3 недели в течение 1 года (всего 16 циклов) после АТСГК. Всего в исследование было включено 329 пациентов: 165 получали брентуксимаб ведотин и 164 – плацебо [77].
Обновленные данные по эффективности и безопасности подтвердили полученные результаты: пациенты, получавшие брентуксимаб ведотин после АТСГК, имели 3-летнюю ВБП 61% в сравнении с 43% в группе плацебо. Медиана ВБП в группе брентуксимаба ведотина не была достигнута, при этом в группе плацебо составила 15,8 мес.
Анализ эффективности терапии в зависимости от факторов риска продемонстрировал, что максимальную пользу от брентуксимаба получили пациенты с большим количеством факторов риска. Свободный от прогрессирования интервал у пациентов из группы брентуксимаба ведотина был у тех, которые получали этот препарат дольше. В группе брентуксимаба ведотина 112 (67%) пациентов имели периферическую сенсорную нейропатию, из них у 88% наблюдалось улучшение или исчезновение ее симптомов, а у 66% состояние полностью разрешилось. Пациенты продолжают наблюдение. Финальная оценка эффективности запланирована на 2020 год.
Комбинированная терапия. Промежуточный анализ результатов исследования II фазы комбинированной терапии брентуксимабом ведотином3 с дакарбазином или бендамустином у пациентов с кЛХ >60 лет, не получавших ранее терапию, представил Ch. Yasenchak (США). Результаты комбинированной терапии были представлены у 22 больных из группы дакарбазина и у 20 больных в группе бендамустина. Средний возраст больных в группе дакарбазина был 69 лет и 75 лет в группе комбинации с бендамустином. Минимум 70% больных имели III-IV стадию заболевания на момент диагностики и большинство – значительную сопутствующую патологию.
В группе пациентов, получавших комбинацию брентуксимаба ведотина и дакарбазина, у всех 100% участников удалось получить объективный ответ, при этом 14 (67%) достигли полной ремиссии и 7 (33%) – частичной. Медиана наблюдения составила 13,4 мес, а 6-месячная ВБП – 95%, на 9 мес – 89% и на 12 мес – 66%. В группе комбинированной терапии с бендамустином все 16 доступных для анализа больных имели объективный ответ, включая 13 пациентов (81%) с полной ремиссией и 3 (19%) – с частичной. Время наблюдения было слишком коротким для оценки выживаемости.
Наиболее частыми побочными эффектами, которые наблюдались у 25% больных, были: периферическая сенсорная нейропатия (77%), запоры (45%), слабость и тошнота (по 41%), боли в суставах и периферические отеки (по 32%) [78].
Таким образом, брентуксимаб ведотин представляет собой эффективный вариант терапии с благоприятным профилем безопасности, который показан для лечения взрослых пациентов с рецидивирующей или рефрактерной формой CD30-положительной ЛХ: после АТСГК или после хотя бы 2 предшествующих линий терапии, если АТСГК или полихимиотерапия не могут быть проведены. Препарат подтвердил свою эффективность3 как после АТСГК с целью уменьшения риска рецидива у больных ЛХ из группы повышенного риска, так и в случае рецидива или рефрактерного течения ЛХ перед проведением АТСГК или аллогенной ТСГК. Более раннее включение брентуксимаба в схемы терапии позволит улучшить результаты лечения и снизить ее токсичность.
Опыт Киевского центра трансплантации костного мозга
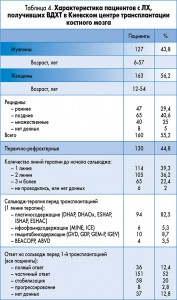
С 30 сентября 2000 г. по 1 октября 2016 г. в Киевском центре трансплантации костного мозга выполнено 305 трансплантаций гемопоэтических клеток 290 пациентам с рецидивом или рефрактерным течением ЛХ. Из них 290 первичных аутологичных трансплантаций, 9 тандемных, 3 повторных и одна аллогенная (после аутологичной). Характеристика пациентов представлена в таблице 4.
На 1 октября 2016 г. живы 198 пациентов, умерли 76, 16 потеряны для наблюдения. Пятилетняя бессобытийная выживаемость составила 65% и ОВ – 74%. Статистическая обработка данных при подсчете показателей не проводилась, не учтены пациенты, вышедшие из-под наблюдения. Анализ по подгруппам не проводился. Основная причина смерти – рецидив/прогрессирование основного заболевания.
Заключение
Стандартным лечением пациентов с рецидивом или рефрактерным течением ЛХ является проведение сальвадж-терапии с последующей ВДХТ и АТСГК. Достижение и поддержание полной ремиссии до трансплантации является основным фактором благоприятного прогноза и длительной выживаемости. Использование новых препаратов в предтрансплантационной сальвадж-терапии, особенно в группе высокого риска, позволяет значительно уменьшить токсичность проводимого лечения и увеличить шансы больных на выздоровление.
1 ПЭТ – позитронно-эмиссионная томография.
2 КТ – компьютерная томография.
3 В Украине брентуксимаб ведотин (ИНН) зарегистрирован для лечения взрослых пациентов с рецидивирующей или рефрактерной формой CD30-положительной ЛХ: после АТСГК; после хотя бы 2 предшествующих линий терапии, если АТСГК или полихимиотерапия не являются целесообразными; а также для лечения взрослых пациентов с рецидивирующей или рефрактерной системной анапластической крупноклеточной лимфомой в рекомендуемой дозе 1,8 мг/кг массы тела в виде внутривенной инфузии по 30 мин каждые 3 недели (в случае стабилизации заболевания или улучшения состояния проходят от 8 до 16 циклов лечения). Для более детальной информации см. инструкцию по медицинскому применению.
4 Препараты ниволумаб и пембролизумаб не зарегистрированы в Украине для терапии ЛХ.
Литература
1. Hasenclever D., Diehl V. A prognostic score for advanced Hodgkin’s disease. International Prognostic Factors Project on Advanced Hodgkin’s Disease. N Engl J Med. 1998 Nov 19; 339(21): 1506-14.
2. Armitage J.O. Early-stage Hodgkin’s lymphoma. N Engl J Med. 2010; 363(7): 653-662.
3. Kuruvilla J. Standard therapy of advanced Hodgkinlymphoma. Hematology Am Soc Hematol Educ Program. 2009; 497-506.
4. Josting A., Rudolph C., Mapara M. et al. Cologne high-dose sequential chemotherapy in relapsed and refractory Hodgkin lymphoma: results of a large multicenter study of the German Hodgkin Lymphoma Study Group (GHSG). AnnOncol. 2005; 16(1): 116-123.
5. Longo D.L., Duffey P.L., Young R.C., Hubbard S.M., Ihde D.C., Glatstein E., Phares J.C., Jaffe E.S., Urba W.J. & DeVita V.T., Jr. Conventional-dose salvage combination chemotherapy in patients relapsing with Hodgkin’s disease after combination chemotherapy: the low probability for cure. J Clin Oncol. 1992; 10: 210-218.
6. Bonfante V., Santero A., Viviani S., Devizzi L., Balzarotti M., Sonciani F., Zanini M., Valagussa P., Bonnadonna G. Outcome of patients with Hodgkin’s disease failing after primary MOPP-ABVD. J Clin Oncol. 1997; 15: 528–34.
7. Josting A., Rueffer U., Franklin J., Sieber M., Diehl V., Engert A. Prognostic factors and treatment outcome in primary progressive Hodgkin lymphoma: a report from the German Hodgkin Lymphoma Study Group. Blood. 2000 Aug 15; 96(4): 1280-6.
8. Josting A., Franklin J., May M. et al. New prognostic score based on treatment outcome of patients with relapsed Hodgkin’s lymphoma registered in the database of the German Hodgkin’s lymphoma study group. J Clin Oncol. 2002; 20(1): 221-230.
9. Brice P., Bouabdallah R., Moreau P. et al. Prognostic factors for survival after high-dose therapy and autologous stem cell transplantation for patients with relapsing Hodgkin’s disease: analysis of 280 patients from the French registry. Societe Francaise de Greffe de Moelle. Bone Marrow Transplant. 1997; 20: 21-26.
10. Moskowitz C.H., Nimer S.D., Zelenetz A.D. et al. A 2-step comprehensive high-dose chemoradiotherapy second-line program for relapsed and refractory Hodgkin disease: analysis by intent to treat and development of a prognostic model. Blood. 2001; 97(3): 616-623.
11. Martin A., Fernandez-Jimenez M.C., Caballero M.D. et al. Long-term follow-up in patients treated with Mini-BEAM as salvage therapy for relapsed or refractory Hodgkin’s disease. Br J Haematol. 2001; 113(1): 161-171.
12. Crump M., Smith A.M., Brandwein J. et al. High-dose etoposide and melphalan, and autologous bone marrow transplantation for patients with advanced Hodgkin’s disease: importance of disease status at transplant. J Clin Oncol. 1993; 11(4): 704-711.
13. Brice P., Bastion Y., Divine M. et al. Analysis of prognostic factors after the first relapse of Hodgkin’s disease in 187 patients. Cancer. 1996; 78(6): 1293-1299.
14. Ferme C., Bastion Y., Lepage E. et al. The MINE regimen as intensive salvage chemotherapy for relapsed and refractory Hodgkin’s disease. Ann Oncol. 1995; 6(6): 543-549.
15. Lohri A., Barnett M., Fairey R.N. et al. Outcome of treatment of first relapse of Hodgkin’s disease after primary chemotherapy: identification of risk factors from the British Columbia experience 1970 to 1988. Blood. 1991; 77(10): 2292-2298.
16. Bierman P.J., Lynch J.C., Bociek R.G. et al. The International Prognostic Factors Project score for advanced Hodgkin’s disease is useful for predicting outcome of autologous hematopoietic stem cell transplantation. Ann Oncol. 2002; 13(9): 1370-1377.
17. Reece D.E., Barnett M.J., Shepherd J.D. et al. High-dose cyclophosphamide, carmustine (BCNU), and etoposide (VP16-213) with or without cisplatin (CBV +/− P) and autologous transplantation for patients with Hodgkin’s disease who fail to enter a complete remission after combination chemotherapy. Blood. 1995; 86(2): 451-456.
18. Jagannath S., Armitage J.O., Dicke K.A. et al. Prognostic factors for response and survival after high-dose cyclophosphamide, carmustine, and etoposide with autologous bone marrow transplantation for relapsed Hodgkin’s disease. J Clin Oncol. 1989; 7:179-185.
19. Yahalom J., Gulati S.C., Toia M. et al. Accelerated hyperfractionated total-lymphoid irradiation, high-dose chemotherapy, and autologous bone marrow transplantation for refractory and relapsing patients with Hodgkin’s disease. J Clin Oncol. 1993; 11: 1062-1070.
20. Sureda A., Arranz R., Iriondo A., Carreras E., Lahuerta J.J., Garcia-Conde J., Jarque I., Caballero M.D., Ferra C., Lopez A., Garcia-Larana J., Cabrera R., Carrera D., Ruiz-Romero M.D., Leon A., Rifon J., Diaz-Mediavilla J., Mataix R., Morey M., Moraleda J.M., Altes A., Lopez-Guillermo A., de la Serna J., Fernandez-Ranada J.M., Sierra J., Conde E.; Grupo Espanol de Linformas / Transplante Autologo de Medula Osea Spanish Cooperative Group Autologous stem-cell transplantation for Hodgkin’s disease: results and prognostic factors in 494 patients from the Grupo Espanol de Linfomas / Transplante Autologo de Medula Osea Spanish Cooperative Group. J Clin Oncol. 2001 Mar 1; 19(5): 1395-404.
21. Jabbour E., Hosing C., Ayers G. et al. Pretransplant positive positron emission tomography/gallium scans predict poor outcome in patients with recurrent/refractory Hodgkin lymphoma. Cancer. 2007; 109: 2481-2489.
22. Moskowitz A.J., Yahalom J., Kewalramani T. et al. Pretransplantation functional imaging predicts outcome following autologous stem cell transplantation for relapsed and refractory Hodgkin lymphoma. Blood. 2010; 116: 4934-4937.
23. Smeltzer J.P., Cashen A.F., Zhang Q. et al. Prognostic significance of FDG-PET in relapsed or refractory classical Hodgkin lymphoma treated with standard salvage chemotherapy and autologous stem cell transplantation. Biol Blood Marrow Transplant. 2011; 17: 1646-1652.
24. Thomson K.J., Kayani I., Ardeshna K. et al. A response-adjusted PET-based transplantation strategy in primary resistant and relapsed Hodgkin Lymphoma. Leukemia. 2013; 27: 1419-1422.
25. Moskowitz C.H., Matasar M.J., Zelenetz A.D. et al. Normalization of pre-ASCT, FDG-PET imaging with second-line, non-cross-resistant, chemotherapy programs improves event-free survival in patients with Hodgkin lymphoma. Blood. 2012; 119(7): 1665-1670.
26. Crump M., Smith A.M., Brandwein J. et al. High-dose etoposide and melphalan, and autologous bone marrow transplantation for patients with advanced Hodgkin’s disease: importance of disease status at transplant. J Clin Oncol. 1993; 11(4): 704-711.
27. Brusamolino E., Orlandi E., Canevari A., Morra E., Castelli G., Alessandrino E.P. et al. Results of CAV regimen (CCNU, melphalan, and VP-16) as third-line salvage therapy for Hodgkin’s disease. Ann Oncol. 1994; 5: 427-32.
28. Linch D.C., Winfield D., Goldstone A.H., Moir D., Hancock B., McMillan A. et al. Dose intensificationwith autologous bone marrow transplantation in relapsed and resistant Hodgkin’s disease. Results of a BNLI randomized trial. Lancet. 1993; 341: 1051-4.
29. Schmitz N., Pfistner B., Sextro M., Sieber M., Carella A.M., Haenel M. et al. Aggressive conventional chemotherapy compared with high-dose chemotherapy with autologous hemopoietic stem-cell transplantation for relapsed chemosensitive Hodgkin’s disease: a randomised trial. Lancet. 2002; 359: 2065-71.
30. Yuen A.R., Rosenberg S.A., Hoppe R.T., Halpern J.D., Horning J.S. Comparison between conventional salvage therapy and high-dose therapy with autografting for recurrent or refractory Hodgkin’s disease. Blood. 1997; 89: 814-22.
31. Andre M., Henry-Amar M., Pico J.L., Brice P., Didier B., Kuentz M. et al. Comparison of high-dose therapy and autologous stem cell transplantation with conventional therapy for Hodgkin’s disease induction failure: A case-control study. J Clin Oncol. 1999; 17: 222-9.
32. Gopal A.K., Metcalfe T.L., Gooley T.A., Pagel J.M., Petersdorf S.H., Bensinger W.I., Holmberg L., Maloney D.G., Press O.W. High-dose therapy and autologous stem cell transplantation for chemoresistant Hodgkin lymphoma: the Seattle experience. Cancer. 2008 Sep 15; 113(6): 1344-50.
33. Mauch P.M., Armitage J.O., Diehl V., Hoppe R.T., Weiss L.M., Goldstone A.H., Carella A.M., Schmitz N., Philips G., Bierman P.G. Role of bone marrow transplantation in Hodgkin’s Disease. Hodgkin’s Disease (Еd.) Mauch P.M., Armitage J.O., Diehl V., Hoppe R.T., Weiss L.M. (Еds) Lippincott Williams and Wilkins. 1999; 521-30.
34. Anderson J.E., Litzow M.R., Appelbaum F.R., Schoch G., Fisher L.D., Buckner C.D. et al. Allogeneic, syngeneic, and autologous marrow transplantation for Hodgkin’s disease: The 21- year Seattle experience. J Clin Oncol. 1993; 11: 2342-50.
35. Milpied N., Fielding A.K., Pearce R.M., Ernst P., Goldstone A.H. Allogeneic bone marrow transplant is not better than autologous transplant for patients with relapsed Hodgkin’s disease. European Group for Blood and Bone Marrow Transplantation. J Clin Oncol. 1996; 14: 1291-6.
36. Gajewski J.L., Phillips G.L., Sobocinski K.A., Armitage J.O., Gale R.P., Champlin R.E. et al. Bone marrow transplants from HLA identical siblings in advanced Hodgkin’s disease. J Clin Oncol. 1996; 14: 572-8.
37. Alvarez I., Sureda A., Caballero M.D., Urbano-Ispizua A., Ribera J.M., Canales M., Garcia-Conde J., Sanz G., Arranz R., Bernal M.T., de la Serna J., Diez J.L., Moraleda J.M., Rubio-Felix D., Xicoy B., Martinez C., Mateos M.V., Sierra J. Nonmyeloablative stem cell transplantation is an effective therapy for refractory or relapsed hodgkin lymphoma: results of a spanish prospective cooperative protocol. Biol Blood Marrow Transplant. 2006 Feb; 12(2): 172-83
38. Robinson S.P., Sureda A., Canals C., Russell N., Caballero D., Bacigalupo A., Iriondo A., Cook G., Pettitt A., Socie G., Bonifazi F., Bosi A., Michallet M., Liakopoulou E., Maertens J., Passweg J., Clarke F., Martino R., Schmitz N. Reduced intensity conditioning allogeneic stem cell transplantation for Hodgkin’s lymphoma: identification of prognostic factors predicting outcome. Haematol. 2009 Feb; 94(2): 230-238.
39. Marcais A., Porcher R., Robin M., Mohty M., Michalet M., Blaise D., Tabrizi R., Clement L., Ceballos P., Daguindau E., Bilger K., Dhedin N., Lapusan S., Bay J.O., Pautas C., Garban F., Ifrah N., Guillerm G., Contentin N., Bourhis J.H., Yakoub Agha I., Bernard M., Cornillon J., Milpied N. Impact of disease status and stem cell source on the results of reduced intensity conditioning transplant for Hodgkin’s lymphoma: a retrospective study from the French Society of Bone Marrow Transplantation and Cellular Therapy (SFGM-TC). Haematol. 2013 Sep; 98(9): 1467-75.
40. Kako S., Izutsu K., Kato K., Kim S.W., Mori T., Fukuda T., Kobayashi N., Taji H., Hashimoto H., Kondo T., Sakamaki H., Morishima Y., Kato K., Suzuki R., Suzumiya J. Adult Lymphoma Working Group of the Japanese Society for Hematopoietic Cell Transplantation. The role of hematopoietic stem cell transplantation for relapsed and refractory Hodgkin lymphoma. Am J Hematol. 2015 Feb; 90(2): 132-8.
41. Majhail N.S., Weisdorf D.J., Defor T.E. et al. Long-term results of autologous stem cell transplantation for primary refractory or relapsed Hodgkin’s lymphoma. Biol Blood Marrow Transplant. 2006; 12(10), 1065-1072.
42. Kuruvilla J., Keating A., Crump M. How I treat relapsed and refractory Hodgkin lymphoma. Blood. 2011; 117(16): 4208-17.
43. Mendler J.H., Friedberg J.W. Salvage therapy in Hodgkin’s lymphoma. The Oncologist. 2009; 14(4): 425-32.
44. Martin A., Fernandez-Jimenez M.C., Caballero M.D. et al. Long-term follow-up in patients treated with Mini-BEAM as salvage therapy for relapsed or refractory Hodgkin’s disease. Br J Haematol. 2001; 113(1): 161-171.
45. Colwill R., Crump M., Couture F. et al. Mini-BEAM as salvage therapy for relapsed or refractory Hodgkin’s disease before intensive therapy and autologous bone marrow transplantation. J Clin Oncol. 1995; 13(2): 396-402.
46. Rodriguez J., Rodriguez M.A., Fayad L. et al. ASHAP: a regimen for cytoreduction of refractory or recurrent Hodgkin’s disease. Blood. 1999; 93(11): 3632-3636.
47. Aparicio J., Segura A., Garcera S. et al. ESHAP is an active regimen for relapsing Hodgkin’s disease. Ann Oncol. 1999; 10(5): 593-595.
48. Josting A., Rudolph C., Reiser M., Mapara M., Sieber M., Kirchner H.H., Dоrken B., Hossfeld D.K., Diehl V., Engert A. Time-intensified dexamethasone/cisplatin/cytarabine: an effective salvage therapy with low toxicity in patients with relapsed and refractory Hodgkin’s disease. Ann Oncol. 2002 Oct; 13(10): 1628-35.
49. Rigacci L., Fabbri A., Puccini B., Chitarrelli I., Chiappella A., Vitolo U., Levis A., Lauria F., Bosi A. Oxaliplatin-based chemotherapy (dexamethasone, high-dose cytarabine, and oxaliplatin)±rituximab is an effective salvage regimen in patients with relapsed or refractory lymphoma. Cancer. 2010 Oct 1; 116(19): 4573-9.
50. Proctor S.J., Taylor P.R., Angus B., Wood K., Lennard A.L., Lucraft H., Carey P.J., Stark A., Iqbal A., Haynes A., Russel N., Leonard R.C., Culligan D., Conn J., Jackson G.H. High-dose ifosfamide in combination with etoposide and epirubicin (IVE) in the treatment of relapsed/refractory Hodgkin’s disease and non-Hodgkin’s lymphoma: a report on toxicity and efficacy. Eur J Haematol Suppl. 2001 Jul; 64: 28-32.
51. Sibon D., Ertault M., Al Nawakil C., de Bazelaire C., Franchi P., Briere J., de Kerviler E., Beranger N., Thieblemont C., Brice P. Combined ifosfamide, etoposide and oxalipatin chemotherapy, a low-toxicity regimen for first-relapsed or refractory Hodgkin lymphoma after ABVD/EBVP: a prospective monocentre study on 34 patients. British Journal of Haematol. 2011; 153: 191-198.
52. Bartlett N.L., Niedzwiecki D., Johnson J.L., Friedberg J.W., Johnson K.B., van Besien K., Zelenetz A.D., Cheson B.D., Canellos G.P.; Cancer Leukemia Group B. Gemcitabine, vinorelbine, and pegylated liposomal doxorubicin (GVD), a salvage regimen in relapsed Hodgkin’s lymphoma: CALGB 59804. Ann Oncol. 2007 Jun; 18(6): 1071-9. Epub 2007 Apr 10.
53. Baetz T., Belch A., Couban S. et al. Gemcitabine, dexamethasone and cisplatin is an active and nontoxic chemotherapy regimen in relapsed or refractory Hodgkin’s disease: a phase II study by the National Cancer Institute of Canada Clinical Trials Group. Ann Oncol. 2003; 14: 1762-1767.
54. Santoro A., Magagnoli M., Spina M., Pinotti G., Siracusano L., Michieli M., Nozza A., Sarina B., Morenghi E., Castagna L., Tirelli U., Balzarotti M. Ifosfamide, gemcitabine, and vinorelbine: a new induction regimen for refractory and relapsed Hodgkin’s lymphoma. Haematol. 2007 Jan; 92: 35-41.
55. Chau I. et al. Gemcitabine, cisplatin and methylprednisolone chemotherapy (GEM-P) is an effective regimen in patients with poor prognostic primary progressive or multiply relapsed Hodgkin’s and non-Hodgkin’s lymphoma. Br J Haematol. 2003; 120: 970-977.
56. Moskowitz A.J., Hamlin P.A. Jr., Perales M.A. et al. Phase II study of bendamustine in relapsed and refractory Hodgkin lymphoma. J Clin Oncol. 2013; 31: 456-460.
57. Moore S., Kayani I., Peggs K., Qian W., Lowry L., Thomson K., Linch D.C., Ardeshna K. Mini-BEAM is effective as a bridge to transplantation in patients with refractory or relapsed Hodgkin lymphoma who have failed to respond to previous lines of salvage chemotherapy but not in patients with salvage-refractory DLBCL. Br J Haematol. 2012 Jun; 157(5): 543-52.
58. Wuchter P., Ran D., Bruckner T., Schmitt T., Witzens-Harig M., Neben K. et al. Poor mobilization of hematopoietic stem cells-definitions, incidence, risk factors, and impact on outcome of autologous transplantation. Biol Blood Marrow Transplant. 2010; 16: 490-499.
59. Younes A. Novel treatment strategies for patients with relapsed classical Hodgkin lymphoma. Hematology Am Soc Hematol Educ Program. 2009; 507-19.
60. Jona A., Younes A. Novel treatment strategies for patients with relapsed classical Hodgkin lymphoma. Blood Rev. 2010; 24(6): 233-8.
61. Moskowitz A.J. Novel agents in Hodgkin lymphoma. Curr Oncol Rep. 2012; 14(5): 419-23.
62. Fehniger T.A., Larson S., Trinkaus K. et al. A phase 2 multicenter study of lenalidomide in relapsed or refractory classical Hodgkin lymphoma. Blood. 2011; 118(19): 5119-5125.
63. Johnston P.B., Inwards D.J., Colgan J.P. et al. A phase II trial of the oral mTOR inhibitor everolimus in relapsed Hodgkin lymphoma. Am J Hematol 2010; 85(5): 320-324.
64. Younes A., Sureda A., Ben-Yehuda D. et al. Panobinostat in patients with relapsed/refractory Hodgkin’s lymphoma after autologous stem-cell transplantation: results of a phase II study. J Clin Oncol 2012; 30(18): 2197-2203.
65. Oki Y., Fanale M.A., Westin J. et al. A phase I study of panobinostat in combination with ICE (ifosfamide, carboplatin and toposide) in patients with relapsed or refractory classical Hodgkin lymphoma (cHL) [ASH abstract 252]. Blood. 2013; 122(21 suppl).
66. Fanale M., Fayad L., Pro B. et al. Phase I study of bortezomib plus ICE (BICE) for the treatment of relapsed/refractory Hodgkin lymphoma. Br J Haematol. 2011; 154(2): 284-286.
67. Armand P., Shipp M.A., Ribrag V. et al. PD-1 Blockade with Pembrolizumab in Patients with Classical Hodgkin Lymphoma after Brentuximab Vedotin Failure: Safety, Efficacy, and Biomarker Assessment. 57th ASH Annual Meeting. 2015; Abstract 584.
68. Ansell S.M., Lesokhin A.M., Borrello I. et al. PD-1 blockade with nivolumab in relapsed or refractory Hodgkin’s lymphoma. N Engl J Med. 2015; 372: 311-319.
69. Herbaux C., Gauthier J., Brice P. et al. Nivolumab Is Effective and Reasonably Safe in Relapsed or Refractory Hodgkin’s Lymphoma after Allogeneic Hematopoietic Cell Transplantation: A Study from the Lysa and SFGM-TC. 57th ASH Annual Meeting. 2015; Abstract 3979.
70. Ссылка на информацию с сайта FDA: http://www.fda.gov.
71. Ссылка на информацию с сайта ЕМА: http://www.ema.europa.eu.
72. Moskowitz C.H. et al. Brentuximab vedotin as consolidation therapy after autologous stem-cell transplantation in patients with Hodgkin’s lymphoma at risk of relapse or progression (AETHERA): a randomised, double-blind, placebo-controlled, phase 3 trial. The Lancet. Vol. 385, Issue 9980. 2015 May 9-15; 1853-1862.
73. Younes A. et al. Frontline therapy with brentuximab vedotin combined with ABVD or AVD in patients with newly diagnosed advanced stage hodgkin lymphoma [abstract]. Blood. 2011; 118: 955.
74. Younes A. et al. Brentuximab vedotin (SGN-35) for relapsed CD30-positive lymphomas. N Engl J Med. 2010; 363(19): 1812-1821.
75. Younes A. et al., Results of a pivotal phase II study of brentuximab vedotin for patients with relapsed or refractory Hodgkin’s lymphoma. J Clin Oncol. 2012 Jun 20; 30(18): 2183-9.
76. Chen R., Gopal A.K., Smith S.E., Ansell S.M., Rosenblatt J.D., Savage K.J., Connors J.M., Engert A., Larsen E.K., Huebner D., Fong A., Younes A. Five-year survival and durability results of brentuximab vedotin in patients with relapsed or refractory Hodgkin lymphoma. Blood. 2016 Sep 22; 128(12): 1562-6.
77. Updated Efficacy and Safety Data from the AETHERA Trial of Consolidation with Brentuximab Vedotin after Autologous Stem Cell Transplant (ASCT) in Hodgkin Lymphoma Patients at High Risk of Relapse (Abstract #3172, poster presentation on Sunday, December 6, 2015).
78. Yasenchak C.A., Forero-Torres A., Cline-Burkhardt V.J.M. et al. Brentuximab vedotin in combination with dacarbazine or bendamustine for frontline treatment of Hodgkin lymphoma in patients aged 60 years and above: interim results of a multi-cohort phase 2 study [ASH abstract 587]. Blood. 2015; 126 (suppl 23).
При поддержке ООО «Такеда Украина».
UA/ADC/1216/0031