25 січня, 2017
Неоадъювантная терапия рака молочной железы: преимущества, показания и влияние на прогноз

Хирургическая резекция остается ведущим методом лечения пациенток с ранними стадиями рака молочной железы (РМЖ). Последние исследования показали, что системная противоопухолевая терапия, проводящаяся в адъювантном или неоадъювантном режиме, обеспечивает равные преимущества с точки зрения выживаемости без прогрессирования (ВБП) и общей выживаемости (ОВ) для этой категории пациенток. У неоадъювантной терапии есть свои преимущества и недостатки, поэтому адекватный отбор пациенток имеет решающее значение для оптимизации онкологических и косметических результатов лечения.
Преимущества, показания, перспективы
Исходно основное показание к проведению неоадъювантной терапии было связано с преобразованием неоперабельных опухолей в операбельные, а также снижением объема хирургического вмешательства. Действительно, в определенных случаях неоадъювантная терапия может служить «мостом» к достижению операбельного состояния. Для пациенток с воспалительным РМЖ неоадъювантная терапия считается стандартом лечения (при отсутствии противопоказаний) и может обеспечить увеличение выживаемости. Кроме того, на такое лечение часто претендуют пациентки, стремящиеся получить органосохраняющее хирургическое лечение; доля органосохраняющих операций после неоадъювантной терапии достигает 72,3%.
Пациентки с химиочувствительным РМЖ могут получить существенные преимущества от проведения химиотерапии (ХТ) именно в неоадъювантном режиме. Из всех клинических подтипов РМЖ наиболее химиочувствительными являются HER2-позитивный (HER2+) и трижды негативный (ТНРМЖ) подтипы, которые рассматриваются как наиболее подходящие для проведения неоадъювантной ХТ. Действительно, у пациенток с HER2+ и ТНРМЖ наблюдаются самые высокие уровни достижения полного патологического ответа (пПО). Пациентки с агрессивными опухолями, экспрессирующими эстрогеновые рецепторы (ЭР+), либо люминальным-B подтипом, как правило, чаще демонстрируют пПО, чем больные с менее агрессивными ЭР+ подтипами (пПО 15% против 7,5% соответственно), и поэтому могут подходить для неоадъювантной терапии.
Пациентки с классическим инвазивным очаговым РМЖ обычно хуже отвечают на неоадъювантную ХТ, чем больные с инвазивной протоковой карциномой (уровни пПО составляют 11 и 25% соответственно, p=0,01), поэтому неоадъювантные режимы для них обычно не рассматриваются. Для больных с поражением регионарных лимфоузлов (ЛУ) назначение ХТ является стандартом лечения независимо от последовательности ее введения, а ответ на неоадъювантный режим потенциально способен влиять на выбор локорегионарного лечения, включая степень аксиллярной лимфодиссекции и размер облучаемой области при проведении лучевой терапии (ЛТ).
Ограничения
Неоадъювантная ХТ обычно не рекомендуется пациенткам с I стадией РМЖ. Результаты патогистологического исследования хирургически удаленной опухоли зачастую имеют первостепенное значение для принятия решений о необходимости ХТ в принципе и определяют выбор цитостатиков.
Фокальность опухоли может влиять на перспективы проведения органосохраняющей операции после неоадъювантной ХТ, снижая шансы с 71,6% при монофокальном росте опухоли до 58,5% при мультифокальном и 30% при мультицентрическом. Уровень достижения пПО также может незначительно отличаться в зависимости от фокальности: 19,4% при монофокальном, 16,5% при мультифокальном и 14,4% при мультицентрическом РМЖ. Пациентки с мультицентрическими опухолями могут уступать больным с монофокальным РМЖ по уровню ВБП (р<0,001) и ОВ (р<0,009) после неоадъювантной ХТ – но не в тех случаях, когда был достигнут пПО.
В настоящее время недостаточно данных в поддержку органосохраняющего лечения после неоадъювантной ХТ при мультицентрическом и мультифокальном РМЖ, важен индивидуальный подход. Если для пациенток с мультицентрическим РМЖ и с очагами в разных квадрантах молочной железы стандартом лечения остается мастэктомия (независимо от степени ответа на неоадъювантную терапию), то при мультифокальном росте РМЖ в пределах одного квадранта органосохраняющее лечение может быть рассмотрено. Важно учитывать: хотя отдельные очаги могут уменьшиться в размере под воздействием неоадъювантной терапии, расстояние между ними остается таким же.
Прогрессирование во время неоадъювантной ХТ наблюдается редко. Исследования показали, что до 12% пациенток, начавших неоадъювантную ХТ, впоследствии не смогли получить хирургическое лечение. Еще более редким феноменом является отдаленное метастазирование (до 4% пациенток, у которых РМЖ прогрессировал во время неоадъювантной терапии). Прогностическими факторами повышенного риска прогрессии опухоли во время неоадъювантной терапии являются принадлежность к негроидной расе, поздние стадии опухоли, высокая степень злокачественности, высокий уровень Ki‑67, отсутствие экспрессии гормональных рецепторов.
У пациенток со слабо химиочувствительными подтипами РМЖ, такими как люминальный-А или классический инвазивный лобулярный РМЖ, преимущества от проведения неоадъювантной терапии маловероятны. Эти данные подчеркивают значимость тщательного отбора и наблюдения пациенток во время лечения.
Первоначальное обследование
Оценка размеров опухоли должна быть выполнена в соответствии с руководством Национальной онкологической сети США (NCCN). Магнитно-резонансная томография (МРТ) является наиболее чувствительным методом стадирования, допускает возможность оценки контралатеральной молочной железы на предмет синхронного РМЖ (который выявляется в 3-10% случаев), но может преувеличить размер опухоли. По результатам исследований, МРТ достоверно снижает вероятность повторной резекции. Выбор МРТ в качестве метода визуализации должен производиться с учетом конкретной клинической ситуации и особенно предпочтителен, когда рассматривается возможность органосохраняющего лечения.
В соответствии с рекомендациями NCCN, для верификации диагноза необходима трепанобиопсия под визуальным контролем; обязательна оценка патологических маркеров, включая ЭР, прогестероновые рецепторы (ПР) и статус HER2. Для планирования лечения после завершения неоадъювантной терапии важно четко определить ложе опухоли при первичном обследовании. Также может оцениваться степень дифференцировки опухоли и уровня Ki‑67, что позволяет выявить агрессивный фенотип РМЖ и предсказать реакцию на ХТ.
Все кандидаты на неоадъювантную ХТ должны пройти тщательное обследование аксиллярной области, в том числе с использованием маммографии и ультразвукового исследования. При отсутствии клинических признаков поражения лимфатических узлов необходимость проведения биопсии сигнального ЛУ до или после неоадъювантной ХТ является спорной. В исследовании SENTINA в материалах биопсии, выполненной до неоадъювантной ХТ, признаки заболевания обнаруживались у 35% пациенток, у которых отсутствовали клинические признаки поражения ЛУ. Кроме того, при повторной биопсии после завершения неоадъювантной ХТ у 61% этих пациенток обнаруживались дополнительные сигнальные ЛУ, а также отмечалась высокая (51,6%) частота ложноотрицательных результатов. Напротив, биопсия сигнальных ЛУ, впервые проводимая после неоадъювантной ХТ, показала меньшую частоту их поражения и приводила к меньшей частоте подмышечных лимфодиссекций или облучения (45% против 33%; р=0,006).
Немаловажно, что удаление пораженных ЛУ до начала неоадъювантной терапии исключает возможность адекватной оценки ответа и уменьшает значение достижения пПО. Учитывая отсутствие убедительных данных в пользу рутинного взятия биопсии сигнального ЛУ до неоадъювантного лечения, даже у больных с клиническими признаками поражения аксиллярных ЛУ предпочтительно выполнять эту манипуляцию по окончании неоадъювантной терапии.
Пациентки с I и II стадиями РМЖ при отсутствии симптомов не требуют рутинного обследования на предмет отдаленных метастазов, однако для пациенток с III стадией следует рассматривать применение методов системной визуализации даже при отсутствии симптомов. Костная сцинтиграфия и компьютерная томография (КТ) с контрастированием области грудной клетки, малого таза и брюшной полости позволяют адекватно оценить системное поражение и рассматриваются в качестве первого выбора (при отсутствии противопоказаний). Дополнительные методы, в том числе позитронно-эмиссионная томография (ПЭТ) и МРТ, могут потребоваться в конкретных случаях. Пациенткам с симптомами со стороны центральной нервной системы проводится МРТ головного мозга. Из всех участков, в которых подозревается метастатическое поражение, должна быть взята биопсия.
В сложных случаях оптимальному выбору стратегии лечения способствует привлечение междисциплинарной группы специалистов – патологов, онко- и пластических хирургов, медицинских и радиационных онкологов. Раннее обсуждение возможностей реконструкции важно при планировании хирургического лечения для достижения оптимальных косметических результатов. Генетическое консультирование также может влиять на подход к терапии: так, при наличии наследственных мутаций в генах BRCA1 или BRCA2 рассматривается вопрос о проведении мастэктомии и/или профилактической мастэктомии контралатеральной молочной железы.
Остаточная болезнь
Остаточная болезнь включает целый спектр ответов в диапазоне от превосходной реакции с минимальным наличием заболевания до полного отсутствия ответа или даже прогрессирования на фоне неоадъювантной терапии.
Пациентки, у которых после неоадъювантной ХТ присутствует остаточная болезнь, впоследствии имеют повышенный риск рецидива. Этот риск особенно выражен у пациенток с ТНРМЖ и HER2+ РМЖ, а также люминальным-В подтипом. В связи со сложностью оценки патологических характеристик остаточной болезни при РМЖ международные рекомендации сосредоточивают внимание на междисциплинарном подходе, строгом отборе образцов, использовании диагностических клипов при биопсии, а также повторной оценке рецепторного статуса в случаях, когда это может повлиять на выбор лечения.
Изменение рецепторного статуса РМЖ после неоадъювантной ХТ может влиять на прогноз. В одном из исследований 10,3% опухолей, которые исходно имели статус ЭР+ HER2-, после неоадъювантной ХТ приобрели статус ЭР-, в то время как у 34,5% пациенток с ТНРМЖ опухоль, наоборот, начала экспрессировать ЭР. Это исследование имеет ряд ограничений; тем не менее изменение рецепторного статуса было связано с результатами лечения. В частности, потеря рецепторов эстрогена приводила к ухудшению безрецидивной выживаемости (относительный риск – ОР – 3,54; 95% доверительный интервал – ДИ – 1,60-7,85), в то время как среди пациенток, опухоли которых приобрели статус ЭР+, наблюдалась тенденция к улучшению данного показателя (ОР 1,32; 95% ДИ 0,64-2,74).
Кроме классификации TNM для определения риска рецидива у пациенток с остаточной болезнью может быть использована классификация RCB (Residual Cancer Burden), которая учитывает как остаточный РМЖ, так и размер первичной опухоли и поражение ЛУ. На этапе исследования – прогностические биомаркеры для пациенток с остаточной болезнью после неоадъювантной терапии.
Анализ биомаркеров и мультигенных сигнатур может быть полезен при выборе таргетной терапии для пациенток с повышенным риском рецидива РМЖ. В настоящее время нет стандарта дополнительной терапии для пациенток, имеющих остаточную болезнь после неоадъювантной ХТ, продолжается изучение этой проблемы. Для преодоления механизмов устойчивости РМЖ к стандартной терапии требуется углубить понимание молекулярной биологии опухоли.
Патологический полный ответ и его интерпретация
Использование пПО как конечной точки в клинических испытаниях получило признание в качестве инструмента для начальной оценки эффективности новых лекарственных молекул. Однако сопоставить результаты этих исследований непросто, поскольку в них использовались разные определения пПО. Во многих ранних исследованиях проводилась оценка ответа на неоадъювантную терапию только в молочной железе. Соответственно, пПО определялся как отсутствие остаточного инвазивного рака в молочной железе, независимо от наличия протоковой карциномы in situ (DCIS) или вовлечения ЛУ (ypT0/is ypNx). В более поздних исследованиях использовали более жесткие требования: пПО определялся как отсутствие остаточной инвазивной карциномы в молочной железе и подмышечных ЛУ (ypT0/is ypN0) либо как отсутствие признаков инвазивного рака и DCIS в молочной железе в сочетании с отсутствием вовлечения подмышечных ЛУ (ypT0 ypN0).
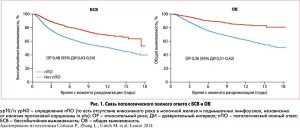
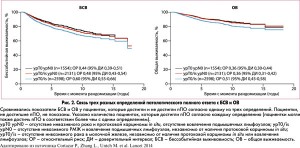
Исследовательской группой CTNeoBC (P. Cortazar et al., 2014) проведен метаанализ 12 основных рандомизированных исследований, посвященных неоадъювантной терапии, с целью изучения связи разных подходов к определению общего уровня пПО (всего 22% ypT0/is ypNx, 18% ypT0/is ypN0 и 13% ypT0 ypN0) с ОВ и ВБП. Метаанализ охватил результаты лечения 11 955 пациенток. В целом у пациенток, которые достигли пПО, показатели бессобытийной выживаемости (БСВ) и ОВ были достоверно выше, чем у тех, у кого после завершения неоадъювантной терапии в молочной железе выявлялась остаточная инвазивная карцинома (рис. 1 и 2). Показатели БСВ и ОВ были значительно хуже в группе Nx (возможное вовлечение ЛУ), но оставались аналогичными в остальных двух группах – то есть не зависели от наличия или отсутствия DCIS (рис. 2).
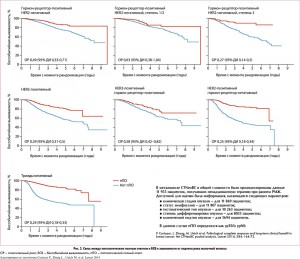
Также оценивалось влияние пПО на отдаленные результаты лечения в зависимости от молекулярного профиля опухоли. В популяции с гормон-рецептор-позитивным HER2-негативным РМЖ подтверждена положительная корреляция пПО с показателями БСВ (ОР 0,49; 95% ДИ 0,33-0,71) и ОВ (ОР 0,43; ДИ 0,23‑0,71). Связь между пПО и отдаленными результатами лечения была сильнее всего при опухолях высокой степени злокачественности (рис. 3). Кроме того, достижение пПО было связано с отдаленными результатами лечения у пациенток с HER2+ РГЖ независимо от статуса ЭР и ПР (БСВ – ОР 0,39; 95% ДИ 0,31-0,50 и ОВ – ОР 0,34; ДИ 0,24-0,47). Сила связи увеличивалась в подгруппе гормон-рецептор-негативных опухолей (БСВ – ОР 0,25; ДИ 0,18-0,34; ОВ – ОР 0,19; ДИ 0,12-0,31). Большинство благоприятных исходов после достижения пПО были отмечены в подгруппе больных с HER2+ гормон-рецептор-негативным РМЖ, которые получали трастузумаб (БСВ – ОР 0,15; ДИ 0,09-0,27 и ОВ – ОР 0,08; ДИ 0,03‑0,22), и в подгруппы с ТНРМЖ (рис. 3).
По результатам данного метаанализа Управление по контролю качества пищевых продуктов и лекарственных препаратов США (FDA) предложило использовать для определения пПО ypT0 ypN0 либо ypT0/is ypN0. В руководстве FDA, регламентирующем процедуру ускоренного утверждения новых лекарственных препаратов на основании результатов неоадъювантной терапии раннего агрессивного РМЖ, пПО именно в таком понимании разрешен для использования в качестве конечной точки клинических исследований.
Многочисленные данные свидетельствуют о том, что у пациенток, достигающих ответа на неоадъювантную терапию, наблюдается увеличение выживаемости, если пПО определяется как ypT0/ypN0. Определение пПО должно быть четко указано в патогистологическом заключении. Вне зависимости от того, какое определение используется патологом, наличие остаточной DCIS и метастазов в ЛУ должно быть отмечено и учитываться при выборе адъювантного режима.
Согласно современным представлениям, определение пПО после проведения неоадъювантной терапии должно включать в себя оценку подмышечных ЛУ, поскольку несколько исследований показали, что наличие остаточного их поражения указывает на худший прогноз даже при пПО в молочной железе. Вопрос о том, должна ли быть DCIS включена в определение пПО, является спорным; к настоящему времени метаанализ CTNeoBC и большинство других исследований не показали различий в выживаемости между пациентками с наличием остаточной DCIS и без нее. Тем не менее объединенный анализ семи проспективных неоадъювантных клинических испытаний, выполненный немецкой и австрийской исследовательскими группами (G. von Minckwitz et al., 2012), обнаружил достоверное увеличение БСВ у пациенток без остаточной DCIS (ОР 1,74; р<0,001), а также тенденцию к увеличению ОВ (ОР 1,41, р=0,166). Исследования продолжаются.
Проведение неоадъювантной терапии в тщательно отобранной группе больных обеспечивает улучшение хирургических и косметических результатов лечения, снабжает ценной прогностической информацией, а также может улучшить отдаленные результаты терапии. При выборе оптимальной стратегии ведения пациенток с РМЖ важен междисциплинарный подход.
Литература
1. Santa-Maria C. A., Camp M., Cimino-Mathews A. et al. Neoadjuvant Therapy for Early-Stage Breast Cancer: Current Practice, Controversies, and Future Directions. Cancer Network. November 15, 2015.
2. Cortazar P., Zhang L., Untch M. et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet 2014; 384: 164-72.
3. Earl Helena, Provenzano Elena et al. Jean Abraham Neoadjuvant trials in early breast cancer: pathological response at surgery and correlation to longer term outcomes – what does it all mean? Earl et al. BMC Medicine (2015) 13:234.
Подготовлено по заказу ООО «Рош Украина»,
РID#248
Подготовила Катерина Котенко