24 січня, 2017
Прорыв в иммунотерапии опухолей: возможности пембролизумаба
Тот, кто научится лечить иммунодефицит, научится лечить рак.
Р. Петров
Знаменитое высказывание выдающегося советского иммунолога Рэма Викторовича Петрова стало путеводной звездой для нескольких поколений врачей, специализирующихся в области иммунотерапии опухолей. Но только сейчас благодаря беспрецедентным инновационным достижениям в иммуноонкологии становится все более очевидной обнадеживающая перспектива достижения высоких идеалов физиологически выверенного, эффективного и безопасного иммунотерапевтического ведения пациентов со злокачественными новообразованиями. Данная статья посвящена новой группе препаратов моноклональных антител с принципиально иным механизмом противоопухолевого действия, максимально соответствующим нормальному, естественному иммунному ответу против малигнизированных клеток. Пембролизумаб – гуманизированные моноклональные антитела иммуноглобулина (Ig) G4 к рецептору PD‑1 [9].
История иммунотерапии опухолей
История применения иммунотерапевтических агентов в онкологии включает несколько важных этапов. Впервые в сообщениях о клинических случаях и небольших контролируемых испытаниях была показана эффективность нормального в/в Ig при злокачественной тимоме [22], колоректальном раке [7], а также при профилактике метастазов солидных опухолей [8]. Также были предприняты попытки создания иммунотоксинов – Ig, к которым присоединены цитостатические химиопрепараты или радиоизотопы, однако недостаточная прицельность действия иммунотоксинов в связи с незначительными антигенными отличиями опухолей от здоровых тканей не позволила внедрить данный иммунотерапевтический подход в широкую клиническую практику.
Параллельно развивалась клеточная терапия опухолей. Были разработаны методики лечения неоплазий при помощи так называемых лимфоцитов, инфильтрирующих опухоль (ЛИО), и лимфокин-активированных киллеров. Эти иммунотерапевтические подходы продемонстрировали эффективность в клинических испытаниях, однако непредсказуемость эффекта, дороговизна и техническая сложность выполнения не позволили клеточной терапии стать элементом рутинной практики онкологов, хотя такие технологии сейчас применяются в некоторых клинических центрах. В последнее время клеточные технологии вышли на новый уровень развития благодаря разработке методик лечения опухолей при помощи дендритных клеток с заданными свойствами (так называемых противоопухолевых вакцин), а также попыткам использования стволовых клеток. Однако такие подходы пока еще не получили достаточной доказательной базы эффективности и безопасности.
Следующим этапом развития иммунотерапии опухолей стало внедрение цитокинотерапии. Среди множества апробированных иммунотерапевтических агентов именно препараты интерферонов-α (ИФН-α) и рекомбинантного интерлейкина‑2 получили наибольшую доказательную базу эффективности. На данный момент в онкологии продемонстрирована польза от применения естественных (лейкоцитарных), лимфобластоидных и рекомбинантных ИФН-α, однако именно рекомбинантные ИФН-α2а и ИФН-α2b вошли в современные международные протоколы лечения новообразований. Так, ИФН-α2а показан при волосатоклеточном лейкозе, саркоме Капоши и хроническом миелоидном лейкозе. ИФН-α2b применяют в клинической практике при меланоме, волосатоклеточном лейкозе, остроконечных кондиломах и саркоме Капоши.
Новую эру в иммунотерапии опухолей открыла разработка препаратов моноклональных антител, полученных при помощи гибридомных технологий. Первые препараты моноклональных антител были наделены прямой и опосредованной противоопухолевой активностью, благодаря чему напоминали цитостатические химиопрепараты. Примером успеха в этом направлении является ритуксимаб, рекомендованный для лечения В-клеточных лимфом. Препарат оказывает прямое онкостатическое действие благодаря блокаде молекулы СD20 на поверхности В-лимфоцитов и опосредованное цитолитическое воздействие на В-клетки, осуществляемое путем индукции реакций комплемент-опосредованной и антителозависимой клеточно-опосредованной цитотоксичности [15]. Хотя ритуксимаб привел к прорыву в лечении В-клеточных лимфом, такой подход имеет существенные недостатки из-за неспецифичности воздействия и индукции вторичного иммунодефицита. Так, в связи с истощением пула В-лимфоцитов формируется тяжелая гипоиммуноглобулинемия, которую необходимо корректировать путем дополнительного назначения в/в Ig.
И наконец, последним этапом становления иммунотерапии опухолей стала разработка препаратов моноклональных антител, которые направлены не на непосредственное разрушение опухолевых клеток, а на устранение индуцированной опухолью иммуносупрессии, что позволяет организму человека реализовать эффективную иммунную реакцию против опухоли даже в случае начальной иммунорезистентности неоплазии. Примерами таких иммунотерапевтических агентов являются ипилимумаб и пембролизумаб, которые на данный момент успешно прошли клинические испытания в онкологии.
Механизм противоопухолевого иммунного ответа
Сейчас это может показаться странным, но до недавнего времени значимость иммунного ответа в противоопухолевой защите вызывала сомнения. Ф. Бернет, автор всемирно признанной клонально-селекционной теории иммунитета, впервые обобщил доказательства участия иммунитета в противоопухолевой защите. К таким доказательствам он отнес:
– мононуклеарную клеточную инфильтрацию опухолей;
– продукцию специфических антител и цитотоксических Т-лимфоцитов;
– положительные кожные тесты гиперчувствительности немедленного и замедленного типа на введение экстрактов из опухолевых клеток у онкобольных;
– длительное развитие опухолей (опухоли-свидетели);
– случаи спонтанной регрессии опухолей;
– признаки активации естественных киллеров и цитотоксических Т-лимфоцитов.
Еще одним доказательством важной роли иммунной системы в противоопухолевой защите является повышенная частота развития онкологических осложнений при первичных иммунодефицитах, а также при ВИЧ-инфекции, индуцирующей синдром приобретенного иммунодефицита. Если ранее указывали на риск новообразований при тяжелых, редко встречающихся первичных иммунодефицитах, то в последнее время получены доказательства ассоциации онкологических осложнений с минорными иммунными дисфункциями. Так, недавно J.F. Ludvigsson и соавт. в популяционном когортном исследовании с участием 2320 пациентов с тотальным дефицитом IgA и 23 130 лиц общей популяции продемонстрировали ассоциацию этой иммунодефицитной болезни с раком, особенно гастроинтестинальной локализации (относительный риск – ОР – 1,64; 95% доверительный интервал – ДИ – 1,07-2,5) [19].
Знание механизма противоопухолевого иммунного ответа позволяет понять принцип действия иммунотерапевтических агентов, применяемых в онкологии. Различают инициальную, распознающую фазу иммунного ответа, реализующуюся в периферических иммунных органах, и завершающую, повреждающую фазу, которая проходит непосредственно в ткани, где расположена опухоль. Выделение этих фаз важно в понимании различий в механизме действия и профиле безопасности ипилимумаба и пембролизумаба. Естественные киллеры являются первой линией защиты от малигнизированных клеток. Эти лимфоциты индуцируют апоптоз или некроз опухолевых клеток при отсутствии на их поверхности молекул HLA I класса (меток «своего») или при нарушении баланса сигналов, полученных через киллинг-активирующие и киллинг-ингибирующие рецепторы. Апоптотические тельца или элементы некротического детрита захватываются дендритными клетками или макрофагами, которые выделяют и представляют иммуногенные пептиды опухоли в составе молекул HLA II класса специфическим Т-хелперам и в составе HLA I – цитотоксическим Т-лимфоцитам, экспрессирующим молекулу CD8 (феномен двойного распознавания). Для полноценной активации опухоль-специфический цитотоксический Т-лимфоцит должен получить контактный антиген-специфический сигнал от дендритной клетки и удаленный цитокиновый сигнал от Т-хелперов 1 типа (интерлейкин‑2, ИФН-γ, факторы некроза опухоли). Если не поступает надлежащего цитокинового сигнала, то специфический цитотоксический Т-лимфоцит переходит в состояние анергии, если же такой сигнал получен, он мигрирует в ткань, где расположена опухоль, и распознает иммуногенный пептид в составе молекул HLA I на поверхности малигнизированных клеток, индуцируя их апоптоз или некроз путем продукции перфорина и гранзимов.
Продукция специфических антител плазматическими клетками при поддержке Т-хелперов 2 типа также важна в противоопухолевой иммунной защите. Ig нейтрализуют некоторые опасные антигены опухоли, а также модулируют иммунный ответ путем обеспечения реакций иммунного фагоцитоза, комплемент-опосредованной и антителозависимой клеточно-опосредованной цитотоксичности.
Механизмы индуцированной опухолью иммуносупрессии
Рост и прогрессия опухоли становятся возможными только при проявлении защитных реакций со стороны малигнизированных клеток по отношению к иммунному ответу.
Следует отметить, что опухоли различаются по чувствительности к иммунотерапии, так как обладают различной иммунорезистентностью. Выделяют новообразования, которые высокочувствительны к иммунотерапевтическим вмешательствам (меланома, рак почки, мочевого пузыря), со средней (рак толстой кишки, некоторые лимфомы) и низкой чувствительностью (рак молочной железы, легкого).
Опухоль развивается на фоне развертывания по крайней мере двух противоположно направленных процессов – иммунного ответа, который нацелен на уничтожение злокачественных клеток, и опухоль-индуцированной иммуносупрессии, способствующей уклонению новообразования от иммунного ответа путем подавления иммунных реакций. Динамика опухолевого роста определяется текущим результатом взаимодействия анти- и пробластомных факторов.
Выделяют два типа нарушений в системе взаимодействия иммунитета и опухоли, обусловливающих онкогенез: развитие новообразования при первичных иммунодефицитах, когда имеется предсуществующее генетически детерминированное нарушение противоопухолевого иммунного ответа, и выживание опухоли при нормальном иммунном ответе вследствие своевременной индукции опухоль-опосредованной иммуносупрессии. Именно пациенты из второй группы с вызванным опухолью вторичным иммунодефицитом могут отвечать на современную иммунотерапию пембролизумабом, направленную на устранение индуцированной иммуносупрессии и нормализацию иммунного ответа против злокачественных клеток.
К известным механизмам иммунорезистентности опухолей относят низкую иммуногенность антигенов, дисбаланс между скоростью пролиферации опухолевых и иммунокомпетентных клеток, изменение антигенов при опухолевой прогрессии, селекцию иммунорезистентных малигнизированных клеток, прекращение экспрессии молекул гистосовместимости I класса, появление растворимых антигенов, быстрый катаболизм антител на поверхности опухоли, продукцию иммуносупрессивных субстанций, появление рецепторов к ростовым факторам, индукцию апоптоза цитотоксических клеток иммунной системы и экспрессию рецепторов-ловушек (табл.).
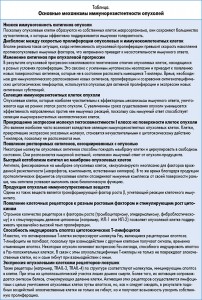
Именно механизм индукции апоптоза цитотоксических Т-лимфоцитов, в норме разрушающих опухолевые клетки, является ключевым механизмом уклонения от иммунного ответа при ряде новообразований. Его устранение играет решающую роль в достижении прогностически благоприятного изменения баланса про- и антибластомных факторов.
Моноклональные антитела, блокирующие ключевые точки опухоли
Пассивная иммунотерапия опухолей основывается на применении специфических Ig. Эти антитела воздействуют на новообразование при помощи трех принципиальных механизмов:
1) специфического повреждения сигнальных рецепторов на поверхности малигнизированных клеток;
2) нейтрализации трофических сигналов, продуцируемых опухолевыми клетками или стромальным микроокружением;
3) специфического распознавания неопластических клеток за счет связывания с опухоль-ассоциированными антигенами [9].
Различают 5 вариантов атакующих опухоль Ig:
1) антитела, угнетающие сигнальные рецепторы малигнизированных клеток, необходимые для их выживания или прогрессии (цетуксимаб, ингибитор рецептора эпидермального фактора роста; лечение рака головы и шеи и колоректальной карциномы);
2) антитела, активирующие потенциально летальные рецепторы опухоли (тигатузумаб, активатор рецепторов к фактору некроза опухоли; находится на стадии испытаний);
3) иммунные конъюгаты, состоящие из молекул Ig, связанных с токсинами или радионуклидами (гемтузумаб озогамицин, состоящий из анти-CD33 Ig, конъюгированных с калихеамицином; лечение острого миелоидного лейкоза);
4) опухоль-специфические антитела, которые опсонизируют неоплазию, индуцируя антителозависимую клеточно-опосредованную цитотоксичность, антителозависимый фагоцитоз опухолевых клеток и комплемент-опосредованную цитотоксичность (ритуксимаб, моноклональные антитела к молекуле CD20; лечение хронического лимфолейкоза и неходжкинских лимфом);
5) биспецифические Т-клеточные усилители, представляющие собой химерные молекулы, состоящие из двух разных Ig, один из которых распознает клетки опухоли, а другой связывается с Т-лимфоцитом (блинатумомаб, химерное антитело к молекулам CD19 и CD3; лечение В-клеточного острого лимфобластного лейкоза без филадельфийской хромосомы) [10].
Если говорить об иммуномодулирующих моноклональных антителах, то в этом направлении разработано 4 различных терапевтических подхода:
1) угнетение иммуносупрессивных рецепторов, экспрессирующихся на Т-лимфоцитах (ипилимумаб, ингибитор CTLA‑4, и пембролизумаб, ингибитор PD‑1, см. ниже);
2) ингибирование лигандов к указанным иммуносупрессивным молекулам лимфоцитов (например, молекулы PD‑L1, лиганда PD‑1; препараты BMS‑936559, MPDL3280A и MED4736, находящиеся на стадии клинических испытаний);
3) активация костимуляционных рецепторов иммунокомпетентных клеток, например суперсемейства рецепторов фактора некроза опухоли (тигатузумаб);
4) нейтрализация иммуносупрессивных факторов микроокружения опухоли, таких как трансформирующий фактор роста β1 [14].
Именно иммуномодулирующие препараты моноклональных антител первого типа на данный момент имеют наибольшую доказательную базу и внедрены в клиническую практику. Анти-CTLA‑4-препарат ипилимумаб одобрен Управлением по контролю качества пищевых продуктов и лекарственных препаратов США (FDA) для использования при неоперабельной меланоме в марте 2011 г. [29], анти-PD‑1-агент пембролизумаб одобрен FDA по ускоренной процедуре для лечения метастатической меланомы [13], ниволумаб рекомендован в Японии для лечения меланомы с июля 2014 г. [4].
Проведение клинических испытаний препаратов моноклональных антител, блокирующих ключевые точки опухоли, таких как ипилимумаб, ниволумаб и пембролизумаб, стало возможным благодаря формированию фундаментальных знаний о механизме регуляции активации Т-лимфоцитов. Была доказана модель двух сигналов, описывающая механизм активации Т-клеток, согласно которой первый сигнал формируется при активации антигенраспознающего рецептора лимфоцита опухолевым антигеном, а второй – при реализации костимуляционного взаимодействия между молекулами В7 и CD28. Получение двойного сигнала приводит к активации Т-киллера и реализации противоопухолевого цитотоксического ответа. Если Т-лимфоцит распознает опухоль, но не получает костимуляционного сигнала, то переходит в состояние анергии (функциональной бездеятельности). Так формируется приобретенная иммунная толерантность к опухоли, способствующая прогрессированию неоплазии. Если же вместо костимулирующего сигнала Т-лимфоцит получает коингибирующий стимул, то иммунокомпетентная клетка может погибнуть путем апоптоза [21].
Клетки злокачественных новообразований часто экспрессируют такие коингибиторные молекулы для формирования иммунорезистентности. Это приводит к развитию специфического клеточного иммунодефицита к опухоли из-за избирательного подавления или гибели опухоль-специфических Т-лимфоцитов. Напротив, блокада коингибиторных молекул, таких как CTLA‑4 (4-й антиген цитотоксических Т-лимфоцитов), PD‑1 (рецептор программированной смерти 1 типа) и LAG3 (лимфоцит-активационный ген 3), равно как и стимуляция костимулирующих молекул GITR (индуцированный кортикостероидами рецептор к фактору некроза опухоли), OX40 и 4-1BB, могут усиливать Т-клеточный ответ против опухоли (рис. 1) [20].
![Рис. 1. Интерфейс взаимодействия специфического цитотоксического Т-лимфоцита и опухолевой клетки с указанием активирующих и угнетающих сигнальных путей (B.S. Henick et al. [14])](http://health-ua.com/wp-content/uploads/2017/01/44_21-214x300.jpg) Рис. 1. Интерфейс взаимодействия специфического
Рис. 1. Интерфейс взаимодействия специфическогоцитотоксического Т-лимфоцита и опухолевой
клетки с указанием активирующих и угнетающих
сигнальных путей (B.S. Henick et al. [14])
Молекулы CTLA‑4 и PD‑1 функционируют на разных этапах иммунного ответа против опухоли. Так, CTLA‑4 (СD152) ослабляет раннюю активацию наивных Т-лимфоцитов и Т-клеток памяти в лимфоидных органах при связывании с CD80 (В7-1) или CD84 (В7-2), в то время как молекула PD‑1 (CD279) вовлечена в модуляцию Т-клеточной активности в завершающую фазу иммунного ответа в периферических тканях, включая место расположения опухоли, путем взаимодействия со специфическими лигандами PD-L1 (В7-Н1, или СD274) и PD-L2 (В7-DC, или CD273) (рис. 2) [25].
![Рис. 2. Фаза раннего иммунного ответа и эффекторная фаза противоопухолевого иммунитета в контексте механизма действия инновационных иммуномодулирующих препаратов моноклональных антител (C. Kyi et al. [17])](http://health-ua.com/wp-content/uploads/2017/01/44_31-300x213.jpg) Рис. 2. Фаза раннего иммунного ответа и эффекторная фаза противоопухолевого иммунитета
Рис. 2. Фаза раннего иммунного ответа и эффекторная фаза противоопухолевого иммунитетав контексте механизма действия инновационных иммуномодулирующих препаратов моноклональных
антител (C. Kyi et al. [17])
Высокая экспрессия PD‑1 на ЛИО, равно как и наличие PD-L1 на клетках различных опухолей, позволяют считать этот путь важным в реализации феномена уклонения неоплазии от иммунного ответа. PD-L1 и PD-L2 экспрессируются на поверхности многих опухолей человека, включая урологические неоплазии, рак яичника, молочной железы, шейки матки, толстой кишки, поджелудочной железы и желудка, а также меланому, глиобластомы и рак легкого. Такие молекулы идентифицированы на некоторых гематологических новообразованиях – ходжкинской лимфоме, первичной медиастинальной В-клеточной лимфоме, ангиоиммунобластической Т-клеточной лимфоме, множественной миеломе, остром миелоидном лейкозе, хроническом лимфоцитарном лейкозе и Т-клеточных лимфомах у взрослых [29].
Уровень экспрессии PD-L1 коррелирует с прогнозом при указанных опухолях. Это подтверждает представления о том, что выработка PD-L1 является ключевым механизмом уклонения неоплазий от иммунного надзора. Так, карцинома почки и рак яичника характеризуются неблагоприятным прогнозом в случае экспрессии PD‑1 и PD-L1 [12]. В другом исследовании показано, что появление PD‑1 на поверхности ЛИО при меланоме ассоциировано с критическим нарушением функциональной активности CD8+ Т-лимфоцитов [1].
Блокирование взаимодействия в системе PD‑1/PD-L1 и PD‑1/PD-L2 может быть многообещающим объектом иммунотерапевтических вмешательств, направленных на устранение избирательной супрессии специфического клеточного иммунного ответа в опухолевом микроокружении. Таким образом, неоплазии, использующие экспрессию молекул PD-L1 и PD-L2 для выживания путем уклонения от иммунного ответа, являются потенциальными мишенями для пембролизумаба – препарата моноклональных антител к PD‑1, обеспечивающего нечувствительность периферических цитотоксических Т-лимфоцитов, инфильтрирующих опухоль, к иммуносупрессивному влиянию неоплазии через молекулы PD-L1 и PD-L2.
Молекула PD‑1 экспрессируется шире, нежели CTLA‑4. Эта молекулярная структура может появляться на поверхности естественных киллеров и В-лимфоцитов, лимитируя их активность. Поэтому, хотя основной терапевтический эффект пембролизумаба осуществляется благодаря усилению активности опухоль-специфических цитотоксических Т-лимфоцитов, препарат дополнительно усиливает цитотоксический потенциал естественных киллеров и продукцию антител производными В-клеток [6].
Также следует отметить, что PD-L1 может функционировать как лиганд и рецептор в зависимости от текущих условий. При блокаде PD‑1 под воздействием пембролизумаба PD-L1 начинает действовать как стимулятор Т-лимфоцитов, в связи с чем иммуносупрессивная активность опухоли парадоксально оборачивается усилением антитуморозного иммунного ответа [29].
Существует 2 основных механизма регуляции PD-L1 опухолевыми клетками: врожденная и адаптивная иммунорезистентность (рис. 3). Некоторые опухоли, например глиобластомы, экспрессируют PD-L1 конститутивно в контексте реализации типичных онкогенных сигнальных путей пролиферации и прогрессии (врожденная иммунорезистентность, не связанная с реализацией иммунного ответа). Это мешает инициации противоопухолевой клеточной иммунной реакции и формированию опухоль-специфических Т-клеток. При адаптивной иммунорезистентности отмечается индуцибельная экспрессия молекулы PD-L1 на опухолевых клетках во время осуществления иммунной агрессии, причем воздействие ИФН-γ, продуцируемого Т-лимфоцитами, является главным предиктором такой экспрессии. При этом иммунный ответ против опухоли реализуется, однако инфильтрирующие неоплазию цитотоксические Т-лимфоциты инактивируются или даже уничтожаются опухолевыми клетками [18]. Применение пембролизумаба позволяет противостоять как врожденной, так и адаптивной иммунорезистентности опухоли, опосредованной экспрессией PD-L1.
![Рис. 3. Механизмы врожденной и адаптивной иммунорезистентности опухолей, основанные на взаимодействии в системе PD-1/PD-L1 и PD-1/PD-L2 (D.M. Pardoll [25])](http://health-ua.com/wp-content/uploads/2017/01/451-300x200.jpg) Рис. 3. Механизмы врожденной и адаптивной иммунорезистентности опухолей, основанные
Рис. 3. Механизмы врожденной и адаптивной иммунорезистентности опухолей, основанныена взаимодействии в системе PD-1/PD-L1 и PD-1/PD-L2 (D.M. Pardoll [25])
Мышиная модель продемонстрировала терапевтический потенциал блокирования оси PD‑1 [33]. Мыши с генетически детерминированным дефицитом PD‑1 характеризуются более сильным иммунным ответом на опухоль, но и повышенным риском формирования аутоиммунных осложнений по типу дилатационной кардиомиопатии [24] и волчаночно-подобного синдрома [23]. Тем не менее при дефиците PD‑1 формируется более мягкий аутоиммунный фенотип по сравнению с дефицитом молекулы CTLA‑4.
Моноклональные антитела к CTLA‑4 (ипилимумаб) отменяют иммунную толерантность на ранней стадии противоопухолевого иммунного ответа, реализующейся в периферических иммунных органах (лимфатических узлах, селезенке), вызывая значительное ослабление иммунной толерантности. Моноклональные антитела к PD‑1 (пембролизумаб) блокируют опухоль-индуцированную анергию и апоптоз специфических цитотоксических Т-лимфоцитов в периферических тканях, включая саму опухоль. Пембролизумаб действует на заключительной, эффекторной фазе иммунного ответа против опухоли, во время которой Т-киллеры непосредственно индуцируют апоптоз или некроз неопластических клеток.
Таким образом, ипилимумаб ингибирует проксимальный, лимфоидный этап формирования иммунной толерантности к опухоли, а пембролизумаб – дистальный, тканевой, реализующийся в непосредственной близости к неоплазии. Эти различия крайне важны для безопасности терапии.
Побочные реакции иммуномодулирующих препаратов моноклональных антител
Ранние исследования показали, что PD-L1 в норме не экспрессируется на здоровых клетках солидных органов, включая молочные железы, толстую кишку, поджелудочную железу, почки, матку, скелетную мускулатуру и легкие, что делает антагонисты PD‑1 привлекательными иммунотерапевтическими агентами в плане безопасности лечения.
Хотя результаты клинических испытаний свидетельствуют о безопасности обеих иммунотерапевтических стратегий и их преимуществах перед цитостатическими химиопрепаратами, ипилимумаб вызывает большее количество побочных эффектов по сравнению с пембролизумабом. Дело в том, что ипилимумаб оказывает более обширное влияние на систему поддержания иммунной толерантности, что приводит к нежелательной отмене анергии некоторых аутореактивных клеток, покоящихся в иммунных органах, и связанной с этим индукции ряда аутоиммунных осложнений. Эти медикаментозно-индуцированные аутоиммунные реакции обычно являются нетяжелыми и купируются при помощи кортикостероидов или блокаторов фактора некроза опухоли, включая инфликсимаб, которые используются при неэффективности стероидов. Тем не менее развитие таких осложнений снижает комплайенс и ухудшает качество жизни онкологических пациентов.
Аутоиммунные реакции встречаются как минимум в 25-30% случаев при использовании ипилимумаба, причем чаще всего развиваются дерматит и колит, несколько реже – пневмонит, гепатит, пангипопитуитаризм и тиреоидит. Применение коротких курсов ипилимумаба c использованием 4 доз препарата по 3 мг/кг каждые 3 недели, одобренное FDA, позволяет сократить удельный вес тяжелых побочных эффектов до 10-15% случаев [32].
При рассмотрении механизма развития аутоиммунных осложнений иммунотерапии следует учитывать, что CTLA‑4 и PD‑1 экспрессируются на высоком уровне на регуляторных СD4+CD25+ Т-лимфоцитах, которые участвуют в поддержании механизмов периферической иммунной толерантности. Активация этих рецепторов приводит к усилению пролиферации регуляторных Т-клеток и служит профилактикой срыва иммунной толерантности к антигенам собственного организма. Поскольку многие опухоли инфильтрированы регуляторными Т-лимфоцитами, блокада их активности при помощи пембролизумаба позволяет усилить противоопухолевый иммунный ответ, помимо прочего, и путем устранения иммуносупрессии, опосредованной регуляторными Т-лимфоцитами, инфильтрирующими опухоль. Тем не менее параллельное подавление регуляторных Т-клеток периферических иммунных органов, более выраженное при использовании ипилимумаба с проксимальным механизмом действия, способствует срыву иммунной толерантности и индукции аутоиммунных осложнений у некоторых пациентов, получающих иммунотерапию.
Пембролизумаб не воздействует на систему поддержания иммунной толерантности в лимфоидных органах. Этот препарат оказывает прицельное, сосредоточенное влияние на эффекторные цитотоксические Т-клетки, накапливающиеся в периферических тканях, включая ЛИО. Поэтому частота тяжелых побочных эффектов, требующих применения стероидов, не превышает 13-14% даже при проведении длительных курсов терапии [2]. При этом пембролизумаб отменяет опухоль-индуцированный апоптоз специфических Т-киллеров, распознающих опухолевые антигены, то есть купирует вторичный дефицит специфического клеточного иммунитета, лежащий в основе прогрессирования злокачественного новообразования. Данный эффект не позволяет опухоли ускользать от иммунного ответа и создает условия для реализации эффективной клеточной цитотоксической реакции против неоплазии.
Пембролизумаб не наделен свойствами цитостатика и не разрушает опухоль непосредственно, что позволяет избежать ряда тяжелых побочных эффектов. Этот препарат устраняет вызванный опухолью иммунодефицит, а разрушение опухоли и профилактику метастазов осуществляет иммунная система организма.
Результаты клинических испытаний
Ипилимумаб успешно прошел двойные слепые плацебо-контролируемые исследования у пациентов с меланомой [28]. Пембролизумаб находится на завершающей стадии исследований, посвященных терапии меланомы и рака легких, однако убедительные предварительные результаты позволили уже сейчас внедрить данное лекарственное средство в современные алгоритмы лечения меланомы.
Недавно A. Daud и соавт. представили результаты последнего рандомизированного клинического исследования с участием 411 пациентов с неоперабельной меланомой. В целом общая частота ответов составила 34%, в группе пациентов, не получавших ранее ипилимумаб, – 39%, а в группе ипилимумаба – 29%. В 81% случаев отмечался клинический ответ на иммунотерапию с медианой на уровне 18 мес.
Результаты последнего открытого мультикогортного клинического исследования фазы Ib с участием 665 пациентов с запущенной меланомой показывают, что назначение пембролизумаба ассоциировано с возрастанием общего уровня ответа на терапию на 33%, уровня 12-месячного выживания без прогрессирования на 35% и медианы общего выживания – на 23 мес. Побочные эффекты 3 и 4 степени тяжести отмечались лишь в 14% случаев [27].
Пембролизумаб доказал эффективность при немелкоклеточном раке легкого. Экспрессия PD‑1, обнаруженная при иммуногистохимическом анализе образцов ткани опухоли, была информативным предиктором положительного ответа на иммунотерапию, поскольку 67% пациентов с такой экспрессией ответили на лечение, в то время как лишь у 4% лиц без молекул PD‑1 отмечался хороший ответ на иммунотерапевтические вмешательства [11]. Повторное лечение антагонистом PD‑1 было апробировано у пациента, который ответил на первичный курс иммунотерапии, и это вмешательство привело к 16-месячной ремиссии опухоли. Поэтому есть основания для инициации специальных исследований, посвященных повторным курсам анти-PD‑1 иммунотерапии у ответчиков.
Комбинированная терапия при помощи анти-CTLA‑4 агента ипилимумаба и ниволумаба, блокирующего PD‑1, недавно продемонстрировала благоприятный профиль безопасности и более сильный терапевтический эффект по сравнению с монотерапией каждым препаратом в специально спланированном исследовании с небольшим количеством участников, причем у 42% пациентов отмечалась редукция опухоли более чем на 80% на протяжении 36 недель терапии, однако удельный вес аутоиммунных осложнений возрос до 73-93% случаев [30]. Пациент с фолликулярной лимфомой положительно ответил на комбинированную терапию пембролизумабом и ритуксимабом без развития тяжелых побочных эффектов [15]. На данный момент проходит II фаза клинических испытаний подобного комбинированного подхода. Также продолжаются исследования I/II фаз комбинированной терапии пембролизумабом и леналидомидом при множественной миеломе и пембролизумабом со стандартной химиотерапией при ряде солидных опухолей, включая рак поджелудочной железы.
Результаты недавнего открытого сравнительного рандомизированного клинического исследования ІІІ фазы с участием 305 пациентов с запущенным PD-L1-положительным немелкоклеточным раком легкого, проведенное M. Reck и соавт., указывают на медиану выживаемости без прогрессирования на уровне 10,3 мес у пембролизумаба и лишь 6 мес у конвенционной химиотерапии. Кроме того, уровень общей 6-месячной выживаемости (80,2 против 72,4%), равно как и чувствительность к лечению (44,8 против 27,8%), были выше у пембролизумаба по сравнению с рекомендуемыми химиотерапевтическими препаратами. При лечении пембролизумабом отмечалось вдвое меньше побочных эффектов 3-5 степени тяжести (26,6 против 53,3% случаев) [26].
Данные открытого рандомизированного когортного клинического исследования ІІ фазы под названием KEYNOTE‑021 с участием 123 пациентов с запущенным несквамозным немелкоклеточным раком легких указывают на пользу от добавления пембролизумаба к цитостатикам карбоплатину и пеметрекседу в схеме противоопухолевой терапии. Объективный ответ на проводимое лечение отмечен в 55% случаев в группе с применением пембролизумаба по сравнению с 18% случаев в группе использования только химиотерапевтических агентов (расчетная терапевтическая разница 26%; 95% ДИ 9-42%; p=0,0016), хотя количество зарегистрированных побочных эффектов выше 3 степени тяжести оказалось одинаковым в обеих группах наблюдения [18].
Биомаркеры инновационной иммунотерапии
Обнаружение экспрессии PD‑L1 при иммуногистохимическом анализе образцов ткани опухоли, полученных при биопсии, является предиктором выраженного положительного ответа на пембролизумаб [11], что открывает возможности для внедрения персонифицированной иммунотерапии злокачественных новообразований. Тем не менее показана эффективность PD‑1‑антагонистов и при PD-L1‑отрицательных опухолях. Возрастание абсолютного количества лимфоцитов в крови на 3, 7 и 12 неделе терапии ипилимумабом коррелировало с клиническим улучшением и выживаемостью пациентов. Также показано, что увеличение количества эозинофилов между 2 и 3 инфузией ипилимумаба связано с повышенной выживаемостью участников исследования [5]. Небольшой стартовый размер опухоли (менее 90 мм) ассоциирован с лучшим клиническим ответом на пембролизумаб, хотя препарат был эффективным и при больших по размеру новообразованиях [16]. По уровню ИЛ‑17 в сыворотке крови на 7 неделе терапии можно предсказать развитие колита во время применения ипилимумаба [3]. Также следует учитывать, что у пациентов с анамнезом аутоиммунных заболеваний чаще развиваются побочные реакции иммуномодулирующей иммунотерапии.
Заключение
Блокада взаимодействия в системе PD‑1/PD-L1 и PD‑1/PD-L2 при помощи иммуномодулирующего препарата моноклональных антител пембролизумаба является многообещающей инновационной стратегией лечения злокачественных новообразований человека. На сегодняшний день пембролизумаб одобрен FDA для лечения метастатической меланомы в 1-й линии терапии, немелкоклеточного рака легкого при высокой экспрессии PD-L1 в 1-й линии, плоскоклеточного рака головы и шеи при прогресии на платинумсодержащей химиотерапии.
Иммуногистохимическое определение экспрессии PD-L1 в ткани опухоли – эффективный способ отбора пациентов, которые потенциально ответят на иммунотерапию. Это открывает возможности для персонифицированной терапии в онкологии.
Инновационность подхода обусловлена самой философией иммунотерапии опухоли, заключающейся не в прямом разрушении опухолевых клеток под воздействием препарата, неизбежно сопровождающемся рядом тяжелых побочных эффектов, а в устранении ключевого механизма опухоль-индуцированной иммуносупрессии, при помощи которого неоплазия уклоняется от иммунного надзора. При этом осуществляется минимальное вмешательство в деятельность организма человека, позволяющее реализоваться естественному механизму противоопухолевой защиты, сформированному в процессе миллионов лет эволюционного развития человеческого вида. Успехи инновационной иммунотерапии в онкологии открывают ошеломляющие и поистине вдохновляющие перспективы эффективного, безопасного и, главное, патофизиологически обоснованного лечения злокачественных новообразований человека.
Литература
1. Ahmadzadeh M., Johnson L.A., Heemskerk B. et al. Tumor antigen-specific CD8 T cells infiltrating the tumor express high levels of PD‑1 and are functionally impaired // Blood. – 2009. – Vol. 114(8). – P. 1537-1544.
2. Berger R., Rotem-Yehudar R., Slama G. et al. Phase I safety and pharmacokinetic study of CT‑011, a humanized antibody interacting with PD‑1, in patients with advanced hematologic malignancies // Clin. Cancer Res. – 2008. – Vol. 14. – P. 3044-3051.
3. Callahan M.K., Yang A., Tandon S. et al. Evaluation of serum IL‑17 levels during ipilimumab therapy: Correlation with colitis // J. Clin. Oncol. – 2011. – Vol. 29, abstr. 2505.
4. Deeks E.D. Nivolumab: a review of its use in patients with malignant melanoma // Drugs. – 2014. Vol. 74. – P. 1233-1239.
5. Delyon J., Mateus C., Lefeuvre D. et al. Experience in daily practice with ipilimumab for the treatment of patients with metastatic melanoma: an early increase in lymphocyte and eosinophil counts is associated with improved survival // Ann. Oncol. – 2013. – Vol. 24. – P. 1697-1703.
6. Fanoni D. et al. New monoclonal antibodies against B-cell antigens: possible new strategies for diagnosis of primary cutaneous B-cell lymphomas // Immunol. Lett. – 2011. – Vol. 134. – P. 157-160.
7. Faraone V., Arsena A., De Pasquale M.C. Purified human IgG administration, after chemotherapy, to patients with colorectal carcinoma // Minerva Gastroenterol. Dietol. – 1993. – Vol. 39(1). – P. 37-39.
8. Fishman P., Bar-Yehuda S., Shoenfeld Y. IVIg to prevent tumor metastases // Int. J. Oncol. – 2002. – Vol. 21(4). – P. 875-880.
9. Galluzzi L., Kroemer G., Eggermont A. Novel immune checkpoint blocker approved for the treatment of advanced melanoma // Oncoimmunology. – 2014. – Vol. 3(11). – e967147.
10. Galluzzi L., Vacchelli E., Bravo-San Pedro J.M. et al. Classification of current anticancer immunotherapies // Oncotarget. – 2014. – Vol. 5(24). – P. 12472-12508.
11. Garon E.B., Balmanoukian A., Hamid O. et al. MK‑3475 monotherapy for previously treated non-small cell lung cancer: preliminary safety and clinical activity // Clin. Cancer. Res. – 2014. – Vol. 20. – abstract nr A20.
12. Hamanishi J., Mandai M., Iwasaki M., Okazaki T. et al. Programmed cell death 1 ligand 1 and tumor-infiltrating CD8+ T lymphocytes are prognostic factors of human ovarian cancer // Proc. Natl. Acad. Sci USA. – 2007. – Vol. 104(9). – P. 3360-3365.
13. Hamid O., Robert C., Daud A. et al. Safety and tumor responses with lambrolizumab (anti-PD‑1) in melanoma // N. Engl. J. Med. – 2013. – Vol. 369(2). – P. 134-144.
14. Henick B.S., Herbst R.S., Goldberg S.B. The PD‑1 pathway as a therapeutic target to overcome immune escape mechanisms in cancer // Expert. Opin. Ther. Targets. – 2014. – Vol. 18(12). – P. 1407-1420.
15. Herbst R.S., Gordon M.S., Fine G.D. et al. A study of MPDL3280A enengineered PD-L1 antibody in patients with locally advanced or metastatic tumors // ASCO Meeting Abstract. – 2013. – Vol. 31. – 3000.
16. Joseph R.W., Elassaiss-Schaap J., Wolchok J.D. et al. Baseline tumor size as an independent prognostic factor for overall survival in patients with metastatic melanoma treated with the anti-PD‑1 monoclonal antibody MK‑3475 // J. Clin. Oncol. – 2014. – Vol. 32, abstr. 3015.
17. Kyi C., Postow M.A. Checkpoint blocking antibodies in cancer immunotherapy // FEBS Lett. – 2014. – Vol. 588(2). – P. 368-376.
18. Langer C., Gadgeel S.M., Borghaei H. et al. Carboplatin and pemetrexed with or without pembrolizumab for advanced, non-squamous non-small-cell lung cancer: a randomised, phase 2 cohort of the open-label KEYNOTE‑021 study // Lancet Oncology. – 2016. – Oct. 9 [Epub ahead of print].
19. Ludvigsson J.F., Neovius M., Ye W., Hammarstrom L. IgA deficiency and risk of cancer: a population-based matched cohort study // J. Clin. Immunol. – 2015. – Vol. 35(2). – P. 182-188.
20. Luke J.J., Ott P.A. PD‑1 pathway inhibitors: the next generation of immunotherapy for advanced melanoma // Oncotarget. – 2015. – Vol. 6(6). – P. 3479-3492.
21. Momtaz P., Postow M.A. Immunologic checkpoints in cancer therapy: focus on the programmed death‑1 (PD‑1) receptor pathway // Pharmgenomics Pers. Med. – 2014. – Vol. 7. – P. 357-365.
22. Murie-Fernandez M., Gurpide A., de la Cruz S., de Castro P. Total remission of thymus carcinoma after treatment with intravenous immunoglobulin // Clin. Transl. Oncol. – 2006. – Vol. 8(9). – P. 697-699.
23. Nishimura H. et al. Development of lupus-like autoimmune diseases by disruption of the PD‑1 gene encoding an ITIM motif-carrying immunoreceptor // Immunity. – 1999. – Vol. 11. – P. 141-151.
24. Nishimura H. et al. Autoimmune dilated cardiomyopathy in PD‑1 receptor-deficient mice // Science. – 2001. – Vol. 291. – P. 319-322.
25. Pardoll D.M. The blockade of immune checkpoints in cancer immunotherapy // Nat. Rev. Cancer. – 2012. – Vol. 12(4). – P. 252-264.
26. Reck M., Rodrigez-Abreu D., Robinson A.G. et al. Pemrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer // N. Eng. J. Med. – 2016. Oct. 8 [Epub ahead of print].
27. Ribas A., Hamid O., Daud A. et al. Association of Pembrolizumab with tumor response among patients with advanced melanoma // JAMA. – 2016. – Vol. 315 (15). – P. 1600-1609.
28. Robert C., Ribas A., Wolchok J.D. et al. Anti-programmed-death-receptor‑1 treatment with pembrolizumab in ipilimumab-refractory advanced melanoma: a randomised dose-comparison cohort of a phase 1 trial // Lancet. – 2014. – Vol. 384. – P. 1109-1117.
29. Thompson R.H. et al. B7–H1 glycoprotein blockade: a novel strategy to enhance immunotherapy in patients with renal cell carcinoma // Urology. – 2005. – Vol. 66. – P. 10-14.
30. Wolchok J.D. et al. Nivolumab plus ipilimumab in advanced melanoma // N. Engl. J. Med. – 2013. – Vol. 369. – P. 122-133.
31. Wolchok J.D., Neyns B., Linette G. et al. Ipilimumab monotherapy in patients with pretreated advanced melanoma: a randomised, double-blind, multicentre, phase 2, dose-ranging study // Lancet Oncol. – 2010. – Vol. 11. – P. 155-164.
32. Yervoy® (ipilimumab) prescribing information. Princeton, NJ, USA: 2013. Bristol-Myers Squibb Company. http://packageinserts.bms.com/pi/pi_yervoy.pdf
33. Zeng J. et al. Anti-PD‑1 blockade and stereotactic radiation produce long-term survival in mice with intracranial gliomas // Int. J. Radiat. Oncol. Biol. Phys. – Vol. 2013. – Vol. 86. – P. 343-349.
В Украине пембролизумаб зарегистрирован под торговым наименованием Китруда® и показан для лечения меланомы (нерезектабельной или метастатической) в виде монотерапии, а также для лечения локально прогрессирующего или метастатического немелкоклеточного рака легкого (НМРЛ) у взрослых, у которых опухоль экспрессирует PD‑L1 и которые получали ранее как минимум один курс химиотерапии. Пациенты с EGFR- либо ALK‑положительными мутациями также должны получать плановую терапию при этих мутациях до начала лечения препаратом Китруда®.
Настоящая информация предоставлена компанией MSD в качестве профессиональной поддержки специалистам здравоохранения. Информация, относящаяся к любому продукту(-ам), может не совпадать с инструкцией по применению препарата. Пожалуйста, ознакомьтесь с полным текстом инструкции для получения точной информации или данных по продуктам, рассматриваемым в настоящей публикации, до назначения.
ONCO-1205186-0000


