24 січня, 2017
Проблема лучевого проктита и современные возможности ее решения
Радиационный проктит является широко известным осложнением после лучевой терапии (ЛТ) злокачественных опухолей органов малого таза. Понимание доступных методов неинвазивной коррекции этого состояния имеет решающее значение для обеспечения адекватной помощи пациентам. Предлагаем вниманию читателей обзор современных методов терапии лучевого проктита.
Как известно, ЛТ вызывает апоптоз и гибель опухолевых клеток вследствие повреждения ДНК, белков, липидов и обычно воздействует на быстро пролиферирующие клетки опухоли. Облучение является важной составляющей комплексного лечения локализованных в тазовой области злокачественных новообразований и проводится в неоадъювантном либо адъювантном режиме. Первоначально ЛТ считалась неэффективной для лечения пациентов с опухолями этих локализаций (особенно при раке прямой кишки) из-за устойчивости к облучению. Со временем было обнаружено, что повышение дозы облучения позволяет преодолеть сопротивление опухоли, но способно приводить к повреждению органов, находящихся в зоне облучения или поблизости от нее. Наиболее часто лучевой (радиационный) проктит развивается после ЛТ рака предстательной железы (РПЖ).
Доза облучения может подводиться к целевой области с помощью внешнего пучка излучения либо посредством внедрения радиоактивных имплантатов (брахитерапия). В первом случае используется внешний генератор фотонов из различных источников, включая γ-лучи, электроны и рентгеновские лучи, подводящий к опухоли четырехмерный пучок облучения. Отрицательное воздействие такой ЛТ на окружающие органы и ткани особенно выражено при лечении РПЖ, когда некоторые области прямой кишки подвергаются облучению в тех же дозах, что и предстательная железа. С точки зрения профилактики лучевых поражений перспективны новые методы целевой доставки внешнего пучка излучения, позволяющие снизить токсичность для окружающих опухоль органов и тканей; эти условия включают в себя трехмерную конформную лучевую терапию (3D-CRT) и модулированную по интенсивности лучевую терапию (IMRT). Оба этих метода (а также другие, которые сейчас исследуются) позволяют использовать более высокие дозы облучения для тканей-мишеней при меньшем воздействии на нормальную ткань. В то же время стоимость инновационных методов значительно превышает стоимость обычной ЛТ, что ограничивает их широкое применение.
Брахитерапия уменьшает лучевое повреждение окружающей ткани за счет тщательного позиционирования имплантированных гранул. Частота развития колоректальных осложнений при применении брахитерапии, как правило, ниже по сравнению с таковыми при использовании внешнего пучка облучения. Исследование, проведенное Lesperance и соавт. (2008), показало снижение острых (6 против 43%) и хронических (2 против 21%) осложнений при использовании брахитерапии по сравнению с обычной ЛТ.
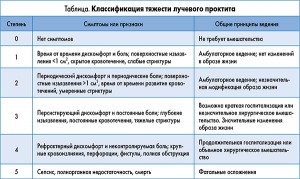
Частота развития лучевого проктита окончательно не определена из-за отсутствия консенсуса по методологии ее определения и медицинской отчетности. Существует общее представление о связи его развития с дозой облучения, способом ее доставки и областью воздействия. Как правило, лучевой проктит возникает при облучении области таза в дозах от 45 до 50 Гр в адъювантном или неоадъювантном режиме при РПЖ или аноректальных злокачественных опухолях; повышение дозы до 90 Гр считается радикальным режимом ЛТ при гинекологических злокачественных опухолях. Если дозы от 45 до 70 Гр (диапазон доз, применяющийся в большинстве случаев) сопровождаются относительно незначительными осложнениями, то дозы выше 70 Гр вызывают значительное и продолжительное повреждение окружающих органов и тканей. Онкологическая группа лучевой терапии (Radiation Therapy Oncology Group – RTOG) и Европейская организация по изучению и лечению рака (EORTC) независимо друг от друга пытались классифицировать степень лучевого проктита в градуированную систему симптомов, прогрессирующих от незначительных проявлений до фатальных осложнений (табл.). В разных исследованиях частота развития лучевого проктита при использовании обычной ЛТ колебалась в диапазоне от 2 до 39% (в зависимости от оцениваемой тяжести/класса проктита) и от 1 до 9% при применении IMRT. Заболеваемость лучевым проктитом у пациентов, получавших только брахитерапию, колебалась от 8 до 13% и повышалась до 21% при использовании в комбинации с другими методами.
Лучевой проктит следует подозревать у любого пациента, которому проводилось облучение тазовой области и у которого наблюдаются соответствующие симптомы (см. табл.). Большинство симптомов диагностируются при проведении колоноскопии или ректороманоскопии, при которых выявляются характерная бледность и рыхлость слизистых оболочек, а также телеангиэктазии. При диагностике должны быть исключены другие причины этих нарушений, в частности инфекции или воспалительные заболевание кишечника. Развитие ректовагинальных, ректоуретральных и ректовезикулярных свищей может быть поздним симптомом лучевого проктита, но их развитию, как правило, предшествуют другие симптомы.
С целью снижения степени лучевых повреждений слизистой оболочки прямой кишки исследуются возможности модификации доз ЛТ или методов ее проведения, однако результаты исследования всех существующих профилактических подходов разочаровывают. В целом все предложенные меры профилактики не способны обеспечить достоверное снижение заболеваемости лучевым проктитом.
Острый проктит является самоограничивающимся заболеванием, более 20% пациентов, проходящих ЛТ, нуждаются в коротких перерывах в лечении, чтобы купировать его симптомы. В этом случае, как правило, требуется только поддерживающее медикаментозное лечение, включающее в себя гидратацию, антидиарейные препараты и, возможно, клизмы со стероидами или 5-аминосалицилатом (месалазином). С прекращением ЛТ необходимость в дальнейшем лечении обычно отпадает.
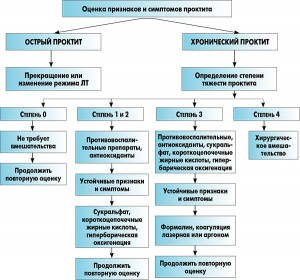
Лечение хронического проктита может осуществляться неинвазивными (противовоспалительные препараты, сукральфат, короткоцепочечные жирные кислоты, гипербарическая терапия, антиоксиданты) и инвазивными методами (абляции и хирургическое вмешательство). Хотя могут быть значительные различия в стратегиях терапии хронического проктита у разных пациентов, как правило, принято использовать наименее инвазивные вмешательства, прежде чем симптомы заболевания ухудшатся вследствие прогрессирования лучевых поражений. Общие принципы выбора терапии лучевого проктита в зависимости от степени поражения представлены в алгоритме (рис.).
Неинвазивная терапия хронического лучевого проктита начинается с введения нестероидных противовоспалительных препаратов, сукральфата, короткоцепочечных жирных кислот, гипербарической оксигенации, а также антиоксидантов.
Препаратами первого выбора, как правило, являются противовоспалительные средства, такие как сульфасалазин или 5-аминосалициловая кислота (месалазин). Считается, что механизм их действия связан с ингибированием синтеза простагландинов либо подавлением активности нейтрофильной липооксигеназы. Другие предложенные эффекты включают ингибирование фолатзависимых ферментов и активности свободных радикалов. Сульфасалазин экскретируется с желчью после поглощения через тонкую кишку и расщепляется на сульфапиридин и 5-аминосалициловую кислоту бактериями ободочной кишки.
Исследования показали, что 5-аминосалициловая кислота является активным метаболитом сульфасалазина. Другие противовоспалительные средства, которые используются в сочетании с сульфасалазином или 5-аминосалициловой кислотой, включают преднизолон, бетаметазон, гидрокортизон и метронидазол. Стероиды обладают несколькими механизмами терапевтического воздействия, которые обеспечивают разнообразные противовоспалительные эффекты – от стабилизации лизосом в нейтрофилах, что позволяет предотвратить дегрануляцию, до повышающей регуляции противовоспалительных генов путем связывания с рецепторами кортикостероидов.
Сохранение симптомов лучевого проктита после лечения противовоспалительными агентами, такими как 5-аминосалициловая кислота, в течение более пяти месяцев обусловливает необходимость лечения с применением сукральфата или пентозана полисульфата. Сукральфат представляет собой комплекс сульфатированных сахарозы и гидроксида алюминия и предположительно способен стимулировать заживление эпителия и образование защитного барьера. Результаты нескольких исследований, в том числе рандомизированных плацебо-контролируемых, показали преимущества в достижении клинических исходов при применении ректального сукральфата (2 г 2 р день). Также было показано, что ректальный сукральфат (3 г) превосходит по эффективности противовоспалительные схемы при лечении лучевого проктита и может привести к облегчению симптомов у 75% пациентов.
Короткоцепочечные жирные кислоты обеспечивают питание и стимулируют пролиферацию слизистой оболочки толстой кишки. Кроме того, они оказывают сосудорасширяющее влияние на артериолы кишечной стенки, способствуя улучшению кровотока. В здоровом организме такие кислоты синтезируются кишечными бактериями. Радиационная травма приводит к ишемии и потере архитектуры микроворсинок, что может нарушить процесс поглощения жирных кислот, тем самым способствуя патологическим изменениям при хроническом лучевом проктите. Добавление в схемы лечения лучевого проктита клизм, содержащих короткоцепочечные жирные кислоты, способствует скорейшему заживлению слизистой оболочки. Два рандомизированных исследования с использованием клизм на основе бутирата (бутират 40 мМ) показали недостоверное улучшение симптомов лучевого проктита вопреки предшествующим сообщениям об отсутствии эффективности этого подхода.
Данные об использовании гипербарической оксигенации при хроническом лучевом проктите очень ограниченны. Преимущество этого метода в лечении лучевого проктита теоретически достигается за счет уменьшения тканевой гипоксии, возможно, посредством стимуляции развития кровеносных сосудов, а также за счет антибактериального эффекта. Большинство исследований показывают, что гипербарическая оксигенация – дорогостоящий метод лечения, который недоступен для пациентов, проходящих лечение за пределами высокоспециализированных медицинских центров, поскольку требует повторяющихся процедур и специализированного оборудования.
Считается, что окислительный стресс является основным механизмом развития хронического лучевого проктита; вещества, обладающие антиоксидантными свойствами, использовались при попытке ограничить повреждение тканей в области лучевой травмы. Исследование, проведенное M. Kennedy и соавт. (2001) с участием только 10 пациентов, показало, что использование витаминов Е и С значительно снижает частоту диареи. Также изучалась эффективность витамина А как монотерапии и в сочетании с другими методами. В двойном слепом исследовании, проведенном E. Ehrenpreis и соавт. (2005), применение витамина А значительно снижало симптомы проктита и эффекты, наблюдавшиеся у пациентов в группе плацебо после кроссовера.
Менее 10% пациентов с лучевым проктитом нуждаются в хирургическом вмешательстве. Хирургические методы лечения направлены на конкретные симптомы и осложнения лучевого проктита, такие как непрекращающиеся кровотечения, перфорации, стриктуры и свищи. В редких случаях хирургические вмешательства используются для лечения неконтролируемой боли. При рассмотрении возможности хирургического лечения важно принимать во внимание патофизиологию радиационного повреждения: микроваскулярные лучевые повреждения не только вызывают симптомы проктита, но также способны значительно ухудшить заживление после любой операции. Целесообразность хирургического лечения рекомендуется обсуждать с пациентами, поскольку даже в случае технического успеха операции высока вероятность неприемлемых долгосрочных отрицательных эффектов, включая осложненное рубцевание, стриктуры и недержание мочи. При тяжелых и непрекращающихся кровотечениях хирургические варианты лечения очень ограниченны, поскольку редко позволяют полностью контролировать кровотечение. Во всех случаях, принимая во внимание плохое качество тканей в облученной области, следует рассматривать по крайней мере временную отсрочку операции. Большинство исследований демонстрируют плохие результаты хирургического лечения лучевого проктита и высокую частоту осложнений (15-80%), в том числе приводящих к гибели пациента в 3-9% случаев.
В целом лучевой проктит является относительно редким осложнением ЛТ. Частота развития острого и хронического проктита уменьшается с развитием методов ЛТ, которые обеспечивают целевую доставку высоких доз облучения. Лучевой проктит возникает в результате облучения в дозах, находящихся за пределами способности нормальной ткани к репарации или восстановлению от лучевой травмы. Последние данные свидетельствуют о том, что ухудшение состояния слизистой оболочки прямой кишки, требующее лечения, может также означать, что на другие органы воздействиют столь же высокие дозы облучения, и впоследствии они могут быть подвержены повышенному риску развития злокачественной трансформации.
Было высказано предположение, что пациенты, подвергающиеся ЛТ в высоких дозах, должны быть более тщательно экранированы, в этом направлении необходимы дальнейшие исследования. Хотя в настоящее время не существует никаких адекватных профилактических мер, большинство случаев лучевого проктита поддаются лечению. Противовоспалительные препараты, сукральфат, стероиды в сочетании с контролем боли обеспечивают успешное устранение симптомов в большинстве клинических случаев. В более тяжелых случаях, особенно при наличии кровотечений, эффективно химическое (формалин) или термическое (эндоскопическая коагуляция) воздействие. Хирургическое вмешательство редко требуется для лечения этого состояния и в тяжелых клинических случаях может привести к значительному улучшению, однако сопровождается повышенным риском послеоперационных осложнений. Необходимы дополнительные исследования, чтобы оценить дальнейшие перспективы профилактики и лечения лучевого проктита, особенно с учетом наличия у пациентов некоторых сопутствующих заболеваний.
Для справки
Месалазин (Салофальк) выпускается в нескольких лекарственных формах: таблетки, гранулы, суппозитории и клизма. Выбор лекарственной формы зависит от длительности пораженного участка кишечника и локализации патологического процесса. При проктите и проктосигмоидите (дистальные формы колита) рекомендуется преимущественно ректальное введение в виде клизм или в форме суппозиториев. У пациентов с левосторонним патологическим процессом в толстой кишке возможна монотерапия в виде местного назначения клизм и суппозиториев или комбинация местной формы с таблетками или гранулами. Обычно применяют в дозах 500 мг 3 р/сут, рекомендованная суточная доза составляет 1500 мг. При тяжелом течении заболевания суточная доза может быть повышена до 3-4 г.
Do N., Nagle D., Poylin V. Radiation Proctitis: Current Strategies in Management. Gastroenterology Research and Practice. Volume 2011, Article ID917941
Сокращенный перевод и адаптация Катерины Котенко