14 листопада, 2016
Опухоли поджелудочной железы и микроокружение. Новые научные данные
К настоящему времени накоплен массив разрозненных данных, посвященных метаболическим аспектам взаимодействия между опухолевыми клетками поджелудочной железы и клетками микроокружения. В основе этого взаимодействия лежит передача опухолевыми клетками целенаправленных сигналов, приводящих к изменению метаболизма клеток микроокружения в пользу клеток опухоли.
Избыток жировых клеток в микроокружении опухоли ухудшает прогноз и результаты химиотерапии [1]
У лиц с избыточной массой тела отмечается белее высокий риск возникновения протоковой аденокарциномы поджелудочной железы (ПАПЖ). Рост этой опухоли сопровождается выраженными структурными изменениями в окружающей ткани, в частности нарушением секреторной функции ацинарных клеток, инфильтрацией тканей иммунными клетками, избыточным образованием соединительной ткани или коллагена вокруг опухоли и повышенным накоплением компонентов внеклеточного матрикса.
Согласно результатам исследования J. Incio и соавт. (2016), адипоциты наряду с иммунными и звездчатыми клетками поджелудочной железы активируют процесс миграции нейтрофилов в микроокружение опухоли посредством стимуляции экспрессии интерлейкина (ИЛ‑1β) и активации рецептора ангиотензина первого типа (AT1). Накопление нейтрофилов увеличивает воспалительные и фиброзные реакции в опухолевой ткани, что способствует снижению эффективности химиотерапии и неблагоприятному прогнозу заболевания.
На экспериментальной модели животных исследователи наблюдали повышение фиброзной реакции в участках опухоли, окруженных большим количеством адипоцитов или расположенных рядом с жировой тканью. Показано, что фиброз является характерным признаком жировой ткани у людей, страдающих ожирением при ПАПЖ; накопление коллагена как компонента фиброзной реакции в непосредственной близости от жировых клеток является важной особенностью при ожирении. Обнаружено также, что инфильтрация адипоцитами микросреды опухоли коррелирует с неблагоприятным прогнозом и неудовлетворительными результатами терапии. У лабораторных животных, страдающих ожирением, перфузия кровеносных сосудов определенного участка была значительно снижена. Ожирение также сопровождалось существенным снижением концентрации 5-фторурацила в опухоли по сравнению с контрольной группой, что подтвердило снижение эффективности химиотерапии (рис. 1).
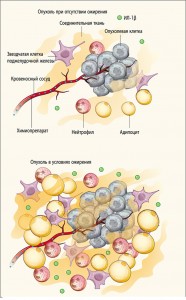 Рис. 1. Жировые клетки изменяют микроокружение опухоли. При ожирении наблюдается увеличение количества звездчатых клеток, нейтрофилов и IL-1β, а также адипоцитов. Из-за перекрестных сигнальных воздействий между адипоцитами, нейтрофилами, звездчатыми клетками и другими компонентами микроокружения увеличивается количество воспалительных клеток, происходит избыточное образование фиброзной соединительной ткани в непосредственной близости от опухоли. Более плотное микроокружение опухоли, которое отмечается при ожирении, создает дополнительное механическое напряжение тканей, может препятствовать нормальной перфузии и уменьшать ответ на ХТ
Рис. 1. Жировые клетки изменяют микроокружение опухоли. При ожирении наблюдается увеличение количества звездчатых клеток, нейтрофилов и IL-1β, а также адипоцитов. Из-за перекрестных сигнальных воздействий между адипоцитами, нейтрофилами, звездчатыми клетками и другими компонентами микроокружения увеличивается количество воспалительных клеток, происходит избыточное образование фиброзной соединительной ткани в непосредственной близости от опухоли. Более плотное микроокружение опухоли, которое отмечается при ожирении, создает дополнительное механическое напряжение тканей, может препятствовать нормальной перфузии и уменьшать ответ на ХТПредполагается, что хронический фиброз играет ключевую роль в ускорении роста опухоли и блокировании доставки препаратов. Тем не менее в предыдущих исследованиях медикаментозное ингибирование хронического фиброза приводило к увеличению иммуносупрессии, ускорению роста опухоли и снижению выживаемости. В противоположность этому J. Incio и соавт. выявили, что ингибирование основного профиброзного сигнального пути АТ1 замедляет прогрессирование опухолевого роста у лабораторных животных. Авторы предполагают, что миграция ассоциированных с опухолью нейтрофилов и продукция ИЛ‑1β являются ведущими в регуляции роста опухоли, а изменения сосудистой перфузии за счет снижения кровяного давления играют менее значительную роль. Когда авторы уменьшали количество нейтрофилов или блокировали активность ИЛ‑1β соответствующими антителами, наблюдались существенные изменения в состоянии иммуносупрессивного микроокружения опухоли и замедлялось прогрессирование ПАПЖ.
В экспериментальных исследованиях воздействие на сигнальный путь АТ1 позволяло воздействовать также на другие процессы, связанные с этим сигнальным путем, такие как эпителиально-мезенхимальная трансформация клеток или дифференцировка адипоцитов. Необходимо дальнейшее исследование роли фиброза в процессе развития и прогрессирования ПАПЖ, особенно при ожирении.
Заслуживают внимания и клеточные изменения, вызванные механическим воздействием адипоцитов. Баланс между внутренним и внешним механическим воздействием на клетку может регулировать апоптоз клеток, клеточную пролиферацию, адгезию и миграцию, и его нарушение может привести к повышению риска развития опухоли. Кроме того, давление, оказываемое компонентами твердых тканей микроокружения опухоли, может приводить к сжатию кровеносных сосудов, в результате чего дополнительно снижается перфузия.
J. Incio и соавт. показали, что лечение с применением блокатора АТ1 лозартана может уменьшать механическое воздействие на клетки и замедлять рост ПАПЖ у лабораторных животных. Необходимы дополнительные исследования для определения типа переключения процессов транскрипции в условиях плотного микроокружения опухоли, характерного при ожирении. Нормализация состояния внеклеточного матрикса опухоли за счет уменьшения его жесткости может оказаться более эффективным и безопасным подходом к терапии, чем попытки удалять непосредственно компоненты стромы.
Также важно исследование взаимосвязи между адипоцитами и регуляцией стволовых клеток. Зрелые белые адипоциты отвечают на пищевые и гормональные сигналы через секрецию сигнальных протеинов. Предшествующие исследования указывают на то, что белая жировая ткань принимает участие в регенерации тканей и регулирует стволовые клетки, занимая центральное место во многих процессах при опухолевой прогрессии. Мезенхимальные или стромальные стволовые клетки вносят существенный вклад в образование адипоцитов. Установлено, что механическое напряжение также является пусковым механизмом для развития некоторых популяций стволовых клеток.
Дальнейшие исследования покажут, сможет ли воздействие на опухоль-ассоциированные нейтрофилы, панкреатические звездчатые клетки или адипоциты стать эффективным и безопасным методом лечения ПАПЖ.
Клетки микроокружения в процессе аутофагии высвобождают аминокислоты для опухолевых клеток [2]
Развитие ПАПЖ сопровождается явлением десмоплазии, в результате которой опухоль оказывается окруженной плотной рубцовой тканью. Хотя десмоплазия стимулируется сигналами, поступающими из опухолевых клеток, образующаяся рубцовая ткань препятствует кровоснабжению опухоли и, следовательно, снижает доступ к ней кислорода, глюкозы и других питательных веществ.
Каким же образом опухолевые клетки восполняют дефицит нутриентов в условиях недостаточного кровоснабжения? В ходе исследований, проведенных С.М. Sousa и соавт. (2016), выявлено, что факторы, выделяемые звездчатыми клетками, могут стимулировать активность митохондрий в клетках опухоли. Повышенная митохондриальная активность обусловлена потреблением опухолью аминокислоты аланина, которая выделяется звездчатыми клетками в огромном количестве. Чтобы проследить путь аминокислоты в клетках ПАПЖ, использовали молекулы аланина, меченые тяжелыми изотопами углерода. В итоге были обнаружены изменения метаболизма аланина, не соответствующие его нормальной роли в биосинтезе белка. При поступлении в клетки аланин подвергается трансаминированию с образованием пирувата. Пируват является ключевой молекулой в митохондриальном цикле трикарбоновых кислот и в здоровых клетках образуется преимущественно из глюкозы в процессе гликолиза. Другим потенциальным источником пирувата является аланин.
Трансаминирование аланина с образованием пирувата обычно осуществляется в цитоплазме. Однако в опухолевых клетках аланин в первую очередь поступает в митохондрии, где подвергается трансаминированию; образовавшийся пируват далее включается в цикл трикарбоновых кислот, обеспечивая клетки энергией и липидами (рис. 2). Глюкоза в условиях ограниченного ее поступления используется опухолью в других обменных процессах (в частности, для биосинтеза серина, необходимого для биосинтеза нуклеиновых кислот). Следует отметить, что в здоровых клетках пируват, синтезированный из аланина в цитоплазме, также может транспортироваться в митохондрии, однако этот процесс не играет значительной роли. Прямое трансаминирование большого количества аланина в пируват в митохондриях определяет его роль как источника энергии, а также структурных молекул.
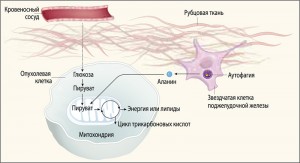 Рис. 2. Рубцовая ткань ограничивает кровоснабжение, доставку кислорода, глюкозы и других питательных веществ в опухолевые клетки. В процессе аутофагии звездчатые клетки поджелудочной железы высвобождают аминокислоты из собственных белков. Аминокислота аланин, поступая в митохондрии опухолевой клетки, метаболизируется в пируват, который участвует в цикле трикарбоновых кислот с образованием энергии и липидов
Рис. 2. Рубцовая ткань ограничивает кровоснабжение, доставку кислорода, глюкозы и других питательных веществ в опухолевые клетки. В процессе аутофагии звездчатые клетки поджелудочной железы высвобождают аминокислоты из собственных белков. Аминокислота аланин, поступая в митохондрии опухолевой клетки, метаболизируется в пируват, который участвует в цикле трикарбоновых кислот с образованием энергии и липидовИсследования С.М. Sousa и соавт. (2016) показали, что процесс аутофагии, используемый здоровыми клетками для расщепления и утилизации молекул белков, липидов и других макромолекул в условиях дефицита питательных веществ, может воздействовать на окружающие клетки. Ранее аутофагия рассматривалась исключительно как внутриклеточный процесс, значимый для выживания той клетки, в которой он происходит. Новые исследования показали, что ингибирование аутофагии в панкреатических звездчатых клетках не влияет на их рост, но существенно уменьшает продукцию аланина и рост опухолевых клеток как in vitro, так и in vivo (когда ПАПЖ и звездчатые клетки поджелудочной железы были трансплантированы экспериментальным животным).
Для самих опухолевых клеток также характерна высокая активность аутофагии, что помогает им поддерживать обменные процессы при неблагоприятных условиях. Ранее полученные данные о том, что клетки ПАПЖ могут поглощать внеклеточные белки, например альбумин, свидетельствуют об их способности поддерживать метаболизм, используя разные источники для получения питательных веществ. Дальнейшее изучение механизма стимуляции опухолевыми клетками процесса аутофагии, а также секреции аланина панкреатическими звездчатыми клетками представляет значительный научный интерес.
Литература
1. Arcan M.C. Fat and the fate of pancreatic tumors. Nature, Vol. 536, august 2016.
2. Kamphorst J., Gottlieb E. Friendly neighbours feed tumour cells. Nature, 2016.
Подготовили Катерина Котенко и Екатерина Марушко


