14 листопада, 2016
Микророботы в онкологии: краткий обзор высокотехнологических разработок
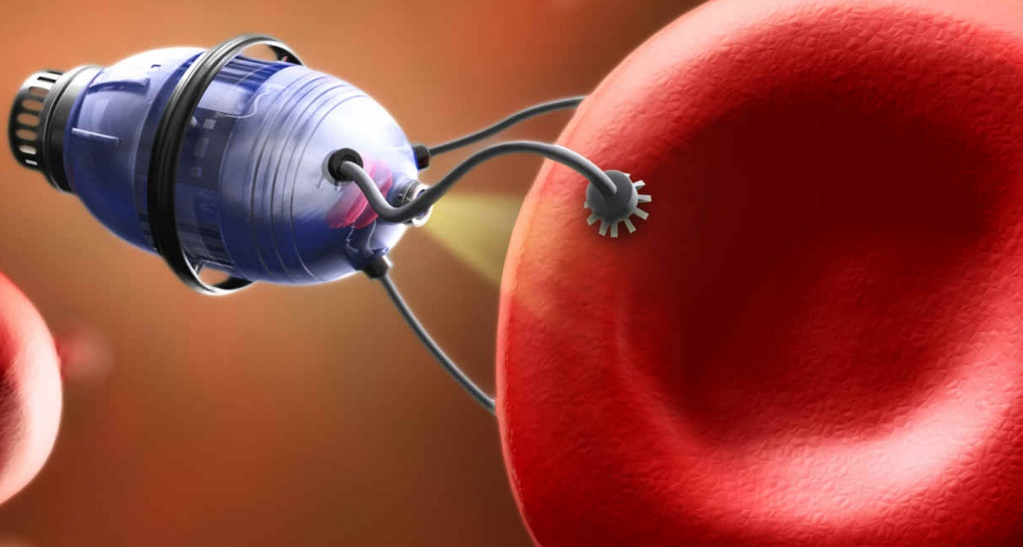
Создание материалов с новыми химическими, биологическими, физическими свойствами может радикально изменить подходы к диагностике и терапии рака. В последние десятилетия наблюдается определенный прогресс во внедрении в клиническую практику микроробототехники, разрабатываются новые методы диагностики и лечения с применением наночастиц. Одним из наиболее интригующих и перспективных направлений в этой области является создание микророботов.
Одно из направлений микроробототехники занимается проектированием и тестированием микроскопических подвижных роботов размером ≤1 мм, предназначенных для применения в медицинских целях и предполагающих внедрение в человеческий организм. Передвигаясь по кровеносной системе человека, микророботы способны прицельно доставлять лекарственные препараты, выявлять и уничтожать опухолевые клетки или разрушать тромбы, в том числе опухолевые (рис. 1). Хирургические микророботы способны выполнять хирургические операции без инвазивных вмешательств. Терапия с применением микророботов, по сравнению со стандартной химиотерапией, может обладать более мощным противоопухолевым эффектом благодаря целенаправленному воздействию на трансформированные ткани и обеспечению более активного перемещения активных веществ внутрь клетки [1]. Микророботы обладают рядом преимуществ, в том числе способностью защищать транспортируемые ими молекулы лекарственных препаратов от разрушения в организме, обеспечивать повышение абсорбции препарата в опухолевых клетках, контроль над распределением препарата в тканях.
В настоящее время в разработке и на этапе исследований находятся разные виды микророботов, которые существенно различаются между собой по строению и функциям. Они могут состоять из гидрогеля, наночастиц и других вспомогательных компонентов (антитела, пептиды), включать в себя компоненты бактерий (рис. 2).
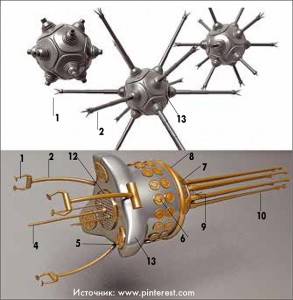 Рис. 2. Варианты структуры наноробота
Рис. 2. Варианты структуры наноробота1. Захват манипулятора
2. Телескопический макроманипулятор
3. Наноманипулятор
4. Основной наноманипулятор
5. Биомолекулярный наносенсор
6. Акустический сенсор
7. Сенсор окружающей среды
8. Дипольная антенна
9. Соединительный коннектор
10. Локомоторный жгутик
11. Жгутиковый пневматический коннектор
12. Место прикрепления наноманипуляторов
13. Корпус
наноробота
Например, магнитные наночастицы обеспечивают передвижение под воздействием электромагнитных полей, помимо этого они служат каркасом для микроробота. Процесс производства микророботов этого типа предполагает, что наночастицы размещаются в слое гидрогеля, а затем под воздействием электромагнитного поля занимают определенное положение в пространстве. Одновременно гидрогель полимеризуют, вследствие чего его структура уплотняется. При попадании в жидкую среду организма микророботы накапливают влагу, раскрываются и принимают заданную форму. В таком виде они способны двигаться под воздействием электромагнитного поля в нужном направлении. В дальнейшем нагрев роботов способствует выделению препаратов либо приводит к активации механизмов, направленных на разрушение опухолевых клеток [2].
Существует несколько принципов доставки молекул лекарственного препарата в опухоль.
• Пассивное нацеливание. Наночастицы могут проникать через стенки кровеносных сосудов в ткани опухоли, неполноценный отток крови и лимфы из опухолевой ткани позволяет препаратам накапливаться в них сильнее, чем в нормальных тканях. Пассивный захват наночастиц возможен также ретикулоэндотелиальной системой.
• Активное нацеливание подразумевает присоединение к носителям «молекулярного адреса», в качестве которого могут выступать самые разные молекулы – антитела, рецепторы, пептиды и небольшие молекулы. Часто упор делается на то, что здоровые и больные клетки несут на поверхности одинаковый набор молекул, но в разном количестве. Таким образом, препарат доставляется к опухолевым клеткам благодаря экспрессии рецепторов на поверхности клетки мишени.
• Комбинированные объекты с активным и пассивным нацеливанием, способные повышать эффективность терапии при снижении дозы препаратов.
Разрабатываются разные варианты покрытия нанороботов, позволяющие избежать нападения на них со стороны иммунной системы человека. Структура нанороботов должна позволять им успешно перемещаться по кровеносной системе, сквозь сложную сеть капилляров, артерий и вен, не теряя при этом своей структуры и функций. С этой целью исследуются и моделируются особенности течения крови в сосудах разного диаметра, распределение температур в кровеносном русле и их взаимосвязь с движением нанороботов [3].
Одной из проблем создания микророботов является обеспечение их высокой работоспособности при ограниченном электропитании. С этой целью можно использовать миниатюрный батарейный источник питания (плоские круглые аккумуляторы), энергию окружающей среды, такую как вибрация или энергия света. Передвижение робота также может осуществляться за счет переменных электромагнитных полей. Электроды, установленные на корпусе микроробота, могут формировать батарею на основе электролитов непосредственно из крови. Робот может переносить небольшой запас химических веществ, которые при взаимодействии с кровью реагируют, выделяя энергию.
Не менее интересным и перспективным является использование биологических моторов в качестве источника энергии. Так, белки жгутиков бактерии Serratia marcescens способны приводить в действие роботизированное устройство, получая химическую энергию из окружающей среды [1].
В целом передвижение микророботов может осуществляться посредством следующих механизмов:
• пассивное передвижение с током крови;
• жгутики и реснички, прикрепленные к корпусу робота, способные спиралевидно двигаться и отталкиваться от объектов;
• миниатюрные придатки для захвата и передвижения по кровеносным сосудам, действующие при наличии магнитного поля;
• электромагнитный насос – при помощи конденсатора генерируются магнитные поля, создающие необходимую для движения силу тяги магнитных наночастиц;
• миниатюрный струйный насос;
• вибрирующие мембраны – попеременное натяжение и расслабление мембраны создает тягу, необходимую для движения [4].
Ученые из Южной Кореи применили новую методологию создания микророботов. В ее основе лежит прикрепление бактерии к микрокапсуле, содержащей лекарственный препарат [5]. Известно, что бактерии способны реагировать на повышенные концентрации определенных веществ, которые выделяются клетками опухоли, и мигрировать в эти области. Ученые создали (и успешно применили in vitro) экспериментальную модель робота, позволяющую переносить флуоресцентный материал непосредственно на поверхность клеток опухоли. Дальнейшим шагом будет создание модели, доставляющей химиопрепараты в опухолевые клетки без нанесения ущерба здоровым клеткам. В структуре микроробота бактерия играет роль микродвигателя, микросенсора и терапевтического агента, так как сама по себе может подавлять рост опухоли. Для создания бактериоробота была выбрана высокоподвижная ослабленная бактерия Salmonella typhimurium. Высокая степень сродства между биотином (белком стенки бактерии) и стрептавидином (белком в структуре микрокапсулы) была использована в моделировании прикрепления бактерии к микрокапсуле робота. Вначале была произведена модификация бактерии, таким образом, что биотин оказался связанным с внешними трансмембранными белками на поверхности бактерии. Затем бактерия была привязана к флуоресцентному полистиролу, ковалентно связанному со стрептавидином. Когда бактерия проникает в злокачественную клетку, флуоресцентный полистирол остается на поверхности, позволяя идентифицировать опухоль.
Одним из последних объектов исследований является микроробот на основе макрофагов, уже ознакомленных с опухолью. Он представляет собой гибридную систему, способную доставлять терапевтические агенты в область опухоли и активировать их на месте [6]. Микророботы на основе макрофагов включают в себя PLGA-наночастицы, содержащие доцетаксел и магнитные наночастицы (Fe3O4). Биоразлагаемые PLGA-наночастицы широко используются в качестве носителей молекул противоопухолевых препаратов или ассоциированных с опухолью антигенов. Кроме того, PLGA-наночастицы способны активировать цитотоксические CD8+ лимфоциты путем презентации антигена иммунным клеткам. Макрофаги, ознакомленные с антигенами опухоли, осуществляют адресную доставку микроробота в зону опухоли.
Магнитные наночастицы, состоящие из Fe3O4, активируются неинвазивным электромагнитным полем, позволяя дистанционно активировать контролируемое высвобождение препарата. Подобные микророботы создаются путем фагоцитоза лекарственного и магнитного компонента макрофагами. Проводилась оценка химиотерапевтического эффекта таких микророботов и их способности активироваться под воздействием электромагнитной системы.
Исследовательской группой из Южной Кореи во главе с Choi Hong был разработан микроробот, который эффективно передвигается в вязкой жидкости, имитируя волнообразные движения ресничек парамеций (Paramecium caudatum) [7]. Данные микророботы были изготовлены с использованием сложнейшей технологии ультратонкой трехмерной обработки с асимметричным магнитным распределением движений ресничек. При помощи трехмерной лазерной технологии на фотоотражающий полимерный материал было нанесено никелевое и титановое покрытие, что обеспечило возможность ассиметричного движения ресничек. Такая технология производства существенно увеличила скорость и свободу передвижения робота. Максимальная скорость таких микророботов длиной 220 мкм и шириной 60 мкм составляет 0,34 мм/с, что в 8,6 раза превышает скорость движения стандартных роботов. Кроме того, эти роботы способны свободно менять направление даже в областях диаметром 80 мкм, что делает их очень маневренными.
Группа ученых из лаборатории медицинской робототехники Израильского технологического института разработала ViRob – микроробота диаметром 1 мм и длиной 14 мм, способного передвигаться по сосудам и полостям (кровеносные сосуды, желудочно-кишечный тракт, дыхательная система) под воздействием внешнего магнитного поля [8]. Основные области применения данного робота – целевая доставка лекарственных препаратов, взятие образцов ткани или перемещение микрокатетера по извилистым каналам организма. В частности, активно изучается применение ViRob при раке легкого. Ученые также планируют обеспечить робота дополнительным оборудованием, таким как камеры, щипцы и т.д. Робот движется, используя внешнюю электромагнитную систему; стимулирование электромагнитным полем (обладающим безопасной для организма частотой и силой) позволяет роботу маневрировать в вязких жидкостях, а также на поверхности сосудов. Вибрация, создаваемая электромагнитным полем, позволяет роботу двигаться со скоростью 9 мм/с [8].
Предполагается, что по завершении своей функции нанороботы будут выводиться из организма через естественные экскреторные пути. Если предположить, что наноробот не предназначен персистировать в организме пациента, он должен быть в состоянии своевременно и эффективно выводиться из организма естественным путем, без каких-либо осложнений [3].
В последние годы разработано много вариантов нанороботов. Ни один из них еще не внедрен в онкологическую практику: необходимо совершенствование экспериментальных технологий и масштабные клинические исследования. Важно совершенствовать производство нанороботов и подходы, позволяющие врачу в условиях реальной клинической практики контролировать их активность непосредственно в опухолевом очаге или других мишенях терапевтического воздействия. В проектировании нанороботов используются методы 3D-визуализации в режиме реального времени и аппаратные средства контроля [3].
Благодаря микророботам станет возможной доставка препаратов непосредственно в опухоль без воздействия на здоровые клетки. Перспективным также является физическое воздействие на клетки посредством роботов (например, хирургическое удаление опухолевых тромбов). Внедрение этих технологий сопряжено с немалыми трудностями, но активная разработка и дальнейшее применение открывают ранее невиданные возможности в терапии рака.
Литература
1. www.robotpark.com/academy
2. www.managedcaremag.com
3. www.nanorobotdesign.com
4. Peyer K., Zhang L., Nelson B. Bio-inspired magnetic swimming microrobots for biomedical applications. Nanoscale 5(4), 2012.
5. Park S.J., Park S.-H., Cho S. et al. New paradigm for tumor theranostic methodology using bacteria-based microrobot. Scientific Reports 3. Article number: 3394 (2013).
6. Han J., Zhen J., Nguyen V.D. et al. Hybrid-Actuating Macrophage-Based Microrobots for Active Cancer Therapy. Scientific Reports 6, Article number: 28717 (2016).
7. Kim S., Lee S., Lee J. et al. Fabrication and Manipulation of Ciliary Microrobots with Non-reciprocal Magnetic Actuation. Scientific Reports, 2016; 6: 30713 DOI: 10.1038/srep30713.
8. Development of Medical robot Database and medical robot curriculum 1/2010.
Подготовили Екатерина Марушко и Катерина Котенко



