9 липня, 2016
Руксолитиниб в терапии истинной полицитемии

Истинная полицитемия (ИП) – миелопролиферативная неоплазия, характеризующаяся увеличением эритроцитарной массы. Цель лечения ИП состоит преимущественно в уменьшении риска тромбоза и смертности, связанных с сердечно-сосудистыми событиями. В последние годы доказательная база в лечении ИП существенно расширилась благодаря результатам крупных рандомизированных исследований.
Развитие ИП связано с дисрегуляцией и активацией сигнального пути JAK/STAT (приблизительно 95% пациентов имеют мутацию JAK2V617F в 14 экзоне, 4% – мутацию JAK2 в 12 экзоне, и только у небольшого количества больных ИП эти мутации отсутствуют). У большинства больных ИП наблюдаются вазомоторные симптомы (в пределах 30% – головные боли, нарушение зрения, эритромегалия) или зуд (около 35%), потенциально связанные с избыточной вязкостью крови; в 36% случаев встречается спленомегалия. В момент постановки диагноза ИП или ранее до 16% пациентов перенесли тромбоз артерий, 7% – венозный тромбоз, 4% – эпизод сильного кровотечения; после установления диагноза эти показатели составляют 12, 9 и 4% соответственно. ИП может трансформироваться в более агрессивные гематологические заболевания, такие как миелофиброз (МФ, 15,2% после 10 лет ИП), острый миелоидный лейкоз (ОМЛ) или миелодиспластический синдром (МДС, 7% в течение 20 лет).
Исследование ECLAP выявило, что низкие дозы аспирина при ИП снижают риск крупных тромботических осложнений или смерти от сердечно-сосудистых причин, не увеличивая риск развития кровотечений. В исследовании CYTO-PV показано, что низкие дозы аспирина могут применяться для коррекции гематокрита и сердечно-сосудистых факторов риска. Пациентам высокого риска (возраст ≥60 лет и/или тромбоз в анамнезе) помимо низких доз аспирина следует назначать циторедуктивные препараты (гидроксимочевину, интерфероны), необходима коррекция факторов сердечно-сосудистого риска.
Интерферон-α (ИФН-α) продемонстрировал эффективность в контроле уровня гематокрита, а также миелопролиферации, размера селезенки и зуда; однако побочные эффекты часто требуют отмены препарата. Пегилированный ИФН-α (ПЭГ-ИФН) является перспективной альтернативой благодаря более длительному периоду полувыведения, лучшей переносимости без отрицательного влияния на контроль заболевания, а также развитию молекулярных ремиссий у части пациентов. Однако влияние ИФН с точки зрения риска тромбозов, сердечно-сосудистой заболеваемости и смертности, а также общей выживаемости неизвестно. В настоящее время продолжаются исследования III фазы MPD-RC111 и MPD-RC112, которые посвящены изучению эффективности ПЭГ-ИФН в достижении контроля гематокрита; среди конечных точек – влияние на риск развития МДС, МФ или ОМЛ, частота основных сердечно-сосудистых событий, токсичность, переносимость и безопасность. Монопегилированный ИФН (ropeg-ИФН-α2b) изучался в исследовании I/II фазы, в том числе у 51 пациента с ИП. На 10-й неделе терапии этот препарат привел к общему гематологическому ответу в 75% случаев (у 26% достигнут полный ответ, ПО). В течение года общий ответ на лечение составил 85% (из них 29% достигли ПО); также отмечено снижение мутантных аллелей JAK2V617F.
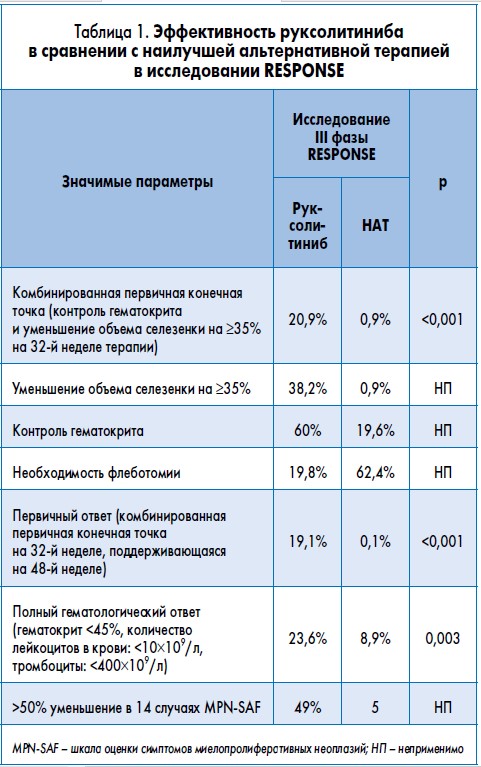 Определенные перспективы в лечении ИП связывают с таргетной терапией. Недавно опубликованы результаты первого исследования III фазы RESPONSE, в котором руксолитиниб сравнивали с наилучшей альтернативной терапией (НAT). Все пациенты получали руксолитиниб в дозе 10 мг дважды в день (доза могла быть увеличена максимум до 25 мг 2 р/день). В общей сложности были включены 222 пациента (110 получали руксолитиниб) без существенных различий в исходных характеристиках между группами. Группа НАТ включала 66 (58,9%) пациентов, получавших гидроксимочевину, 13 (11,6%) – ИФН, 8 (7,1%) – анагрелид, 2 (1,8%) – пипоброман, 5 (4,5%) – иммуномодулирующие агенты, и 17 (15,2%) больных, не получавших терапии.
Определенные перспективы в лечении ИП связывают с таргетной терапией. Недавно опубликованы результаты первого исследования III фазы RESPONSE, в котором руксолитиниб сравнивали с наилучшей альтернативной терапией (НAT). Все пациенты получали руксолитиниб в дозе 10 мг дважды в день (доза могла быть увеличена максимум до 25 мг 2 р/день). В общей сложности были включены 222 пациента (110 получали руксолитиниб) без существенных различий в исходных характеристиках между группами. Группа НАТ включала 66 (58,9%) пациентов, получавших гидроксимочевину, 13 (11,6%) – ИФН, 8 (7,1%) – анагрелид, 2 (1,8%) – пипоброман, 5 (4,5%) – иммуномодулирующие агенты, и 17 (15,2%) больных, не получавших терапии.
Процент пациентов, у которых через 32 недели был достигнут контроль гематокрита и размеры селезенки уменьшились на ≥35%, был выше в группе руксолитиниба (60 и 38,2% соответственно) по сравнению с группой НАТ (19,6 и 0,9% соответственно). Был достигнут ПО у 23,6% пациентов в группе руксолитиниба и 8,9% в группе НАТ (р=0,003). Количество пациентов, нуждавшихся во флеботомии в период с 8-й по 32-ю неделю терапии, было ниже на фоне руксолитиниба (19,8%) по сравнению с НАТ (62,4%). Снижение симптомов по крайней мере на 50% по МPN-SAF наблюдалось у 49% больных в группе руксолитиниба и у 5% в группе НАТ (табл. 1). Несмотря на то что дизайн исследования RESPONSE не предполагал оценки риска тромбоэмболических осложнений как конечной точки, отмечена тенденция к снижению тромбоэмболических событий в группе руксолитиниба.
В исследование IIIb фазы RELIEF были включены пациенты, у которых симптомы сохранялись на фоне терапии гидроксимочевиной, хотя препарат хорошо переносился. Первичной конечной точкой было уменьшение симптомов на >50% на 16-й неделе. Несмотря на тенденцию к большей эффективности руксолитиниба, не наблюдалось статистически значимых различий между группами: первичная конечная точка была достигнута у 43,4% пациентов в группе руксолитиниба в сравнении с 29,6% в группе гидроксимочевины (р=0,139). У пациентов группы гидроксимочевины (лечение той же дозой препарата, что и перед включением в исследование) отмечали снижение выраженности симптомов, что, возможно, объясняется эффектом плацебо. Фиксированная доза руксолитиниба была относительно низкой; можно предположить, что при более высокой дозе или большем количестве включенных в исследование пациентов разница в исходах была бы более существенной.
Несколько других исследований III фазы продолжаются в настоящее время. В их числе исследование RESPONSE‑2, посвященное сравнению руксолитиниба с НАТ у больных ИП с резистентностью/непереносимостью гидроксимочевины и потребностью во флеботомиях. В отличие от исследования RESPONSE, критериям включения в это исследование соответствовали пациенты без спленомегалии. Еще одно открытое рандомизированное исследование MAJIC посвящено сравнению эффективности и безопасности применения руксолитиниба у больных ИП и эссенциальной тромбоцитопенией с непереносимостью или резистентностью к гидроксимочевине. Основным ожидаемым результатом является количество пациентов, достигших ПО (в соответствии с критериями ELN) в течение 1 года лечения. Кроме того, MAJIC исследует такие вторичные конечные точки, как частота геморрагических и тромбоэмболических событий, общая выживаемость, выживаемость без прогрессирования заболевания, качество жизни и выраженность симптомов. Результаты, вероятно, подтвердят выводы исследования RESPONSE с точки зрения ответа на терапию. Результаты долгосрочного лечения (снижение риска геморрагических и тромбоэмболических событий, трансформация в МФ или ОМЛ, смерть), достигнутые в ходе этого исследования, имеют большое значение для подтверждения долгосрочной эффективности руксолитиниба.
Терапия руксолитинибом у пациентов с ИП относительно хорошо переносится, частота прекращения терапии в связи с побочными эффектами незначительна. В исследовании II фазы (S. Verstovsek et al., 2014) только два пациента (5,9%) прекратили лечение в связи с побочными эффектами; частота отмены в исследовании RESPONSE была сходной и составила 3,6% (A. Vanucchi et al., 2015).
Наиболее распространенными гематологическими побочными эффектами руксолитиниба являются анемия и тромбоцитопения. В исследовании RESPONSE анемия развивалась у 43,6% пациентов на фоне руксолитиниба и у 30,6% в группе НАТ, но редко достигала 3-4 степени (1,8% в группе руксолитиниба против 0% в группе НАТ). Тромбоцитопения на фоне руксолитиниба возникала в 24,5% случаев против 18,9% при НАТ, но частота тромбоцитопении 3-4 степени составила 5,4% в сравнении с 3,6% соответственно.
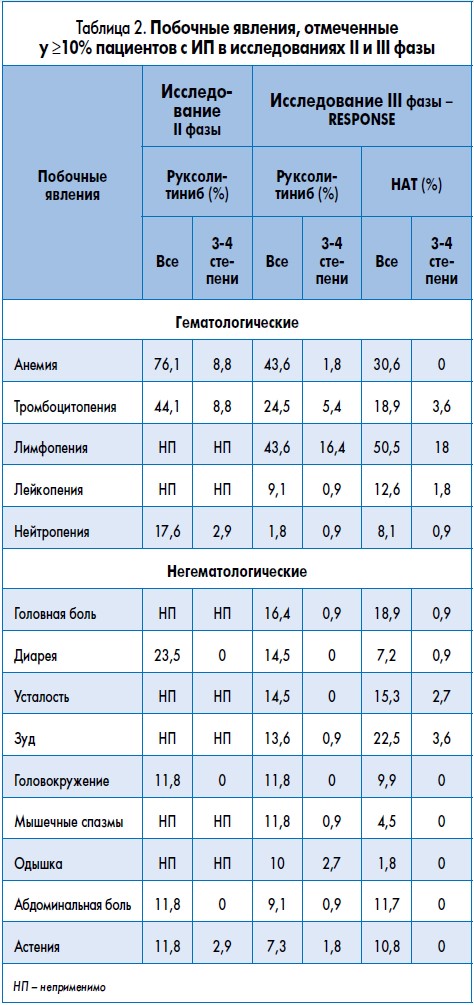 Косвенное сравнение этих результатов с результатами изучения руксолитиниба при МФ (исследование COMFORT‑2: руксолитиниб против НAT) показывает, что гематологические побочные эффекты руксолитиниба намного чаще возникают у пациентов с МФ, чем с ИП (C. Harrison et al., 2012). Подобная разница в частоте гематологических побочных эффектов объясняется фенотипом этих заболеваний (в исследовании RESPONSE исходно не было анемий, а в исследовании COMFORT‑2 анемия наблюдалась у всех пациентов). Наиболее распространенными негематологическими побочными эффектами в исследовании RESPONSE были диарея (14,5% на фоне руксолитиниба против 8,1% на фоне НАТ), мышечные спазмы (12,7 против 4,5%) и одышка (12,7 против 1,8%). Немеланомные формы рака кожи были зарегистрированы у четырех (3,6%) пациентов в группе руксолитиниба против двух (1,8%) в группе НАТ. Гематологические и негематологические побочные эффекты лечения обобщены в таблице 2.
Косвенное сравнение этих результатов с результатами изучения руксолитиниба при МФ (исследование COMFORT‑2: руксолитиниб против НAT) показывает, что гематологические побочные эффекты руксолитиниба намного чаще возникают у пациентов с МФ, чем с ИП (C. Harrison et al., 2012). Подобная разница в частоте гематологических побочных эффектов объясняется фенотипом этих заболеваний (в исследовании RESPONSE исходно не было анемий, а в исследовании COMFORT‑2 анемия наблюдалась у всех пациентов). Наиболее распространенными негематологическими побочными эффектами в исследовании RESPONSE были диарея (14,5% на фоне руксолитиниба против 8,1% на фоне НАТ), мышечные спазмы (12,7 против 4,5%) и одышка (12,7 против 1,8%). Немеланомные формы рака кожи были зарегистрированы у четырех (3,6%) пациентов в группе руксолитиниба против двух (1,8%) в группе НАТ. Гематологические и негематологические побочные эффекты лечения обобщены в таблице 2.
Сегодня рекомендации по ведению больных ИП остаются неизменными и включают:
– флеботомию, контроль факторов сердечно-сосудистого риска, низкие дозы аспирина для пациентов с низким уровнем риска;
– циторедуктивные препараты, контроль факторов сердечно-сосудистого риска, низкие дозы аспирина для пациентов с высоким риском; гидроксимочевина и ИФН продолжают оставаться основой циторедуктивной терапии для пациентов с высоким риском.
Тем не менее последние научные данные показывают, что пациенты, проявляющие резистентность к гидроксимочевине, имеют худшие результаты лечения и, возможно, требуют более агрессивных подходов к терапии. Исследование RESPONSE показало, что на фоне руксолитиниба значительное количество пациентов достигают комплексной первичной конечной точки (включая контроль гематокрита без флеботомии и уменьшение объема селезенки на >35%), а также уменьшения потребности в флеботомиях и снижения выраженности симптомов.
В исследовании RESPONSE руксолитиниб получали пациенты с непереносимостью/устойчивостью к гидроксимочевине, тогда как 58,9% пациентов в группе сравнения получали лечение гидроксимочевиной. Это может быть существенным фактором, объясняющим большие различия в реакции на руксолитиниб и НAT. Актуальность комбинированной первичной конечной точки также дискуссионна: в частности, неизвестно, приведет ли ее достижение к сокращению тромбообразования как основного фактора, определяющего заболеваемость и смертность при ИП, либо к трансформации этого заболевания в лейкоз. Дизайн исследования, предполагавший переключение на НАТ всех пациентов, не достигших первичной конечной точки на фоне терапии руксолитинибом, делает невозможным сравнение обеих групп с точки зрения долгосрочных результатов. Предполагается, что некоторые из этих моментов будут выяснены в других исследованиях III фазы, таких как MAJIC и RESPONSE‑2.
Сегодня назначение руксолитиниба при ИП может рассматриваться для пациентов, демонстрирующих устойчивость к гидроксимочевине или непереносимость этого препарата, с учетом того, что целью лечения является контроль гематокрита на уровне <45% (независимо от того, нуждаются ли пациенты во флеботомии). Важно учитывать, что в настоящее время нет данных о достижении контроля тромбозов, сердечно-сосудистых событий или смерти на фоне терапии руксолитинибом. Специалисты также должны быть осведомлены о потенциальных отдаленных побочных эффектах терапии, таких как повышенный риск атипичных инфекций и вирусной реактивации, а также вероятность развития вторичных новообразований.
По материалам: Y. Beauverd, D.P. McLornan, D.H. Radia, C.N. Harrison, Ruxolitinib: evolution or revolution in treatment of patients with polycythemia vera?// Future Oncology (2016) 12(6), 739-749.
Подготовила Катерина Котенко



