7 червня, 2016
Алгоритм підготовки та проведення високотехнологічної дистанційної променевої терапії при лікуванні пацієнтів, хворих на рак передміхурової залози
За даними Всесвітньої організації охорони здоров’я, кожен шостий чоловік у світі хворіє на рак передміхурової залози (РПЗ) (код за МКХ-10 С.61). Це майже 500 млн чоловіків у всьому світі. У Сполучених Штатах Америки та в країнах Європейського Союзу ця нозологія посідає перше місце серед онкологічних захворювань населення чоловічої статі.
За даними бюлетеня Національного канцер-реєстру, РПЗ у структурі онкологічних захворювань населення чоловічої статі в Україні посідає третє місце. Слід зазначити, що за останні 5 років сформувалася негативна тенденція до зростання рівня захворюваності в середньому на 1,9% на рік, спостерігається збільшення кількості хворих із поширеними стадіями та зниження середнього віку хворих.
Для діагностування РПЗ використовують такі процедури, клініко-лабораторні та інструментальні методи досліджень: визначення простатспецифічного антигена (ПСА) в сироватці крові, пальцеве ректальне обстеження, трансректальну мультифокальну біопсію під контролем ультразвукового дослідження (УЗД) та магнітно-резонансну томографію органів малого таза (МРТ) з контрастним підсиленням. Найсучаснішим методом діагностики є позитронно-емісійна томографія (ПЕТ) з 18F-холіном та 11С-холіном. Ці радіофармпрепарати відрізняються високою специфічністю, точністю та чутливістю, що дає можливість оцінити активність пухлини в передміхуровій залозі та ступінь поширеності пухлинного процесу в усьому організмі.
Становлення та розвиток методів лікування РПЗ розпочалися 7 квітня 1904 року в Балтиморі, коли хірург H.H. Young вперше виконав оперативне видалення передміхурової залози – радикальну простатектомію. Поступово хірургічні техніки вдосконалювалися і на цей час дійшли до виконання робот-асистованої простатектомії.
У 1941 році стався прорив у лікуванні РПЗ, коли C. Haggins і C.V. Hodges засвідчили основи антиандрогенної терапії та естрогенотерапії для лікування метастатичного раку простати, за що отримали Нобелівську премію з медицини (1966 р.). Таким чином, був закладений фундамент для розвитку фармакологічного методу лікування РПЗ – проведення медикаментозної кастрації.
Сьогодні існують такі первинні тактики лікування РПЗ:
• обережне очікування;
• активне спостереження;
•оперативне втручання (радикальна простатектомія (відкрита, лапароскопічна або лапароскопічна за допомогою роботизованих пристроїв);
• гормональне лікування;
• фокусований ультразвук високої інтенсивності (HIFU-терапія);
• кріотерапія (кріоабляція);
•променева терапія (дистанційна променева терапія – ДПТ, внутрішньотканинна брахітерапія (низько- та високодозова), поєднано-променевий метод).
Водночас дуже швидко розвивається галузь променевої терапії стосовно лікування РПЗ.
Перше повідомлення про використання радіотерапії в лікуванні РПЗ було зроблено в 1913 році на урологічній секції Міжнародного медичного конгресу в Лондоні вченими O. Pasteau і J. Degrais. Мова йшла про контактне опромінення пухлини передміхурової залози капсулами радію, які встановлювалися в уретрі. Цікаво, що одним із перших вчених, який вдосконалив внутрішньотканинний метод опромінення інтерстиціальними голками з радієм у 1915 році, був саме хірург H.H. Young.
Дистанційну променеву терапію почали використовувати з 50-х рр. ХХ ст. Згідно з консенсусом, прийнятим Національним інститутом раку США (NCI) в 1988 році, висунуто припущення про те, що ДПТ забезпечує виживаність, співставну з такою після радикальної простатектомії, крім того, якість життя після ДПТ щонайменше не гірша, ніж після радикальної простатектомії.
Однак слід зазначити, що злоякісні пухлини передміхурової залози характеризуються високою променевою резистентністю, це вимагає підведення достатньо великої сумарної осередкової дози (СОД) для досягнення адекватного лікувального ефекту. У сучасній онкології лікувальні заходи спрямовані не тільки на досягнення протипухлинного ефекту, а й на максимальне забезпечення адекватної якості життя пацієнта після проведеного лікування. На спільній конференції NCI та Американського товариства клінічної онкології (ASCO) у 1990 році було зазначено, що якість життя є другим за значущістю (після виживаності) критерієм результатів оцінювання протипухлинної терапії.
При опромінюванні на гамма-терапевтичних кобальтових апаратах (джерелом 60Со енергією 1,25 МеВ) із застосуванням 2D-планування у зв’язку із забезпеченням адекватної лікувальної дози здорові оточуючі тканини отримують істотне дозове навантаження, що призводить до виникнення гострої місцевої токсичності ІІ-ІІІ ступенів, яка є причиною вимушеної перерви у лікуванні (в середньому на 18 днів), що ускладнює ефект променевої терапії. До того ж гостра місцева токсичність завдає шкоди на морфологічному рівні, тому після проведення променевого лікування спостерігається великий відсоток виникнення хронічних циститів (коди за МКХ‑10 N30.4) та ректитів (коди за МКХ‑10 К52.0 та К62.7), що погіршує якість життя пацієнтів. Багаторазовими дослідженнями Міжнародної комісії з радіологічного захисту (ICRP) та Міжнародною комісією з радіологічних одиниць і вимірів (ICRU) було доведено, що продовження терміну опромінення в днях, перерва в лікуванні та прояви місцевої токсичності ІІ-ІІІ ступеня значно знижують ефективність терапії, зменшують відсоток загальної та безрецидивної виживаності та збільшують частоту рецидивів.
Гостре питання щодо покращення показників якості життя пацієнтів вимагало розвитку технологій із використанням нових методик опромінення, які могли б удосконалити підведення лікувальної дози, створити максимальну конформність опромінення та забезпечити зниження дозового навантаження на здорові оточуючі структури.
Технічне вдосконалення радіотерапевтичного обладнання з появою лінійних прискорювачів, розвиток високотехнологічної ДПТ, використання топометричної підготовки за допомогою інтегрованих комп’ютерних засобів візуалізації, застосування спеціальних фіксуючих пристроїв, тривимірного планування, індивідуального формування дозового поля та можливість високоточного підведення дози створюють поле опромінення, яке максимально наближене до форми пухлини, що мінімізує опромінення оточуючих пухлину здорових тканин.
До високотехнологічної ДПТ належать:
• 3D-конформна променева терапія (3D-conformal radiotherapy, 3D-КПТ) – таке опромінення, коли форма об’єму опромінення максимально наближена до форми пухлини, що мінімізує опромінення оточуючих пухлину здорових тканин;
• променева терапія з модульованою інтенсивністю дози (іntensity modulated radiotherapy, IMRT) – методика, за якої використовується складна конфігурація потужності та спрямування пучків, які точно відповідають формі пухлинного осередку, що передбачає опромінення пухлини з оптимальною потужністю дози за рахунок великої кількості полів опромінення з різною інтенсивністю дози, що дозволяє істотно зменшити дозове навантаження на критичні органи;
• об’ємно-модульоване опромінення (volumetric arc therapy, RapydArc чи VMAT) – променева терапія з можливістю одночасної зміни форми, інтенсивності пучка, а також кутової швидкості обертання лінійного прискорювача. Основними перевагами технології є точність і варіантність підведення дози, а також значне прискорення лікування порівняно зі стандартною реалізацією опромінення з модуляцією інтенсивності дози;
• променева терапія під контролем зображення (image-guided radiation therapy, IGRT) – верифікація положення пацієнта за допомогою портальної системної для виконання рентгенівських кіловольтних чи мегавольтних знімків у двох взаємно перпендикулярних проекціях (прямій і боковій) чи комп’ютерної томографії конусним пучком (CBCT), що здійснюється за допомогою рентгенівської трубки та детектора, вмонтованих в апарат.
У країнах Європейського Союзу, США, Японії набуває поширеності адронна променева терапія. Для неї застосовують протони, важкі іони (наприклад, вуглецю), нейтрони. Пучки протонів та іонів вуглецю слабко розсіюються в тканинах і мають чітко визначений пробіг, а їхні лінійні передачі енергії сягають максимуму на певній глибині, утворюючи пік Брегга. Завдяки цьому доза в пухлині може перевищувати дозу на поверхні в кілька разів навіть при опроміненні з одного напрямку, при цьому доза за піком Брегга різко знижується. Використання цих властивостей дозволяє в 2-3 рази зменшити променеве навантаження на оточуючі пухлину нормальні тканини.
В Україні на цей час при лікуванні пацієнтів, хворих на РПЗ, за радикальною програмою методом ДПТ широко застосовують 3D-КПТ. Однак через особливості планування, відсутність можливостей встановлювати ліміти доз на оточуючі здорові органи значне дозове навантаження покриває сечовий міхур, пряму кишку та голівки стегнових кісток. Тому, незважаючи на відносну конформність поля опромінення, досягнення тумороцидного ефекту ускладнюється лімітами значень толерантних доз для «критичних» органів малого таза.
Золотим стандартом у лікуванні РПЗ, оптимальним методом ДПТ є застосування методики IMRT.
Після променевої терапії за радикальною програмою при застосуванні 3D-КПТ 5-річна виживаність у хворих на локалізовані форми раку становить 75-80%, 10-річна сягає 55-70%. За деякими даними (K.M. Langen, 2008; B. Chauvet, 2012), при використанні методики IMRT 5-річна виживаність у хворих з локалізованими формами раку становить 85-95%, 7-річна сягає 80-90%. За іншими даними (X. Giannakopoulus, 2008; Х. Pei, J.F. Chou, 2011), при застосуванні IMRT 5-річна виживаність у хворих з локалізованими формами раку становить 80-90%, 10-річна – 70-80%.
Аналіз результатів конформного опромінення та методики IMRT (L. Blank, 2008) показав, що збільшення СОД на пухлину на 10-15% дозволило зменшити ризик виникнення локальних рецидивів на 20-30% без збільшення частоти місцевих променевих уражень. У рандомізованих випробуваннях вивчали вплив на РПЗ підвищення дози при конформній променевій терапії (Peeters et al., 2006; Dearnaley et al., 2007; Dearnaley et al., 2005; Pollack et al., 2002), однак у роботі Pollack і співавт. використовували тільки збільшення дози конформної променевої терапії. Віддалені результати вказують на покращення показників виживаності без біохімічних ускладнень у групах з вищою дозою опромінення, але спостерігається підвищення токсичності з боку прямої кишки.
Таким чином, у пацієнтів, які отримували IMRT, імовірність виникнення біохімічного рецидиву щороку була на 5% менша порівняно з хворими, які отримували 3D-КПТ.
Однак реалізація променевої терапії з модуляцією інтенсивності дози – це складний високотехнологічний процес, що потребує залучення великої кількості спеціально навченого медичного та інженерного персоналу.
Приклад алгоритму підготовки та проведення високотехнологічної ДПТ з модуляцією інтенсивності при радикальному лікуванні пацієнтів, хворих на РПЗ, можна представити на досвіді відділення променевої терапії Всеукраїнського центру радіохірургії (із застосуванням ПЕТ-технологій) КЛ «Феофанія» ДУС.
Для підготовки та проведення високотехнологічної ДПТ щодо всіх пацієнтів, хворих на РПЗ, застосовується однаковий алгоритм лікувального процесу: ретельне обстеження, передпроменева топометрична підготовка, контуринг патологічного вогнища й основних структур малого таза, індивідуальне планування та лікування.
Перед плануванням лікування проводиться ретельне обстеження для визначення ступеня поширеності пухлинного процесу:
• аналіз медичної документації (оцінка представленої медичної документації, анкетування пацієнтів із використанням анкети IPSS (міжнародна система сумарної оцінки захворювань передміхурової залози) та FACT-P (функціональна оцінка результатів лікування РПЗ);
• лабораторні методи дослідження (загальний аналіз крові, біохімічне дослідження крові: печінкові проби, ниркові проби, коагулограма, загальний аналіз сечі, аналіз рівня ПСА в сироватці крові);
• інструментальні методи дослідження (МРТ органів малого таза з контрастним підсиленням, комп’ютерна томографія (КТ) органів грудної порожнини, УЗД черевної порожнини з допплерографічним дослідженням печінки та заочеревинного простору чи КТ черевної порожнини, остеосцинтиграфія, електрокардіографія).
Обов’язковим етапом було запровадження мультидисциплінарного підходу: обговорення з лікарем-урологом програми комплексного лікування кожного пацієнта (призначення варіанта гормонального лікування).
Передпроменева підготовка пацієнтів проводиться на комп’ютерному томографі Siemens Biograph 64 на плоскій деці з використанням фіксуючих засобів (іммобілізуючий матрац, підставка під коліна та фіксатор стоп) при збереженні положення лікувальної укладки. Щоб повторювати однакове наповнення сечового міхура, за 30 хв до розмітки пацієнтам рекомендували випивати 300 мл рідини. Топограма виконувалася з реконструкцією кроку 2 мм від L3 до середини стегнових кісток. Для подальшого розрахунку плану віртуальний центр пухлини визначався рентгенконтрастними мітками на рівні верхньої межі крил здухвинних кісток.
Контуринг (оконтурювання) проводиться за допомогою сучасної плануючої системи Eclipse із використанням методики суміщення зображень (fusion) КТ, отриманих при проведенні типометрії, з МРТ. КТ дає можливість оцінити анатомічні структури зони сканування та межі пухлинного осередку. МРТ створює можливість чіткого розмежування пухлинного вогнища й оцінки місцевого поширення процесу. Поєднання цих методів візуалізації дає змогу точно оконтурити пухлинне вогнище. Запланований об’єм опромінення охоплює передміхурову залозу, сім’яні міхурці та лімфатичні вузли малого таза (загальні здухвинні, зовнішні здухвинні, внутрішні здухвинні, пресакральні та обтураторні). Здорові оточуючі структури (критичні органи) включають сечовий міхур, пряму кишку, кишечник, голівки стегнових кісток і спинний мозок. Відступ від клінічного об’єму опромінення (CTV) до запланованого об’єму опромінення (PTV) становить по 0,7 см з усіх боків.
Результат перевіряє та затверджує в плануючій системі лікар-радіолог (лікар-рентгенолог). Далі лікар із променевої терапії заповнює направлення на дозиметричне планування, де визначає значення разових і сумарних осередкових доз, дозові ліміти на критичні органи.
Залежно від розміру (об’єму) передміхурової залози (наявності супутньої аденоми) планування лікування проводиться за двома методиками:
1) за великих розмірів, коли передміхурова залоза вдається в просвіт сечового міхура більш ніж на 0,7 см та її об’єм перевищує 70 см3, разова осередкова доза (РОД) становить по 2,0 Гр та досягає СОД на передміхурову залозу 76,0 Гр та на лімфатичні вузли малого таза залежно від стану (ураження) лімфатичних вузлів – 46,0-50,0 Гр;
2) за невеликих розмірів, коли передміхурова залоза вдається в просвіт сечового міхура менш ніж на 0,7 см та її об’єм не перевищує 70 см3, лікування проводиться з використанням середнього режиму фракціонування за методикою інтегрованого бусту з РОД на передміхурову залозу 2,5 Гр до досягнення СОД 67,5 Гр, що ізоефективно 76,0 Гр стандартного фракціонування. Одночасно проводиться опромінення лімфатичних вузлів малого таза РОД 1,75-1,85 Гр залежно від стану лімфатичних вузлів, СОД за 27 фракцій досягає відповідно 46,0-50,0 Гр стандартного фракціонування.
Для розрахунку еквівалентних доз використовується лінійно-квадратична модель. Співвідношення α/β для пухлин передміхурової залози вважається рівним 3 незалежно від ступеня злоякісності пухлинного процесу.
Наступний етап лікувального процесу – створення плану опромінення. Інженер-радіофізик (медичний фізик) у комп’ютерній системі дозиметричного планування (КСДП) розраховує план опромінення. Процедура планування складається з підбору енергії пучків опромінення, кількості та розташування полів, створення оптимальної форми кожного поля за допомогою багатопелюсткового коліматора (multileaf collimator – MLC) та клиноподібних фільтрів, підбору ваги кожного поля. При застосуванні методики IMRT використовується інверсне планування. Алгоритм оптимізації КСДП дозволяє змінювати параметри пучка опромінення залежно від клінічних вимог, підібрати оптимальну кількість і розташування полів опромінення, оптимізувати радіаційний вихід і вагу полів, виставляти в режимі реального часу пріоритети на структури та жорсткі ліміти доз на критичні органи та запланований об’єм опромінення. Усі ці допоміжні функції дають можливість отримувати значні дозові градієнти (перепади доз), при цьому не знижуючи дозове навантаження на запланований об’єм опромінення.
Якість і відповідність вимогам плану опромінення оцінюється за гістограмою «доза–об'єм» (dose-volume histogram –DVH), що являє собою графік розподілу дози в об’ємі опромінення. Для ідеального розподілу дози відносно запланованого об’єму опромінення кумулятивна гістограма «доза–об’єм» має форму прямокутника. За допомогою гістограми оцінюють такі характеристики дозових розподілів: стандартні відхилення дози на пухлину, мінімальні та максимальні дози, середні дози, медіанні дози на критичні органи. Оптимальним вважається план із мінімальними дозами на критичні органи при покритті запланованого об’єму опромінення 95-105% ізодозою.
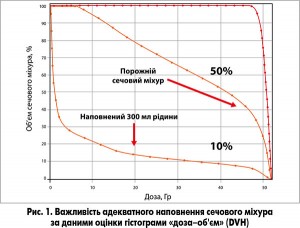
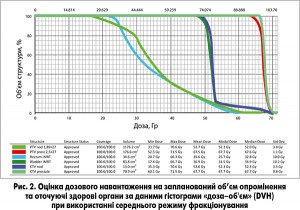
Згідно з доповіддю ICRU62 (доповнення до рекомендацій ICRU50)«Призначення, реєстрація та звітність терапевтичних процедур з пучками фотонів» променеве навантаження на критичні органи має відповідати таким умовам: дозу опромінення 60,0 Гр може отримати не більше ніж 50% об’єму прямої кишки, дозу 65,0 Гр має отримати менше 20% об’єму сечового міхура. Максимальна доза на частину сечового міхура не повинна перевищувати 78,0 Гр. Важливість адекватного наповнення сечового міхура подано на рисунку 1. Максимальна доза в будь-якій точці спинного мозку має бути меншою за 50,0 Гр. Допустиме дозове навантаження на голівки стегнових кісток: доза 50,0 Гр не повинна перевищувати 50% об’єму (рис. 2).
Середня кількість полів при використанні методики IMRT – 8±2 великих поля, що поділяються на два підполя. Тобто при лікуванні застосовується 16±2 поля при опроміненні передміхурової залози та лімфатичних вузлів малого таза. Як правило, при використанні методики IMRT застосовуються кути гантрі лінійного прискорювача 0°, 40°, 80°, 120°, 160°, 200°, 240°, 280° та 320°.
При використанні методики IMRT з класичним режимом фракціонування (РОД 2,0 Гр) середнє променеве навантаження на сечовий міхур дорівнює 38,4±4,95 Гр (p<0,05), на пряму кишку – 37,4±5,75 Гр (p<0,05), що значно нижче, ніж толерантна доза. При застосуванні методики IMRT із середнім режимом фракціонування (РОД 2,5 Гр) променеве навантаження на сечовий міхур дорівнює в середньому 39,6±3,95 Гр (p<0,05), на пряму кишку, відповідно, 38,2±4,84 Гр (p<0,05), що також значно нижче за толерантну дозу.
Перед початком лікування при використанні методики IMRT на лінійному прискорювачі обов’язковою є верифікація плану опромінення. З цією метою за допомогою КСДП створюється верифікаційний план опромінення. Існує кілька методів перевірки плану: портальна дозиметрія, перевірка з використанням 2D-матриці детекторів і перевірка абсолютної дози. При портальній дозиметрії та для 2D-матриці детекторів порівнюється радіаційний вихід (fluence) полів, розрахованих у КСДП, та отриманий на матриці з критерієм за індексом ≤1. При перевірці абсолютної дози допустимі значення відхилення мають бути у межах ±3%.
Такий складний алгоритм підготовки та перевірки плану опромінення пацієнта потребує часових затрат і високої кваліфікації персоналу. Тому для складання IMRT-плану потрібно декілька днів.
Безпосереднє лікування проводиться на лінійних прискорювачах фірми Varian (Clinac iX та Novalis Tx) з використанням IGRT (променевої терапії під контролем зображення). Ритм опромінення – 5 разів на тиждень. Збереження положення пацієнта при лікуванні забезпечується за допомогою фіксуючих засобів (підставка під коліна та фіксатори стоп) та адекватного наповнення порожнинних органів малого таза (за 30 хв до лікування 300 мл рідини та зранку випорожнення прямої кишки). Перед проведенням сеансу опромінення кожному пацієнту для оцінки точності укладки проводиться CBCT для перевірки положення передміхурової залози. На підставі даних CBCT зміщення пацієнта проводяться за положенням м’яких тканин залежно від наповнення сечового міхура та прямої кишки. При дотриманні зазначеного режиму (наповнення порожнинних органів малого таза) зміщення становлять у середньому 5 мм. Усім пацієнтам призначається щоденна терапія супроводу у вигляді пробіотиків, уросептиків та свічок у пряму кишку на ніч щоденно. Протягом лікування (на кожній 7-й, 14-й та останній фракціях) проводяться загальноклінічні дослідження – загальний аналіз крові та сечі, заповнення анкет – модифікованої IPSS (міжнародна система сумарної оцінки захворювань передміхурової залози) та FACT-Р (функціональна оцінка результатів лікування РПЗ). Проведення сеансу IMRT з верифікацією положення пацієнта під контролем зображення становить 20-30 хв.
Токсичні прояви консервативного лікування оцінюються за класифікацією Радіотерапевтичної онкологічної групи разом з Європейською організацією з вивчення та лікування раку (RTOG/EORTC, 1995).
Гостра променева токсичність у вигляді променевого циститу 1 ступеня токсичності спостерігається приблизно у 80-85% пацієнтів, променевого ректиту 1 ступеня токсичності – у 80-83%. Слід зазначити, що проявів гострої місцевої токсичності 2-3 ступеня зареєстровано не було. Це дало можливість проводити лікування без вимушеної перерви та уникнути виникнення проявів хронічної місцевої токсичності. Явища гострої токсичності 1 ступеня зникали через 3-4 тижні після закінчення терапії.
Після закінчення лікування кожні 3 міс протягом першого року проводиться динамічний контроль – визначення рівня ПСА в сироватці крові, МРТ органів малого таза з контрастним підсиленням, загальноклінічні дослідження (загальний аналіз крові, сечі та калу), кожні півроку – остеосцинтиграфія, УЗД черевної порожнини з допплерографічним дослідженням печінки чи КТ черевної порожнини, раз на рік – оглядова рентгенографія органів грудної порожнини в прямій чи боковій проекціях або КТ грудної порожнини.
Також при динамічному спостереженні після проведеного лікування пацієнт заповнює анкети: модифіковану IPSS і FACT-P.
На підставі проведеного аналізу та узагальнення результатів нашого й закордонного досвіду можна зробити такий висновок: практичне впровадження такої моделі дозволить підвищити якість променевого лікування пацієнтів, хворих на РПЗ, за рахунок розроблення чіткого, послідовного алгоритму підготовки та проведення лікування. Застосування високотехнологічної дистанційної променевої терапії створює можливість підведення більшої сумарної осередкової дози на патологічне вогнище, що підвищує ефективність лікування радіорезистентних пухлин. Впровадження методики IMRT і проведення сеансів опромінення під контролем зображення у пацієнтів, хворих на РПЗ, достовірно знижує відсоток виникнення проявів гострої та хронічної місцевої токсичності за рахунок зниження дози навантаження на оточуючі здорові органи та тканини.
На основі цього алгоритму реалізації високотехнологічної ДПТ за радикальною програмою у хворих на РПЗ у Всеукраїнському центрі радіохірургії (із застосуванням ПЕТ-технологій) КЛ «Феофанія» ДУС був розроблений, затверджений і впроваджений Локальний протокол променевого лікування пацієнтів, хворих на рак передміхурової залози (2014 р.).



