5 червня, 2016
Сравнение трастузумаба для подкожного и внутривенного введения при HER2-положительном раке грудной железы: результаты исследования HannaH
Исследование III фазы HannaH посвящено сравнению эффективности и безопасности терапии HER2‑положительного рака грудной железы (РГЖ) с применением двух лекарственных форм трастузумаба, предназначенных, соответственно, для подкожного (ПК) и внутривенного (ВВ) введения. Представлены результаты анализа подгрупп полного ответа и трехлетней бессобытийной выживаемости в зависимости от массы тела и наличия антител против исследуемого препарата.
Введение
В настоящее время таргетный препарат трастузумаб, содержащий моноклональные антитела, является стандартом терапии HER2-положительного РГЖ во всем мире. Стандартный режим терапии предусматривает ВВ введение трастузумаба каждые 3 недели в течение 1 года пациентам с ранними стадиями заболевания либо до начала прогрессирования пациентам с метастатическим РГЖ. Внутривенная инфузия первой дозы осуществляется на протяжении 90 мин. Если препарат хорошо переносится пациентом, последующие инфузии осуществляются в течение 30 мин, дозировка корректируется в соответствии с массой тела.
Новая лекарственная форма трастузумаба была разработана как альтернатива внутривенному режиму с целью обеспечения удобства для пациентов, снижения риска осложнений, связанных с внутривенной инфузией, а также оптимизации использования ресурсов здравоохранения по сравнению со стандартной лекарственной формой. Она содержит фиксированную дозу трастузумаба (600 мг), а в качестве вспомогательного вещества – рекомбинантную гиалуронидазу человека (rHuPH‑20) (фермент, который за счет обратимого разрушения гиалуроновой кислоты в межклеточном пространстве обеспечивает удобство ПК введения, а также способствует доставке трастузумаба в кровеносное русло). По продолжительности подкожная инъекция трастузумаба занимает менее 5 мин.
В связи с особенностями действия моноклональных антител предполагалось, что подкожное введение фиксированной дозы трастузумаба будет равноэффективным по сравнению с внутривенной и позволит достичь целевой концентрации трастузумаба в сыворотке крови независимо от различий в дозах препарата. Экспозиция трастузумаба в сыворотке крови, измеряемая по площади под кривой зависимости концентрации препарата от времени, должна быть похожей на таковую при внутривенном режиме, поэтому период введения подкожной лекарственной формы аналогичен – каждые 3 недели. В свою очередь отсутствие необходимости корректировать дозу в соответствии с массой тела при ПК введении препарата позволит существенно сократить расходы на лечение. Для доказательства этих гипотез было проведено клиническое исследование HannaH.
Критерии включения в исследование
Международное рандомизированное открытое исследование III фазы HannaH (enHANced treatment with Neo Adjuvant Herceptin) проводилось в 81 медицинском центре Европы, Америки, Азии, Африки в период с 19 октября 2009 г. по 1 декабря 2010 г. В исследование были включены 596 пациентов в возрасте от 18 лет и старше. Все участники исследования имели операбельный HER2-положительный (определяемый иммуногистохимически как 3+ либо путем гибридизации in situ и подтвержденный центральной лабораторией) впервые диагностированный первичный инвазивный РГЖ (клиническая стадия I-IIIС) с размерами опухоли ≥1 см по данным УЗИ. У всех пациентов фракция выброса левого желудочка при включении в исследование составляла ≥55%, исходный исполнительный статус по ECOG соответствовал 0-1 (G. Ismael, R. Hegg, S. Muehlbauer et al., 2012). Базовые характеристики пациентов были хорошо сбалансированы между группами.
Дизайн исследования
В рамках исследования 596 пациентов с ранним РГЖ были рандомизированы для получения 8 циклов неоадъювантной терапии: раз в 3 недели – трастузумаб ПК (фиксированная доза 600 мг) или трастузумаб ВВ (8 мг/кг – нагрузочная и 6 мг/кг – поддерживающая доза). Химиотерапия состояла из 4 циклов доцетаксела (75 мг/м2), в дальнейшем – 4 циклов фторурацила (500 мг/м2) / эпирубицина (75 мг/м2) / циклофосфамида (500 мг/м2) через каждые 3 недели.
После хирургического вмешательства пациенты получали 10 циклов адъювантной терапии трастузумабом ПК или ВВ до завершения 1 года терапии. Показатель бессобытийной выживаемости и безопасность терапии также оценивались с учетом различий в массе тела пациентов (по квартилям) с целью исследования правомерности применения фиксированной дозы трастузумаба.
Первичными конечными точками в исследовании стали частота достижения полного патологического ответа (ППО) и концентрация препарата в сыворотке крови перед введением следующей дозы (то есть фармакокинетические особенности). Вторичными конечными точками были безопасность и переносимость, общий полный патологический ответ (ОППО), определяемый как отсутствие опухолевых клеток в грудной железе и подмышечных лимфатических узлах, а также бессобытийная выживаемость (период от рандомизации до развития рецидива, прогрессирования заболевания либо смерти) и общая выживаемость (ОВ).
Результаты первичного анализа
При проведении первичного анализа по 116 пациентов в каждой группе завершили полный курс лечения, при этом ни один из участников не вышел за пределы наблюдения. Медиана продолжительности наблюдения составляла 12,2 мес (диапазон 1-20,8) в группе ВВ и 12,4 мес (0,3-20,4) в группе ПК введения трастузумаба. Средняя интенсивность дозирования трастузумаба ВВ составляла 135,9 мг/неделю (диапазон 87-234,6), а трастузумаба ПК – 195,9 мг/неделю (152,2-211,9). Медиана интенсивности дозирования всех химиотерапевтических препаратов составила 99% в обеих группах лечения.
Двести пять (68,8%) из 298 пациентов в группе трастузумаба ВВ и 211 (71%) из 297 больных в группе трастузумаба ПК получали локорегиональную лучевую терапию в послеоперационном периоде. Пациентам с гормонположительным рецепторным статусом после первичного хирургического вмешательства проводилась гормональная терапия. Наиболее часто назначаемым гормональным препаратом был тамоксифен, который получали 76 (25,5%) из 298 пациентов в группе ВВ и 90 (30,3%) из 297 в группе ПК введения трастузумаба; также применялись анастрозол (20 и 17 пациентов из обеих групп соответственно) и летрозол (21 и 13 соответственно). Кроме того, 8 (2,7%) из 298 пациентов в группе трастузумаба ВВ и 9 (3%) из 297 пациентов в группе трастузумаба ПК получали гозерелин.
Двести тридцать пять пациентов в группе ВВ и 234 в группе ПК введения трастузумаба были включены в протокол фармакокинетического анализа. В итоге было показано, что трастузумаб для ПК введения не уступает трастузумабу для ВВ введения с точки зрения концентрации в сыворотке крови в период до проведения операции: среднее геометрическое соотношение было 1,33 (90% ДИ, 1,24-1,44). Изменчивость концентраций в сыворотке крови также была аналогична в обеих группах. Почти все пациенты в предоперационном периоде достигли концентраций, превышающих целевой терапевтический уровень 20 мкг/мл.
Среднее геометрическое максимальной концентрации препарата в сыворотке крови (Сmax) перед операцией (цикл 7) было выше в группе ВВ, чем в сравниваемой группе (среднее геометрическое соотношение 0,67, 90% ДИ, 0,63-0,71).
Воздействие трастузумаба, демонстрируемое значениями средней площади под кривой, характеризующей изменения концентрации препарата в сыворотке крови в период 0-21 дней, было похожим в обеих группах (среднее геометрическое соотношение 1,07, 90% ДИ, 1,01-1,12).
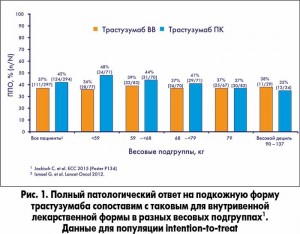
Двести шестьдесят три пациента в группе ВВ и 260 в группе ПК введения трастузумаба были включены в протокол анализа эффективности лечения. Было показано, что подкожная форма трастузумаба не уступает внутривенной с точки зрения ответа на лечение: 118 (45,4%) из 260 пациентов в группе ПК и 107 (40,7%) из 263 в группе ВВ введения трастузумаба достигли ППО (табл. 1). Различие между группами (ПК минус ВВ) составило 4,7% (95% ДИ, 4-13,4). Аналогичные результаты были получены для ОППО (в том числе ответ в подмышечных лимфоузлах – разница между исследуемыми группами составила 5% (95% ДИ, 3,5-13,5 (табл. 1, рис. 1). Множественный логистический регрессионный анализ ППР с поправкой на стратифицированные факторы и конкретные исходные характеристики показал соответствие нескорректированным результатам, а также не обнаружил взаимодействия между массой тела пациентов и достижением ППР. Количество пациентов, достигших ОППО на терапию, было одинаковым в группе трастузумаба ВВ и трастузумаба ПК; медиана продолжительности лечения до появления ответа была практически одинаковой в обеих группах.
Данные, касающиеся бессобытийной и общей выживаемости, были не готовы в момент проведения первичного анализа.
Безопасность и переносимость
Профиль безопасности трастузумаба в исследовании HannaH соответствовал изученному ранее в других исследованиях, новых данных получено не было. Количество побочных реакций было сопоставимым в обеих группах. Количество побочных реакций со стороны сердца составило соответственно 12,1 и 11,4% в группах ВВ и ПК введения трастузумаба. У 11% пациентов, получавших трастузумаб ПК, наблюдалась местная реакция на введение препарата (чаще всего боль в месте инъекции), которая у 95% из них была незначительной.
Наиболее частыми побочными реакциями любого класса (>25% в каждой группе) были алопеция (62,8%) в группе трастузумаба ВВ против 62,6% в группе трастузумаба ПК, тошнота (48,7 против 48,5%, нейтропения (46,3 против 44,1%), диарея (36,6 против 33,7%), астения (25,2 против 24,6%), а также усталость (26,5 против 22,6%). Количество серьезных побочных реакций (степень >3) также было сопоставимым и составило 52% в группе трастузумаба ВВ и 51,9% в группе трастузумаба ПК. Исследователи отметили несколько большую распространенность побочных реакций 3-й и 4-й степени в группе, получавшей трастузумаб ВВ. Большинство серьезных побочных реакций (степень >3) составляли гематологические токсические эффекты, а также нарушения со стороны желудочно-кишечного тракта. Наиболее распространенными серьезными побочными реакциями были нейтропения, лейкопения и фебрильная нейтропения.
Таким образом, первичный анализ результатов исследования HannaH показал, что подкожная форма не уступает внутривенной в отношении частоты достижения ППО и концентрации препарата в сыворотке крови перед введением дозы (первичные конечные точки). Авторы исследования сделали вывод, что соотношение пользы и риска для пациентов при применении подкожной и внутривенной лекарственных форм трастузумаба является практически одинаковым. ПК введение фиксированной дозы 600 мг каждые 3 недели в течение 5 мин способно обеспечить реальную альтернативу внутривенному режиму в терапии HER‑положительного РГЖ. Меньшая продолжительность ПК введения по сравнению с ВВ обладает потенциалом для значительной экономии временных и финансовых ресурсов пациентов, врачей, среднего медицинского персонала (G. Ismael, R. Hegg, S. Muehlbauer et al., 2012).
Результаты дополнительного анализа
В 2015 г. C. Jackisch, R. Hegg, D. Stroyakovskiy и соавт. представили обновленные результаты оценки вторичных конечных точек исследования HannaH после двухлетнего периода наблюдения по завершении терапии. В этом анализе были впервые приведены данные по таким вторичным конечным точкам исследования HannaH, как:
• бессобытийная выживаемость;
• общая выживаемость;
дополнительные данные относительно безопасности применения подкожной формы трастузумаба по сравнению с классической внутривенной лекарственной формой;
анализ эффективности лечения в зависимости от наличия или отсутствия у пациента антител к трастузумабу (т.е. иммунной реакции на препарат).
Медиана наблюдения составила 40,3 мес в группе, получавшей трастузумаб ПК (диапазон 0,3-50,7), и 40,6 мес в группе, получавшей внутривенную форму препарата (1-51).
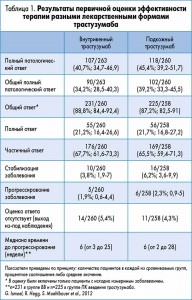
Медиана массы тела пациентов составила 66 кг в группе трастузумаба ВВ и 68 кг в группе трастузумаба ПК. В дополнение к данным первого анализа было показано, что достижение ППО и ОППО (включая лимфоузлы) не зависело от массы тела пациентов (как при общей оценке эффективности терапии в соответствии с протоколом исследования, так и в популяции intention-to-treat) (рис. 1, 2).
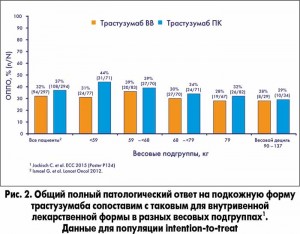
Показатель трехлетней бессобытийной выживаемости составил 74% (218 из 294 пациентов) в группе, получавшей трастузумаб ПК, и 73% (217 из 297) в группе, получавшей трастузумаб ВВ (HR 0,95; 95% ДИ, 0,69-1,3). Бессобытийная выживаемость оказалась одинаковой в обеих сравниваемых группах, а также не отличалась в зависимости от массы тела пациентов, что подтверждает правомерность фиксированной дозы трастузумаба (рис. 3). Трехлетний показатель ОВ составил 93% (272 из 294 пациентов) в группе, получавшей трастузумаб ПК, и 90% (268 из 297) в группе ВВ введения (HR 0,76; 95% ДИ, 0,44-1,32).
Что касается влияния иммунного статуса (наличия антител против трастузумаба) на эффективность терапии, авторы отмечают, что интерпретация результатов исследования должна проводиться с учетом дисбаланса в количестве пациентов. Так, большинство пациентов в обеих группах не имели антител к трастузумабу: антитела были обнаружены только у 68 пациентов из 523 включенных в анализ, из них 24 пациента входили в группу, получавшую трастузумаб ВВ, и 44 – в группу ПК введения (C. Jackisch et al., 2015). Учитывая эти ограничения, авторы отмечают, что исследование HannaH не показало влияния находящихся в сыворотке крови пациента антител к трастузумабу на эффективность терапии. Трехлетняя бессобытийная выживаемость в группе пациентов, получавших трастузумаб ВВ, составила 74% при негативном иммунном статусе и 71% при наличии антител к трастузумабу; в группе ПК введения эти показатели были соответственно 75 и 80%.
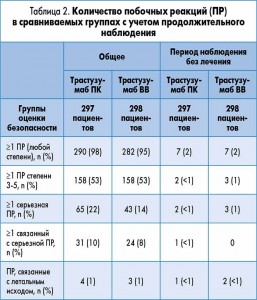
Частота развития побочных реакций со стороны сердца была похожей в обеих группах, а также у пациентов, отличающихся по массе тела (по квартилям). Лишь небольшое количество новых побочных явлений были отмечены в период наблюдения после завершения терапии трастузумабом, и они были сбалансированы между группами. Обновленные результаты оценки безопасности терапии представлены в таблице 2.
Исследователи подчеркивают, что следует избегать назначения терапии трастузумабом беременным пациенткам, за исключением тех случаев, когда потенциальная польза для матери превышает потенциальный риск для плода. Существует ограниченное количество данных о применении трастузумаба беременными женщинами, безопасность использования трастузумаба во время беременности и в период лактации не установлена.
В условиях постмаркетинговых исследований у беременных женщин, получавших трастузумаб, были зафиксированы случаи нарушения внутриутробного роста и/или функции почек плода в сочетании с маловодием, а также фатальные случаи легочной гипоплазии плода. Женщинам детородного возраста рекомендуется использовать эффективные противозачаточные средства во время терапии трастузумабом, а также в течение 7 мес после введения последней дозы этого препарата. Поскольку IgG1 секретируется в грудное молоко и связанные с этим явлением риски для ребенка неизвестны, на фоне терапии трастузумабом (или в течение 7 мес после введения последней дозы) запрещается грудное вскармливание.
Авторы исследования делают вывод, что при долгосрочном наблюдении вторичные конечные точки исследования HannaH, касающиеся эффективности лечения (бессобытийная и общая выживаемость), поддерживают ранее установленную сопоставимую эффективность подкожной и внутривенной форм трастузумаба, продемонстрированную в более раннем анализе при оценке первичных конечных точек (ППО и концентрация препарата в сыворотке крови). Начальная нагрузочная доза и подбор дозы в соответствии с массой тела не требуются при ПК введении трастузумаба. Пациентам назначается одна и та же доза независимо от массы тела. Профиль безопасности подкожной формы трастузумаба согласуется с известным в настоящее время профилем безопасности лекарственной формы для ВВ введения.
По заказу ООО «Рош Украина»
Литература
1. Ismael G., Hegg R., Muehlbauer S., Heinzmann D., Lum B., Kim S-B., Pienkowski T., Lichinitser M., Semiglazov V., Melichar B., Jackisch C. Subcutaneous versus intravenous administration of (neo)adjuvant trastuzumab in patients with HER2-positВВe, clinical stage I-III breast cancer (HannaH study): a phase 3, open-label, multicentre, randomised trial. Lancet Oncology 2012; 13: 869-78. Published Online August 9, 2012 http://dx.doi.org/10.1016/S1470-2045(12)70329-7.
2. Jackisch C., Hegg R., Stroyakovskiy D., Ahn J., Melichar B., Chen S., Crepelle-Flechais A., Heinzmann D., Shing M., Pivot X. Subcutaneous versus intravenous trastuzumab in early breast cancer: 2-year follow-up of HannaH/The Breast 24S1 (2015) S87-S150.
Подготовила Катерина Котенко