8 лютого, 2016
Хирургические аспекты лечения обструктивных заболеваний панкреатодуоденальной зоны
Заболевания органов панкреатодуоденальной зоны (ПДЗ) относятся к разряду трудно диагностируемых и часто поздно выявляемых патологических процессов, требующих в большинстве случаев выполнения сложных оперативных вмешательств. Большинство этих заболеваний являются злокачественными опухолями головки поджелудочной железы (ПЖ), Фатерова соска, двенадцатиперстной кишки (ДПК) и дистального отдела холедоха, которые сопровождаются стенозированием и обтурацией просвета общего желчного протока, главного протока поджелудочной железы и просвета двенадцатиперстной кишки [1].
Все указанные выше патологические процессы рационально рассматривать как обструктивные заболевания органов ПДЗ. Эти патологические процессы объединяет прогрессирующая обструкция панкреатического, общего желчного протоков и большого дуоденального сосочка (БДС) с развитием механической желтухи, реже – стеноз просвета двенадцатиперстной кишки (ДПК) с развитием дуоденальной непроходимости. Обструктивные патологические процессы включают злокачественные и доброкачественные заболевания, куда входят опухоли головки ПЖ, БДС и периампулярной зоны, опухоли и стриктуры терминального отдела холедоха, хронический панкреатит (ХП) с преимущественным фиброзом, кальцинозом и кистами в области головки ПЖ [1, 5].
Более 90% обструктивных заболеваний ПДЗ составляют злокачественные новообразования, среди которых превалирует протоковая аденокарцинома ПЖ. Во всем мире отмечается перманентный рост онкологической патологии органов ПДЗ, которая, по данным М.Ю. Кабанова и соавт. (2012), занимает 8-9 место среди всех онкозаболеваний, но в структуре смертности рак ПЖ занимает 4-5 место, и более 80% больных умирают в течение первого года. Причины неблагоприятного течения заболевания кроются в особенностях структуры и локализации рака ПЖ, раннем метастазировании с частыми инвазиями в крупные венозные и артериальные сосуды и периневральном распространении опухолевого процесса [4, 7].
Малая частота радикальных операций (15-26%), высокий уровень послеоперационных осложнений (30-50%) и летальности (7-17%) характеризуют особую сложность и тяжесть этой патологии, заставляя проводить дальнейшее активное совершенствование диагностики, дооперационной подготовки, хирургической техники и послеоперационного ведения больных с обструктивными заболениями органов ПДЗ [2, 4].
Эпидемиология
Заболеваемость раком ПЖ составляет 10-12 случаев на 100 тыс. населения в странах Европы и Северной Америки. В Японии заболеваемость раком ПЖ за последние 30 лет возросла в 1,5 раза и составляет 12,6 случаев на 100 000 населения для мужчин и 7,3 – для женщин. В Украине за последние 5 лет заболеваемость раком ПЖ остается на одном уровне – 10,3 на 100 тыс. (12,2 – для мужчин и 8,6 – для женщин). Частота рака ПЖ среди всех злокачественных опухолей – 3,4% (9 место) для мужчин и 2,8% (10 место) для женщин. Пик заболеваемости – в возрасте 65-75 лет. Показатели заболеваемости возрастают почти в 2 раза после 45 лет и продолжают неуклонно повышаться, демонстрируя резкий скачок после 65 лет [1, 3].
Этиология
Все типы хронического панкреатита (алкогольный, неалкогольный, наследственный, тропический) приводят к 10-20-кратному повышению риска возникновения РПЖ. Хронический панкреатит повышает риск развития рака ПЖ в 9-16 раз. Основная роль в развитии хронического панкреатита и рака ПЖ принадлежит панкреатическим звездчатым клеткам (PSC). Они формируют фиброз и одновременно стимулируют онкогенез [1, 4].
Более 90% опухолей ПЖ – протоковые аденокарциномы, в 70-75% случаев опухоли возникают в головке ПЖ, в 15 % – в теле, в 10% – в хвосте. По последним данным A. Masamune (2013), продуцируя экстрацеллюлярный матрикс, PSC индуцируют апоптоз и снижают продукцию инсулина в β-клетках, чем можно объяснить новый механизм возникновения сахарного диабета (СД). Одновременно с этим PSC повышают в стволовых клетках онкогенетические свойства, стимулируя возникновение и прогрессирование рака ПЖ. PSC в настоящее время рассматривают не только как профиброгенетические клетки, а как мультифункциональные клетки, активно взаимодействующие с другими типами клеток ПЖ (эндокринными и экзокринными), что привлекает пристальное внимание исследователей разных стран. На развитие рака ПЖ влияют факторы, подобные тем, что вызывают рак толстой кишки: так называемый западный тип диеты (еда с повышенным содержимым белков и жиров), недостаток витаминов в еде (особенно А и С), вредные привычки (алкоголь и курение, канцерогены в продуктах питания – нитриты, нитраты и тому подобное). Иногда рак ПЖ связан с СД, однако нужно иметь в виду, что у 10% больных раком ПЖ сахарный диабет является следствием опухолевого процесса. В отдельных случаях явно определяется генетический фактор: более чем в 80% опухолей ПЖ, удаленных при операции, обнаруживают мутации гена K-Ras [1, 4].
Отмечают рак ПЖ в семьях с мутацией гена р16 у больных с семейным раком грудной железы, колоректальным раком, семейным полипозом Пейтца-Егерса [2, 6].
Рак БДС выявляется в 0,5-1,6% случаев среди всех злокачественных новообразований и более чем в 2% случаев опухолей органов ЖКТ.
Рак внепеченочных желчных протоков встречается в 2,8-4,6% среди злокачественных опухолей ПДЗ. В странах Европы и Северной Америки заболеваемость холангиокарциномой составляет 1-2 случая на 100 000 населения в год, но ее уровень растет в течение последних десятилетий. К факторам риска развития холангиокарциномы относится наличие у пациента первичного склерозирующего холангита, врожденных пороков развития печени и желчевыводящих путей.
При раке ПЖ происходит около 63 генетических мутаций, которые меняют 12 клеточных сигнальных путей, включая реактивацию генов эмбриогенеза. Точные причины развития данного вида рака не выявлены, но существуют данные о роли определенных средовых факторов: курение, наследственный фактор, СД [1, 2].
Классификация опухолей ПЖ
Все опухоли ПЖ разделяют на две группы: эпителиальные (95-98%) и нейроэндокринные (2-5%). Эпителиальные опухоли ПЖ делятся на редко встречающиеся доброкачественные опухоли, редко диагностируемые пограничные опухоли (с неопределенным злокачественным потенциалом) и злокачественные.
К числу доброкачественных опухолей относят серозную и муцинозную цистаденому, внутрипротоковую папиллярно-муцинозную аденому и зрелую тератому.
К пограничным опухолям относят муцинозную цистаденому с умеренной дисплазией, внутрипротоковую папиллярную муцинозную опухоль с умеренной дисплазией (IPMN) и солидно-псевдопапиллярную опухоль.
К злокачественным опухолям ПЖ относят: протоковые аденокарциномы, серозные и муцинозные цистаденокарциномы (малигнизированные цистаденомы), ацинарноклеточный рак, панкреатобластома (чаще у детей), смешанноклеточная аденокарцинома (крайне редкая), а также внутрипротоковая папиллярно-муцинозная карцинома (малигнизированная IPMN). Наиболее часто встречающейся опухолью ПЖ (около 90%) является протоковая аденокарцинома, которая является высокоагрессивной опухолью с сильной десмопластической реакцией и частой васкулярной, лимфатической и периневральной инвазивностью (J. Kleef, H. Friess, M. Buchler, 2007). Предшественниками рака ПЖ являются муцинозные цистаденомы, внутрипротоковые муцинпродуцирующие неоплазмы (IPMN), а также панкреатическая внутриэпителиальная неоплазия (PanIN-I). Этот термин, введенный в литературу с 1999 г., заменил такие термины, как дисплазия, метаплазия и протоковое поражение ПЖ. Постепенная трансформация атипии от низкого до высокого уровня приводит к формированию PanIN-III, считающейся прединвазивной стадией рака in situ, не распространяющегося за пределы слизистой оболочки [2, 4].
 При этом существует мнение, что от появления первых признаков генных мутаций до формирования неинвазивной опухоли проходит около 10 лет, еще около 5 лет длится процесс трансформации в инвазивную и метастатическую форму, после чего онкопроцесс активно прогрессирует, приводя в течение 1,5-2 лет к неблагоприятному исходу [4, 8].
При этом существует мнение, что от появления первых признаков генных мутаций до формирования неинвазивной опухоли проходит около 10 лет, еще около 5 лет длится процесс трансформации в инвазивную и метастатическую форму, после чего онкопроцесс активно прогрессирует, приводя в течение 1,5-2 лет к неблагоприятному исходу [4, 8].
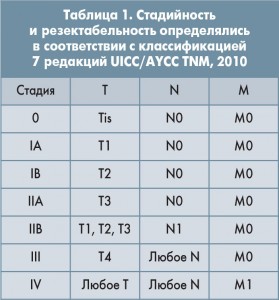
Приводим последнюю классификацию рака ПЖ по системе TNM, стадийность и резектабельность в соответствии с классификацией 7 редакций UICC/AYCC TNM, 2010 (табл. 1).
Первичная опухоль (Т):
Тх – недостаточно данных для оценки первичной опухоли;
Т0 – первичная опухоль не определяется;
Тis – carcinoma in situ;
Т1 – опухоль ограничена ПЖ, 2 см или меньше в наибольшем измерении;
Т2 – опухоль ограничена ПЖ, более 2 см в наибольшем измерении;
Т3 – опухоль распространяется за пределы ПЖ, но без поражения крупных сосудов: верхней брыжеечной вены, воротной вены, чревного ствола или верхней брыжеечной артерии;
Т-4 – опухоль распространяется на крупные кровеносные сосуды (неректабельная опухоль).
Лимфатические узлы:
Nx – недостаточно данных для оценки лимфатических узлов;
N0 – нет признаков поражения регионарных лимфатических узлов;
N1 – наличие метастазов в регионарных лимфатических узлах.
Отдаленные метастазы (М):
Мх – недостаточно данных для определения отдаленных метастазов;
М0 – отдаленные метастазы не определяются;
М1 – наличие отдаленных метастазов.
При стадии от 0 до IIВ – опухоль резектабельна, при III стадии – опухоль нерезектабельна, при IV стадии – опухоль неоперабельна.
Клиника и лабораторно-инструментальная диагностика
Ведущим симптомом обструкции ПДЗ в большинстве случаев является механическая желтуха. У многих больных со злокачественными заболеваниями обструкция ПДЗ часто проявляется появлением механической желтухи (МЖ) среди почти полного благополучия. В небольшом числе случаев появление желтухи сопровождается болевыми ощущениями или дискомфортом в животе. Возникновение болевого абдоминального синдрома, как правило, предшествует появлению МЖ. МЖ при раке головки ПЖ обусловлена тем, что раковый узел, увеличиваясь в размерах, распространяется на желчевыводящие протоки, вызывая нарушение их проходимости, раздвигает «подкову» ДПК и сдавливает ее просвет, затем прорастает ее стенку. Желтушная окраска кожного покрова сменяется постепенно оливковым, далее темно-зеленым цветом; характерны желтушность склер глаз и видимой слизистой оболочки, бесцветный (ахоличный) кал, темная моча, кожный зуд. Безболевая желтуха – это не ранний симптом заболевания. На момент ее диагностики 66% больных имеют метастазы в печень, 22% – в лимфоузлы и 10% – в легкие. К системным симптомам относят: снижение массы тела, ощущение дискомфорта, потерю аппетита, повышенный уровень глюкозы в крови. У некоторых пациентов с раком ПЖ развивается диабет, поскольку рак влияет на способность ПЖ вырабатывать инсулин.
У больных с патологией БДС патогномоничным признаком является кожный зуд. Кожный зуд обусловлен раздражением кожных рецепторов желчными кислотами. Обычно он возникает после появления желтухи, чаще – при высоком содержании билирубина в крови, но иногда больные отмечают зуд кожного покрова еще в дожелтушный период. Кожный зуд значительно ухудшает самочувствие больных, не дает им покоя, вызывает бессонницу и повышенную раздражительность, часто приводит к многочисленным расчесам, следы которых видны на коже. Потеря массы тела является одним из наиболее важных симптомов. Она обусловлена интоксикацией за счет развивающейся опухоли и нарушением кишечного пищеварения в результате закупорки желчных и панкреатических протоков. Кожный зуд носит интенсивный, упорный характер, усиливающийся в ночное время.
На ранних стадиях процесс протекает скрыто. В развернутой стадии в клинической картине выделяют общие и местные симптомы. К общим симптомам относят слабость, снижение работоспособности, потерю аппетита, снижение массы тела, мигрирующий тромбофлебит. Местные симптомы включают боль в верхних отделах живота опоясывающего характера, а также признаки сдавления того или иного органа (при закупорке панкреатического протока – запоры и поносы, стеаторея, при сдавлении общего желчного протока – желтуха, при сдавлении или прорастании опухоли в ДПК – рвота, кишечное кровотечение). Локализация опухоли определяет особенности клинической картины и преобладание тех или иных симптомов.
Прощупать опухоль на ранних стадиях затруднительно и становится возможным лишь при значительных размерах опухоли или при метастазировании. Чаще при объективном исследовании, помимо желтухи, определяется увеличение печени и ЖП (симптом Курвуазье). При прорастании опухоли в ДПК или желудок может развиться стеноз и кровотечение. Заторможенность, инверсия сна (выраженная сонливость днем и отсутствие сна ночью) на фоне выраженной МЖ свидетельствуют о развитии гепатоцеребральной недостаточности.
Снижение или полное прекращение оттока желчи в кишечник сопровождается развитием диспептических расстройств: тошнота, понос или явления пареза кишечника. У большинства больных отмечается обесцвечивание кала и потемнение мочи.
Лабораторные показатели, подтверждающие наличие обструкции в панкреатодуоденальной зоне
Об активности воспалительного процесса в зоне обструкции, нарушении функций печени и ПЖ свидетельствуют данные лабораторных методов исследования, которые наиболее ярко проявляются в нарушении пигментного обмена – гипербилирубинемия за счет прямой фракции.
Гипербилирубинемия наблюдается одновременно с повышением уровня щелочной фосфатазы, что свидетельствует о нарушении экскреторной функции печени. Также повышен уровень трансаминаз в сыворотке крови при холестазе, что обусловлено некрозом или повреждением мембраны печеночной клетки и является показателем не только наличия воспалительного процесса в ткани печени, но также процесса цитолиза гепатоцитов на фоне холестаза.
Сочетание холемической интоксикации с желчной гипертензией и цитолитическим синдромом ведет к значительному нарушению белково-синтетической функции печени, что характеризуется гипопротеинемией, гипоальбуминемией, гипергаммаглобулинемией, снижением альбумино-глобулинового коэффициента.
При развитии синдрома цитолиза с нарушением синтетической функции печени наряду со снижением уровня сывороточного альбумина наблюдается, как правило, снижение синтезируемых печенью ферментов протромбинового комплекса.
Нарушение условий функционирования печеночной клетки, некроз большого количества гепатоцитов при одновременном перенапряжении оставшихся клеток на фоне холестаза ведет к значительному нарушению детоксикационной функции печени, развитию синдрома эндогенной интоксикации.
Значительно более информативным является определение уровня опухолевых маркеров в крови. Из всех известных маркеров наиболее чувствительным и специфичным (около 90%) при раке ПЖ является карбоангидратный гликопротеин (СА-19-9) эмбрионального происхождения. У здоровых лиц его содержание в крови не превышает 37 ед., в то время как при раке ПЖ этот показатель возрастает в десятки, а иногда в сотни и тысячи раз. К сожалению, уровень СА-19-9 при раннем раке ПЖ обычно не повышен, что существенно ограничивает применение данного метода в скрининговом исследовании на предмет выявления ранних форм рака ПЖ, даже у больных, входящих в группу риска.
Инструментальная диагностика обструктивных процессов панкреатодуоденальной зоны
Основными инструментальными методами исследования больных обструктивными заболеваниями ПДЗ являются УЗИ, эндо-УЗИ, ЭРХПГ, компьютерная томография (КТ), магнитно-резонансная томография (МРТ), позитронно-эмиссионная томография (ПЭТ), магнитно-резонансная холангиопанкреатография (МРХПТ), эндоскопическая фиброгастродуоденоскопия с биопсией, рентгенконтрастное исследование ЖКТ, фистулография, интраоперационная экспресс-биопсия, лапароскопия.
УЗИ является наиболее частым методом исследования, у многих больных – первичным методом инструментального обследования с установлением окончательного диагноза объемного обструктивного процесса в ПДЗ.
Одним из новых методов исследования является эндо-УЗИ – ультразвуковое исследование, выполняемое во время эндоскопии. Данное исследование позволяет неинвазивно диагностировать интраампулярные доброкачественные и злокачественные опухоли БДС при стандартном эндосонографическом исследовании панкреатобилиарной зоны и уже на ранних стадиях заболевания определять показания к радикальному оперативному лечению. По данным литературы, эндо-УЗИ является высокоинформативным методом уточняющей диагностики, характеризующимся превосходящей в сравнении с другими методами точностью (в оценке критерия T – 87%, критерия N – 80%, инвазии в сосуды – 95%).
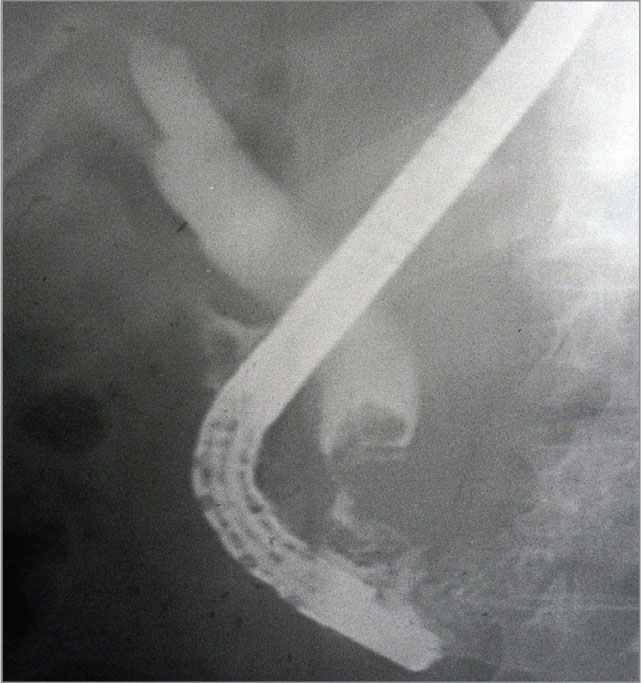
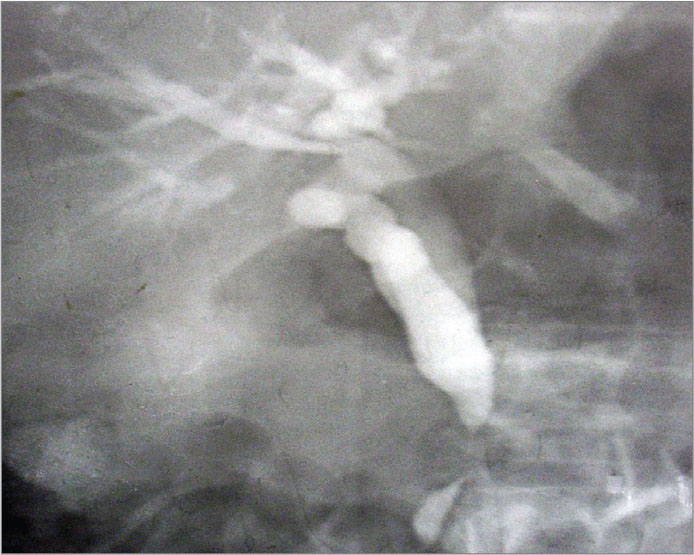
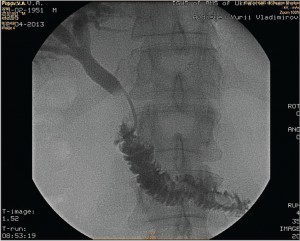
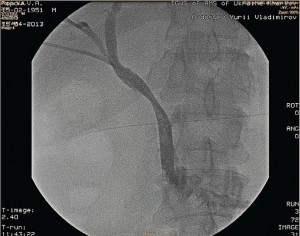
ЭРПХГ является основным диагностическим методом выбора для определения уровня обтурации желчного и панкреатического протоков и уточнения диагноза. ЭРПХГ осуществляется с помощью дуоденоскопа с боковой оптикой и мобильной рентгеноскопической установкой по стандартной методике с применением водорастворимых рентгеноконтрастных препаратов (триомбраст, ультравист) (рис. 1, 2).
Возможности мультидетекторной (64-срезовой) СКТ с 3D реконструкцией
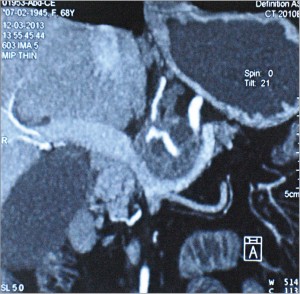
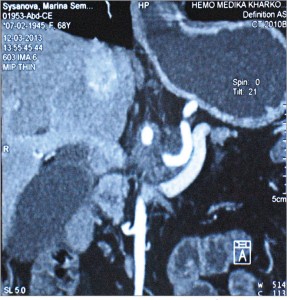
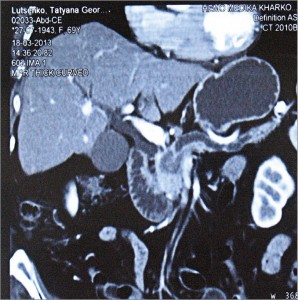
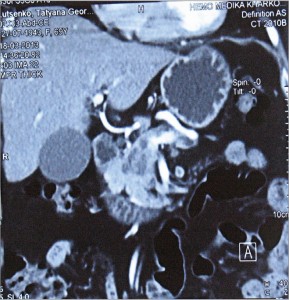
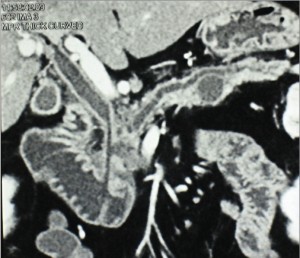
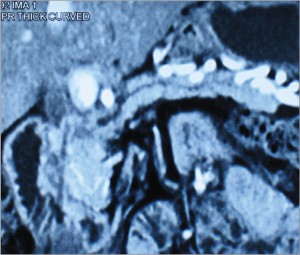
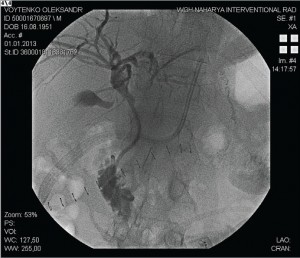
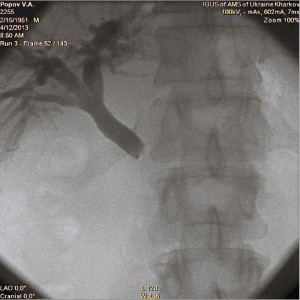
Мультидетекторная СКТ является наиболее информативным предоперационным методом для установления резектабельности опухоли, так как позволяет определить размеры опухоли, инвазию в близлежащие крупные сосуды; уровень блокады и деформации желчных протоков, оценить взаимоотношения опухоли с окружающими органами и тканями; прорастание опухоли в гепатодуоденальную связку или корень брыжейки тонкой кишки; распространение опухоли головки ПЖ на перешеек и тело; оценить возможность выполнения сосудистой реконструкции, определить наличие метастазов в лимфатические узлы, печень и другие органы, обнаружить канцероматоз брюшины (рис. 3-6).
Разработана и успешно применена методика одномоментного ЭРПХГ и СКТ для наиболее точной диагностики уровня обструкции и объема обструктивного поражения органов ПДЗ. Изначально пациентам производили ЭРХПГ, затем в течение 15-30 мин проводилась СКТ с уже имеющимся внутрипротоковым контрастным усилением. Проведение ЭРХПГ и СКТ с незначительным временным интервалом обеспечивало высокую степень достоверности в диагностике хирургических заболеваний печени, билиарного тракта и ПЖ, дало возможность определить уровень, протяженность, причину обтурации, позволяло оценить характер содержимого внутрипеченочных желчных протоков.
Наряду с СКТ, информативной методикой топической диагностики распространенности, уровня обтурации и определения операбельности обструктивных процессов в ПДЗ является МРТ.
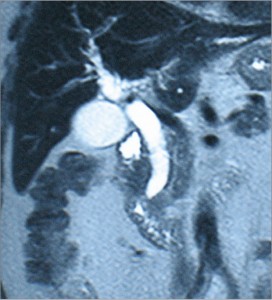
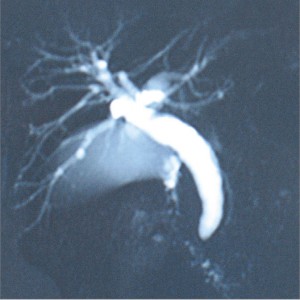
Новая методика визуализации желчных и панкреатических протоков – МРХПГ, которая дает возможность определить уровень, протяженность, причину обтурации, позволяет оценить характер содержимого внутрипеченочных желчных протоков. Возможность построения трехмерного изображения желчных протоков и выяснения соотношения их с портальной системой при МРХПГ позволяет определить безопасный доступ и вид декомпрессии билиарного тракта, возможность визуализации внепротоковых образований, особенно опухолей печени и желчных путей (рис. 7, 8).
Рентгеноконтрастное исследование ЖКТ с применением методики релаксационной дуоденоскопии позволяет установить степень нарушения проходимости желудка и ДПК у больных с обструктивными процессами ПДЗ.
Проведение тонкоигольной биопсии малоинформативно при небольших размерах опухоли, имеет высокий риск ложноотрицательного результата и риск диссеминации, рекомендуется при нерезектабельных случаях, а также при сомнительном диагнозе аденокарциномы и подозрении на иной тип опухоли или псевдотуморозный панкреатит. По образному высказыванию М. Треде, «лучшей биопсией поджелудочной железы является операция Уиппла». Проведение интраоперационной экспресс-биопсии ПЖ, печени и окружающих лимфоузлов – это одно из и самых важных диагностических исследований для дифференциальной диагностики злокачественного и доброкачественного обструктивного процессов ПДЗ.
В последнее время активно применяется позитронно-эмиссионная томография (ПЭТ) – новейший диагностический метод, основанный на применении радиофармпрепаратов, который позволяет строить трехмерную реконструкцию функциональных процессов, происходящих в организме. В отличие от СКТ и МРТ, ПЭТ применяется не для изучения анатомических особенностей тканей и органов, а для диагностики их функциональной активности.
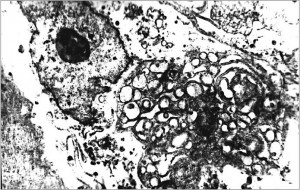
В нашей клинике проведены морфологические исследования препаратов печени и ПЖ у пациентов с патологией органов панкреатодуоденальной зоны: при раке фатерова сосочка, раке головки ПЖ, хроническом головчатом псевдотуморозном панкреатите и стенозирующем папиллите с помощью электронной, световой и поляризованной микроскопии с использованием гистохимических реакций [1, 2].
Практически во всех препаратах были обнаружены «stellate cells», коллаген I и ІІІ типов, миофибробластоподобные клетки, что свидетельствовало об активации фиброзно-склеротических процессов, увеличении числа и повышении уровня синтетической активности коллагенпродуцирующих клеток. Эти данные подтверждают взаимосвязь между хроническими фиброзирующими процессами и онкопроцессами в ПЖ (рис. 9, 10).
Методики выполнения билиарной декомпрессии
Выполнение радикальных оперативных вмешательств у больных с длительной желтухой, сопровождающейся высокими цифрами билирубина, увеличивает риск послеоперационных осложнений и сопровождается высокой летальностью. Двухэтапный подход к лечению этой группы больных, заключающийся в предварительной декомпрессии желчных протоков и последующей операции, позволяет уменьшить послеоперационную летальность. Выбор метода билиарной декомпрессии зависит от распространенности опухоли, уровня обструкции желчных протоков, состояния больного, а также от возможности проведения радикального оперативного вмешательства по удалению опухоли в дальнейшем.
Показания к билиарной декомпрессии перед ПДР:
• МЖ (повышение билирубина выше 250 мкмоль/л), печеночно-почечная недостаточность;
• полиорганная недостаточность;
• выраженная интоксикация;
• нарушение свертывающей системы крови при длительной желтухе;
• наличие тяжелой сопутствующей патологии (коронарокардиосклероз, СД, мерцательная аритмия).
Быстрая ликвидация желтухи при выполнении декомпрессии может вести к нарастанию печеночной недостаточности. При МЖ имеются выраженные нарушения энергетического состояния и гипоксия печени. Наличие желчной гипертензии вызывает уменьшение портального кровотока. Быстрая декомпрессия за счет резкого перепада давления в желчевыводящих путях ведет к уменьшению линейного и объемного воротного кровотока в ближайшие часы после восстановления оттока желчи, и при этом может длительное время сохраняться нарушение функционального состояния печени. В первые 2-4 сут при высокой билирубинемии после быстрой билиарной декомпрессии может наблюдаться ухудшение состояния больных и отсутствовать положительная динамика биохимических показателей. Клинически декомпрессионный синдром проявляется нарастанием признаков печеночной недостаточности, нарастанием желтухи, прогрессированием печеночной энцефалопатии, ухудшением функциональных показателей печени. Для профилактики синдрома «быстрой декомпрессии» билиарного тракта предлагается дозированная билиарная декомпрессия, при которой выполняется медленный отток желчи.
С целью билиарной декомпрессии применяются следующие варианты: эндоскопическое стентирование, чрескожное чреспеченочное наружно-внутреннее дренирование, различные варианты холецистостомии, билиодигестивные анастомозы.
Преимуществами эндоскопического стентирования являются мини-инвазивность и меньшая частота осложнений. К преимуществам ретроградного доступа относят возможность выполнения холангиопанкреатографии, взятие материала для морфологической верификации, цитологического исследования. Эндоскопическое стентирование может являться первым этапом лечения с последующим выполнением радикального оперативного вмешательства, так и окончательным методом лечения у пациентов с нерезектабельными опухолями панкреатобилиарной зоны. Для стентирования применяются пластиковые и нитиноловые стенты. При выполнении ЭРХПГ, СКТ определяется правильность установления стента и топическое расположение относительно опухоли (рис. 11-14).
При наличии опухолевых процессов панкреатодуоденальной зоны, сопровождающихся стенозом ДПК, наряду с эндоскопическим стентированием желчных путей применяется гастродуоденальное стентирование. Негативные стороны стентирования: лучевая нагрузка, ограниченные сроки функционирования, миграция стентов во время установки, необходимость замены стентов, пролежни, перфорация, внутренние свищи.
Чрескожная чреспеченочная холангиостомия широко применяется в качестве предоперационной декомпрессии желчных путей или как вид паллиативного хирургического лечения. Данная процедура позволяет провести наружное, наружно-внутреннее дренирование, стентирование желчных протоков (рис. 15-18).
Простым методом декомпрессии является холецистостомия. Выполняют видеолапароскопическая холецистостомия, холецистостомия под УЗИ-контролем.
При невозможности выполнения этих мини-инвазивных методик (отсутствии технических условий для их выполнения) выполняют различные виды билиодигестивных анастомозов. При выполнении холецистоеюноанастомоза важное значение имеет определение проходимости устья пузырного протока и расстояние от устья пузырного протока до верхней границы опухоли (рис. 19).
Оптимальным является (при сомнении в проходимости пузырного протока) наложение гепатикоеюноанастомоза на петле кишки, выделенной по Ру (рис. 20).
При неэффективности традиционного холецистоеюноанастомоза из-за перекрытия опухолью пузырного протока нами предложен компромиссный вариант операции билиарного дренирования с сохранением предыдущего анастомоза и наложением гепатикохолецистоанастомоза с гартмановым карманом или шеечной частью ЖП (патент Украины №84421) (рис. 21).
При сочетании признаков МЖ и дуоденальной непроходимости при обструктивных заболеваниях панкреатобилиарной зоны показано выполнение билиодигестивного анастомоза и гастроэнтероанастомоза (рис. 22, 23).
Таким образом, применение современных методов диагностики у больных с обструктивными заболеваниями панкреатодуоденальной зоны позволяет поставить правильный топический диагноз, определить взаимоотношения опухоли с окружающими крупными сосудами. Выполнение различных вариантов билиарной декомпрессии на первом этапе лечения позволяет подготовить пациентов к радикальному оперативному вмешательству в объеме ПДР с низким риском периоперационных осложнений.
Литература
1. Велигоцкий Н.Н. Обструктивные заболевания органов панкреатодуоденальной зоны / Н.Н. Велигоцкий, А.Н. Велигоцкий. – Харьков: Планета-Принт, 2015. – 136 с.
2. Гальперин Э.И. Лекции по гепатопанкреатобилиарной хирургии / Э.И. Гальперин, Т.Г. Дюжева. – М.: Видар, 2011. – 536 с.
3. Данилов М.В. Выбор оптимального метода обработки культи поджелудочной железы после панкреатодуоденальной резекции / М.В. Данилов // Анналы хирургической гепатологии. – 2013. – Т. 18, №3. – С. 40-45.
4. Рак поджелудочной железы – современные взгляды на проблему / Кабанов М.Ю., Соловьев И.А., Семенцов К.В. [и др.] // Анналы хирургической гепатологии. – 2012. – Т. 17, №4. – С. 106-110.
5. Предварительная билиарная декомпрессия при оперативном лечении опухолей панкреатодуоденальной зоны / Н.Н. Велигоцкий, С.Э. Арутюнов, Ю.В. Авдосьев [и др.] // Харьківська хірургічна школа. – 2014. – №4. – С. 12-16.
6. Эндоскопическая ультрасонография в диагностике инвазии опухоли поджелудочной железы в магистральные сосуды / А.М. Нечипай, М.С. Бурдюков, И.Н. Юричев, Н.В. Романенко // Анналы хирургической гепатологии. – 2010. – Т. 15, №2. – С. 72-80.
7. Pancreatoduodenectomy using a no-touch isolation technique / Hirota M., Kanemitsu K., Takamori H. [et al.] / Am. J. SURG. – 2010. – Vol. 199. – P. 65-68.
8. Problems of reconstruction during pancreatoduodenectomy / Sakorafas G.H., Friess H., Balsiger B.M. [et al.] //Dig. Surg. – 2011. – Vol. 18 (5). – P. 363-369.