25 листопада, 2015
Basket trials: новый принцип организации клинических исследований
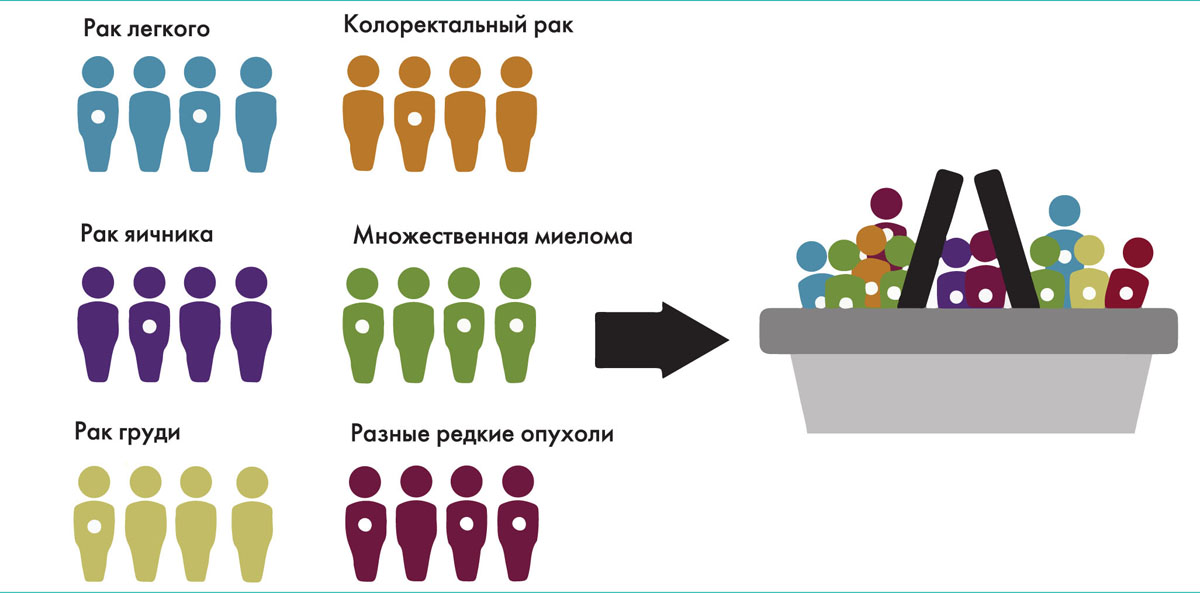
Появление принципиально нового подхода к организации клинических исследований – следствие развития таргетной терапии, направленной на определенную генетическую или молекулярную мишень внутри опухолевой клетки. Если классические клинические испытания предполагают изучение новых лекарственных препаратов в группах больных с определенными типами и локализациями злокачественных новообразований, то basket trials, или «корзинные исследования», сфокусированы на определенных генетических мутациях независимо от типа опухоли.
Обоснование
Стандартные клинические испытания подразумевают набор пациентов с опухолями определенной локализации или гистологического типа, например карциномы желудка, меланомы кожи, саркомы мягких тканей и т.д. Расширение знаний о биологии опухолевой клетки, биологической и предиктивной значимости отдельных генетических маркеров заметно сузило рамки многих исследовательских протоколов. Так, большинство современных клинических исследований, касающихся лечения рака грудной железы (РГЖ), предполагают отбор или стратификацию пациентов на основании статуса гормональных рецепторов и HER2. Кроме того, возможности стандартных исследований, предполагающих изучение только одного вида опухоли, ограничены, поскольку не включают других пациентов, которые могли бы положительно отреагировать на исследуемое лечение и которые оказываются неучтенными.
Но это далеко не предел. Сегодня известно, что многие виды онкологических заболеваний могут быть вызваны одной и той же мутацией конкретного онкогена. Например, мутация гена p53 наблюдается более чем при 50% онкологических заболеваний. Поскольку возможности охарактеризовать молекулярный профиль опухоли расширяются, постепенно начинается переход к новому, все более персонализированному принципу организации клинических испытаний.
Авторы нового подхода к исследованиям подчеркивают, что даже наиболее эффективные таргетные препараты не демонстрируют должного эффекта, когда они оцениваются в неадекватной популяции пациентов, как было показано в начале исследования ингибиторов EGFR в неотобранной популяции пациентов. Кроме того, несмотря на растущее признание значимости геномного анализа в онкологической клинической практике, оценка эффективности таргетных препаратов может представлять собой огромную проблему, когда конкретные мутации редки и разбросаны среди разных типов опухолей.
Некоторые генетические мутации встречаются настолько редко, что обнаруживаются только на фоне общих отрицательных результатов клинических испытаний. Например, в последних исследованиях ингибитор мишени рапамицина млекопитающих (mTOR) эверолимус вызвал чрезвычайный и прочный ответ у двух конкретных пациентов, несмотря на малую эффективность в целом при раке мочевого пузыря и щитовидной железы. У этих пациентов с исключительным ответом на лечение были ретроспективно выявлены специфические мутации в сигнальных путях, связанных с mTOR, которые и обеспечили их уникальную чувствительность к эверолимусу. Если похожие мутации будут идентифицированы у других пациентов, эверолимус может стать препаратом выбора для них независимо от гистологического типа опухоли.
Итак, развитие таргетной терапии продолжает двигаться по пути максимальной индивидуализации, основываясь на поиске и воздействии на специфические молекулярные мишени. Это, в свою очередь, значительно затрудняет набор пациентов для участия в клинических исследованиях, поскольку опухоли определенной локализации, несущие определенную генетическую мутацию, могут быть очень редкими. Например, транслокации гена ALK при раке легкого встречаются не более чем в 4-8% случаев аденокарциномы этого органа и практически не встречаются при плоскоклеточных опухолях. Исследователи подчеркивают: точно так же, как современные возможности исследовать геном опухолей человека планомерно увеличиваются, должны расширяться стратегии, применяемые в дизайне клинических исследований.
Особенности дизайна
Новый подход к дизайну исследований основывается на предпосылке, что препарат, сфокусированный на конкретной генетической мутации, может быть эффективен независимо от гистологического типа опухоли.
«Корзинные исследования» предполагают включение пациентов с разными видами опухолей, которые потенциально могут получить клинический эффект от назначаемой таргетной терапии. Единственным фактором, объединяющим участников исследования, является наличие конкретной молекулярной мишени, на которую воздействует исследуемый таргетный препарат (рис.).
Еще в 2007 году А. Lopez-Chavez и соавт. сообщили о проведении исследования CUSTOM (Molecular Profiling and Targeted Therapies in Advanced Thoracic Malignancies). Это исследование было посвящено выявлению молекулярных биомаркеров при немелкоклеточном раке легкого (НМРЛ), мелкоклеточном раке легких и злокачественных новообразованиях тимуса, с целью одновременно оценить пять видов таргетной терапии у пациентов, сгруппированных по наличию тех или иных молекулярных маркеров. В исследовании назначались пять таргетных препаратов: эрлотиниб (у пациентов с мутациями EGFR), МЕК-ингибитор селуметиниб (при мутациях генов KRAS, HRAS, NRAS и BRAF), AKT-ингибитор MK2206 (при мутациях PIK3CA, AKT1 и PTEN), лапатиниб (при мутации HER2) и сунитиниб (при мутациях KIT и PDGFRA). Была сделана попытка оценить каждую стратегию терапии в разных гистологических подтипах в общей сложности в пятнадцати исследуемых подгруппах. Целью этого дизайна было проведение нескольких независимых и параллельных исследований II фазы.
Исследование CUSTOM быстро показало основные сильные стороны «корзинных исследований»: возможность определить благоприятный ответ таргетной терапии при малом количестве пациентов и возможность проверки клинической мишени, а также показало ограничения, связанные с попыткой отбора по гистологическому подтипу. В этом исследовании только 15 больных НМРЛ с мутацией EGFR были зачислены в группу лечения эрлотинибом, но результаты продемонстрировали уровень общего ответа 60%. Эта ветка исследования была преждевременно закрыта в связи с публикацией доказательств эффективности эрлотиниба, но данные тем не менее иллюстрируют, что с соответствующим парным выбором мишени и терапии не требуется значительное количество пациентов, чтобы определить терапевтическую эффективность. Тем не менее, как отмечают авторы в финальной публикации результатов исследования в этом году, им удалось завершить анализ только в двух из пятнадцати запланированных групп (эрлотиниб при НМРЛ и селуметиниб при НМРЛ), причем во второй из этих групп не достигнута первичная конечная точка. Анализируя это исследование, эксперты говорят о недостатках в его планировании, в первую очередь – о недостаточной оценке доклинических данных.
Следует отметить, что некоторые исследования рассматривают возможность начинать «корзинные исследования» с использования таргетной терапии в невыбранной популяции пациентов, с последующим выявлением у лиц, ответивших на лечение, генетических биомаркеров для последующего проспективного скрининга. В текущем году Национальный институт рака (США) запланировал набор пациентов в исследование NCI-MATCH (Molecular Analysis for Therapy Choice). В рамках этого исследования планируется обследовать около 3000 пациентов, с последующим включением в исследование не менее 1000 больных для назначения им таргетной терапии независимо от гистологического типа опухоли.
Конкретные результаты
Недавно опубликованы результаты первого «корзинного исследования», посвященного изучению эффективности вемурафениба у пациентов с разными типами опухолей, у которых выявлена мутация гена BRAF. Мутации BRAF встречаются не только более чем в 50% меланом, но и в опухолях щитовидной железы, легкого, толстой кишки, заболеваниях кроветворной системы и некоторых других онкологических заболеваниях. Отбор больных и организация отдельного клинического исследования для каждой из перечисленных нозологических единиц крайне затруднительны. В исследовании приняли участие 122 пациента из 23 медицинских центров разных стран. Исследование было ориентировано на конкретную генетическую мишень: включало все разновидности новообразований (в том числе редкие) на основе единственного критерия – наличия активирующей мутации в гене BRAF.
В текущем году D. Hyman и соавт. представили его результаты, показав хорошую активность таргетной терапии при НМРЛ, болезни Эрдгейма-Честера (гистиоцитозе клеток Лангерганса). Ответы на лечение были зафиксированы у 42% больных НМРЛ и у 43% пациентов с болезнью Эрдгейма-Честера. В некоторых случаях также наблюдались ответы BRAF-мутированных опухолей других локализаций, но поскольку в исследование были включены единичные пациенты с такими опухолями, о какой-либо статистике говорить преждевременно. Таргетная терапия, направленная против BRAF-мутации, оказалась неэффективной в отношении карцином толстой кишки (как известно, наличие мутации в гене BRAF – значимый фактор неблагоприятного прогноза при таких опухолях); добавление цетуксимаба лишь в незначительной мере улучшало результаты лечения. Эти данные убедительно показывают, что успех таргетной терапии зависит не только от присутствия в опухоли белка-мишени, но и от сопутствующих биологических факторов.
… и перспективы
В дополнение к разъяснению эффективности препарата при опухолях разных типов «корзинные исследования» предоставляют возможность для тестирования методов лечения редких онкологических заболеваний, которые недостаточно представлены в клинических испытаниях. Пациенты с редкими патологиями могут быть включены в исследования этого типа, имея мутации, которые находятся в стадии изучения в рамках «корзинного исследования».
«Корзинные исследования» позволяют не только осуществить быстрый набор пациентов, оценить перспективность применения таргетного препарата при всех видах опухолей, несущих конкретную мутацию, но и облегчают пациентам с редкими заболеваниями доступ к современному лечению.
Тесты на наличие BRAF и других мутаций в опухоли проводятся преимущественно у больных с запущенными формами онкологических заболеваний. Возможно, внедрение «корзинных исследований» станет основанием для избирательного иммуногистохимического исследования при более ранних стадиях онкологического процесса, а также при тех опухолях, при которых те или иные мутации рутинно не определяют – с целью изучить возможности включения пациентов в исследование. Ученые подчеркивают, что иммуногистохимическое тестирование должно проводиться на индивидуальной основе, исходя из определения, что такое тестирование будет полезно с медицинской точки зрения.
Таким образом, «корзинные исследования» являются одним из путей развития медицинской науки и уверенно вошли в практику исследований в онкологии. Как и в случае с любым другим подходом в трансляционной медицине, успех этой стратегии зависит от строгой оценки доклинических данных при проектировании дизайна исследования.
Комментарии экспертов
 Молекулярные изменения, характеризующие опухоль, могут быть более уместны, чем гистологическое типирование, которое исторически использовалось для классификации опухолей и определения непосредственных терапевтических возможностей».
Молекулярные изменения, характеризующие опухоль, могут быть более уместны, чем гистологическое типирование, которое исторически использовалось для классификации опухолей и определения непосредственных терапевтических возможностей».
Amanda J. Redig
Эти исследования, которые в некоторой степени независимы от типа опухоли, являются более демократичными, особенно для людей с редкими формами рака. «Корзинные исследования» расширяют популяции больных, имеющих право на получение современных таргетных препаратов».
David Hyman
 У нас нет фантазий, что блокирование одного сигнального пути сработает в большинстве случаев. В ближайшие годы «корзинные исследования» коснутся преимущественно комбинированной терапии, но такие исследования будут новаторскими и в этом случае. Это путь вперед».
У нас нет фантазий, что блокирование одного сигнального пути сработает в большинстве случаев. В ближайшие годы «корзинные исследования» коснутся преимущественно комбинированной терапии, но такие исследования будут новаторскими и в этом случае. Это путь вперед».
Jose Baselga
Литература
1. Lopez-Chavez A., Thomas A., Rajan A, et al.: Molecular profiling and targeted therapy for advanced thoracic malignancies: A biomarker-derived, multiarm, multihistology phase II basket trial. J Clin Oncol 33: 1000-1007, 2015.
3. Redig A.J., Jаnne P.A. Basket Trials and the Evolution of Clinical Trial Design in an Era of Genomic Medicine. J. of Clin. Onc., 2015.
4. Hyman D.M., Puzanov I., Subbiah V., Faris J.E., Chau I., Blay J.Y., Wolf J., Raje N.S., Diamond E.L., Hollebecque A., Gervais R., Elez-Fernandez M.E., Italiano A., Hofheinz R.D., Hidalgo M., Chan E., Schuler M., Lasserre S.F., Makrutzki M., Sirzen F., Veronese M.L., Tabernero J., Baselga J. Vemurafenib in Multiple Nonmelanoma Cancers with BRAFV600 Mutations. N Engl J Med. 2015 Aug 20; 373(8): 726-36.
5. www.mskcc.org.
6. www.ascopost.com.
Подготовила Катерина Котенко



