16 липня, 2015
Диффузная В-крупноклеточная лимфома

Неходжкинские лимфомы (НХЛ) – неоднородная группа лимфопролиферативных заболеваний, происходящих из В-лимфоцитов, Т-лимфоцитов или натуральных киллеров (NK-клеток). В США среди диагностируемых НХЛ В-клеточные лимфомы составляют 80-85%, Т-клеточные лимфомы – 15-20%. NK-клеточные лимфомы встречаются очень редко. По прогнозам, в 2015 г. диагноз НХЛ будет установлен 71 850 пациентам, и 19 790 больных умрут от этого заболевания. В структуре онкологической смертности НХЛ занимают 7-е место у мужчин и женщин. Диффузная В-крупноклеточная лимфома (ДВКЛ) является наиболее часто встречающейся лимфоидной неоплазией у взрослых и составляет около 30% диагностируемых НХЛ.
Диагностика
Согласно NCCN ДВКЛ включают следующие подтипы:
• ДВКЛ, не уточненная иным образом (большинство случаев ДВКЛ);
• ДВКЛ с сопутствующей фолликулярной лимфомой любой степени;
• ДВКЛ с сопутствующей MALT-лимфомой желудка;
• ДВКЛ с сопутствующей MALT-лимфомой других локализаций (кроме желудка);
• фолликулярная лимфома 3 степени;
• внутрисосудистая В-крупноклеточная лимфома;
• ДВКЛ, ассоциированная с хроническим воспалением;
• ALK-положительная ДВКЛ;
• EBV-положительная ДВКЛ пожилого возраста;
• T-клеточная / богатая гистиоцитами В-крупноклеточная лимфома.
Наиболее типичным клиническим симптомом ДВКЛ является быстрорастущая масса, локализованная в области тела, богатой лимфоузлами. Первичный диагноз устанавливается путем микроскопии биоптатов опухоли.
Исследования профилей экспрессии генов выявили значительную гетерогенность ДВКЛ. Иммуногистохимически ДВКЛ разделяются на два различных подтипа: герминальноклеточный В-клеточный подтип – GCB (CD10+ или BCL6+, IRF4/MUM1-) и неGCB-подтип (CD10-, IRF4/MUM1+ или BCL6-, IRF4/MUM1-). Расширенный алгоритм классификации учитывает дополнительные иммуногистохимические маркеры – GCET1 и FOXP1. GCB-подтип ассоциируется с лучшим прогнозом по сравнению с неGCB-подтипом, однако лечение обоих подтипов ДВКЛ одинаковое.
Реаранжировка гена MYC выявляется у 9-17% пациентов с ДВКЛ и часто коррелирует с фенотипом GCB. ДВКЛ с одновременными реаранжировками генов BCL2 и MYC получили название лимфомы с «двойным ударом» (double-hit), которые характеризуются агрессивным клиническим течением и имеют общие признаки с лимфомой Беркитта и В-лимфобластной лимфомой. Лимфомы с «двойным ударом» наблюдаются у 2-11% пациентов с впервые установленным диагнозом ДВКЛ; эти больные имеют очень неблагоприятный прогноз даже при использовании ритуксимабсодержащей химиоиммунотерапии или интенсивной терапии с трансплантацией стволовых клеток. С помощью иммуногистохимического окрашивания также можно идентифицировать ДВКЛ с одновременной экспрессией белков MYC и BCL2 (ДВКЛ с «двойной экспрессией» – double-expressing); прогноз у пациентов с этим типом лимфомы хуже по сравнению с ДВКЛ в целом, однако не в такой степени, как у больных с истинными (то есть с генетическими реаранжировками) лимфомами с «двойным ударом». Отдельных рекомендаций по ведению пациентов с ДВКЛ с «двойным ударом» или «двойной экспрессией» на сегодня нет.
Для установления диагноза и определения подтипа (GCB или неGCB) необходимо адекватное иммунофенотипирование. Типичный фенотип ДВКЛ – CD20+, CD45+, CD3-. Рекомендованная иммунофенотипическая панель включает CD20, CD3, CD5, CD10, CD45, BCL2, BCL6, Ki-67, IRF/MUM1 и MYC. В некоторых случаях определить подтип опухоли помогают дополнительные маркеры, такие как CD138, CD30, циклин D1, ALK1, EBV и HHV-8. Кроме того, полезными могут быть молекулярно-генетический анализ для выявления реаранжировки генов CCND1, BCL6 и MYC, а также цитогенетическое исследование (традиционное или флюоресцентная гибридизация in situ – FISH) для определения транслокаций t(14;18), t(3;v), t(8;14) или t(8;v).
Обследование
Первичное обследование пациентов с впервые диагностированной ДВКЛ должно включать физикальный осмотр с особым вниманием на зоны лимфоузлов, оценку функционального статуса и конститутивных симптомов, лабораторные исследования (общий анализ крови с лейкоцитарной формулой, метаболический профиль, уровни β2-микроглобулина и лактатдегидрогеназы – ЛДГ). У пациентов с выраженными симптомами и повышенным уровнем ЛДГ следует исключить синдром спонтанного лизиса опухоли, в том числе с помощью определения уровня мочевой кислоты. Если планируется иммунотерапия, рекомендуется провести тестирование на ВИЧ и гепатит В, поскольку этот вид лечения ассоциируется с реактивацией вирусов. При планировании химиотерапии у пациенток детородного возраста следует исключить беременность.
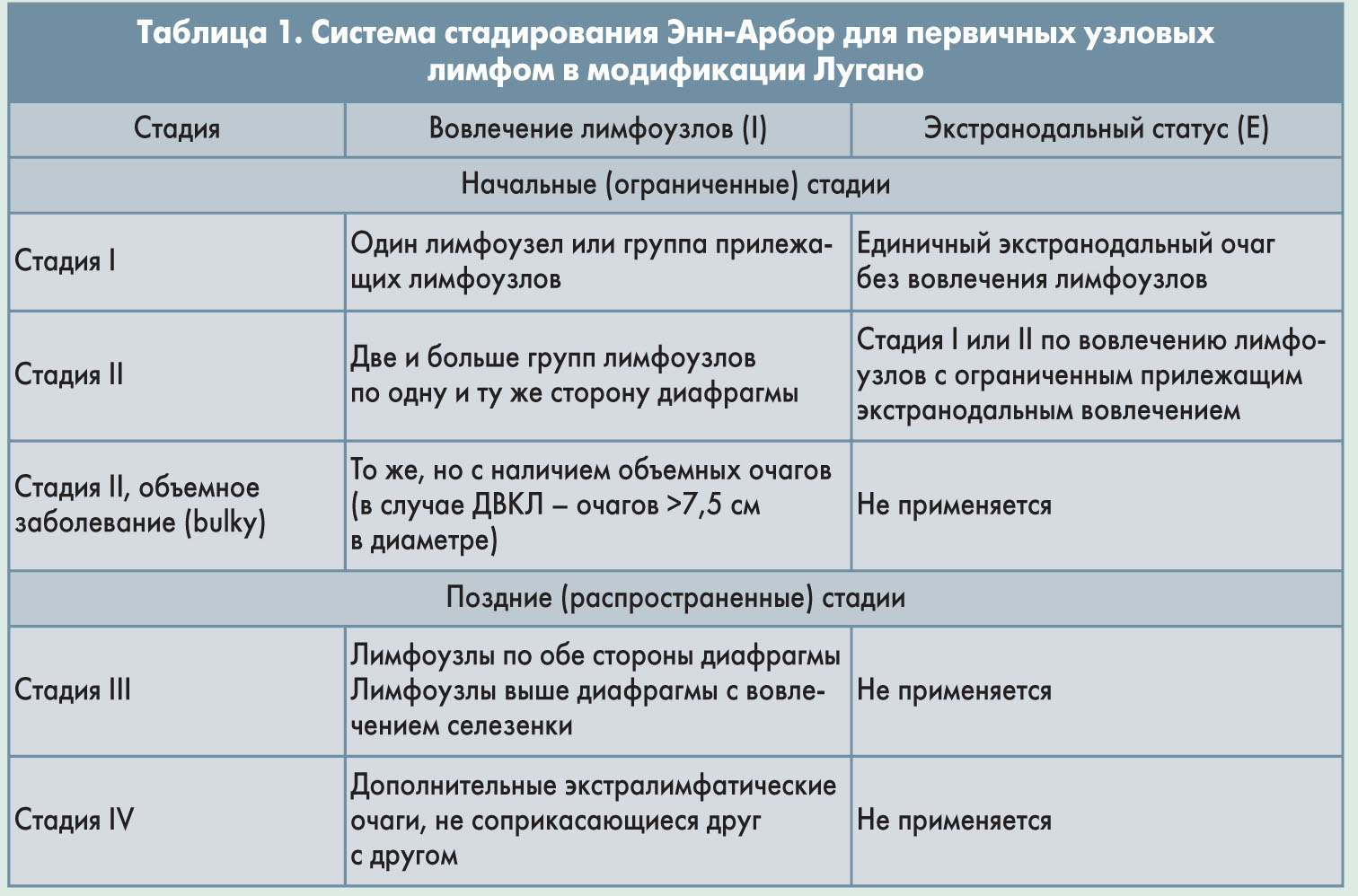
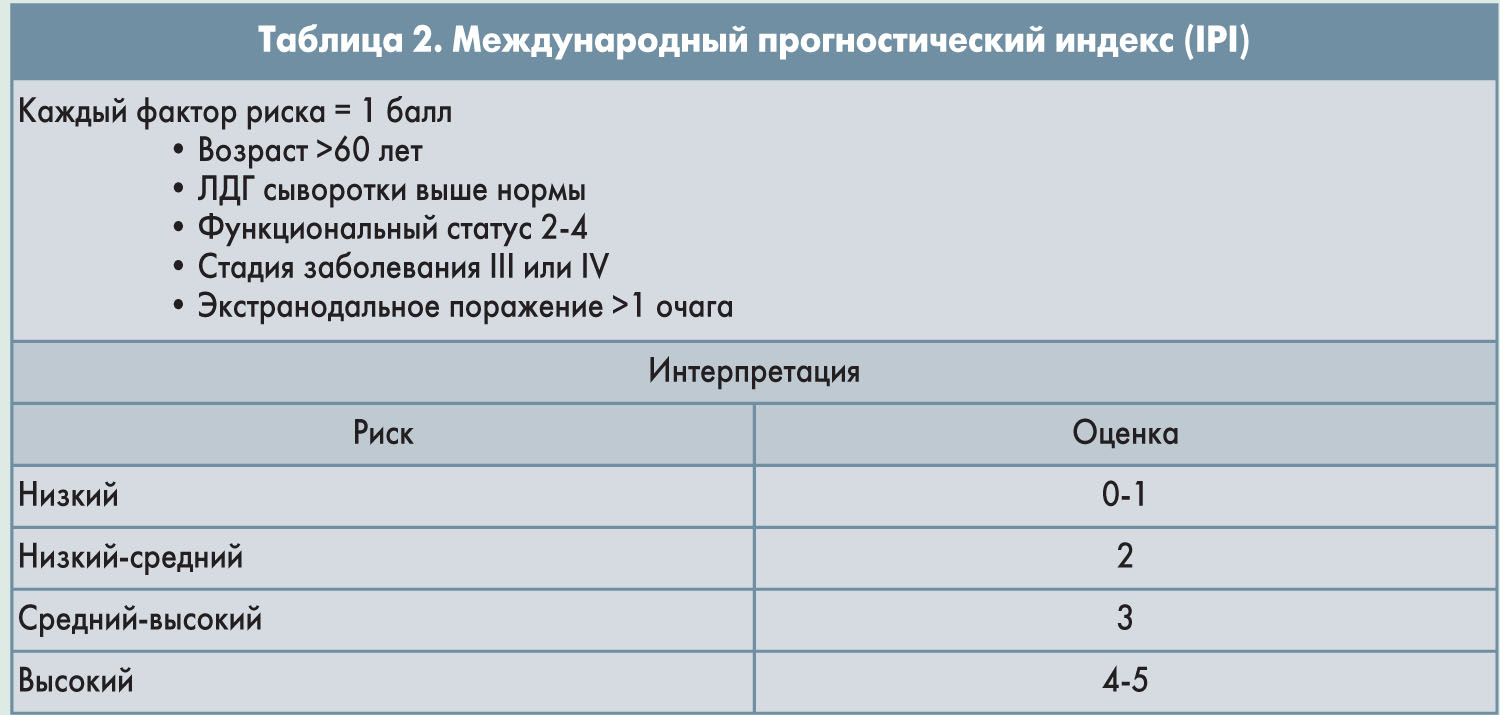
Для первичного определения стадии необходима трепанобиопсия с аспирацией костного мозга или без нее, при этом размер получаемого образца должен составлять не менее 1,6 см. Кроме того, необходимо идентифицировать все очаги заболевания и оценить прогноз на основании клинических факторов риска. К факторам, на основании которых рассчитывается международный прогностический индекс (IPI), относятся возраст, стадия заболевания (табл. 1), уровень ЛДГ, функциональный статус и количество опухолевых очагов за пределами лимфоузлов (табл. 2).
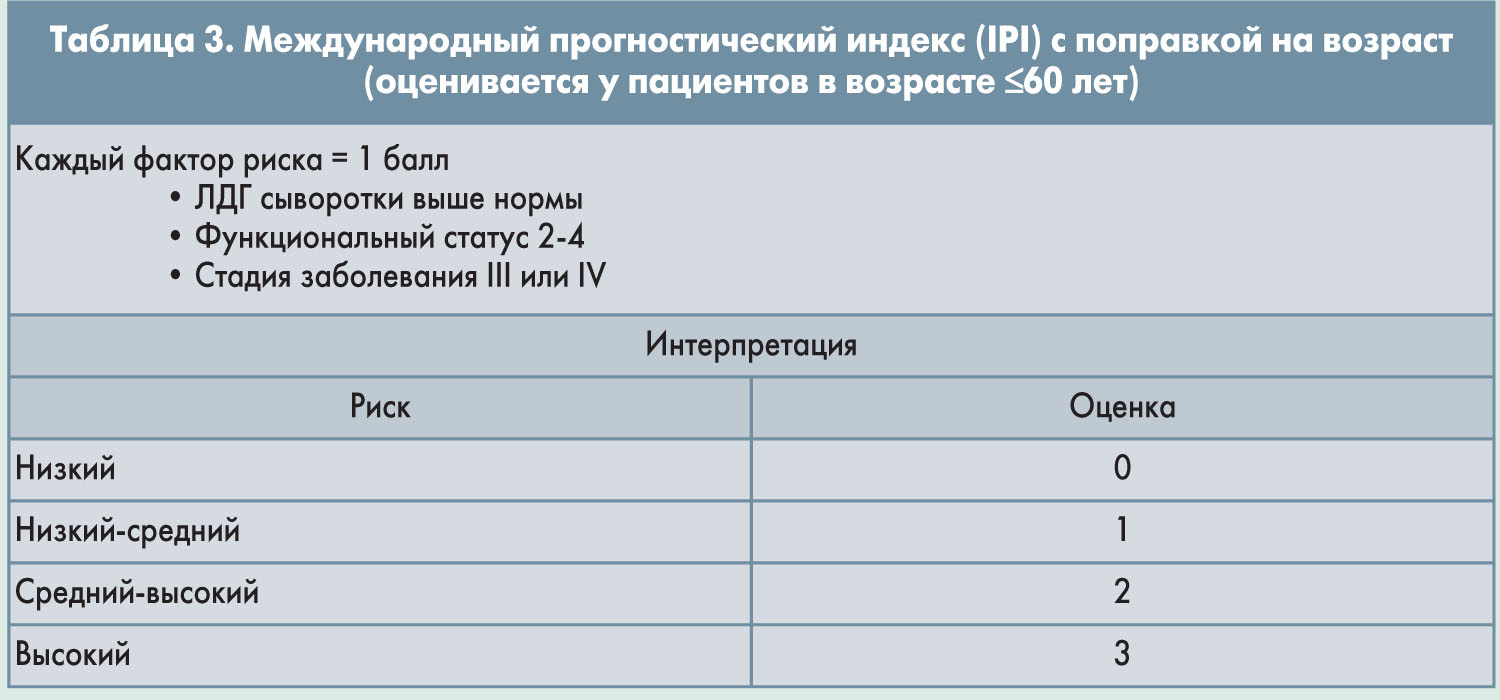
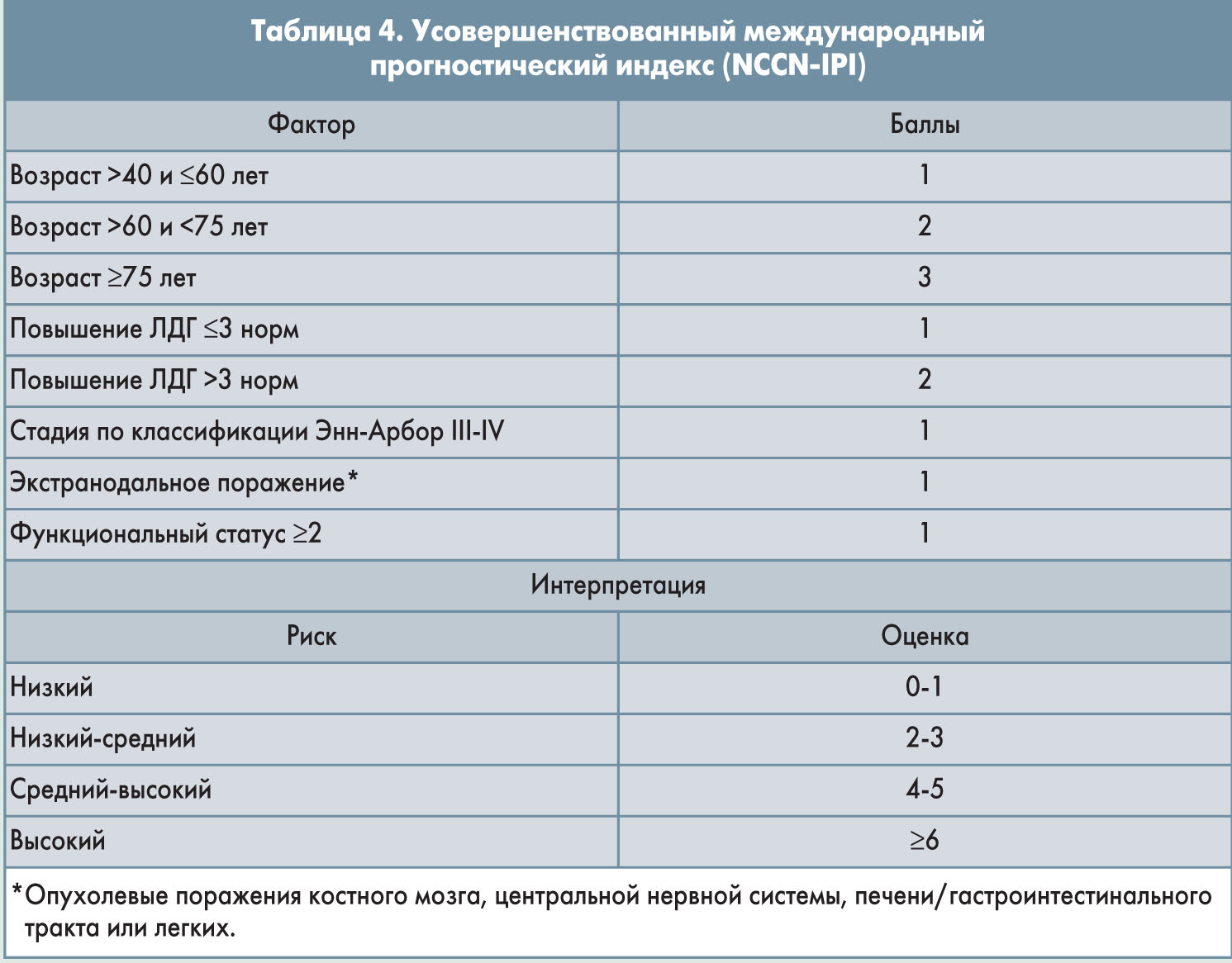
У пациентов младше 60 лет может использоваться IPI с поправкой на возраст (табл. 3). Недавно был разработан усовершенствованный вариант IPI (NCCN-IPI; табл. 4), позволяющий лучше разграничивать больных с низким и высоким риском (5-летняя общая выживаемость – ОВ – 96 vs 33%) по сравнению с IPI (5-летняя ОВ 90 vs 54%). Индекс NCCN-IPI успешно прошел валидацию в исследовании с участием 1138 пациентов.
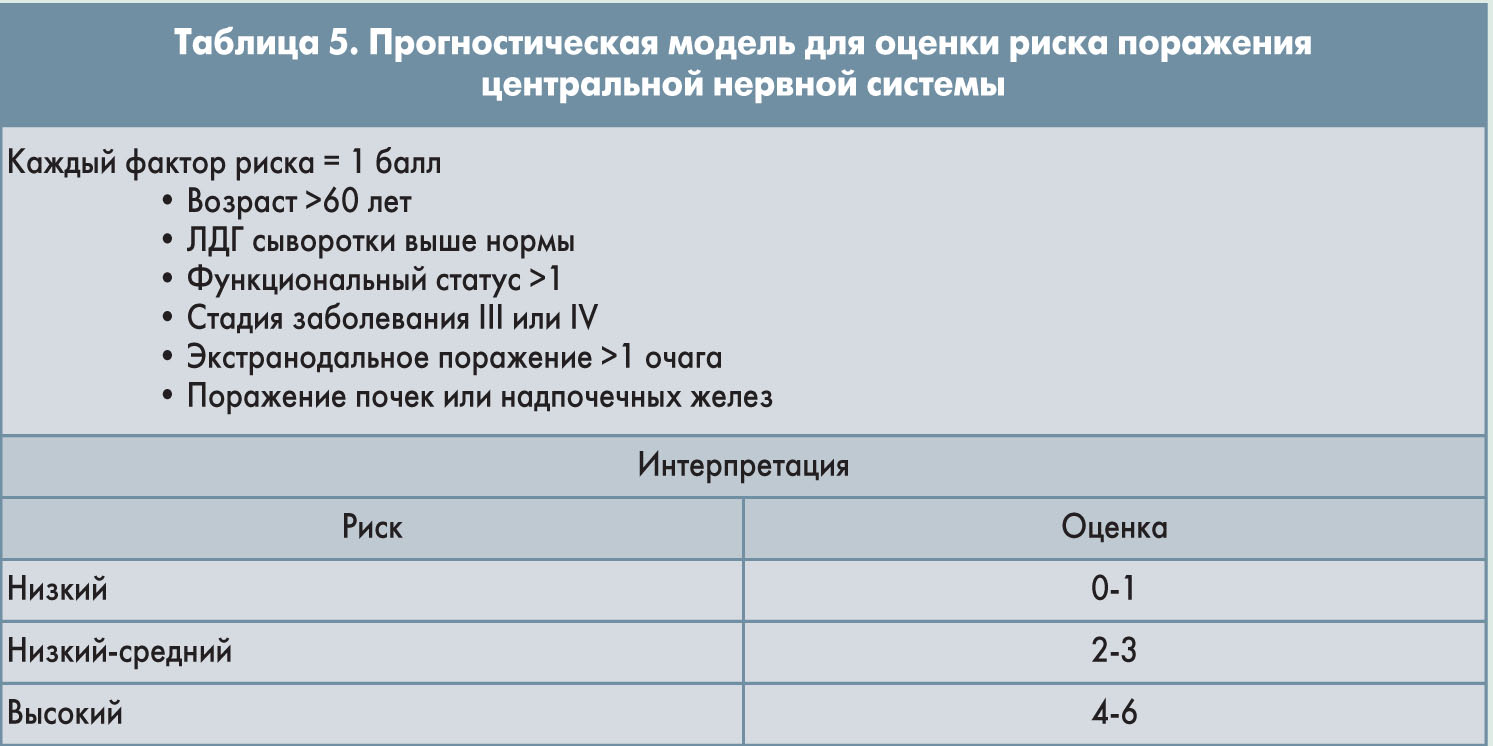
Позитронно-эмиссионная томография (ПЭТ) особенно информативна при первичном определении стадии и оценке ответа на лечение. Люмбальная пункция рекомендуется у пациентов с поражением околоносовых синусов, яичек, эпидурального пространства, костного мозга, с ВИЧ-ассоциированной лимфомой или при наличии ≥2 экстранодальных очагов и повышенного уровня ЛДГ. Диагностическая ценность пункции повышается, если спинномозговая жидкость анализируется с помощью проточной цитометрии. У пациентов с высоким риском поражения центральной нервной системы (табл. 5) следует рассмотреть целесообразность назначения профилактической химиотерапии.
Лечение в зависимости от стадии
Лечение ДВКЛ отличается у пациентов с локализованным заболеванием (стадия I-II по классификации Энн-Арбор) и у больных с более поздними (III-IV) стадиями. При отсутствии факторов риска (повышенный уровень ЛДГ, возраст старше 60 лет, объемное заболевание II стадии, функциональный статус ECOG ≥2) прогноз благоприятный. Остальных больных рекомендуется по возможности включать в клинические исследования.
Стадия I-II
В исследовании SWOG 8736 у пациентов с локализованными НХЛ три цикла CHOP с последующей лучевой терапией (ЛТ) на первично пораженные зоны (IFRT) обеспечили лучшую 5-летнюю выживаемость без прогрессирования (ВБП; 77 vs 64%) и ОВ (82 vs 82%) по сравнению с 8 циклами CHOP без IFRT, однако при дальнейшем наблюдении эта разница нивелировалась. Преимущество CHOP (3 цикла) с последующей IFRT (5-летняя ОВ 95%) у пациентов с начальными стадиями ДВКЛ (в возрасте ≤60 лет без факторов риска) также наблюдалось в серии исследований, организованных Онкологическим агентством Британской Колумбии (BCCA). В рандомизированном исследовании ECOG 1484 добавление ЛТ к CHOP (8 циклов) продлило ВБП у пациентов с ДВКЛ начальных стадий, которые достигли полного ответа на СНОР (6-летняя выживаемость без заболевания – ВБЗ – 73% при назначении IFRT vs 56% при наблюдении). В исследовании LNH 93-4, в котором участвовали пожилые пациенты с локализованной агрессивной лимфомой низкого риска, добавление ЛТ к 4 циклам СНОР не обеспечило преимуществ по сравнению с одной химиотерапией: 5-летняя выживаемость без событий (ВБС; 61 vs 64%) и 5-летняя ОВ (68 vs 72%) между группами статистически не различались. Тем не менее в данном исследовании проведение ЛТ значительно отсрочивалось, и 12% пациентов группы ЛТ этого лечения не получили.
В исследовании SWOG 0014 оценивали 3 цикла R-CHOP с последующей IFRT у пациентов с ≥1 фактором риска (необъемное заболевание II стадии, возраст >60 лет, функциональный статус 2 или повышенный уровень ЛДГ) согласно IPI с поправкой на возраст (n=60). После медианы наблюдения 5 лет 4-летняя ВБП составила 88%, 4-летняя ОВ – 92%. При сравнении с историческим контролем эти показатели были значительно лучше, чем у больных, не получавших ритуксимаб (4-летние ВБП и ОВ 78 и 88% соответственно).
В исследовании MInT изучали эффективность добавления ритуксимаба к 6 циклам химиотерапии типа СНОР у пациентов в возрасте до 60 лет с оценкой 0-1 балл по IPI (75% больных имели заболевание начальных стадий). ЛТ проводилась при экстранодальных очагах либо при наличии любых очагов >7,5 см в диаметре. В результате было продемонстрировано преимущество ритуксимабсодержащей химиотерапии по сравнению с химиотерапией без ритуксимаба: 6-летняя ОВ составила 90,1 vs 80% (р=0,0004), 6-летняя ВБС – 74,3 vs 55,8% (р<0,0001), 6-летняя ВБП – 80,2 vs 63,9% (р<0,0001).
В двух исследованиях GELA интенсивная химиотерапия (доксорубицин, циклофосфамид, виндезин, блеомицин и преднизон с последующей консолидацией метотрексатом, этопозидом, ифосфамидом и цитарабином) ± ритуксимаб обеспечивала лучшие исходы по сравнению с СНОР ± ритуксимаб (3 цикла) + ЛТ у пациентов с заболеванием начальных стадий низкого риска. Тем не менее эта схема также ассоциировалась со значительной токсичностью и включала виндезин, не доступный в США и многих других странах.
Стадия III-IV
Химиотерапия по схеме R-CHOP-21 стала стандартной терапией пациентов с поздними стадиями ДВКЛ на основании результатов исследования GELA LNH98-5, в котором добавление ритуксимаба к СНОР-21 улучшило ОВ и ВБП. В указанном исследовании пациентов в возрасте 60-80 лет (n=399) рандомизировали для получения 8 циклов R-CHOP или CHOP. Длительное наблюдение (медиана 10 лет) показало, что ВБП (36,5 vs 20%), ВБЗ (64 vs 43%) и ОВ (43,5 vs 28%) были значительно лучше в группе R-CHOP. В дальнейшем эти результаты были подтверждены в трех рандомизированных исследованиях: MInT (6 циклов R-CHOP или СНОР; относительно молодые пациенты с 0-1 фактором риска), Dutch HOVON and Nordic Lymphoma group (8 циклов R-СНОР-14 или СНОР-14) и ECOG/CALGB 9703. В исследовании ECOG/CALGB 9703 также было установлено, что поддерживающая терапия ритуксимабом при первой ремиссии не имеет клинических преимуществ у больных, получавших R-СНОР в качестве индукционной терапии.
Еще до появления ритуксимаба в исследовании German High Grade было продемонстрировано, что 6 циклов дозоинтенсивной химиотерапии по схеме СНОР (СНОР-14) в качестве 1-й линии терапии превосходят 6 циклов СНОР-21. В исследовании RICOVER 60 добавление ритуксимаба к 6 или 8 циклам СНОР-14 (R-СНОР-14) значительно улучшило клинические исходы у пожилых больных. При медиане наблюдения 82 мес отмечено достоверное улучшение ВБС и ОВ. У пациентов, получивших 8 циклов вместо 6, дополнительная клиническая польза отсутствовала, но повышалась токсичность. Авторы пришли к выводу, что 6 циклов R-CHOP-14 в сочетании с 8 дозами ритуксимаба следует считать предпочтительной схемой лечения этой группы больных.
В двух рандомизированных исследованиях сравнивали R-CHOP-21 и R-CHOP-14. В крупном исследовании III фазы, включившем 1080 пациентов с впервые диагностированной ДВКЛ, при медиане наблюдения 46 мес статистически значимые различия по ВБП и ОВ отсутствовали: 2-летняя ОВ составила 82,7% в группе R-CHOP-14 и 80,8% в группе R-CHOP-21 (p=0,3763), 2-летняя ВБП – 75,4 и 74,8% соответственно (р=0,5907). Токсичность была одинаковой, за исключением более низкой частоты нейтропении 3-4 степени в группе R-CHOP-14 (31 vs 60%). Это объясняется тем, что все больные группы R-CHOP-14 получали первичную профилактику гранулоцитарным колониестимулирующим фактором (Г-КСФ), в то время как в группе R-CHOP-21 первичная профилактика не проводилась. Интересно, что в этой крупной популяции пациентов отсутствовали различия в исходах между GCB- и неGCB-подтипами ДВКЛ. В исследовании III фазы GELA LNH03-6B сравнивали 8 циклов R-CHOP-14 и R-CHOP-21 у 602 пациентов в возрасте 60-80 лет с нелеченной ДВКЛ. После медианы наблюдения 56 мес группы статистически не различались в отношении 3-летней ВБС (56 vs 60%; р=0,7614), ВБП (60 vs 62%) и ОВ (69 vs 72%). Нейтропения 3-4 степени чаще регистрировалась при дозоинтенсивной терапии (74 vs 64% в группе R-CHOP-21), несмотря на то что Г-КСФ получали больше пациентов в группе R-CHOP-14 (90 vs 66% в группе R-CHOP-21). В целом результаты этих исследований указывают на то, что R-CHOP-21 остается стандартной схемой лечения для пациентов с впервые диагностированной ДВКЛ, при этом дозоинтенсивная терапия в эру ритуксимаба не улучшает исходы.
Пациенты старческого возраста (старше 80 лет) не были представлены в проспективных клинических исследованиях R-CHOP и обычно не являются кандидатами на полнодозовую терапию. Группа GELA провела многоцентровое проспективное исследование II фазы по оценке эффективности и безопасности низкодозовой CHOP + ритуксимаб в стандартной дозе (R-mini CHOP) у 149 пациентов старше 80 лет с ДВКЛ. После медианы наблюдения 20 мес медианы ОВ и ВБП составили 29 и 21 мес соответственно. Двухлетние показатели ОВ и ВБП равнялись 59 и 47%, четырехлетние – 49 и 41% соответственно. Нейтропения 3-4 степени была самым частым проявлением гематологической токсичности и наблюдалась у 59 больных.
У нелеченных пациентов с ДВКЛ значительную активность продемонстрировала схема DA-EPOCH-R (EPOCH с коррекцией доз препаратов + ритуксимаб). В многоцентровом исследовании II фазы GALBG схему DA-EPOCH-R (6-8 циклов) изучали у 69 ранее не получавших лечения пациентов с ДВКЛ. Индекс IPI соответствовал среднему-высокому риску у 21% пациентов. После медианы наблюдения 62 мес 5-летнее время до прогрессирования (ВДП) в общей популяции исследования составило 81%, ОВ – 84%. У пациентов с низким/низким-средним, средним-высоким и высоким риском 5-летнее ВДП составило 87, 92, и 54% соответственно (р=0,0085), 5-летняя ОВ – 95, 92 и 43% соответственно (р<0,001). Показатель ВДП был значительно выше в подгруппе пациентов c GCB-фенотипом по сравнению с неGCB-генотипом (100 vs 67%; р=0,008). Фенотип GCВ также ассоциировался с более высокой 5-летней ОВ (94 vs 68%; р=0,04). Высокий индекс пролиферации (Ki67 ≥60%) был связан с достоверно более низкими показателями ВДП и ОВ только в подгруппе пациентов с неGCB-фенотипом. Фебрильная нейтропения регистрировалась у 36% больных (4 степени – у 7%); другие значимые токсические эффекты 4 степени не наблюдались. Наиболее частыми проявлениями негематологической токсичности 3 степени были нейропатии (25%), патологическая усталость (16%) и аритмия (6%). В продолжающемся сегодня рандомизированном исследовании III фазы CALGB 50303 сравнивают схемы DA-EPOCH-R и R-CHOP у нелеченных пациентов с ДВКЛ. До публикации результатов этого исследования DA-EPOCH-R не может рекомендоваться в качестве стандартной стартовой терапии у пациентов с впервые диагностированной ДВКЛ, кроме отдельных клинических ситуаций (низкая функция левого желудочка, неклассифицируемая В-клеточная лимфома с признаками ДВКЛ и лимфомы Беркитта, первичная медиастинальная В-клеточная лимфома).
Как уже указывалось, стандартной терапии для больных ДВКЛ с «двойным ударом» (реаранжировкой гена MYC в сочетании с транслокацией t(14;18), вызывающей реаранжировку гена BCL2) на сегодня не существует. Такие лимфомы отличаются высокой агрессивностью, при этом стандартные схемы лечения, такие как R-CHOP, малоэффективны. В исследовании с участием 193 пациентов с ДВКЛ, получавших R-CHOP, медиана ОВ (13 vs 95 мес), медиана ВБП (6 vs 95 мес), 3-летняя ВБП (46 vs 65%; р=0,012) и 3-летняя ОВ (46 vs 72%, р=0,002) были значительно ниже у больных лимфомой с «двойным ударом». В другом похожем исследовании 5-летние показатели ВБП и ОВ у пациентов с ДВКЛ с «двойным ударом», получавших R-CHOP, составили 18 и 27% соответственно. В этих исследованиях также было установлено, что высокая одновременная экспрессия белков MYC и BCL2 (по данным иммуногистохимии), но не экспрессия генов MYC или BCL2 в отдельности, ассоциируется с достоверно худшими исходами после терапии R-CHOP. Многомерный анализ с поправкой на индекс IPI и происхождение клеток опухоли показал, что одновременная экспрессия генов MYC/BCL2 является независимым предиктором худших показателей ВБП и ОВ после R-CHOP.
В многоцентровом ретроспективном анализе 106 пациентов с ДВКЛ (77% больных лимфомами с «двойным ударом») схема R-EPOCH обеспечила более высокую частоту полного ответа по сравнению с R-CHOP (p=0,01) и другими интенсивными индукционными схемами (р=0,07). Кроме того, первичное рефракторное заболевание реже наблюдалось при использовании R-EPOCH по сравнению с R-CHOP (р=0,005) и другими схемами (р=0,03).
Рекомендации NCCN
Пациентам с малообъемным (<10 см) заболеванием I или II стадии рекомендуются R-CHOP (3 цикла) + IFRT или R-CHOP (6 циклов) ± IFRT. Больным, не являющимся кандидатами на химиотерапию, рекомендуется IFRT. У пациентов с объемным заболеванием (≥10 см) более высокую эффективность обеспечивают 6 циклов R-CHOP ± локорегионарная ЛТ.
У пациентов с поздними стадиями следует использовать R-CHOP-21. В некоторых случаях положительный эффект может оказать ЛТ на области с объемными очагами. R-CHOP-21 рекомендуется в качестве стартовой терапии; тем не менее могут применяться и другие антрациклинсодержащие схемы, в частности DA-EPOCH-R и R-CHOP-14.
У пациентов с плохим общим состоянием здоровья, а также у больных с низкой функцией левого желудочка в качестве 1-й линии терапии можно использовать следующие схемы:
• R-miniCHOP (у пациентов старше 80 лет);
• СЕРР (циклофосфамид, этопозид, преднизон, прокарбазин) + ритуксимаб;
• CDOP (циклофосфамид, липосомальный доксорубицин, винкристин, преднизон) + ритуксимаб;
• CNOP (циклофосфамид, митоксантрон, винкристин, преднизон) + ритуксимаб;
• DA-EPOCH + ритуксимаб;
• СЕОР (циклофосфамид, этопозид, винкристин, преднизон) + ритуксимаб.
По возможности пациентов следует включать в клинические исследования новых схем. У больных с объемным заболеванием или нарушенной почечной функцией первичная терапия включает мониторинг и профилактику синдрома лизиса опухоли.
Пациентам с высоким риском поражения центральной нервной системы (табл. 5) рекомендуется профилактическое назначение 4-8 доз метотрексата и/или цитарабина интратекально или 3-3,5 г/м2 метотрексата внутривенно. У больных с симптомами паренхиматозного поражения центральной нервной системы в план лечения необходимо включить метотрексат 3-8 г/м2 внутривенно, при лептоменингеальном поражении – 4-8 доз метотрексата и/или липосомального цитарабина интратекально и/или 3-3,5 г/м2 метотрексата внутривенно. При назначении высоких доз метотрексата пациентов следует подготовить с помощью гидратации и ощелачивания крови; через 24 ч от начала инфузии метотрексата должен быть назначен лейковорин. Во время лечения необходимо контролировать почечную и печеночную функцию. Следующий цикл R-CHOP проводится только после полного восстановления гематологических показателей. В составе R-CHOP-21 внутривенный метотрексат с лейковорином могут безопасно назначаться в 15-й день 21-дневного цикла R-CHOP.
Оценка ответа и последующая терапия
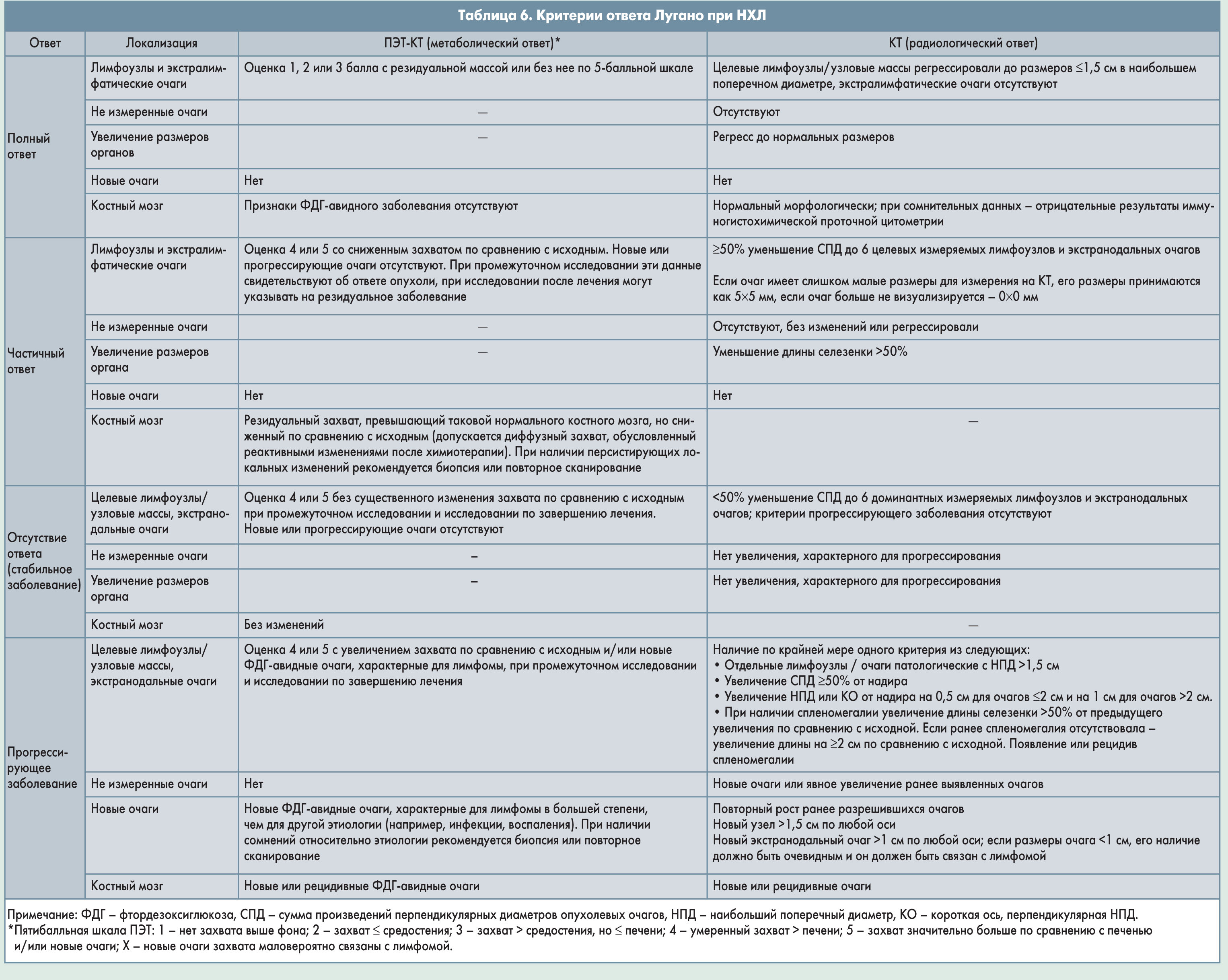
ПЭТ-КТ- и КТ-критерии ответа представлены в таблице 6.
Промежуточное стадирование проводится для выявления пациентов с отсутствием ответа или прогрессированием на фоне индукционной терапии. С помощью ПЭТ можно определить, что собой представляют резидуальные массы – фиброз или жизнеспособную опухоль. В клинических исследованиях отрицательные результаты ПЭТ после 2-4 циклов индукционной химиотерапии ассоциировались с благоприятным прогнозом. Так, у пациентов с агрессивной лимфомой (n=90), получавших антрациклинсодержащую индукционную химиотерапию (с ритуксимабом в 41% случаев), отрицательные результаты ПЭТ после 2 циклов (n=54) были связаны с более высокими 2-летними показателями ВБС (82 vs 43%; р<0,001) и ОВ (90 vs 61%; р=0,006) по сравнению с положительными результатами (n=36). В другом исследовании у пациентов с агрессивной лимфомой (n=103), в качестве 1-й линии терапии получавших СНОР или похожие схемы (с ритуксимабом в 49% случаев), 5-летняя ВБС была значительно выше при отрицательных результатах ПЭТ после 4 циклов (80 vs 36%; р<0,0001). Тем не менее у некоторых пациентов промежуточные ПЭТ-сканограммы могут быть ложноположительными, и некоторые больные, несмотря на положительные результаты ПЭТ, имеют благоприятный отдаленный прогноз. По этой причине данные промежуточной ПЭТ не рекомендуется использовать как основание для изменения терапии. В противном случае для подтверждения истинной положительности рекомендуется повторная биопсия резидуальных масс. Пациенты, получающие индукционную терапию, перед проведением ЛТ должны быть обследованы после 3-4 циклов химиотерапии. По завершении лечения (для ПЭТ лучше выждать 6-8 нед) стадию заболевания оценивают повторно.
У пациентов с заболеванием I-II стадии, достигших полного ответа на 1-ю линию терапии, рутинное применение ПЭТ или компьютерной томографии (КТ) в период наблюдения не рекомендуется. У больных с ДВКЛ III-IV стадии, достигших ремиссии после 1-й линии терапии, КТ следует проводить не чаще чем каждые 6 мес первые 2 года после завершения лечения, в дальнейшем при отсутствии клинических показаний КТ не требуется. У большинства пациентов КТ является более предпочтительным методом контрольной визуализации по сравнению с ПЭТ-КТ.
Оценка ответа при заболевании I-II стадии
Если после короткого курса лечения планируется ЛТ, до ее начала следует повторно оценить стадию заболевания, в том числе с помощью КТ, поскольку от полученного результата будет зависеть доза радиации.
Через 6-8 нед после завершения полного курса проводят контрольную визуализацию. У пациентов с полным ответом последующие наблюдения осуществляют каждые 3-6 мес на протяжении 5 лет и затем ежегодно или по показаниям, при этом КТ рекомендуется проводить только при наличии клинических показаний. Ведение больных с частичным ответом или его отсутствием либо с прогрессирующим заболеванием такое же, как и пациентов с рецидивной или рефрактерной ДВКЛ.
Оценка ответа при заболевании III-IV стадии
Через 6-8 нед после завершения полного курса проводят контрольную визуализацию. У пациентов с полным ответом рекомендуется наблюдение. У больных с изначально объемным заболеванием может проводиться консолидация высокодозовой терапией с последующей аутологической трансплантацией стволовых клеток (ВДТ/АТСК). Наблюдение пациентов с полным ответом должно осуществляться с регулярными интервалами (каждые 3-6 мес в течение 5 лет, затем ежегодно или по показаниям). КТ рекомендуется проводить не чаще 2 раз в год первые 2 года, а затем только при наличии показаний. Ведение больных с частичным ответом или его отсутствием либо с прогрессирующим заболеванием такое же, как и пациентов с рецидивной или рефрактерной ДВКЛ.
Рецидивное или рефрактерное заболевание
Роль ВДТ/АТСК у пациентов с рецидивной или рефрактерной ДВКЛ была продемонстрирована в международном рандомизированном исследовании III фазы PARMA. Пациентов с ДВКЛ, ответившей на индукционную терапию по схеме DHAP (дексаметазон, цисплатин и цитарабин) после первого или второго рецидива (n=109), рандомизировали для получения дополнительной химиотерапии DHAP + ЛТ или или ЛТ + ВДТ/АТСК. Пятилетняя ВБС была значительно выше в группе трансплантации по сравнению с группой без трансплантации (46 vs 12%; р=0,001), как и 5-летняя ОВ (53 vs 32%; р=0,038). Следует отметить, что исследование PARMA проводилось до появления ритуксимаба.
Недавно был осуществлен ретроспективный анализ данных реестра EBMT для оценки роли ВДТ/АТСК у пациентов, достигших второго полного ответа после 2-й линии терапии (n=470). В этом анализе 25% больных до АТСК получали ритуксимабсодержащую терапию. В целом 5-летние показатели ВПЗ и ОВ после АТСК составили 48 и 63%. Медиана ВБЗ после АТСК составила 51 мес, что значительно превышало соответствующий показатель после первого полного ответа (11 мес; р<0,001). Это увеличение ВБЗ было статистически значимым также в подгруппе пациентов, ранее получавших ритуксимаб (медиана не достигнута vs 10 мес; р<0,001), и в подгруппе больных, у которых заболевание рецидивировало в пределах 1 года после завершения 1-й линии терапии (медиана 47 мес vs 6 мес; р<0,001).
Эффективность 2-й линии терапии можно прогнозировать по повторно рассчитанному IPI с поправкой на возраст. Кроме того, неблагоприятными прогностическими факторами являются положительные результаты ПЭТ перед трансплантацией и химиорезистентность. Результаты исследований, проведенных группами GEL-TAMO и ABMTR, свидетельствуют о том, что ВДТ/АТСК предпочтительно использовать у пациентов, не достигших полного ответа, но еще чувствительных к химиотерапии.
У больных с рецидивной или рефрактерной ДВКЛ изучались различные схемы 2-й линии терапии, однако ни одна из них не стала предпочтительной. У пациентов с рефрактерной В-клеточной лимфомой (n=28) схема R-ICE (ритуксимаб в комбинации с ифосфамидом, карбоплатином и этопозидом) обеспечила объективный ответ в 71% случаев (полный ответ – у 25%) при 1-летних показателях ВБЗ и ОВ 60 и 72% соответственно. В исследовании II фазы применение схемы R-ICE ассоциировалось с полным ответом у 53% пациентов с рецидивной или рефракторной ДВКЛ (n=34), что значительно превышает соответствующий показатель в историческом контроле при использовании ICE без ритуксимаба (27%). Ритуксимаб у таких больных также может применяться в комбинации с химиотерапией на основе гемцитабина и в качестве монотерапии.
В международном рандомизированном исследовании CORAL сравнивали схемы R-ICE и R-DHAP с последующей АТСК в качестве 2-й линии терапии у химиочувствительных пациентов с рецидивной или рефрактерной ДВКЛ. Существенных различий в исходах между группами не наблюдалось. Общая частота ответа составила 63% для R-ICE и 64% для R-DHAP, 4-летняя ВБС – 26 и 34% соответственно (р=0,2), 4-летняя ОВ – 43 и 51% соответственно (р=0,3). Таким образом, обе схемы могут использоваться у больных с рецидивной или рефрактерной ДВКЛ. Следует отметить, что пациенты, заболевание которых рецидивировало в пределах года после 1-й линии терапии по схеме R-CHOP, имели особенно неблагоприятный прогноз (3-летняя ВБП 23%). Кроме того, независимо от группы терапии неблагоприятный прогноз отмечался в подгруппе больных с реаранжировками гена MYC (с сопутствующими реаранжировками генов BCL2 и/или BCL6 либо без них): 4-летняя ВБП у таких пациентов составила 18% по сравнению с 42% у больных без реаранжировок MYC, 4-летняя ОВ – 29 vs 62% соответственно (р=0,011). Подгрупповой анализ этого исследования (Bio-CORAL) показал, что у пациентов с GCB-фенотипом схема R-DHAP ассоциировалась с улучшением ВБП (3-летняя ВБП 52% vs 31% в группе R-ICE), в то время как у больных с неGCB-фенотипом разница в ВБП отсутствовала (3-летняя ВБП 32% для R-DHAP vs 27% для R-ICE).
В рамках исследования CORAL также оценивалась роль ритуксимаба в поддерживающей терапии (каждые 2 мес в течение 1 года) после АТСК. По 4-летней ВБС группы ритуксимаба и наблюдения не различались (52 vs 53% соответственно). Количество пациентов, заболевание которых прогрессировало или рецидивировало, также было одинаковым в обеих группах. В то же время серьезные побочные эффекты чаще наблюдались в группе ритуксимаба. Учитывая отсутствие пользы от назначения ритуксимаба в качестве поддерживающей терапии по сравнению с наблюдением после АТСК, этот вид лечения не рекомендуется.
У пациентов с рецидивной или рефрактерной ДВКЛ, не являющихся кандидатами на трансплантацию стволовых клеток, а также у больных, заболевание которых рецидивировало после трансплантации, хорошие результаты показала схема BR (бендамустин + ритуксимаб). У пожилых пациентов с рецидивной или рефрактерной ДВКЛ (n=59; средний возраст 74 года) схема BR (с бендамустином в дозе 120 мг/м2) обеспечила объективный ответ в 45,8% случаев, в том числе полный ответ – в 15,3% случаев. Медиана продолжительности ответа и медиана ВБП составили 17,3 и 3,6 мес соответственно. Наиболее частым проявлением токсичности 3-4 степени была миелосупрессия. В другом исследовании II фазы при использовании схемы BR объективный ответ достигался в 63% случаев (полный ответ – в 37% случаев). Следует отметить, что практически все участники данного исследования ранее получали лечение ритуксимабсодержащими схемами. Медиана ВБП составила примерно 7 мес. Наиболее частыми проявлениями токсичности 3-4 степени были нейтропения (76%) и тромбоцитопения (22%).
У пациентов с рецидивной или рефрактерной ДВКЛ, не являющихся кандидатами на АТСК, также оценивалась схема R-GemOX (ритуксимаб, гемцитабин, оксалиплатин). В исследовании с участием 46 больных с В-клеточной лимфомой (72% – ДВКЛ) частота объективного ответа на R-GemOX составила 83%, половина пациентов достигла полного ответа. Двухлетние показатели ВБС и ОВ составили 43 и 66% соответственно.
Рекомендации NCCN
У пациентов с рецидивной или рефрактерной ДВКЛ, химиочувствительных на момент рецидива, терапией выбора является ВДТ/АТСК. Больным – кандидатам на проведение ВДТ/АТСК должна быть назначена 2-я линия химиотерапии с ритуксимабом или без него (в зависимости от предыдущего ответа на ритуксимаб). Рекомендуются следующие схемы (± ритуксимаб):
• DHAP (дексаметазон, цисплатин, цитарабин);
• ESHAP (метилпреднизолон, этопозид, цитарабин, цисплатин);
• GDP (гемцитабин, дексаметазон, цисплатин);
• GemOX (гемцитабин, оксалиплатин);
• ICE (ифосфамид, карбоплатин, этопозид);
• MINE (митоксантрон, ифосфамид, месна, этопозид).
Пациентам с полным или частичным ответом на 2-ю линию химиотерапии рекомендуется консолидация ВДТ/АТСК ± ЛТ. IFRT перед ВДТ/АТСК показала хорошие результаты в отношении локального контроля и улучшении выживаемости.
Пациентов, не являющихся кандидатами на ВДТ/АТСК, рекомендуется включать в клинические исследования. При отсутствии такой возможности существуют следующие варианты лечения:
• ритуксимаб в монотерапии;
• бендамустин ± ритуксимаб;
• леналидомид ± ритуксимаб (у пациентов с неGCB ДВКЛ);
• DA-EPOCH ± ритуксимаб;
• CEPP (циклофосфамид, этопозид, преднизон, прокарбазин) ± ритуксимаб;
• GDP ± ритуксимаб;
• GemOx ± ритуксимаб.
Первичная медиастинальная В-крупноклеточная лимфома (ПМВКЛ)
ПМВКЛ – отдельный подтип НХЛ, гистологически не отличимый от ДВКЛ. Средний возраст пациентов с ПМВКЛ – 35 лет, наблюдается небольшое преобладание женщин. Опухоль происходит из В-клеток тимуса с первичным локальным распространением в надключичные, шейные, прикорневые лимфоузлы, средостение и легкие. На момент установления диагноза экстранодальное распространение в другие области встречается примерно у 25% больных. Клинические проявления обусловлены быстрым ростом медиастинальной массы и включают синдром верхней полой вены, плевральный и перикардиальный выпот.
Профиль экспрессии генов ПМВКЛ отличается от такового ДВКЛ и больше похож на профиль классической лимфомы Ходжкина. ПМВКЛ экспрессируют антигены В-клеток и не имеют поверхностных иммуноглобулинов. Профиль ПМВКЛ – CD19+, CD20+, СD22+, CD21-, IRF4/MUM1+ и CD23+ с вариабельной экспрессией BCL2 и BCL6. CD30 слабо и неоднородно экспрессируется более чем в 80% случаев; иногда наблюдается экспрессия CD15. ПМВКЛ также характеризуются низкой экспрессией молекул HLA I и II. В очень редких случаях выявляются медиастинальные лимфомы серой зоны с признаками ПМВКЛ и классической лимфомы Ходжкина. Цитогенетические аномалии, часто встречающиеся при ПМВКЛ, включают дупликации в хромосоме 9р24 (с вовлечением гена JAK2 у 50-75% пациентов) и хромосоме 2р15 (с вовлечением гена c-REL, кодирующего синтез одного из факторов транскрипции семейства NF-κB), а также делеции в хромосомах 1р, 3р, 13q, 15q и 17p. Индекс IPI с поправкой на возраст не позволяет достоверно оценить прогноз ПМВКЛ на момент установления диагноза. Ретроспективный анализ 141 пациента из реестра MSKCC показал, что предикторами ВБС являются 2 и более экстранодальных очага и тип первичной терапии, при этом последний также выступает единственным предиктором ОВ.
В ретроспективных анализах исследований, проводившихся до появления ритуксимаба, интенсивные химиотерапевтические режимы были более эффективными по сравнению с CHOP, при этом дополнение химиотерапии IFRT ассоциировалось с улучшением ВБП. Добавление ритуксимаба к схеме MACOP-B или VACOP-B не оказывало существенного влияния на исходы.
В ретроспективном исследовании, включившем 63 пациента с ПМВКЛ, получавших
R-CHOP, первичная неэффективность индукционной терапии наблюдалась в 21% случаев, при этом предикторами неблагоприятного исхода были поздняя стадия заболевания и высокий риск по индексу IPI. В небольшом проспективном исследовании схема DA-EPOCH-R без ЛТ ассоциировалась с ВБС 91% при медиане наблюдения 4 года. Схема DA-EPOCH-R (6-8 циклов) + филграстим также оценивалась в другом проспективном исследовании с участием 51 пациента с ранее не леченной ПМВКЛ. Заболевание IV стадии имели 29% больных. После медианы наблюдения 63 мес показатели ВБС и ОВ составили 93 и 97% соответственно. Нейтропения и тромбоцитопения 4 степени развивались после 50 и 6% циклов соответственно, госпитализация по поводу фебрильной нейтропении потребовалась в 13% циклов. Таким образом, в исследовании было продемонстрировано, что DA-EPOCH-R является высокоэффективной схемой терапии пациентов ПМВКЛ.
В подгрупповом анализе пациентов с ПМВКЛ (n=87) – участников исследования MInT добавление ритуксимаба к СНОР-подобным схемам лечения значительно улучшало частоту достижения частичного ответа (80 vs 54% без ритуксимаба; р=0,015) и 3-летнюю ВБС (78 vs 52%; р=0,012), но не ОВ (89 vs 78%; р=0,158). При анализе более длительного наблюдения этих же пациентов (медиана 62 мес) увеличение ВБС оставалось статистически значимым через 5 лет (79 vs 47%; р=0,011). Пятилетняя ВБП также была достоверно выше в группе ритуксимаба (90 vs 60%; р=0,006). По 5-летней ОВ группы статистически не различались (90 vs 78%), тем не менее у пациентов с ПМВКЛ удалось достичь такой же ОВ, как и больных с ДВКЛ (92% с ритуксимабом vs 81% без ритуксимаба; р<0,001). У пациентов с ПМВКЛ высокую эффективность также демонстрирует дозоинтенсивная терапия R-CHOP с последующей консолидацией схемой ICE (без ЛТ): при медиане наблюдения 3 год показатели ОВ и ВБП составляли 88 и 78% соответственно.
На основании имеющихся данных пациентам с ПМВКЛ в качестве 1-й линии терапии рекомендуются следующие схемы:
• R-CHOP (6 циклов) + ЛТ;
• DA-EPOCH-R (6 циклов) + ЛТ на области персистирующих локальных очагов;
• R-CHOP (4 цикла), затем ICE (3 цикла) ± ЛТ.
После лечения необходима контрольная ПЭТ-КТ. При отрицательных результатах (и изначально малообъемном заболевании) пациентов можно наблюдать. У больных, в качестве 1-й линии терапии получивших R-CHOP, можно рассмотреть целесообразность консолидирующей ЛТ, особенно если активность фтордезоксиглюкозы в первичной опухоли остается повышенной. При положительных результатах ПЭТ-КТ и планировании дальнейшего лечения рекомендуется биопсия.
Лимфомы серой зоны
Лимфомы серой зоны представляют собой группу лимфом с гистологическими и клиническими характеристиками, общими для различных подтипов лимфом. В контексте В-клеточных лимфом они относятся к категории «В-клеточная лимфома, неклассифицируемая, с промежуточными признаками ДВКЛ и классической лимфомы Ходжкина» классификации ВОЗ 2008 г. В качестве синонимов также используются понятия «В-крупноклеточная лимфома с признаками лимфомы Ходжкина» и « Ходжкин-подобная анапластическая крупноклеточная лимфома». Пациенты с лимфомами серой зоны могут иметь медиастинальное или немедиастинальное заболевание. Клинически у больных с медиастинальными лимфомами выявляется крупная масса в переднем средостении с вовлечением надключичных лимфоузлов или без него. Такие лимфомы чаще диагностируются у мужчин в возрасте от 20 до 40 лет. Пациенты с немедиастинальными лимфомами обычно старше, имеют заболевание более поздней стадии и более высокий риск по индексу IPI. Морфологические лимфомы серой зоны характеризуются пластинчатым ростом плеоморфных клеток в диффузно фиброзированной строме; клетки обычно крупнее и более плеоморфные по сравнению с ПМВКЛ, иногда могут напоминать клетки лакунарные или Ходжкин-подобные клетки. Часто наблюдается некроз без нейтрофильной инфильтрации.
Иммунофенотип лимфом серой зоны атипический, во многих случаях с переходными признаками между ПМВКЛ и классической лимфомой Ходжкина. CD45, CD15, CD20, CD30 и CD79a, как правило, положительные, а CD10 и ALK – отрицательные. Факторы транскрипции В-клеток, такие как PAX5, BOB.1 и ОСТ-2, часто могут быть положительными. Если морфология больше напоминает ПМВКЛ, на лимфому серой зоны указывают отсутствие CD20, положительный CD15 или наличие EBV. При морфологии, больше похожей на классическую лимфому Ходжкина, характерными для лимфомы серой зоны признаками являются сильная экспрессия CD20 (и/или других маркеров В-клеток) и отсутствие CD15. При изучении эпигенетических изменений с помощью анализа метилирования ДНК в микросрезах опухолевых клеток, полученных у пациентов с медиастинальными лимфомами серой зоны, ПМВКЛ, классической лимфомой Ходжкина и ДВКЛ, были обнаружены различные сигнатуры метилирования (гипо- и гиперметилированные сайты) мишеней CpG для ПМВКЛ и лимфомы Ходжкина. Профили метилирования у пациентов с лимфомами серой зоны занимали промежуточную позицию между ПМВКЛ и классической лимфомой Ходжкина, но отличались от ДВКЛ. Авторы пришли к выводу, что уникальная эпигенетическая сигнатура лимфом серой зоны является веским основанием для их выделения как отдельной нозологии.
Лечение пациентов с лимфомами серой зоны является трудной клинической задачей, поскольку эти лимфомы ассоциируются с худшим прогнозом по сравнению с ПМВКЛ и классической лимфомой Ходжкина. Стандартных рекомендаций на сегодня нет, однако большинство пациентов получают комбинированную химиотерапию по схемах, использующихся при ДВКЛ, в сочетании с ЛТ. По данным ряда авторов, лимфомы серой зоны часто являются резистентными к схемам химиотерапии, которые применяются при лимфоме Ходжкина. Добавление ритуксимаба рекомендуется при лимфомах, экспрессирующих CD20. В исследовании по оценке 6-8 циклов DA-EPOCH-R у 11 пациентов с медиастинальной лимфомой серой зоны 4-летние показатели ВБП и ОВ составили 30 и 83% соответственно. Для сравнения, у пациентов с ПМВКЛ в этом же исследовании 4-летние показатели ВБП и ОВ составили 100%. Кроме того, половине больных с лимфомами серой зоны потребовалась ЛТ на область средостения. Учитывая явно худшие исходы у пациентов с лимфомами серой зоны, получающими лечение по стандартным схемам, таким больным настоятельно рекомендуется консолидирующая ЛТ (при условии, что заболевание находится в ограниченной стадии). По возможности пациенты с лимфомами серой зоны должны наблюдаться в центрах, имеющих опыт лечения этого типа лимфомы.
Перевел с англ. Алексей Терещенко
Полный текст руководства на www.nccn.org